一种莫沙必利-丁二酸共晶的制作方法
1.本发明属于药物化学技术领域,具体涉及莫沙必利-丁二酸共晶及其制备方法。
背景技术:
2.莫沙必利(mosapride)商品名为“gasmotin@”,化学名称是(+/-)-4-氨基-5-氯-2-乙氧基-n-[4-氟苄基)-吗啉-2-基甲基]苯甲酰胺柠檬酸盐二水合物。以品牌销售,适用于胃肠道症状与慢性胃炎有关(胃灼热,恶心/呕吐)。莫沙必利刺激胃肠神经丛中的血清素5-ht4受体,这增加乙酰胆碱的释放,从而增强胃肠运动和胃排空。
[0003]
莫沙必利目前已获批准,用于治疗与慢性胃炎相关的胃肠症状,包括胃灼热、恶心、呕吐和胃食管反流病(gerd)。莫沙必利也正处在用于胃肠倾倒综合征或胃切除术后综合征治疗的iⅱ期临床试验中。已使用莫沙必利开始其它临床研究,用于治疗患有帕金森病(parkinson's disease)的患者的便秘;治疗患有2型糖尿病的患者以改进胰岛素作用;治疗患有胃轻瘫的患者;和治疗患有鸦片剂(opiate)诱发的呼吸抑制的患者。
[0004]
目前有关莫沙必利的晶型报道较少,现有技术所公开的晶型包括专利jp2011225491a报道的莫沙必利乙醇溶剂合物,专利kr20090044694a报道的莫沙必利一水合物晶型及专利wo2011107903a1报道的柠檬酸二水合物,其在ph1.0的盐酸溶液中溶解度较小,在枸橼酸莫沙必利口服固体制剂的实际生产中经常遇到溶出度低甚至不合格的问题。
[0005]
对于莫沙必利稳定性的研究,《hplc法测定枸橼酸莫沙必利的稳定性》临床合理用药2015年8月第8卷第8a期,报道了莫沙必利固体在4500lx光照下10天后无明显降解,在高温3h、氧化5h下主峰会降低了10.0%左右,但是并未公开具体杂质结构。
[0006]
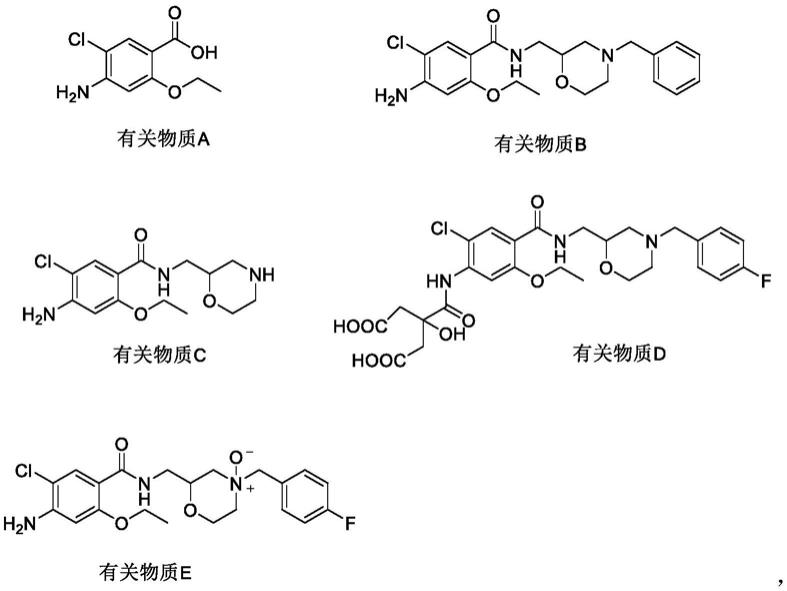
专利cn111505154a公开了一种枸橼酸莫沙必利及其制剂中五种关键杂质的检测方法,
[0007]
五种杂质的具体结构为:
[0008][0009]
其中,杂质a是莫沙必利合成的中间体,也是降解产物,降解途径为莫沙必利水解产生;杂质b为莫沙必利的脱氟产物,是原料药莫沙必利合成过程中产生的副产物;杂质c为莫沙必利的降解产物,在加热或光照或酸性条件下产生;杂质d为莫沙必利和枸橼酸的缩合产物,在加热条件下产生;杂质e为莫沙必利的氧化产物,在光照或氧化条件下产生。
[0010]
虽然莫沙必利存在有利活性,但仍需要新型化合物来治疗前述疾病和病状。
技术实现要素:
[0011]
鉴于现有技术的不足,本发明提供一种莫沙必利-丁二酸共晶。
[0012]
本发明的第一方面,提供一种莫沙必利-丁二酸共晶,所述莫沙必利-丁二酸共晶使用cu-kα辐射,以2θ表示的x射线衍射谱在5.93
±
0.2
°
,8.13
±
0.2
°
,9.53
±
0.2
°
,17.73
±
0.2
°
,23.70
±
0.2
°
处有特征峰。
[0013]
优选地,所述莫沙必利-丁二酸共晶,使用cu-kα辐射,以2θ表示的x射线衍射谱在5.93
±
0.2
°
,8.13
±
0.2
°
,9.53
±
0.2
°
,10.51
±
0.2
°
,17.73
±
0.2
°
,19.36
±
0.2
°
,21.72
±
0.2
°
,22.87
±
0.2
°
,23.70
±
0.2
°
,26.45
±
0.2
°
处有特征峰。
[0014]
优选地,所述莫沙必利-丁二酸共晶,使用cu-kα辐射,以2θ表示的x射线衍射谱在5.93
±
0.2
°
,8.13
±
0.2
°
,9.53
±
0.2
°
,10.51
±
0.2
°
,13.30
±
0.2
°
,14.98
±
0.2
°
,17.73
±
0.2
°
,18.71
±
0.2
°
,19.36
±
0.2
°
,20.06
±
0.2
°
,21.72
±
0.2
°
,22.87
±
0.2
°
,23.23
±
0.2
°
,23.70
±
0.2
°
,25.25
±
0.2
°
,25.81
±
0.2
°
,26.12
±
0.2
°
,26.45
±
0.2
°
处有特征峰。
[0015]
进一步优选地,所述莫沙必利-丁二酸共晶,使用cu-kα辐射,特征峰符合如图1所示的x射线粉末衍射图谱。
[0016]
优选地,所述莫沙必利-丁二酸共晶,其晶体学参数是:三斜晶系,空间群为p-1;晶胞参数:α=89.7760(10)
°
,β=
74.1490(10)
°
,γ=69.7320(10)
°
,晶胞体积
[0017]
本发明的第二方面,提供一种莫沙必利-丁二酸共晶的制备方法,具体包括以下步骤:将莫沙必利和丁二酸溶于丙酮和有机溶剂a的混合溶剂中,超声加热溶解,反应完毕后过滤,滤液静置控温析晶,过滤干燥得莫沙必利-丁二酸共晶。
[0018]
优选地,有机溶剂a选自甲醇、乙醇、异丙醇、乙腈中的一种或其组合,进一步优选为甲醇、乙腈中的一种或其组合。
[0019]
优选地,所述混合溶剂中丙酮的体积分数为70~100%。
[0020]
优选地,所述莫沙必利和丁二酸的摩尔比为1:2.0~3.0,进一步优选为1:2.05~2.25。
[0021]
优选地,所述加热反应温度为40~55℃,进一步优选为45~50℃。
[0022]
优选地,所述莫沙必利和混合溶剂的质量体积比为15~24:1,其中质量以mg计,体积以ml计。
[0023]
优选地,所述控温析晶的温度为16~26℃。
[0024]
优选地,所述析晶时间为24~72小时,进一步优选为24~48小时。
[0025]
优选的,所述干燥温度为35~55℃,干燥时间为26~50小时。
[0026]
以下内容进一步详述本发明中莫沙必利-丁二酸共晶的制备方法:
[0027]
将摩尔比为1:2.15~2.25的莫沙必利和丁二酸溶于丙酮和有机溶剂a的混合溶剂中,超声加热至45~50℃,化合物溶解,继续超声加热10~25min,反应完毕后过滤,滤液静置,控温16~26℃析晶,过滤,用丙酮淋洗滤饼,40~50℃真空干燥得莫沙必利-丁二酸共晶。
[0028]
本发明第三方面,提供一种含有本发明所述的莫沙必利-丁二酸共晶的药物组合物。
[0029]
本发明的药物组合物制备方法可以如下:使用标准和常规的技术,使本发明化合物与制剂学上可接受的固体或液体载体结合,以及使之任意地与制剂学上可接受的辅助剂和赋形剂结合制备成可用剂型。
[0030]
本发明的第四方面,提供一种莫沙必利-丁二酸共晶作为活性成分用于制备治疗功能性消化不良胃病药物的应用。
[0031]
晶体结构的确认:
[0032]
本发明提供的莫沙必利-丁二酸共晶,对其进行x-射线单晶衍射测试分析。本发明所涉及的x-射线单晶衍射仪器及测试条件为:理学xtalab synergy x-射线单晶衍射仪,测试温度293(2)k,用cuka辐射,以ω扫描方式收集数据并进、行lp校正。用直接法解析结构,差值傅里叶法找出全部非氢原子,所有碳及氮上的氢原子采用理论加氢得到,采用最小二乘法对结构进行精修。
[0033]
测试及解析本发明制备的莫沙必利-丁二酸共晶所得晶体学数据见表1,其晶体学参数是:三斜晶系,空间群为p-1;晶胞参数:α=89.7760(10)
°
,β=74.1490(10)
°
,γ=69.7320(10)
°
,晶胞体积
[0034]
本发明制备的莫沙必利-丁二酸共晶的ortep图表明一分子的莫沙必利结合了两分子丁二酸,如图2所示;莫沙必利-丁二酸共晶的氢键图表明莫沙必利和丁二酸通过分子
间氢键,连接成三维立体结构,如图3所示。
[0035]
表1莫沙必利-丁二酸共晶的主要晶体学数据
[0036][0037][0038]
本发明中所涉及的x-射线粉末衍射测试仪器及测试条件:x-射线粉末衍射仪:panalytical empyrean;cu-kα;样品台:平板;入射光路:bbhd;衍射光路:plxcel;电压45kv,电流40ma;发散狭缝:1/4;防散射狭缝:1;索拉狭缝:0.04rad;步长:0.5s;扫描范围:3~50
°
。
[0039]
依据上述晶体学数据,其对应的x射线粉末衍射图(cu-kα)中特征峰详见图1及表
2。
[0040]
表2莫沙必利-丁二酸共晶的pxrd峰
[0041]
[0042][0043]
本发明中tga/dsc热分析测试仪及测试条件:tga/dsc热分析仪:mettler toledo tga/dsc3+;动态温度段:30~300℃;加热速率:10℃/min;程序段气体n2;气体流量:50ml/min;坩埚:铝坩埚40μl。
[0044]
本发明所述方法制备的莫沙必利-丁二酸共晶的tga/dsc测试结果如图4所示,dsc检测谱图显示该共晶有一个吸热峰,温度范围为164.50~176.74℃,其峰值为168.71℃。
[0045]
本发明所述方法制备的莫沙必利-丁二酸共晶相对于目前报道的莫沙必利晶型具有以下优势:
[0046]
(1)溶解度高,本发明制备的莫沙必利-丁二酸共晶在ph1.0的盐酸中溶解度达到
5.79mg/ml,高于莫沙必利现有晶型的溶解度。
[0047]
(2)稳定性好,本发明制备的莫沙必利-丁二酸共晶在热溶液中经过水解试验后,纯度变化不大,生成的水解杂质a的量较少。
附图说明
[0048]
图1:莫沙必利-丁二酸共晶的x射线粉末衍射图谱;
[0049]
图2:莫沙必利-丁二酸共晶的ortep图;
[0050]
图3:莫沙必利-丁二酸共晶的氢键图;
[0051]
图4:莫沙必利-丁二酸共晶的dsc/tga图。
具体实施方式
[0052]
以下通过具体实施方式的描述对本发明作进一步说明,应该正确理解的是:本发明的实施例仅仅是用于说明本发明,而不是对本发明的限制。所以,在本发明的方法前提下对本发明的简单改进均属本发明要求保护的范围。
[0053]
实施例1
[0054]
将莫沙必利211mg和丁二酸124.0mg溶于12.0ml混合溶剂(10.0ml丙酮和2.0ml甲醇)中,超声加热至50℃,溶解后继续超声15min,过滤,16~20℃静置析晶36小时,过滤,45℃烘干40小时,得305.4mg莫沙必利-丁二酸共晶。收率92.82%,纯度99.95%。
[0055]
实施例2
[0056]
将莫沙必利211mg和丁二酸121.0mg溶于10.0ml丙酮中,超声加热至45℃,溶解后继续超声20min,过滤,20~26℃静置析晶48小时,过滤,55℃烘干30小时,得301.9mg莫沙必利-丁二酸共晶。收率91.76%,纯度99.93%。
[0057]
实施例3
[0058]
将莫沙必利211mg和丁二酸132.9mg溶于14.0ml混合溶剂(10.0ml丙酮和4.0ml乙腈)中,超声加热至50℃,溶解后继续超声25min,过滤,16~20℃静置析晶24小时,过滤,45℃烘干45小时,得300.6mg莫沙必利-丁二酸共晶。收率91.35%,纯度99.94%。
[0059]
实施例4
[0060]
将莫沙必利211mg和丁二酸118.1mg溶于9.0ml混合溶剂(5.0ml丙酮和4.0ml乙醇)中,超声加热至40℃,溶解后继续超声10min,过滤,20~26℃静置析晶72小时,过滤,55℃烘干35小时,得295.6mg莫沙必利-丁二酸共晶。收率89.85%,纯度99.86%。
[0061]
实施例5
[0062]
将莫沙必利211mg和丁二酸177.1mg溶于16.0ml混合溶剂(8.0ml丙酮和8.0ml异丙醇)中,超声加热至50℃,溶解后继续超声30min,过滤,16~20℃静置析晶72小时,过滤,60℃烘干60小时,得290.1mg莫沙必利-丁二酸共晶。收率88.16%,纯度99.82%。
[0063]
实施例6
[0064]
将莫沙必利211mg和丁二酸115.1mg溶于8.0ml混合溶剂(4.0ml丙酮和4.0ml四氢呋喃)中,超声加热至35℃,溶解后继续超声30min,过滤,10~15℃静置析晶75小时,过滤,55℃烘干48小时,得277.5mg莫沙必利-丁二酸共晶。收率84.35%,纯度99.41%。
[0065]
实施例7
[0066]
将莫沙必利211mg和丁二酸183.0mg溶于17.0ml混合溶剂(9.0ml丙酮和6.0ml正丁醇)中,超声加热至60℃,溶解后继续超声15min,过滤,26~30℃静置析晶50小时,过滤,30℃烘干75小时,得276.7mg莫沙必利-丁二酸共晶。收率84.10%,纯度99.28%。
[0067]
1、溶解度试验
[0068]
参照药典的方法,为节约物料,同比例缩小用量。分别取实施例1-7制备的适量莫沙必利-丁二酸共晶、按照wo2011107903a1公开的方法制备的枸橼酸莫沙必利二水合物依次放入有ph1.0的盐酸溶液的具塞试管内,将样品放入水浴恒温振荡器中,于37℃,200r/min条件下平衡24h,取样,0.45μm微孔滤膜过滤,取续滤液,用水稀释至线性范围,以水溶液为空白溶液,在波长274nm测定吸光度,至吸光度不再发生变化为止。试验结果见表3。
[0069]
表3莫沙必利-丁二酸共晶的溶解度
[0070][0071]
本发明实施例中所制备的莫沙必利-丁二酸共晶样品的溶解度远高于枸橼酸莫沙必利二水合物的溶解度。
[0072]
2.莫沙必利-丁二酸共晶在热溶液中稳定性试验
[0073]
分别取莫沙必利-丁二酸共晶、枸橼酸莫沙必利二水合物各适量(约含枸橼酸莫沙必利10mg),加水10ml使分散,振摇后于75℃水浴下放置10小时,再加甲醇稀释至10ml,振摇30分钟,离心,取上清液作为供试溶液,纯度检测用hplc法,可以参照中国药典2015版第二部附录vd的方法。结果见表4。
[0074]
表4溶液热稳定性试验结果
[0075][0076]
备注:/表示未检测出
[0077]
结论:莫沙必利-丁二酸共晶溶解在溶液中,经过10小时热稳定性试验后纯度稍有降低,为99.54%,水解杂质a为0.22%;枸橼酸莫沙必利二水合物溶解在溶液中,经过10小时热稳定性试验后纯度降低至95.70%,水解杂质a明显增多,为2.17%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1