一种定量区分检测Cys、Hcy、GSH和H2S的荧光探针及其制备方法和应用与流程
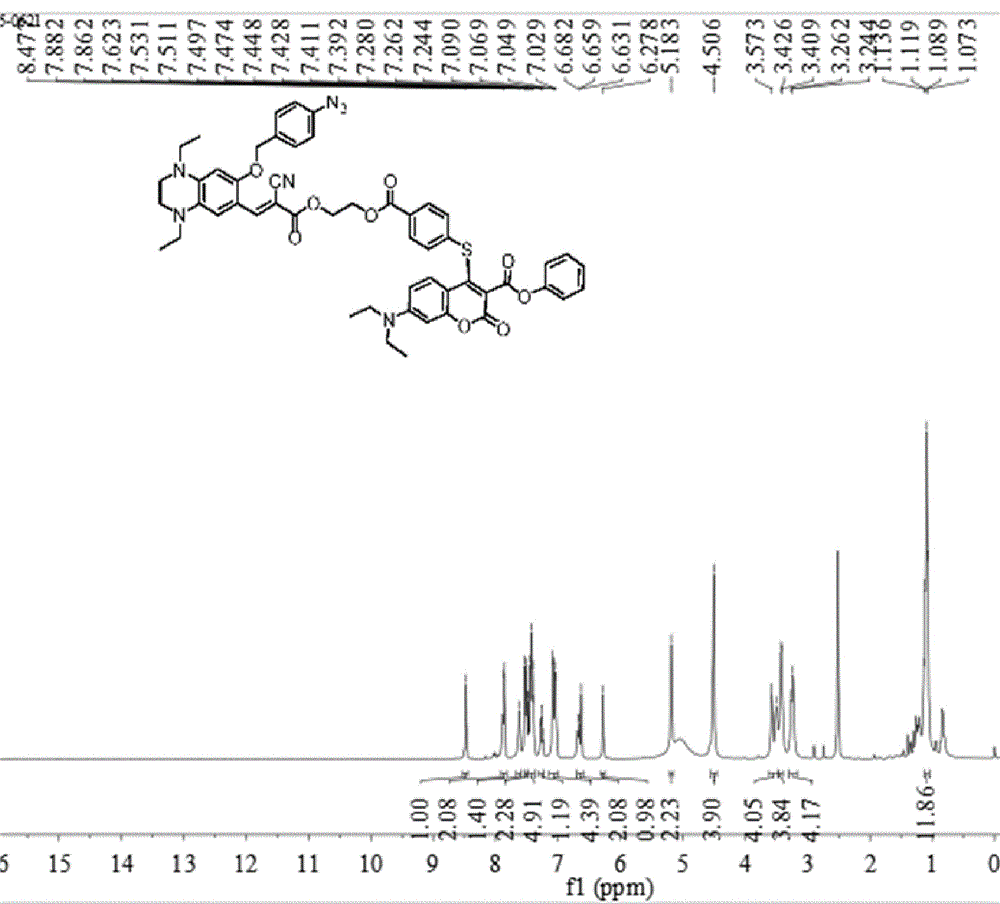
本发明属于荧光检测领域,涉及同时区分检测cys、hcy、gsh和h2s的荧光探针,特别是指一种定量区分检测cys、hcy、gsh和h2s的荧光探针及其制备方法和应用。
背景技术:
巯基化合物是生物体酶发挥作用后和生理活动中的重要信号分子,同时巯基化合物也可以调节细胞的正常氧化还原状态,在生物体的生理活动中具有重要的功能。生物体内巯基化合物的浓度异常与许多种疾病有关,cys的缺乏与生长缓慢、肝损伤、毛发褪色、皮肤病、昏睡以及水肿等疾病有关;血浆中hcy浓度过高与心血管疾病、阿兹海默症和骨质疏松症有关;gsh能够保护机体免受氧化及自由基介导的氧应激损伤,其浓度与白血病、癌症及艾滋病等有关;h2s被认为是继一氧化碳(co)和一氧化氮(no)之后的第三种气体传递物质,胱硫醚β-合成酶(cbs)和胱硫醚g-裂解酶(cse)催化cys和hcy生成内源性h2s,其浓度由生物系统中cys、hcy和gsh的浓度决定,内源性h2s的水平失衡也许多疾病相关,如阿尔茨海默病、帕金森病、肝硬化等。然而目前市面上检测生物硫醇通常是同时检测cys、hcy和gsh的量,并不能分别单独检测。
专利cn201811090573.2为本发明人前期研究的课题,公开了一种多通道同时区分检测cys/hcy,gsh和h2s的荧光探针的设计、合成及应用,通过将nbd和叠氮基团通过两个染料的桥连构建到一个分子上,利用不同的荧光信号组合,来实现单分子区分检测cys/hcy,gsh和h2s的目的,但是该探针在最终判断时,cys/hcy(蓝光+绿光),gsh(蓝光),h2s(蓝光+红光),即需要通过混合光来判定,并不能通过单一的颜色得到准确的结果,且不能区分cys和hcy。
技术实现要素:
为解决上述技术问题,提供一种快速、准确、无误差的区分检测cys、hcy、gsh和h2s的方法,本发明提出一种定量区分检测cys、hcy、gsh和h2s的荧光探针及其制备方法和应用。
本发明的技术方案是这样实现的:
一种定量区分检测cys、hcy、gsh和h2s的荧光探针,具有如下结构式:
上述荧光探针的制备方法,步骤如下:
(a)将化合物1与氰基乙酸羟乙酯溶于无水二氯甲烷中,再加入两滴哌啶,室温搅拌反应8小时,然后将反应液旋干得到固体粗产品,经柱层析法分离得到化合物3;
技术路线为:
(b)将化合物4、4-巯基苯甲酸与三乙胺溶于无水乙腈中,室温下搅拌2小时,将反应液旋干得到固体粗产品,经柱层析分离得化合物6;
技术路线为:
(c)将步骤(a)制备的化合物3、步骤(b)制备的化合物6、edci、dmap依次溶于无水二氯甲烷中,室温下搅拌12小时,减压除去溶剂得到粗产品,经柱层析分离得探针kc;
技术路线为:
上述步骤中化合物1的结构式为:
所述步骤(a)中化合物1、氰基乙酸羟乙酯和哌啶的物质的量比为1:(1-1.2):(0.01-0.02);柱层析法采用的硅胶200-300目,淋洗剂为v乙酸乙酯/v石油醚=1/2。
所述步骤(b)中化合物4、4-巯基苯甲酸与三乙胺的物质的量比为1:1:1.2;柱层析法采用的硅胶200-300目,淋洗剂为vdcm:vmeoh=2/1。
所述步骤(c)中化合物3、化合物6、edci和dmap的质量比为(115-120):(122-123):48:1;其中柱层析法采用的硅胶200-300目,淋洗剂为vdcm:vea=10/1。
上述的荧光探针在制备定量区分检测cys、hcy、gsh和h2s的试剂中的应用,步骤为:将荧光探针kc溶于hepes缓冲液中,配制成荧光探针kc的浓度为1.0×10-5mol/l的溶液,然后加入待测样品,分别在10分钟、70分钟、12分钟和15分钟后通过荧光监测在610nm、450nm或530nm处,观察荧光变化。
上述的荧光探针在制备定量区分检测cys、hcy、gsh和h2s的试剂中的应用,步骤为:将荧光探针kc溶于hepes缓冲液中,配制成荧光探针kc的浓度为1.0×10-5mol/l的溶液,然后加入待测样品,检测荧光强度,根据荧光强度随待测样品浓度的变化曲线见图7,分别定量计算出cys、hcy、gsh和h2s的含量。
所述hepes缓冲液ph为7.4、浓度为20mm、且含有1mm的ctab。
本发明的荧光探针的响应机理如下:由于探针kc的光诱导电子转移(pet)过程,荧光被猝灭,所以探针无荧光。如图4所示,当用h2s处理时,叠氮基团(位点1)被还原成氨基,硫醚键(位点2)会断裂。在此过程中,会生成无荧光化合物cou-sh和中间体ksh。然后ksh会依次进行消除和环化反应,生成强烈红色荧光化合物kcn和无荧光化合物psh。
用cys、hcy和gsh处理kc探针,将分别产生无荧光的k-n3和绿色荧光中间体cou-s-cys/hcy/gsh。对于cys,cou-s-cys可以通过smile重排反应快速转化为有蓝色荧光的cou-n-cys。对于hcy,cou-n-hcy的生成方式与cys相似,只是smile重排的反应速率较慢,并且cou-s-cys与cou-n-hcy是同时存在的。cou-s-gsh由于其重排的动力学结构不稳定,不能发生smile重排反应。因此,探针kc可以对h2s、cys、hcy、gsh产生明显的荧光信号:h2s为红色,cys为蓝色,hcy为蓝绿色,gsh为绿色。探针分子的响应过程见图4。
本发明具有以下有益效果:
1、本发明的荧光探针本身没有荧光,与h2s响应后发射强烈的红色荧光,最大发射峰在610nm处;与cys响应后发射蓝色荧光,最大发射峰在450nm处;与hcy响应后发射蓝绿色荧光,最大发射峰在450nm处;与gsh响应后发射绿色荧光,最大发射峰在530nm处。
2、本发明所述的探针分子生物相容性好,可以实现区分检测cys、hcy、gsh和h2s。
3.本申请的荧光探针,可以实现定量检测h2s、cys、hcy、gsh的目的。cys与探针kc响应时,在cys浓度为40-130μm,470nm处的荧光强度变化与cys的浓度成正相关的关系,显示了良好的线性关系,根据检测线计算公式:d=3σ/k(d为检测线,σ为标准偏差,k为斜率),探针kc对cys的检测限为32nm(信噪比s/n=3)。同理,得到探针kc对hcy的检测限为28nm(信噪比s/n=3)。gsh与探针kc响应时,530nm(绿光)处荧光强度随着浓度的增加而不断增强,探针kc对gsh的检测限为12nm(信噪比s/n=3)。h2s与探针rc响应后,610nm(红光)处荧光强度随着浓度的增加而不断增强,探针kc对h2s的检测限为1.2μm(信噪比s/n=3)。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明的荧光探针在氘代dmso中核磁共振氢谱,横坐标化学位移,纵坐标为强度。
图2为本发明的荧光探针在氘代dmso中核磁共振碳谱,横坐标化学位移,纵坐标为强度。
图3为本发明的荧光探针(1.0×10-5mol/l)在hepes缓冲液(20mm,ph=7.4,含1mmctab)中对cys、hcy、gsh、h2s和其它干扰物质的响应(pro、glu、ala、lys、asp、、phe、no3-、no2-、clo-、h2o2、o2-、ca2+、zn2+、mg2+、k+、ac-、so42-、i-、po43-、s2o32-、so32-,50倍当量)。横坐标为波长,纵坐标为荧光强度。
图4为探针分子的响应过程图。
图5为探针kc与生物硫醇和h2s响应后蓝光通道的荧光信号。
图6为探针kc与生物硫醇和h2s的反应速度曲线图。
图7为探针kc对cys、hcy、gsh和h2s的灵敏度曲线图。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
本实施例的定量区分检测cys、hcy、gsh和h2s的荧光探针的制备方法,技术路线如下:
具体制备步骤为:
(a)将化合物1(180mg,0.5mmol)和氰基乙酸羟乙酯(65mg,0.5mmol)溶于5ml无水二氯甲烷中,再加入0.006mmol哌啶,室温下搅拌8小时。将反应液旋干得到固体粗产品,用柱层析法(硅胶200-300目,淋洗剂:v乙酸乙酯/v石油醚=1/2)分离得到化合物3,红色固体,150mg,产率63%;
(b)将化合物4(65mg,0.2mmol)、4-巯基苯甲酸(31mg,0.2mmol)和0.24mmol的三乙胺溶于3ml无水乙腈中,室温下搅拌2小时。将反应液旋干得到固体粗产品,用柱层析法(硅胶200-300目,淋洗剂:vdcm:vmeoh=2/1)分离得到化合物6,黄色固体,67mg,产率72%;
(c)化合物3(239mg,0.5mmol)、化合物6(245mg,0.5mmol)、edci(96mg,0.5mmol)、dmap(2mg)溶于5ml无水二氯甲烷中。室温下搅拌12小时,减压除去溶剂得到粗产品。用柱层析法(硅胶200-300目,淋洗剂:vdcm:vea=10/1)分离得到探针kc,红色固体,261mg,产率55%。
该探针的1hnmr(400mhz,dmso-d6)δ8.49(s,1h),7.57–7.47(m,3h),7.16(d,j=8.3hz,2h),6.26(s,1h),5.22(s,2h),4.23–4.17(m,2h),3.66–3.61(m,2h),3.52(d,j=19.5hz,4h),3.17(s,2h),1.09(dd,j=15.3,7.1hz,6h).13cnmr(100mhz,dmso-d6)δ165.36,164.76,162.92,157.52,156.12,152.39,150.52,146.96,146.15,145.17,140.17,139.50,133.98,130.75,130.22,129.63,129.03,128.52,126.77,121.67,119.66,118.69,110.53,108.42,106.85,70.1,63.4,46.60,45.67,44.70,12.75,11.21,9.82.
实施例2
本实施例的定量区分检测cys、hcy、gsh和h2s的荧光探针的制备方法,技术路线如下:
具体制备步骤为:
(a)将化合物1(180mg,0.5mmol)和氰基乙酸羟乙酯(0.6mmol)溶于5ml无水二氯甲烷中,再加入0.005mmol哌啶,室温下搅拌8小时。将反应液旋干得到固体粗产品,用柱层析法(硅胶200-300目,淋洗剂:v乙酸乙酯/v石油醚=1/2)分离得到化合物3,红色固体;
(b)将化合物4(65mg,0.2mmol)、4-巯基苯甲酸(31mg,0.2mmol)和0.24mmol的三乙胺溶于3ml无水乙腈中,室温下搅拌2小时。将反应液旋干得到固体粗产品,用柱层析法(硅胶200-300目,淋洗剂:vdcm:vmeoh=2/1)分离得到化合物6,黄色固体;
(c)化合物3(240mg)、化合物6(244mg)、edci(96mg,0.5mmol)、dmap(2mg)溶于5ml无水二氯甲烷中。室温下搅拌12小时,减压除去溶剂得到粗产品。用柱层析法(硅胶200-300目,淋洗剂:vdcm:vea=10/1)分离得到探针kc,红色固体,261mg。
该探针的1hnmr(400mhz,dmso-d6)δ8.49(s,1h),7.57–7.47(m,3h),7.16(d,j=8.3hz,2h),6.26(s,1h),5.22(s,2h),4.23–4.17(m,2h),3.66–3.61(m,2h),3.52(d,j=19.5hz,4h),3.17(s,2h),1.09(dd,j=15.3,7.1hz,6h).13cnmr(100mhz,dmso-d6)δ165.36,164.76,162.92,157.52,156.12,152.39,150.52,146.96,146.15,145.17,140.17,139.50,133.98,130.75,130.22,129.63,129.03,128.52,126.77,121.67,119.66,118.69,110.53,108.42,106.85,70.1,63.4,46.60,45.67,44.70,12.75,11.21,9.82.
实施例3
本实施例的定量区分检测cys、hcy、gsh和h2s的荧光探针的制备方法,技术路线如下:
具体制备步骤为:
(a)将化合物1(180mg,0.5mmol)和氰基乙酸羟乙酯(0.55mmol)溶于5ml无水二氯甲烷中,再加入0.0055mmol哌啶,室温下搅拌8小时。将反应液旋干得到固体粗产品,用柱层析法(硅胶200-300目,淋洗剂:v乙酸乙酯/v石油醚=1/2)分离得到化合物3,红色固体;
(b)将化合物4(65mg,0.2mmol)、4-巯基苯甲酸(31mg,0.2mmol)和0.24mmol的三乙胺溶于3ml无水乙腈中,室温下搅拌2小时。将反应液旋干得到固体粗产品,用柱层析法(硅胶200-300目,淋洗剂:vdcm:vmeoh=2/1)分离得到化合物6,黄色固体;
(c)化合物3(235mg)、化合物6(246mg)、edci(96mg,0.5mmol)、dmap(2mg)溶于5ml无水二氯甲烷中。室温下搅拌12小时,减压除去溶剂得到粗产品。用柱层析法(硅胶200-300目,淋洗剂:vdcm:vea=10/1)分离得到探针kc,红色固体。
该探针的1hnmr(400mhz,dmso-d6)δ8.49(s,1h),7.57–7.47(m,3h),7.16(d,j=8.3hz,2h),6.26(s,1h),5.22(s,2h),4.23–4.17(m,2h),3.66–3.61(m,2h),3.52(d,j=19.5hz,4h),3.17(s,2h),1.09(dd,j=15.3,7.1hz,6h).13cnmr(100mhz,dmso-d6)δ165.36,164.76,162.92,157.52,156.12,152.39,150.52,146.96,146.15,145.17,140.17,139.50,133.98,130.75,130.22,129.63,129.03,128.52,126.77,121.67,119.66,118.69,110.53,108.42,106.85,70.1,63.4,46.60,45.67,44.70,12.75,11.21,9.82.
应用例
利用实施例1制备的荧光探针区分检测cys、hcy、gsh和h2s:
将探针kc溶于hepes缓冲液(20mm,ph=7.4,含1mmctab)中,配制成1.0×10-5mol/l的溶液,加入三种生物硫醇可以迅速观测到610nm、450nm和530nm处的荧光变化,其检测时间较短,可以实现定性、定量检测生物硫醇。
实施效果例
1、探针kc的选择性实验
为了评估探针kc对cys、hcy、gsh和h2s的特异性选择性能力,检测了探针kc对众多分析物的响应情况,分析物与之前探针rc的一样,包括:cys、hcy、h2s、gsh、pro、glu、ala、lys、asp、po43-、s2o32-、so32-、i-、so42-、ac-、k+、ca2+、mg2+、zn2+、h2o2、clo-、o2-、no3-、no2-。如图3所示,检测物加到探针kc的缓冲液中之后,当用370nm激发时,只有cys和hcy能够在450nm处检测到一个明显的荧光强度增强(图3a);当用422nm激发时,只有gsh能够在530nm处检测到一个明显的荧光强度增强(图3b)。当用466nm激发时,只有h2s能够在610nm处检测到一个明显的荧光强度增强(图3c),表明探针kc能够特异性选择cys、hcy、gsh和h2s。
2、探针kc的灵敏度、定量实验
以三个不同的激发波长:370nm、422nm、466nm激发,分别研究了探针kc与cys、hcy、gsh和h2s响应的荧光性能。收集蓝色,绿色以及红色的荧光通道信号,以实现对cys、hcy、gsh和h2s的区分检测。
首先,研究了探针kc与生物硫醇响应后蓝光通道的荧光信号。当探针kc的缓冲溶液中加入50倍当量cys之后,用370nm激发时,450nm处的荧光信号明显增强(大约36倍),大约10分钟达到荧光最大值,该反应也符合准一级反应,反应速率常数kobs为0.45829min−1(图5a1,6a)。当70倍当量hcy与探针响应后,可以观察到一个类似的实验结果,在450nm处的荧光强度增强了大约29倍,大约70分钟反应完全(图5b1,6b)。在450nm处的发射峰,对应的应该是产物cou-n-cys和cou-n-hcy(图4)。但是,当gsh、h2s和探针响应后,用370nm激发时,在450nm处均观察不到明显的荧光信号(图5c1,d1)。随后,研究了探针kc与生物硫醇响应后绿光通道的荧光信号。当探针kc的缓冲溶液中加入10倍当量gsh之后,用422nm激发时,530nm处的荧光强度明显增强(大约26倍),大约12分钟达到荧光最大值(图5c2,6c),该反应也符合准一级反应,反应速率常数kobs为0.30688min−1(图5c1,6c)。当hcy与探针响应后,用422nm激发时,在530nm处也能观察到一个较强的荧光信号,大约15分钟达到最大值,达到最大值后荧光强度逐渐下降,大约70分钟达到反应平衡,但此时荧光信号仍然比较强(图5b2),530nm对应的产物应该是cou-s-hcy(图4)。如图5a2,5d2所示,探针kc与cys、h2s响应时,在530nm处均不能观察到明显的荧光信号。最后,用466nm激发,研究了探针kc与生物硫醇响应后红光通道的荧光信号。如图5所示,当探针与cys,hcy,gsh响应后,用466nm激发时,在610nm处均观察不到明显的荧光信号,但是当探针与h2s响应后,在610nm处的荧光强度明显增强(大约16倍),大约70分钟反应完全(图5d3,6d),探针与h2s之间的反应也符合准一级反应,反应速率常数kobs为0.01731min−1(图6d)。这个530nm对应的产物应该是kcn(图4)。所以探针kc与cys、hcy、gsh、h2s响应后对应的荧光信号结果是:红光(h2s)、蓝光(cys)、蓝光-绿光(hcy)、绿光(gsh)。因此探针kc能够实验cys、hcy、gsh和h2s的区分检测。
随后,进一步通过荧光滴定实验研究了探针kc对cys、hcy、gsh和h2s的灵敏度。在cys与探针kc响应时,用370nm激发时,在cys浓度一定范围内,470nm处的荧光强度变化与cys的浓度成正相关的关系,如图5a1所示,反应的饱和浓度为50倍当量,并且在cys浓度为40-130μm,荧光强度和浓度显示了良好的线性关系(图7a2),探针kc对cys的检测限为0.032μm(信噪比s/n=3)。当hcy与探针响应时,可以得到一个类似的实验结果,其反应的饱和浓度为70倍当量,在cys浓度为5-60μm,探针kc对hcy的检测限为0.028μm(信噪比s/n=3)(图7b1,b2)。当用422nm激发,gsh与探针kc响应时,在一定浓度范围内,530nm(绿光)处荧光强度随着浓度的增加而不断增强,反应的饱和浓度为2倍当量(图7c1)。并且在gsh浓度为2-12μm,荧光强度和浓度显示了良好的线性关系(图7c2),探针kc对gsh的检测限为0.012μm(信噪比s/n=3)。当用466nm激发时,h2s与探针rc响应后,在一定浓度范围内,610nm(红光)处荧光强度随着浓度的增加而不断增强,反应的饱和浓度为70倍当量(图7d1)。并且在h2s浓度为40-130μm,荧光强度和浓度显示了良好的线性关系(图7d2),探针kc对h2s的检测限为1.2μm(信噪比s/n=3)。实验结果证明,探针kc有能力实现对cys、hcy、gsh和h2s的区分检测。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!