一种外显子连接蛋白、核酸分子、表达载体、重组蛋白表达系统、应用的制作方法
[0001]
本发明涉及基因工程技术领域,具体涉及一种外显子连接蛋白、核酸分子、表达载体、重组蛋白表达系统、应用。
背景技术:
[0002]
近年来,生物医药产业已经成为了21世纪创新最为活跃、发展最为迅猛、前景最为光明、影响最为深远的新兴产业。利用外源蛋白表达系统生产具有重要价值的药用蛋白是现代生物技术产业的核心技术和研究热点。哺乳动物细胞生产的重组蛋白质能够进行正确折叠、装配和翻译后修饰,具有与人源蛋白分子结构更为接近的优势,因此哺乳动物细胞已经成为蛋白药物的主要表达宿主。目前近80%批准上市的重组蛋白药物均来自于哺乳动物细胞,其中应用最广泛的是人胚胎肾细胞293(human embryonic kidney cells 293)细胞和中国仓鼠卵巢细胞(chinese hamster ovary cells,cho)。但与大肠杆菌等表达系统相比,哺乳动物细胞的表达水平仍较低、获得高表达工程细胞株所需的时间长、细胞大规模培养的成本高等导致哺乳动物细胞生产蛋白质类药物的成本较高。这就需要改善哺乳动物细胞表达系统,进一步提高重组蛋白的表达量、增强细胞株的稳定性、降低生产成本的同时确保产品的质量和安全。
[0003]
目前,常用的提高哺乳动物细胞重组蛋白表达水平的策略主要为表达载体的优化、细胞系的改造、培养基及培养工艺的优化(如申请公布号为201910012271.1的中国专利申请文件中公开了一种提高cho细胞重组蛋白表达水平的方法及其应用,表达载体、表达系统及其制备方法;申请公布号为201711321218.7的中国专利申请文件中公开了一种cho细胞无血清培养基;申请公布号为201911425714.6的中国专利申请文件中公开了一种稳定表达gpc3的重组cho细胞株及其应用)。在哺乳动物细胞中,新合成的转录初始物(mrna前体)要经过细胞核内多步骤加工才能成为成熟mrna模板用于蛋白质合成。其中,mrna前体的剪接(splicing)对于基因表达至关重要,因为它不仅可以去除内含子,同时可以赋予mrnas参与3'-端加工,mrna的输出、定位和翻译等蛋白质翻译的下游步骤。由于剪接和翻译是时间和空间分离发生的事件,剪接过程有外显子连接复合体(exon-junction complex,ejc)蛋白质参与(leung cs,johnson tl.the exon junction complex:a multitasking guardian of the transcriptome.mol cell.2018;72(5):799-801.gerbracht jv,gehring nh.the exon junction complex:structural insights into a faithful companion of mammalian mrnps.biochem soc trans.2018;46(1):153-161),这些因子通过转运到细胞质而与rna结合。有些ejc蛋白能够增强剪接mrna的翻译能力,进而增强蛋白质的表达。因此,研究发现能够应用于提高重组蛋白表达的外显子连接点复合体,对重组蛋白类的生物制剂的发展具有重要的意义。
技术实现要素:
[0004]
为了克服现有技术的缺陷,本发明的目的之一在于提供一种外显子连接蛋白,该连接蛋白能用于提高哺乳动物细胞重组蛋白表达水平。
[0005]
本发明的目的之二在于提供一种核酸分子,编码本发明外显子连接蛋白。
[0006]
本发明的目的之三在于提供一种外显子连接蛋白表达载体,包含本发明核酸分子,用于表达本发明外显子连接蛋白。
[0007]
本发明的目的之四在于提供一种重组蛋白表达系统,包含本发明表达载体,提高目的蛋白表达水平。
[0008]
本发明的目的之五在于提供本发明外显子连接蛋白、重组蛋白表达系统的应用。
[0009]
为了实现上述目的,本发明采用的技术方案如下:
[0010]
一种外显子连接蛋白,由与基因序列seq id no:2同源性≥80%的核酸分子编码而成。
[0011]
进一步优选的,上述外显子连接蛋白,其基因序列如seq id no:2所示;其氨基酸序列如seq id no:1所示。
[0012]
一种核酸分子,其基因序列如seq id no:2所示。
[0013]
一种外显子连接蛋白表达载体,包含上述核酸分子。
[0014]
可选的,上述外显子连接蛋白表达载体的出发载体为pires-neo、pires-neo2、pires-neo3、prc/cmv、pee6.4、pee12.4、pegfp-c1、pcdna 3.1中的任意一种。
[0015]
上述外显子连接蛋白表达载体可以采用任何已知的方法构建而成,作为举例说明,其构建方法包括将如seq id no:2所示基因序列插入出发载体的启动子下游,即得。具体的,pcr克隆如seq id no:2所示的外显子连接蛋白基因序列,用克隆技术将pcr克隆的外显子连接蛋白基因序列连接至出发载体,通过序列鉴定筛选,即得所述的外显子连接蛋白表达载体。
[0016]
上述外显子连接蛋白在提高重组蛋白表达水平方面的应用。进一步优选的,所述重组蛋白通过哺乳动物重组蛋白表达系统制备而成。更进一步的,上述外显子连接蛋白表达载体应用于表达外显子连接蛋白,用于提高重组蛋白表达水平。
[0017]
一种重组蛋白表达系统,由上述外显子连接蛋白表达载体与含目的基因的表达载体共转染宿主细胞构建而成。
[0018]
可选的,所述宿主细胞为cho、hek293、bhk或c127;优选的,所述宿主细胞为cho。
[0019]
可选的,重组蛋白表达系统构建过程中,外显子连接蛋白表达载体与含目的基因的表达载体的转染比例为2:1、1:1或1:2。进一步优选的,外显子连接蛋白表达载体与含目的基因的表达载体的转染比例为1:2。
[0020]
上述重组蛋白表达系统可以采用任何已知的方法构建而成,包括分别构建外显子连接蛋白表达载体、含有目的基因的表达载体,然后将构建的外显子连接蛋白表达载体与含有目的基因的表达载体按照一定的比例共转染入宿主细胞,通过筛选即获得重组蛋白表达系统。其中目的基因来自人及其他哺乳动物、植物、昆虫或微生物。
[0021]
上述重组蛋白表达系统在制备含目的蛋白的药物制剂、诊断试剂方面的应用
[0022]
本发明通过构建含有外显子连接蛋白的重组蛋白表达系统,将外显子连接蛋白应用于重组蛋白的表达,同等条件下,与不含外显子连接蛋白的细胞系进行比较,能够显著提
高重组蛋白的表达量,表达水平提高6~11倍多。
[0023]
同时可以理解的是,上述通过构建表达外显子连接蛋白的表达载体,再与含有目的基因的表达载体共转染宿主细胞构建重组蛋白表达系统,仅仅是外显子连接蛋白应用于重组蛋白表达的一个举例说明,其他能够使外显子表达蛋白发挥其剪接mrna的翻译能力的应用方式均在本发明的保护范围内。
附图说明
[0024]
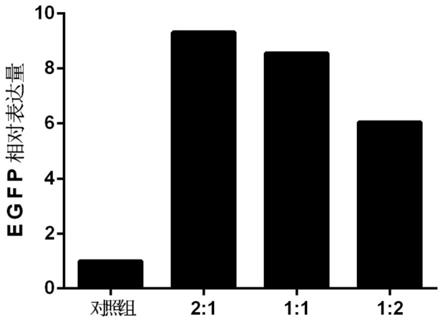
图1为试验例1瞬时表达情况下本发明外显子连接蛋白与egfp基因共转染与不含外显子连接蛋白的egfp的表达水平比较结果;
[0025]
图2为试验例2稳定表达情况下本发明外显子连接蛋白与egfp基因共转染与不含外显子连接蛋白的egfp的表达水平比较结果;
[0026]
图3为试验例1瞬时表达情况下本发明外显子连接蛋白基因与epo基因共转染与不含外显子连接蛋白的epo的表达水平比较结果;
[0027]
图4为试验例2稳定表达情况下本发明外显子连接蛋白基因与epo基因共转染与不含外显子连接蛋白的epo的表达水平比较结果。
具体实施方式
[0028]
实施例及试验例中所用的各类培养基、试剂、大肠杆菌(e.coli jm109)pires-neo质粒、细胞系试剂、工具酶等均为市售商品。pires-neo、pires-neo2、pires-neo3、prc/cmv、pee6.4、pee12.4、pegfp-c1、pcdna3.1、pcho1.0质粒等均为市售商品。下述实施例仅对本发明作进一步详细说明,但不构成对本发明的任何限制。
[0029]
实施例1外显子连接蛋白基因的合成
[0030]
根据seq id no.1所示氨基酸序列,按照cho细胞密码子偏爱性,设计外显子连接蛋白(ejc)基因序列,如seq id no.2所示。为便于克隆,在合成的基因序列5
′
端引入ecori(gaattc)酶切位点,3
′
端引入bamhi酶切位点(ggatcc)。
[0031]
实施例2含有外显子连接蛋白基因表达载体构建
[0032]
用ecori/bamhi分别双酶切实施例1合成的ejc基因序列,ejc序列的双酶切体系为:ejc序列10μl(1μg/μl),10
×
ne buffer 3.1 3μl,ecori/bamhi(10u/μl)各1.0μl,补足水至30μl;酶切条件为:37℃,酶切3min。
[0033]
用ecori/bamhi双酶切pires-neo质粒dna载体;pires-neo质粒的双酶切体系为:pires-neo质粒5μl(1μg/μl),10
×
ne buffer 3.1 2μl,ecori/bamhi(10u/μl)各0.5μl,补足水至20μl;酶切条件为:37℃,酶切3min。
[0034]
琼脂糖凝胶电泳鉴定酶切结果,凝胶回收酶切后的外显子连接蛋白序列片段和pires-neo线形质粒dna。
[0035]
取酶切后的ejc序列片段和pires-neo线形质粒dna(摩尔比5:1),使用neb公司
tm
的连接试剂盒,25℃连接5min。将连接产物加入到大肠杆菌(e.coli)jm109菌株感受态细胞悬液中转化,取150μl转化菌液接种到含有氨苄青霉素的lb平板上,37℃培养过夜,挑取单菌落继代培养。提取重组质粒并进行双酶切(ecori/bamhi)验证,取酶切验证正确的质粒进行测序验证,构建正确的质粒命名为pires-ejc(包含如seq id no.2所示序列)。
1.0-egfp。
[0052]
实施例5 epo重组表达载体的构建
[0053]
步骤如下:
[0054]
1)pcr扩增人epo基因
[0055]
根据人epo序列(genbank:kf178447.1,第10~591位碱基)设计引物p3和p4(用于扩增582bp的人epo基因dna),引物的5
′
端分别引入ecorv、paci酶切位点,引物序列如下(下划线为酶切位点):
[0056]
p3:5
′-
ccggatatcatgggggtgcacgaa-3
′
;
[0057]
p4:5
′-
cta ttaattaa aactctgtcccctgtcctg-3
′
。
[0058]
提取人外周血基因组dna,作为pcr扩增的模板,使用引物p3、p4扩增人epo基因,反应体系和反应条件基本同实施例4,p1、p2替换为p3、p4即可。
[0059]
琼脂糖凝胶电泳回收pcr扩增产物,纯化后送生物公司测序验证。结果表明,扩增出的dna片段与genbank公开的人epo序列完全一致。
[0060]
2)构建含epo序列的表达载体
[0061]
用ecorv、paci双酶切人epo序列的pcr扩增产物(经测序验证正确的序列),同时用ecorv、paci双酶切pcho 1.0(包含如seq id no.2所示序列)。琼脂糖凝胶电泳鉴定酶切结果,凝胶回收酶切后的人epo序列片段和pcho 1.0线性质粒dna。
[0062]
人epo序列的酶切体系为:1μl 10
×
neb buffer 2.1,10u/μl ecorv、paci酶各0.5μl,0.78μg/μl epo扩增产物1.39μl,补足水至20μl。充分混匀后,37℃孵育6h。
[0063]
质粒的酶切体系为:1μl 10
×
neb buffer 2.1 1μl,10u/μl ecorv、paci酶各0.5μl,1.17μl质粒pcho 1.0(0.854μg/μl),补足水至20μl。充分混匀后,37℃孵育3h。
[0064]
取酶切后的人epo序列片段和pcho 1.0线性质粒dna,用t4连接酶进行连接(连接体系为:2
×
quick ligation buffer 10μl,pcho 1.0线性质粒dna 200ng,酶切后的epo序列片段70.5ng,350u/μl t4连接酶1μl,补足水至20μl),16℃连接过夜。将连接产物加入e.coli jm109感受态细菌悬液中转化,取100μl转化菌液接种在含有氨苄青霉素的lb固体培养板上,37℃培养过夜,挑取单菌落摇菌培养。提取细菌质粒并进行重组质粒的酶切验证,选取酶切鉴定正确的质粒,进行测序验证,将目的基因序列完全正确的载体命名为pcho 1.0-epo。
[0065]
上述实施例制备的外显子连接蛋白能够应用于哺乳动物重组蛋白的表达,提高重组蛋白的表达量水平高,应当可以理解的是与上述实施例提供的外显子连接蛋白的基因序列同源性≥80%的蛋白同样也可应用于提高重组蛋白的表达量水平。具体的应用方式包括将上述实施例制备的含有外显子连接蛋白基因序列的表达载体,与含有外源目的基因的表达载体共转染至哺乳动物宿主细胞,例如cho细胞等,获得外源目的基因重组蛋白表达系统,培育该表达系统,即可得到外源目的基因蛋白。下面分别以试验例1~4验证本发明外显子连接蛋白对哺乳动物重组蛋白表达系统的目的基因表达量水平的影响。
[0066]
试验例1 ejc对cho细胞外源egfp基因瞬时表达的影响
[0067]
cho细胞于37℃、5%co2条件下,在含10%灭活胎牛血清的dmem培养基中培养。在6孔板内接种cho细胞(3
×
106/孔),铺板培养24小时后细胞达到约90%融合度。以lip3000(3000)为转染试剂,将表达载体pcho 1.0-egfp单独转染、pcho1.0-egfp与
pires-ejc质粒按照2:1、1:1、1:2共转染进入cho细胞中。将培养基换成无血清培养基进行培养。每天细胞计数,第5-6天细胞凋亡数高于50%收集细胞进行流式细胞检测,分析ejc对egfp基因瞬时表达的影响,试验结果见图1。
[0068]
由图1可知,与pcho 1.0-egfp的对照载体相比,按照2:1、1:1、1:2共转染pcho1.0-egfp、pires-ejc的均能显著提高egfp基因的瞬时表达水平,增加倍数达9.32、8.56、6.04倍(p<0.05)。所有数据均为三次重复试验统计数据。
[0069]
试验例2 ejc对cho细胞外源egfp基因稳定表达的影响
[0070]
用含浓度为800μg/ml g418与10μg/ml嘌呤霉素的培养基培养细胞,正常cho细胞(未转染细胞)全部死亡时降低g418浓度,换用含500μg/ml g418及5μg/ml的培养基维持多克隆细胞生长,两周后得到稳定转染的多克隆cho细胞株。待细胞密度达到1
×
106个细胞/ml时,收集细胞进行流式细胞检测,分析ejc对重组基因稳定表达的影响,试验结果见图2。
[0071]
由图2可知,与pcho 1.0-egfp的对照载体相比,按照2:1、1:1、1:2共转染pcho1.0-egfp、pires-ejc能提高egfp基因的稳定表达水平达11.32、9.43、6.76倍(p<0.05)。所有数据均为三次重复试验统计数据。
[0072]
试验例3 ejc对cho细胞人epo基因瞬时表达的影响
[0073]
按照上述试验例1进行pcho 1.0-epo单独转染、pcho 1.0-epo与pires-ejc质粒按照2:1、1:1、1:2共转染进入cho细胞,进行瞬时表达实验,每天细胞计数,培养至第七天收集细胞上清,用elisa检测试剂盒测定各组目的蛋白epo的表达量,试验结果见图3。
[0074]
由图3可知,转染pcho 1.0-epo的cho细胞epo产量仅为5.48mg/l,按照2:1、1:1、1:2共转染pires-ejc的cho细胞epo体积产量为56.94mg/l、51.89mg/l、41.54mg/l,分别提高10.39、9.47、7.58倍(p<0.05)(p<0.05),说明ejc序列可显著提高提高epo基因的表达,其中以共转染2:1效果最为显著。
[0075]
试验例3 ejc对cho细胞人epo基因稳定表达的影响
[0076]
用含浓度为800μg/ml g418与10μg/ml嘌呤霉素的培养基培养细胞,正常cho细胞(未转染细胞)全部死亡时,换用含500μg/ml g418及5μg/ml的培养基维持多克隆细胞生长,两周后得到稳定转染的多克隆cho细胞株。将稳定转染epo的多克隆细胞株转入125ml悬浮培养瓶中,初始细胞量为5~6
×
106个/ml,加入30ml无血清培养基,120rpm悬浮培养。每天细胞计数,并收集细胞上清,用elisa检测试剂盒测定各组目的蛋白epo的表达量,试验结果见图4。
[0077]
由图4可知,转染pcho 1.0-epo的cho细胞epo产量仅为16.35mg/l,按照2:1、1:1、1:2共转染pires-ejc的cho细胞epo体积产量为195.09mg/l、165.27mg/l、139.19mg/l,分别提高11.93倍、10.10倍、8.51倍(p<0.05),其中以共转染2:1效果最为显著。
[0078]
未特别指明的,实施例及试验例中相关操作均为领域内常规技术手段,比如参照sambrook等编著的分子克隆实验手册(sambrook j&russell dw.molecular cloning:a laboratory manual.2001),或者产品制造厂商提供的说明书等。
[0079]
实施例及试验例中所用细胞系、质粒载体、试剂、工具酶等均为市售商品。
[0080]
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;
而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
[0081]
[0082]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1