一种利用全细胞转化制备覆盆子酮的方法与流程
本发明涉及一种利用全细胞转化制备覆盆子酮的方法,属于基因工程技术领域。
背景技术:
覆盆子酮最早从覆盆子果中提取出来,是覆盆子果的主要香气成分,具有特征性甜果香气,天然覆盆子酮一般从植物中提取,如树莓、黑莓、悬钩子的果实中,产量较少且价格昂贵,每公斤约3000美元。市场上普遍使用的覆盆子酮是利用化石燃料对羟基苯甲醛和丙酮合成得到的。现如今在香料工业中,覆盆子酮已经成为一种具有极高经济价值的香料,且仅次于香兰素。覆盆子酮由于其特有的果香在食用香精、化妆品、诱虫剂、医药等方面应用广泛。覆盆子酮的乙酸酯(4-对乙酰氧基苯基-2-丁酮,ceulure)被称为诱蝇酮,是一种昆虫引诱剂,对瓜蝇的检测和防治起到了巨大作用(floridaentomologist,1995);覆盆子酮还被发现可以剂量依赖性的降低血糖,增加胰岛素分泌,从而起到降糖的作用(lifesciences,2005)。
目前的覆盆子酮的合成主要为化学合成和生物合成。
其中,覆盆子酮的化学合成路径比较多,但生产上主要有3种:albertus等人使用甲基乙烯基酮和苯酚为原料,强酸作为催化剂来合成覆盆子酮,再经萃取、蒸馏、重结晶等操作后得到覆盆子酮成品,收率约为69%,但该合成工艺中使用的原料甲基乙烯基酮的制备方法特别复杂,毒性较大,未能得到大范围推广;以苯酚和丁醇酮为原料,在酸催化下进行烷基化反应生成覆盆子酮,使用丁醇酮可以替代具有毒性甲基乙烯基酮,但反应过程中丁醇酮易失水生成甲基乙烯酮,并伴有其他的副产物的生成,而且此反应同样要求在强酸和低温条件下进行,也存在环境污染、设备腐蚀等问题;claisen-schmidt缩合法用对羟基苯甲醛和丙酮进行缩合之后加氢还原反应生成覆盆子酮,该方法收率高,产品质量好,但也会造成设备腐蚀、环境污染等问题。
而生物法合成覆盆子酮目前还处于实验室阶段;1998年fuganti等人利用14种不同微生物将对羟基亚苄基丙酮还原,可检测到覆盆子酮产生(journalofmolecularcatalysisbenzymatic,1998);2007年beekwilder等基于大肠杆菌中苄基丙酮还原酶的活性进一步引入来源于烟草的对香豆酸:coa连接酶与来源于树莓的查尔酮合成酶在大肠杆菌和酵母表达系统中进行表达,在大肠杆菌中覆盆子酮仅仅达到了5mg/l的产量(biochemicaljournal,2006);2019年王程程等人于在大肠杆菌中过表达源于植物的编码4-香豆酰辅酶a连接酶、苄基丙酮合酶、苄基丙酮还原酶3个基因,通过在发酵培养基中添加对香豆酸,仅仅只是获得了178mg/l覆盆子酮的产量(appliedmicrobiologyandbiotechnology,2019);可见,上述发酵法生产覆盆子酮的浓度普遍不高,并且发酵时间较长;多种异源蛋白的表达增加了大肠杆菌的代谢负担,并且前体底物与代谢的中间产物均对细胞具有毒性,不利于菌体生长和前体底物转化,也满足不了生产要求。
技术实现要素:
本发明所要解决的技术问题是提供一种低成本、操作简单且生产效率高的制备覆盆子酮的方法。
为解决上述技术问题,本发明的基本思路是:苄基丙酮还原酶是一种nadph依赖型还原酶,是覆盆子酮合成的关键酶,对底物亚苄基丙酮具有很强的特异性和很高的催化效率;而葡萄糖脱氢酶sygdh是一种来源于嗜酸嗜热菌thermoplasmaacidophilum的nadp+依赖型的葡萄糖脱氢酶,对底物葡萄糖和nadp+具有较强特异性。通过共表达葡萄糖脱氢酶来维持辅因子再生循环,使反应持续进行;本发明以对羟基亚苄基丙酮为底物,利用共表达苄基丙酮还原酶和葡萄糖脱氢酶,一步法催化生产覆盆子酮。这使得底物浓度可以维持在较高水平且大大缩短生产时间,菌体生长与生产催化合成反应分离步进行,可以极大的减轻底物与产物对细胞生长的抑制。
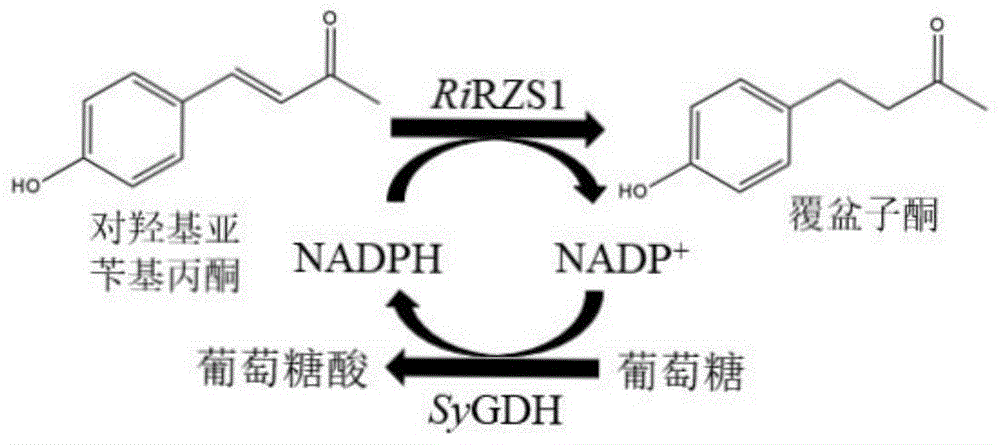
本发明的反应原理(如图1所示)如下:
苄基丙酮还原酶转化底物对羟基亚苄基丙酮时会同时消耗辅因子nadph,从而产生产物覆盆子酮和nadp+,为了维持反应的进行,引入的葡萄糖脱氢酶sygdh可以以葡萄糖为底物同时消耗辅因子nadp+,从而再生nadph并产生副产物葡萄糖酸,nadph得到再生后可继续用于苄基丙酮还原酶催化的反应。副产物葡萄糖酸进入细胞自身代谢途径参加代谢。
本发明提供了一种高产覆盆子酮的重组大肠杆菌,该重组大肠杆菌共表达了来苄基丙酮还原酶和葡萄糖脱氢酶。
在本发明的一种实施方式中,所述苄基丙酮还原酶的核苷酸序列如seqidno.1所示。
在本发明的一种实施方式中,所述葡萄糖脱氢酶核苷酸序列如seqidno.2所示。
在本发明的一种实施方式中,所述重组大肠杆菌以prsfduet-1、pacycduet-1、pcdfduet-1、petduet-1、pet-20b(+)或pet-28a(+)为表达载体;共表达来源于rubusidaeus的苄基丙酮还原酶和来源于thermoplasmaacidophilum的葡萄糖脱氢酶。
在本发明的一种实施方式中,以e.colibl21(de3)为宿主。
在本发明的一种实施方式中,所述表达载体中,编码所述苄基丙酮还原酶的基因位于编码所述葡萄糖脱氢酶的基因的下游。
本发明还提供了一种构建上述重组大肠杆菌的方法,包括如下步骤:
(1)将编码苄基丙酮还原酶的基因以及编码葡萄糖脱氢酶的基因克隆到同一载体上,其中,编码苄基丙酮还原酶的基因位于编码葡萄糖脱氢酶的基因的下游;
(2)步骤(1)构建的表达载体转化至宿主细胞中。
在本发明的一种实施方式中,将(1)构建的表达载体,导入大肠杆菌bl21(de3)感受态细胞,在含30~100mg/l卡那霉素的lb抗性平板上筛选获得构建正确的表达载体。
本发明还提供了一种全细胞转化生产覆盆子酮的方法,将上述重组大肠杆菌经培养后,添加至含有对羟基亚苄基丙酮和葡萄糖的反应体系中,进行转化反应。
在本发明的一种实施方式中,所述重组大肠杆菌的培养条件为:将重组大肠杆菌接种于含有30~100mg/l卡那霉素的lb液体培养基中,于37℃过夜培养获得种子液;再将种子液以2~5%(v/v)的接种量接种于含有30~100mg/l卡那霉素的tb液体培养基中,37℃培养至od600为0.3~1.8,得到培养液;向得到的培养液中加入终浓度为0.4~1.4mmol·l-1的诱导剂iptg,在16-25℃下诱导培养5~7h,得到发酵液;将发酵液离心取湿菌体。
在本发明的一种实施方式中,所述重组大肠杆菌以湿菌体添加至反应体系中,具体步骤为:采用ph为4.5~8.0的缓冲液重悬至重组大肠杆菌菌体浓度达到100g/l-200g/l后,添加至反应体系中进行反应。
在本发明的一种实施方式中,所述缓冲液为ph4.5~6.0的柠檬酸盐缓冲液。
在本发明的一种实施方式中,所述柠檬酸盐缓冲液浓度为0.1~0.3mol·l-1;柠檬酸盐缓冲液成分为柠檬酸和柠檬酸钠。
在本发明的一种实施方式中,所述缓冲液为pbs缓冲液。
在本发明的一种实施方式中,反应体系中底物对羟基亚苄基丙酮的浓度为1~20g/l。
在本发明的一种实施方式中,底物葡萄糖的浓度为20~300mm。
在本发明的一种实施方式中,反应温度为25~50℃。
在本发明的一种实施方式中,反应体系中还包含有机溶剂,将底物溶于有机溶剂中。
在本发明的一种实施方式中,所述有机溶剂包括甲醇。
在本发明的一种实施方式中,反应体系中,底物对羟基亚苄基丙酮和辅底物葡萄糖的比例为:1:3~3:1。
本发明还提供了上述重组大肠杆菌或上述方法在制备含覆盆子酮的食品、药品方面的应用。
有益效果
(1)本发明以异源表达覆盆子来源的苄基丙酮还原酶rirzs1的微生物全细胞为催化剂进行生物催化反应;采用本发明提供的方法,在50ml体系中,加入终浓度10g/l的亚苄基丙,在45℃下反应1小时,产物覆盆子酮浓度可高达9.4g/l。
(2)本发明是建立在全细胞催化的基础上的,由于细胞具有维持其生命活动的完整的多酶系统,各种酶又保持着原有活细胞所处的状态和特定位置,因此用微生物细胞直接作为催化剂进行酶催化反应,能迅速高效的完成酶催化反应;在本发明中利用微生物细胞,采用全细胞催化技术保证了胞内酶系统的完整性;其特点在于克服了化学合成法成本高,条件苛刻,使用大量酸碱有毒试剂和生物法生产效率低,对细胞生长毒性大的缺陷。制备过程更加环保,能耗更低且效率更高。
(3)由于覆盆子来源的异源酶苄基丙酮还原酶(rirzs)为nadph依赖型酶,催化反应需要还原型烟酰胺腺嘌呤二核苷酸磷酸(nadph)作为辅酶,反应消耗大量nadph导致还原力快速下降;而嗜酸嗜热菌来源的葡萄糖脱氢酶sygdh可利用细胞自身nadp+,以葡萄糖为底物,直接在胞内再生nadph,因此能够迅速有效的完成催化反应,相对于其他生物法合成,具有转化效率高、成本低,以及污染小的优点。
附图说明
图1:本发明的实验原理示意图。
图2:单质粒表达体系的催化活性与双质粒表达体系比较。
图3:不同诱导剂浓度下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果。
图4:不同诱导温度下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果。
图5:不同诱导剂加入时机下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果。
图6:不同缓冲液ph下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果。
图7:不同反应温度下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果。
图8:不同菌体终浓度下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果。
图9:不同底物与辅底物摩尔比下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果。
图10:最佳条件下全细胞催化反应过程中产物增加和辅底物的消耗情况。
具体实施方式
下面结合具体实施例对本发明进行进一步的阐述,根据下述实施例,可以更好的理解本发明;然而,本领域的技术人员容易理解,实施例所描述的具体物料配比、工艺条件及其结果仅用于说明本发明,不应当也不会限制权利要求书中所详细描述的本发明。
下述实施例中涉及的大肠杆菌jm109感受态细胞、大肠杆菌bl21(de3)感受态细胞、prsfduet-1、pacycduet-1、pcdfduet-1、petduet-1、pet-20b(+)和pet-28a(+)载体购自novagen公司,所涉及的柠檬酸缓冲液、对羟基亚苄基丙酮、葡萄糖均购自国药集团。
下述实施例中涉及的培养基如下:
lb液体培养基:10g/l蛋白胨,5g/l酵母粉和10g/lnacl。
lb固体培养基:10g/l蛋白胨,5g/l酵母粉,10g/lnacl和10g/l琼脂粉。
tb液体培养基:酵母粉24g·l-1,蛋白胨12g·l-1,甘油4ml·l-1,磷酸二氢钾17mmol·l-1,磷酸氢二钾72mmol·l-1。
下述实施例中涉及的检测方法如下:
覆盆子酮含量检测方法:
采用高效液相色谱(highperformanceliquidchromatography,hplc)分析,分别为waters高效液相色谱仪,waters2487紫外检测器,waters2707自动进样器,以及waters1525hplc泵。
样品处理方法:1ml转化液14000r·min-1离心5min,之后取100μl上清液与9倍体积的甲醇混合后再14000r·min-1离心8min,用0.22μm的滤膜过滤,hplc(waters)定量检测底物对羟基亚苄基丙酮和产物覆盆子酮。
具体检测条件:色谱柱为amethystc18-h(4.6×250mm,5μm)反相色谱柱,检测波长222nm,柱温35℃,流动相为乙腈∶0.1%磷酸=2:8,进样量为20μl,流速1ml·min-1,单个样品运行时间为20min。
实施例1:含有葡萄糖脱氢酶基因sygdh的重组质粒的构建
具体步骤如下:
以经密码子优化后的核苷酸序列如seqidno.2所示的葡萄糖脱氢酶基因sygdh为模板,以sygdh-f,sygdh-r为引物进行pcr扩增;pcr反应条件为:90-95℃预变性3~5min,94℃变性30~45sec,55℃退火30~45sec,70~72℃延伸1min,30个循环,70~72℃充分延伸5~10min。
pcr反应结束后,琼脂糖凝胶电泳检测pcr产物,切胶回收葡萄糖脱氢酶基因sygdh。所述引物为:
sygdh-f:ggatccatgaccgaacagaaag(seqidno.3)
sygdh-r:aagcttgcggccgcttactgc(seqidno.4)
将上述步骤获得葡萄糖脱氢酶基因sygdh分别与载体petduet-1,pacycduet-1,pcdfduet-1和prsfduet-1通过连接酶连接,得到连接产物,将连接产物导入大肠杆菌jm109感受态细胞,得到转化产物,将转化产物涂布于含有30~100mg/l的氨苄青霉素、氯霉素、硫酸链霉素和卡那霉素抗性的lb固体培养基,挑取阳性克隆,菌落pcr验证正确即获得重组质粒,分别命名为:pet-sygdh,pacyc-sygdh,pcdf-sygdh和prsf-sygdh。送苏州金唯智生物科技有限公司测序。
实施例2:含葡萄糖脱氢酶基因sygdh和苄基丙酮还原酶基因rirzs1的重组质粒的构建
具体步骤如下:
以经密码子优化后的核苷酸序列如seqidno.1所示的苄基丙酮还原酶基因rirzs1为模板,以rirzs1-f,rirzs1-r为引物进行pcr扩增;pcr反应条件为:90-95℃预变性3~5min,94℃变性30~45sec,55℃退火30~45sec,70~72℃延伸1min,30个循环,70~72℃充分延伸5~10min。
pcr反应结束后,琼脂糖凝胶电泳检测pcr产物,切胶回收苄基丙酮还原酶基因rirzs1。所述引物为:
rirzs1-f:agatctatggccagcggc(seqidno.5)
rirzs1-r:ggtaccttattcacggctaacca(seqidno.6)
将上述步骤获得苄基丙酮还原酶基因rirzs1与实施例1得到的重组载体pet-sygdh,pacyc-sygdh,pcdf-sygdh和prsf-sygdh用连接酶进行连接,得到连接产物,将连接产物导入大肠杆菌jm109感受态细胞,得到转化产物,将转化产物分别涂布于含有100mg/l的氨苄青霉素、50mg/l氯霉素、50mg/l硫酸链霉素和50mg/l卡那霉素抗性的lb固体培养基,挑取阳性克隆,菌落pcr验证正确即获得重组质粒,分别命名为:pet-sygdh-rirzs1,pacyc-sygdh-rirzs1,pcdf-sygdh-rirzs1和prsf-sygdh-rirzs1。送苏州金唯智生物科技有限公司测序。
实施例3:共表达苄基丙酮还原酶和葡萄糖脱氢酶的重组大肠杆菌构建
具体步骤如下:
(1)将实施例2构建的重组质粒pet-sygdh-rirzs1,pacyc-sygdh-rirzs1,pcdf-sygdh-rirzs1和prsf-sygdh-rirzs1分别转入大肠杆菌bl21(de3)感受态细胞中,得到含单一质粒的重组工程菌株bl21/pet-sygdh-rirzs1,bl21/pacyc-sygdh-rirzs1,bl21/pcdf-sygdh-rirzs1和bl21/prsf-sygdh-rirzs1。
(2)含双质粒表达载体pet20b(+)-rirzs1和pet28a(+)-sygdh的重组工程菌株构建
以经密码子优化后的核苷酸序列如seqidno.2所示的葡萄糖脱氢酶基因sygdh和经密码子优化后的核苷酸序列如seqidno.1所示的苄基丙酮还原酶基因rirzs1为模板,以sygdh-f-ncoi,sygdh-r-xhoi,rirzs1-f-ndei,rirzs1-r-kpni为引物进行pcr扩增;pcr反应条件为:90-95℃预变性3~5min,94℃变性30~45sec,55℃退火30~45sec,70~72℃延伸1min,30个循环,70~72℃充分延伸5~10min。
pcr反应结束后,琼脂糖凝胶电泳检测pcr产物,切胶回收葡萄糖脱氢酶基因sygdh和苄基丙酮还原酶基因rirzs1。所述引物为:
sygdh-f-ncoi:ccatgggcggatccatgaccgaac(seqidno.7)
sygdh-r-xhoi:ctcgagttactgccatttgataacggttttg(seqidno.8)
rirzs1-f-ndei:catatggcagatctatggccag(seqidno.9)
rirzs1-r-kpni:ggtaccttattcacggctaacc(seqidno.10)
将上述步骤获得葡萄糖脱氢酶基因sygdh和苄基丙酮还原酶基因rirzs1分别与载体pet-28a(+)和pet-20b(+)连接,得到连接产物,将连接产物导入大肠杆菌jm109感受态细胞,得到转化产物,将转化产物涂布于含有50mg/l的卡那霉素和100mg/l氨苄青霉素抗性的lb固体培养基,挑取阳性克隆,菌落pcr验证正确获得重组质粒:pet20b(+)-rirzs1和pet28a(+)-sygdh。送苏州金唯智生物科技有限公司测序。
将已构建质粒同时转入大肠杆菌bl21(de3)感受态中构建重组工程菌株bl21/pet-28a(+)-sygdhandpet-20b(+)-rirzs1。
实施例4:共表达苄基丙酮还原酶和葡萄糖脱氢酶的重组工程菌株的培养
具体步骤如下:
(1)将实施例3中获得的重组工程菌株bl21/pet-sygdh-rirzs1,bl21/pacyc-sygdh-rirzs1,bl21/pcdf-sygdh-rirzs1和bl21/prsf-sygdh-rirzs1分别在含有100mg/l的氨苄青霉素、50mg/l氯霉素、50mg/l硫酸链霉素和50mg/l卡那霉素抗性的lb固体培养基上划线,在37℃下培养活化后,再分别挑取经活化后的bl21/pet-sygdh-rirzs1,bl21/pacyc-sygdh-rirzs1,bl21/pcdf-sygdh-rirzs1和bl21/prsf-sygdh-rirzs1的单菌落,分别接种于含有100mg/l的氨苄青霉素、50mg/l氯霉素、50mg/l硫酸链霉素和50mg/l卡那霉素抗性的lb液体培养基中,在37℃,220rpm下培养10h获得种子液;
将实施例3中获得的重组工程菌株bl21/pet-28a(+)-sygdhandpet-20b(+)-rirzs1在含有50mg/l的卡那霉素和100mg/l氨苄青霉素抗性的lb固体培养基划线,在37℃下培养活化,再挑取单菌落接种于含有50mg/l的卡那霉素和100mg/l氨苄青霉素抗性的lb液体培养基中,在37℃,220rpm下培养10h,获得种子液。
(2)分别将步骤(1)得到的种子液按2~5%(v/v)的接种量接种至tb液体培养基中,于37℃,220rpm摇床中培养1h,培养至od600为0.3~1.8后,加入终浓度为1.0mmol·l-1的诱导剂iptg,在25℃,220rpm下诱导21h后,在4℃,8000rpm条件下离心10min得到菌体,分别为:bl21/pet-sygdh-rirzs1,bl21/pacyc-sygdh-rirzs1,bl21/pcdf-sygdh-rirzs1、bl21/prsf-sygdh-rirzs1和bl21/pet28a(+)-sygdhandpet20b(+)-rirzs1的菌体于-20℃下保存备用。
实施例5:单质粒表达体系的催化活性与双质粒表达体系比较
具体步骤如下:
将实施例4中获得的菌体,用ph5.0的柠檬酸盐缓冲液重悬,至菌体浓度达到200g/l得到重悬液,在每5ml重悬液中加入终浓度为10g·l-1的对羟基亚苄基丙酮和终浓度为50mm的辅底物葡萄糖,得到反应体系;将反应体系分别在40℃下反应10min,30min和60min后取样,结束反应。
向反应体系中加入甲醇,沉淀后离心,取上清,用hplc对产物进行定量分析,产物覆盆子酮的产量的检测结果如表1所示:
表1含不同载体的重组菌对催化效果的影响
由表1和图2可知,采用载体prsfduet-1构建的重组菌的催化效果最佳。
实施例6:不同诱导剂浓度下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果
将实施例4中步骤(1)得到的bl21/prsf-sygdh-rirzs1种子液以2%(v/v)的接种量接种至tb液体培养基中,于37℃下220rpm摇床培养1.5小时,至od600为0.6后,加入终浓度为0.4~1.4mmol·l-1的诱导剂,在25℃下220rpm摇床诱导培养21小时,离心后取菌体进行催化反应;
分别取不同诱导剂浓度下得到的菌体,用ph5.0的柠檬酸盐缓冲液重悬,至菌体浓度达到200g/l得到重悬液,在每5ml重悬液中加入终浓度为2g·l-1的对羟基亚苄基丙酮和终浓度为50mm的辅底物葡萄糖,得到反应体系;将反应体系置于40℃下,反应30min后结束反应;
向反应体系中加入甲醇,沉淀后离心,取上清,用hplc对产物进行定量分析,产物覆盆子酮的产量的检测结果如表2所示:
表2不同诱导剂浓度下全细胞催化剂催化效果
由表2和图3可知,全细胞催化剂bl21/prsf-sygdh-rirzs1在0.8~1.2mmol·l-1诱导剂浓度下转化效率较高,其中,在0.8mmol·l-1诱导剂浓度下转化效率最高,为1637.7mg/l。
实施例7:不同诱导温度下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果
将实施例4中步骤(1)得到的bl21/prsf-sygdh-rirzs1种子液以2%(v/v)的接种量接种至tb液体培养基中,于37℃下220rpm摇床培养1.5小时,至od600为0.6后,加入终浓度为0.8mmol·l-1的诱导剂,分别在16℃,20℃,25℃下220rpm摇床诱导培养21小时,离心后取菌体进行催化反应;
分别取不同诱导温度下得到的菌体,用ph5.0的柠檬酸盐缓冲液重悬,至菌体浓度达到200g/l得到重悬液,在每5ml重悬液中加入终浓度为2g/l的对羟基亚苄基丙酮和终浓度为50mm的辅底物葡萄糖,得到反应体系;将反应体系置于40℃下,反应10min后结束反应;
向反应体系中加入甲醇,沉淀后离心,取上清,用hplc对产物进行定量分析,产物覆盆子酮的产量的检测结果如表3所示:
表3不同诱导温度下全细胞催化剂催化效果
由表3和图4可知,诱导温度在20℃下诱导20h时,全细胞催化剂的催化效果最好,10min内产物的产量高达467.1mg/l。
实施例8:不同诱导剂加入时机的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果
将实施例4中步骤(1)得到的bl21/prsf-sygdh-rirzs1种子液以2%(v/v)的接种量接种至tb液体培养基中,于37℃下220rpm摇床培养1.5小时,至od600值分别为0.3,0.6,0.9,1.2,1.4后,加入终浓度为0.8mmol·l-1的诱导剂,在25℃下220rpm摇床诱导培养21小时,离心后取菌体进行催化反应;
分别取不同诱导温度下得到的菌体,用ph5.0的柠檬酸盐缓冲液重悬,至菌体浓度达到200g/l得到重悬液,在每5ml重悬液中加入终浓度为2g/l的对羟基亚苄基丙酮和终浓度为50mm的辅底物葡萄糖,得到反应体系;将反应体系置于40℃下,反应10min后结束反应;
向反应体系中加入甲醇,沉淀后离心,取上清,用hplc对产物进行定量分析,产物覆盆子酮的产量的检测结果如表4所示:
表4不同od600条件下全细胞催化剂催化效果
由表4和图5可知,在od600为1.2时加入诱导剂诱导,全细胞催化剂的催化效果最好,10min内产物的产量高达431.2mg/l。
实施例9:不同缓冲液ph下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果
将实施例4中步骤(1)得到的bl21/prsf-sygdh-rirzs1种子液以2%(v/v)的接种量接种至tb液体培养基中,于37℃下220rpm摇床培养1.5小时,至od600为0.6后,加入终浓度为0.8mmol·l-1的诱导剂,在20℃下220rpm摇床诱导培养21小时,离心收集菌体进行催化反应;
将得到的菌体分别在ph4.5,5.0和5.5的柠檬酸盐缓冲液(cpbs)和ph6.0,6.5,7.0,7.5和8.0的pbs缓冲液中重悬,至菌体浓度达到200g/l,分别得到重悬液在每5ml重悬液分别中加入终浓度2g/l的对羟基亚苄基丙酮和50mm的辅底物葡萄糖,得到反应体系;将反应体系置于40℃下,反应10min后结束反应;
向反应体系中加入甲醇,沉淀后离心,取上清,用hplc对产物进行定量分析,产物覆盆子酮的产量的检测结果如表5所示:
表5不同缓冲液ph下全细胞催化剂催化效果
由表5和图6可知,采用ph为5.0~5.5的柠檬酸缓冲液重悬菌体后,全细胞催化剂的催化效果最佳,10min内最终产物浓度达到420.7mg/l。
实施例10:不同反应温度下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果
将实施例4中步骤(1)得到的bl21/prsf-sygdh-rirzs1种子液以2%(v/v)的接种量接种至发酵培养基中,于37℃下220rpm摇床培养1.5小时,至od600为0.6后,加入终浓度为0.8mmol·l-1的诱导剂,在20℃下220rpm摇床诱导培养21小时,离心后取菌体进行催化反应;
将得到的菌体在ph5.5的柠檬酸缓冲液(cpbs)重悬,至菌体浓度达到200g/l得到重悬液,在每5ml重悬液中加入终浓度为2g·l-1的对羟基亚苄基丙酮和终浓度为50mm的辅底物葡萄糖,得到反应体系;将反应体系分别在25-55℃下反应,反应10min后结束反应;
向反应体系中加入甲醇,沉淀后离心,取上清,用hplc对产物进行定量分析,产物覆盆子酮的产量的检测结果如表6所示:
表6不同反应温度下全细胞催化剂催化效果
由表6和图7可知,将反应体系置于40℃下,全细胞催化剂的催化效率最高,10min内产物的产量高达554.4mg/l。
实施例11:不同菌体终浓度下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果
将实施例4中步骤(1)得到的bl21/prsf-sygdh-rirzs1种子液以2%(v/v)的接种量接种至发酵培养基中,于37℃下220rpm摇床培养1.5小时,至od600为0.6后,加入终浓度为0.8mmol·l-1的诱导剂,在20℃下220rpm摇床诱导培养21小时,离心后取菌体进行催化反应;
将得到的菌体在ph5.5的柠檬酸缓冲液(cpbs)重悬,至菌体浓度达到100g/l、150g/l、200g/l分别得到重悬液,在每5ml重悬液中分别加入终浓度为10g·l-1的对羟基亚苄基丙酮和终浓度为50mm的辅底物葡萄糖,得到反应体系;将反应体系在40℃下反应,反应10min后结束反应;
向反应体系中加入甲醇,沉淀后离心,取上清,用hplc对产物进行定量分析,产物覆盆子酮的产量的检测结果如表7所示:
表7不同菌体浓度下全细胞催化剂催化效果
由表7和图8可知可知,将反应体系中菌体浓度提高至最高的200g/l时,全细胞催化剂的催化效率最高,10min内产物的产量高达554.4mg/l。
实施例12:不同底物与辅底物摩尔比下的bl21/prsf-sygdh-rirzs1全细胞催化剂催化效果
将实施例4中步骤(1)得到的bl21/prsf-sygdh-rirzs1种子液以2%(v/v)的接种量接种至tb液体培养基中,于37℃下220rpm摇床培养1.5小时至od600为0.6后,加入终浓度为0.8mmol·l-1的诱导剂,在20℃下220rpm摇床诱导培养21小时,离心后取菌体进行催化反应。
将得到的菌体在ph5.5的柠檬酸缓冲液(cpbs)重悬,至菌体浓度达到200g/l得到重悬液,在每5ml体系中分别加入底物与辅底物摩尔比为3:1,2:1,1:1,1:2和1:3的对羟基亚苄基丙酮和辅底物葡萄糖(底物与辅底物的具体用量如表7所示),得到反应体系;将反应体系置于40℃下反应,反应6h。
向反应体系中加入甲醇,沉淀后离心,取上清,用hplc对产物进行定量分析,产物覆盆子酮的产量的检测结果如表8所示:
表8不同底物与辅底物摩尔比下重组菌的催化效果
由表8和图9可知,当底物与辅底物摩尔比为1:3时,产物覆盆子酮的产量可高达8.3g·l-1。
实施例13:全细胞催化反应
将实施例4中步骤(1)得到的bl21/prsf-sygdh-rirzs1种子液以2%(v/v)的接种量接种至3l发酵罐中于37℃下400rpm1.5小时,至od600为0.6后,加入终浓度为0.80mmol·l-1的诱导剂,在20℃下400rpm发酵21小时,离心后取菌体进行催化反应;
将得到的菌体在在ph5.5的柠檬酸缓冲液中重悬,至菌体浓度达到200g/l后得到反应体系中,向反应体系中加入终浓度10g·l-1的对羟基亚苄基丙酮和32.4g·l-1的辅底物葡萄糖,在45℃下反应4小时后结束反应;
向反应体系中加入甲醇,沉淀后离心,取上清,用hplc对产物进行定量分析,结果如图10所示,覆盆子酮浓度达到9427.9mg/l。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种利用全细胞转化制备覆盆子酮的方法
<130>baa200951a
<160>10
<170>patentinversion3.3
<210>1
<211>1047
<212>dna
<213>人工序列
<400>1
atggccagcggcggcgagatgcaggtgagcaacaagcaggtgatcttccgcgattacgtt60
acaggcttcccgaaagagagcgacatggaactgaccacccgcagcatcaccctgaaactg120
ccgcagggtagcaccggtctgctgctgaaaaacctgtacctgagctgtgacccgtacatg180
cgcgcccgtatgacaaaccaccatcgcctgagctacgtggatagctttaaaccgggcagc240
ccgatcattggctatggcgtggcacgcgtgttagaaagcggcaacccgaagttcaatccg300
ggtgatctggtttggggctttaccggttgggaagagtatagcgtgatcaccgccaccgag360
agcctgttcaagattcacaacaccgatgtgccgctgagctactacaccggcctgctgggt420
atgccgggtatgaccgcctatgccggcttttacgaaatttgtagcccgaaaaagggcgag480
acagtgtatgttagcgcagccagtggtgcagtgggtcaactggttggccagtttgccaag540
ctgaccggctgctacgttgtgggcagcgccggtagcaaagagaaagtggacctgctgaaa600
aataaatttggttttgatgaagccttcaattacaaagaagaagccgacctggatgcagcc660
ctgcgtcgctatttcccggatggtattgatatttattttgaaaacgtgggcggcaagatg720
ctggatgccgttctgccgaacatgcgcccgaaaggccgcattgcagtgtgcggcatgatc780
agtcagtacaatctggagcagccggaaggtgtgcgcaatctgatggccctgatcgtgaaa840
caggtgcgcatggaaggcttcatggtgtttagctattatcacctgtatggcaagttcctg900
gaaacagtgctgccgtacatcaagcagggcaagatcacctacgtggaagatgtggtggac960
ggcctggataatgcaccggccgccctgattggtctgtattctggtcgtaatgtgggcaaa1020
caagtggttgtggttagccgtgaataa1047
<210>2
<211>1086
<212>dna
<213>人工序列
<400>2
atgaccgaacagaaagccatcgttaccgatgccccgaaaggcggcgttaaatacaccacc60
atcgacatgccggaacctgaacattacgatgccaaactgagcccggtttacatcggcatc120
tgcggcaccgatcgcggcgaagttgccggcgccctgagcttcacctacaatccggaaggc180
gaaaatttcctggttctgggccatgaagccctgctgcgcgttgatgatgcccgcgataat240
ggctacatcaaaaaaggcgatctggttgttccgctggttcgtcgcccgggcaaatgcatc300
aattgtcgcatcggccgccaggataattgcagcatcggcgatccggataaacatgaagcc360
ggcatcaccggtctgcatggcttcatgcgcgatgttatctacgatgatatcgaatacctg420
gttaaagttgaagatccggaactgggccgcatcgccgttctgaccgaaccgctgaaaaat480
gttatgaaagccttcgaagttttcgatgttgttagcaaacgcagcatcttcttcggcgat540
gatagcaccctgatcggcaaacgcatggttatcatcggcagcggcagcgaagccttcctg600
tacagcttcgccggcgttgatcgcggcttcgatgttaccatggttaatcgccatgatgaa660
accgaaaataaactgaaaatcatggatgaattcggcgttaaattcgccaattacctgaaa720
gatatgccggaaaaaatcgatctgctggttgataccagcggcgatccgaccaccaccttc780
aaattcctccgcaaagttaataataatggcgttgttatcctgttcggcaccaatggcaaa840
gccccgggctacccggttgatggcgaagatatcgattacatcgttgaacgcaatatcacc900
atcgccggcagcgttgatgccgccaaaatccattacgttcaggccctgcagagcctgagc960
aattggaatcgccgccatccggatgccatgaaaagcatcatcacctacgaagccaaaccg1020
agcgaaaccaatatcttcttccagaaaccgcatggcgaaatcaaaaccgttatcaaatgg1080
cagtaa1086
<210>3
<211>22
<212>dna
<213>人工序列
<400>3
ggatccatgaccgaacagaaag22
<210>4
<211>21
<212>dna
<213>人工序列
<400>4
aagcttgcggccgcttactgc21
<210>5
<211>18
<212>dna
<213>人工序列
<400>5
agatctatggccagcggc18
<210>6
<211>23
<212>dna
<213>人工序列
<400>6
ggtaccttattcacggctaacca23
<210>7
<211>24
<212>dna
<213>人工序列
<400>7
ccatgggcggatccatgaccgaac24
<210>8
<211>31
<212>dna
<213>人工序列
<400>8
ctcgagttactgccatttgataacggttttg31
<210>9
<211>22
<212>dna
<213>人工序列
<400>9
catatggcagatctatggccag22
<210>10
<211>22
<212>dna
<213>人工序列
<400>10
ggtaccttattcacggctaacc22
- 还没有人留言评论。精彩留言会获得点赞!