MDM2蛋白作为生物标志物在预测非小细胞肺癌患者重离子放疗的疗效中的应用的制作方法
本发明属于生物医学领域,具体涉及mdm2蛋白作为生物标志物在预测p53基因缺失导致辐射抗性非小细胞肺癌患者重离子放疗疗效中的应用。
背景技术:
肺癌主要有小细胞肺癌和非小细胞肺癌(non-smallcelllungcarcinoma,nsclc)两种亚型,分别占所有肺癌的15%和85%。临床上,非小细胞肺癌在诊断时常为晚期。超过半数的非小细胞肺癌患者在确诊后1年内死亡,5年生存率约为17.8%。
非小细胞肺癌的治疗包括手术、放疗和化疗、单药治疗以及这些方法的结合。手术切除是早期nsclc的首选治疗方法。辅助放疗、化疗和联合治疗也被用于提高初次手术后的生存率。除手术治疗以外,放化疗是nsclc的重要治疗方法。在不能手术的晚期nsclc中,放疗起着至关重要的作用。虽然放疗是癌症患者最有效的治疗方法之一,但许多患者的癌症在治疗过程中表现出了辐射抗拒性,放射耐受是导致癌症患者预后不良放疗失败的主要原因,可直接导致肿瘤复发和转移。导致癌细胞辐射抗拒性最主要的原因是基因突变。p53在非小细胞肺癌中特异性和热点区缺失和突变率高(肺腺癌46%,鳞癌81%),是导致nsclc产生辐射抗拒性的主要原因。p53被称为基因组的守护者,辐射主要通过诱导p53表达来控制细胞周期和诱导dna损伤后的凋亡过程。常规x-射线或γ-射线辐射能够诱导p53依赖的细胞凋亡发生。鼠双微体基因(murinedoubleminute2,mdm2)是近几十年才发现的一种癌基因,对细胞生长具有调节作用。重离子放射治疗作为一种新的肿瘤治疗策略越来越受到人们的关注。与广泛使用的光子(如x-射线、γ-射线)放疗相比,重离子放射治疗能够提供更好的物理剂量分布以及更高的生物学效应,从而达到更高的局部控制率和更低的副作用。
技术实现要素:
本发明的目的是评估非小细胞肺癌患者重离子放疗的疗效和预测小细胞肺癌患者重离子放疗预后。
本发明首先保护检测mdm2蛋白表达量和/或活性的物质的应用,可为(b1)-(b7)中的任一种:
(b1)评估非小细胞肺癌患者重离子放疗的疗效;
(b2)评估非小细胞肺癌患者重离子放疗的敏感性;
(b3)预测非小细胞肺癌患者重离子放疗后的癌细胞存活率;
(b4)预测非小细胞肺癌患者重离子放疗后的癌细胞凋亡情况;
(b5)对非小细胞肺癌患者重离子放疗进行预后;
(b6)预测非小细胞肺癌患者重离子放疗后dna损伤情况;
(b7)预测非小细胞肺癌患者重离子放疗时癌细胞的抗辐射能力;
所述应用用于非疾病的诊断和治疗。
本发明还保护检测mdm2蛋白表达量和/或活性的物质的应用,可为(b8)-(b14)中的任一种:
(b8)制备用于评估非小细胞肺癌患者重离子放疗的疗效的产品;
(b9)制备用于评估非小细胞肺癌患者重离子放疗的敏感性的产品;
(b10)制备用于预测非小细胞肺癌患者重离子放疗后的癌细胞存活率的产品;
(b11)制备用于预测非小细胞肺癌患者重离子放疗后的癌细胞凋亡情况的产品;
(b12)制备非小细胞肺癌患者重离子放疗预后的产品;
(b13)制备用于预测非小细胞肺癌患者重离子放疗后dna损伤情况的产品;
(b14)制备用于预测非小细胞肺癌患者重离子放疗时癌细胞的抗辐射能力的产品;
所述应用用于非疾病的诊断和治疗。
本发明还保护检测mdm2基因表达量的物质的应用,可为(b1)-(b7)中的任一种:
(b1)评估非小细胞肺癌患者重离子放疗的疗效;
(b2)评估非小细胞肺癌患者重离子放疗的敏感性;
(b3)预测非小细胞肺癌患者重离子放疗后的癌细胞存活率;
(b4)预测非小细胞肺癌患者重离子放疗后的癌细胞凋亡情况;
(b5)对非小细胞肺癌患者重离子放疗进行预后;
(b6)预测非小细胞肺癌患者重离子放疗后dna损伤情况;
(b7)预测非小细胞肺癌患者重离子放疗时癌细胞的抗辐射能力;
所述应用用于非疾病的诊断和治疗。
本发明还保护检测mdm2基因表达量的物质的应用,可为(b8)-(b14)中的任一种:
(b8)制备用于评估非小细胞肺癌患者重离子放疗的疗效的产品;
(b9)制备用于评估非小细胞肺癌患者重离子放疗的敏感性的产品;
(b10)制备用于预测非小细胞肺癌患者重离子放疗后的癌细胞存活率的产品;
(b11)制备用于预测非小细胞肺癌患者重离子放疗后的癌细胞凋亡情况的产品;
(b12)制备非小细胞肺癌患者重离子放疗预后的产品;
(b13)制备用于预测非小细胞肺癌患者重离子放疗后dna损伤情况的产品;
(b14)制备用于预测非小细胞肺癌患者重离子放疗时癌细胞的抗辐射能力的产品;
所述应用用于非疾病的诊断和治疗。
本发明还保护mdm2蛋白或mdm2基因作为生物标志物的应用,可为(b1)-(b14)中的任一种:
(b1)评估非小细胞肺癌患者重离子放疗的疗效;
(b2)评估非小细胞肺癌患者重离子放疗的敏感性;
(b3)预测非小细胞肺癌患者重离子放疗后的癌细胞存活率;
(b4)预测非小细胞肺癌患者重离子放疗后的癌细胞凋亡情况;
(b5)对非小细胞肺癌患者重离子放疗进行预后;
(b6)预测非小细胞肺癌患者重离子放疗后dna损伤情况;
(b7)预测非小细胞肺癌患者重离子放疗时癌细胞的抗辐射能力;
(b8)制备用于评估非小细胞肺癌患者重离子放疗的疗效的产品;
(b9)制备用于评估非小细胞肺癌患者重离子放疗的敏感性的产品;
(b10)制备用于预测非小细胞肺癌患者重离子放疗后的癌细胞存活率的产品;
(b11)制备用于预测非小细胞肺癌患者重离子放疗后的癌细胞凋亡情况的产品;
(b12)制备非小细胞肺癌患者重离子放疗预后的产品;
(b13)制备用于预测非小细胞肺癌患者重离子放疗后dna损伤情况的产品;
(b14)制备用于预测非小细胞肺癌患者重离子放疗时癌细胞的抗辐射能力的产品;
所述应用用于非疾病的诊断和治疗。
本发明还保护抑制mdm2蛋白活性和/或表达量的物质在制备产品中的应用;所述产品的功能可为(a1)-(a6)中的至少一种:
(a1)提高非小细胞肺癌患者重离子放疗的疗效;
(a2)提高非小细胞肺癌患者重离子放疗的敏感性;
(a3)降低非小细胞肺癌患者重离子放疗后的癌细胞存活率;
(a4)促进非小细胞肺癌患者重离子放疗后的癌细胞凋亡;
(a5)促进非小细胞肺癌患者重离子放疗后dna损伤;
(a6)降低非小细胞肺癌患者重离子放疗时癌细胞的抗辐射能力;
所述应用用于非疾病的诊断和治疗。
本发明还保护抑制mdm2基因表达量的物质在制备产品中的应用;所述产品的功能可为(a1)-(a6)中的至少一种:
(a1)提高非小细胞肺癌患者重离子放疗的疗效;
(a2)提高非小细胞肺癌患者重离子放疗的敏感性;
(a3)降低非小细胞肺癌患者重离子放疗后的癌细胞存活率;
(a4)促进非小细胞肺癌患者重离子放疗后的癌细胞凋亡;
(a5)促进非小细胞肺癌患者重离子放疗后dna损伤;
(a6)降低非小细胞肺癌患者重离子放疗时癌细胞的抗辐射能力;
所述应用用于非疾病的诊断和治疗。
本发明还保护将mdm2蛋白或mdm2基因作为药物靶点的物质在制备产品中的应用;所述产品的功能可为(a1)-(a6)中的至少一种:
(a1)提高非小细胞肺癌患者重离子放疗的疗效;
(a2)提高非小细胞肺癌患者重离子放疗的敏感性;
(a3)降低非小细胞肺癌患者重离子放疗后的癌细胞存活率;
(a4)促进非小细胞肺癌患者重离子放疗后的癌细胞凋亡;
(a5)促进非小细胞肺癌患者重离子放疗后dna损伤;
(a6)降低非小细胞肺癌患者重离子放疗时癌细胞的抗辐射能力;
所述应用用于非疾病的诊断和治疗。
本发明还保护一种评估非小细胞肺癌患者重离子放疗的疗效的方法,可为检测非小细胞肺癌患者癌细胞中mdm2蛋白的表达量,然后进行如下判断:mdm2蛋白的表达量越低,重离子放疗的疗效越好;
所述方法用于非疾病的诊断和治疗。
上述方法中,所述重离子放疗的疗效越好可变现为敏感性提高、癌细胞存活率降低、癌细胞凋亡增加、癌细胞的dna损伤增加和癌细胞的抗辐射能力降低中的至少一种。
本发明还保护一种预测非小细胞肺癌患者重离子放疗的预后的方法,可为检测非小细胞肺癌患者癌细胞中mdm2蛋白的表达量,然后进行如下判断:mdm2蛋白的表达量越低,重离子放疗的预后越好;
所述方法用于非疾病的诊断和治疗。
上述任一所述检测mdm2蛋白表达量和/或活性的物质可为进行免疫印迹分析法检测的试剂和/或仪器,如抗体mdm2。
上述任一所述检测mdm2基因表达量的物质可为通过荧光定量pcr方法检测mdm2基因相对表达量所需的试剂和/或仪器。进一步的,所述通过荧光定量pcr方法检测mdm2基因相对表达量所需的试剂和/或仪器包括检测mdm2基因相对表达量的引物对。更进一步的,所述通过荧光定量pcr方法检测mdm2基因相对表达量所需的试剂和/或仪器还包括检测内参基因的引物对。即所述mdm2基因相对表达量具体可为mdm2基因相对内参基因的表达量。所述内参基因具体为gapdh基因。
上述任一所述抑制mdm2蛋白活性和/或表达量的物质或上述任一所述抑制mdm2基因表达量的物质可为序列#1(qiagen公司的产品,目录号为#si02653392)和序列#2(ambion公司的产品,id为#hss142909)混合而成的序列混合物。混合比例具体可为1:1。
上述任一所述mdm2蛋白的genbank号为geneid:4193。上述任一所述mdm2基因的genbank号为swiss-prot:q00987。
上文中,mdm2蛋白的表达量越低或mdm2基因的表达量越低,则非小细胞肺癌患者重离子放疗的疗效越好。
上文中,mdm2蛋白的表达量越低或mdm2基因的表达量越低,则非小细胞肺癌患者重离子放疗的敏感性越高。
上文中,mdm2蛋白的表达量越低或mdm2基因的表达量越低,则非小细胞肺癌患者重离子放疗后的癌细胞存活率越低。
上文中,mdm2蛋白的表达量越低或mdm2基因的表达量越低,则非小细胞肺癌患者重离子放疗后的癌细胞凋亡比例越大。
上文中,mdm2蛋白的表达量越低或mdm2基因的表达量越低,则非小细胞肺癌患者重离子放疗预后越好。
上文中,mdm2蛋白的表达量越低或mdm2基因的表达量越低,则非小细胞肺癌患者重离子放疗后dna损伤越大。
上文中,mdm2蛋白的表达量越低或mdm2基因的表达量越低,则非小细胞肺癌患者重离子放疗时癌细胞的抗辐射能力越低。
上述任一所述非小细胞肺癌患者可为p53基因缺失导致辐射抗性的非小细胞肺癌患者。
本发明的发明人首次发现,重离子辐射能够抑制p53基因缺失辐射抗拒性癌细胞内mdm2蛋白表达,低表达的mdm2能够阻止γh2ax在细胞核内聚集,延迟dna损伤的修复,诱导细胞发生凋亡。本发明的发明人研究了mdm2作为一种新的转录因子参与重离子辐照诱导的nsclc细胞凋亡的机制,探讨以mdm2为靶标提高癌细胞辐射敏感性的可能,为重离子束克服癌细胞辐射抗拒的作用机理提供一定生物学理论依据,为提高重离子或x-射线放射治疗疗效提供实验依据。本发明具有重要的应用价值。
附图说明
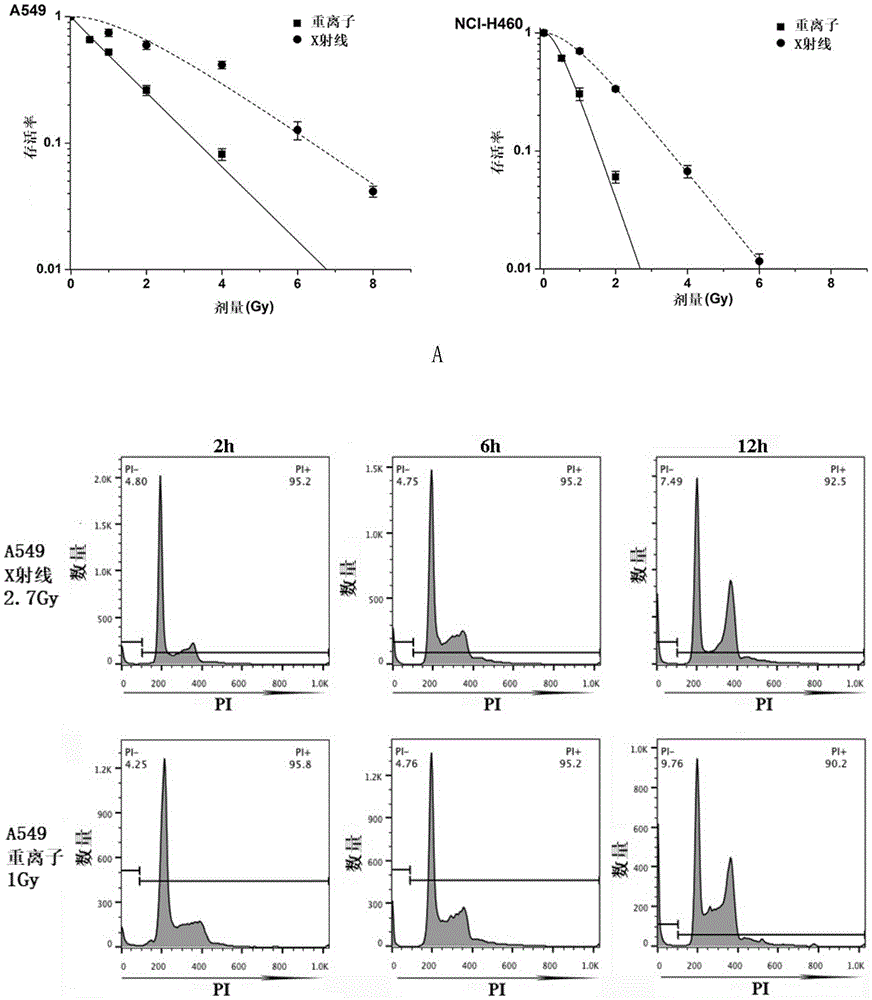
图1为重离子辐射对非小细胞肺癌细胞中mdm2表达量的影响。a为重离子或x射线辐照辐射nci-h460细胞和a549细胞后的存活率。b为重离子或x射线辐射后2、6、12、24、48和72h,nci-h460细胞和a549细胞凋亡增加。c为重离子或x射线辐射后12h,nci-460细胞组差异表达基因的微阵列分析。d和e为检测mdm2和p53的蛋白和mrna表达量。p<0.001,**p<0.01,*p<0.05,与对照组比较;###p<0.001,##p<0.01,与x射线辐射相比。
图2为mdm2参与重离子辐射诱导dna损伤。a、重离子辐射或x射线对h1299细胞存活的影响。b、x射线或重离子辐射照射后2小时h1299细胞mdm2的表达,#p<0.05与x射线照射比较。c、h1299细胞经重离子照射2小时后dna损伤情况及dna离散曲线。m2表示fastdnaladder(新英格兰生物实验室,美国)。m1表示lambdadnahindшdigest(新英格兰生物实验室,美国)。根据长度标准dna,包括lambdadnahindшdigest和fastdnaladder图绘制dna离散曲线(右轴)。产生重离子辐射组(左轴)的dna损伤曲线,计算聚集性dna损伤的频率。***p<0.001与对照组比较;###p<0.001与pcdna组比较;aaap<0.001与pcdna+重离子照射组相比,bp<0.05与sirna组相比。d、用重离子照射后2小时检测h1299细胞中γh2ax和53bp1在细胞核内的聚集情况。#p<0.05和###p<0.001与pcdna组比较,ap<0.05与pcdna+重离子照射组比较。e、电离辐射后2小时h1299细胞mdm2、ku70、xrcc1和rad51的表达分析。*p<0.05与pcdna组比较,#p<0.05与pcdna+照射组比较。
图3为mdm2参与重离子辐射诱导的癌细胞凋亡。a、h1299细胞克隆形成实验。*p<0.05和***p<0.001与对照组比较,###p<0.001与pcdna组比较,aaap<0.001与sirna组比较,bp<0.05与pcdna+重离子辐射组比较,cp<0.05与sidna+重离子辐射组组比较。b、重离子照射后24小时h1299细胞凋亡分析。c、重离子照射后12小时免疫印迹分析。*p<0.05,**p<0.01,***p<0.001与sirna或pcdna组比较;#p<0.05和##p<0.01与sidna+mdm2或pcdna+mdm2组相比。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中涉及3种nsclc细胞系,分别为a549细胞、nci-h460细胞和h1299细胞:a549细胞是一种含有野生型p53的nsclc细胞系,由日本理化学研究所(tsukuba,ibaraki)提供;nci-h460细胞也是一种含有野生型p53的nsclc细胞系,由美国atcc生物标准品资源中心(americantypeculturecollection,va,usa)提供;h1299细胞是一种p53基因缺失的nsclc细胞系,由中国科学院细胞库(中国上海)提供。3种nsclc细胞系的培养方法均如下:将nsclc细胞系接种于含10%胎牛血清、100u/ml青霉素和100μg/ml链霉素的dmem(高糖)培养基或含10%胎牛血清、100u/ml青霉素和100μg/ml链霉素的1640培养基,37℃、5%co2培养。
下述实施例中,nsclc细胞系的辐射条件见表1。
表1
下述实施例中,所有数据均以x±s表示,采用spss17.0软件(ibm,armonk,newyork,usa)进行分析。学生t检验用于比较两组之间的数据。采用单因素方差分析(anova)比较多组间的数据。p值小于0.05被认为具有统计学意义。
下述实施例中,为了识别和功能性地注释差异表达的基因,使用affymetrixprimeviewtm分析a549细胞和nci-h460细胞的人类基因表达阵列。具体如下:(1)用trizol试剂(invitrogen)分离细胞总rna;(2)分别用ovationpico-wta系统v2和encore生物素模块(nugen)进行cdna扩增和标记;(3)根据affymetrixfs450_0002杂交方案进行基因表达的阵列杂交;(4)affymetrix
下述实施例中的免疫印迹分析步骤如下:总蛋白样本在4-15%sds-page预制凝胶(smobiotechnology,中国台湾)上使用以下抗体进行分离:抗体mdm2、bax、p53、p21、bcl-2、p73、e2f1、caspase-3、caspase-8、caspase-9、caspase-12、fas和fasl(美国明尼苏达州bioworld)。cleaved-caspase-3、cleaved-caspase-8、cleaved-caspase-9和cleaved-caspase-12的抗体来自细胞信号技术(cellsignalingtechnology,danvers,ma,usa)。用辣根过氧化物酶山羊抗兔(igg)二级抗体(bioworld)检测蛋白质。使用alphaview软件(naturegenecorp.,medford,nj,usa)测量综合密度值。
下述实施例中rna提取、逆转录pcr和实时定量pcr的步骤如下:(1)用trizol试剂(invitrogen)分离细胞总rna;(2)使用protoscript第一链cdna合成试剂盒(biolabs)反向转录rna;(3)使用sybr预混料ex-taq(takara)进行定量pcr分析。为了便于分析,目标基因的表达被标准化为gapdh。所有引物均由sangonbiotech(中国)公司合成。用于扩增gapdh的引物为:gapdh-f:5'-ccagaaggtgtggaaatc-3'和gapdh-r:5'-aagcgcttggtgtgagatt-3'。用于扩增mdm2的引物为:mdm2-f:5'-aggcaggggagagtgataca-3'和mdm2-r:5'-aattctcacgaagggcccaa-3'。
下述实施例中的免疫荧光分析步骤如下:(1)h1299细胞接种在直径为35mm培养皿中的载玻片上,照射后2小时取细胞;(2)将细胞固定在4%多聚甲醛/磷酸缓冲液中15min,用0.5%tritonx-100/磷酸缓冲液渗透15min,10%小牛血清/磷酸缓冲液封闭1h;(3)阻断后,在黑暗中用γ-h2axalexafluor488(1:100,biolegend,sandiego,ca)或53bp1-alexafluor555(1:100,novusbiologicals,abingdon,uk)抗体在室温下培养1h;(4)细胞用含有4′,6-二氨基-2-苯基吲哚(dapi;sigma-aldrich,st.louis,mo)的防褪色贴装培养基,以1:2000的稀释比染色,盖上盖玻片,用透明指甲油密封,并在激光扫描共聚焦显微镜(lsm700,carlzeiss,germany)下进行检查。
下述实施例中采用细胞克隆法确定半数致死剂量(ld50)的具体步骤为:电离辐射后,将细胞胰蛋白酶消化并在6孔板中以每孔400个细胞的密度重新培养10-15天,直到菌落清晰可见并可计数;之后用甲醇固定菌落,用亚甲蓝染色;然后对由50多个细胞组成的菌落进行评分,并对每个组的3个重复培养皿进行计数;最后使用origin软件(originlab版本8.5)对浓度-反应曲线进行非线性回归分析,确定半数致死剂量(ld50)。
下述实施例中,转空载体的细胞命名为pcdna;转染阴性对照的细胞命名为sirna;转染pcdna+mdm2的细胞命名为pcdna+mdm2,用于mdm2过表达;转染sirna+mdm2的细胞命名为sirna+mdm2,用于抑制mdm2表达;重离子照射的细胞命名为重离子细胞;转空载体和重离子照射的细胞命名为pcdna+重离子照射;转染阴性对照和重离子照射的细胞命名为sirna+重离子照射;转染pcdna+mdm2和重离子照射的细胞命名为pcdna+mdm2+重离子照射;转染sirna+mdm2和重离子照射的细胞命名为sirna+mdm2+重离子照射。细胞为h1299细胞。
转空载体是指向质粒pcdna3转染细胞。转染阴性对照为是指阴性对照sirna(ambion的产品,目录号为4390843)转染细胞。转染pcdna+mdm2是指将目的序列转染细胞;目的序列记载于如下文献中:blattnerc,hayt,meekdw,&lanedp(2002)hypophosphorylationofmdm2augmentsp53stability.molecularandcellularbiology22(17):6170-6182.转染sirna+mdm2是指将序列混合物转染细胞;序列混合物由序列#1(qiagen公司的产品,目录号为#si02653392)和序列#2(ambion公司的产品,id为#hss142909)1:1混合而成。所有转染均使用lipofectamine2000(invitrogen,usa)进行。
下述实施例中,在电离辐射前24小时使用lipofectamine2000转染细胞;之后,在电离辐射后2、6、12、24、48和72小时采集细胞样本。
实施例1、重离子辐射对非小细胞肺癌细胞(nci-h460和a549细胞)中mdm2表达量的影响
1、使用克隆形成法评估细胞存活率。
不同剂量重离子或x射线辐射nci-h460细胞和a549细胞后的存活率见图1中a。
2、采用细胞克隆法确定半数致死剂量(ld50)。
结果表明,a549细胞的重离子辐射半数致死剂量为1gy,x射线辐射半数致死剂量为2.7gy;nci-h460细胞的重离子辐射半数致死剂量为0.6gy,x射线辐射半数致死剂量为1.5gy。因此,选择上述剂量作为后续治疗的剂量点。
3、利用pi染色和流式细胞仪分析非小细胞肺癌细胞在重离子或x-射线辐射后的细胞凋亡情况。具体步骤如下:取非小细胞肺癌细胞(a549细胞或nci-h460细胞),用重离子或x-射线辐射2h、6h、12h、24h、48h或72h,用75%(v/v)乙醇水溶液固定;之后在室温下用碘化丙啶(propidiumiodide,pi;sigma)染色缓冲液(含10mg/mlpi和100mg/ml灭活的rna酶的水溶液)染色30min,观察细胞凋亡。荧光强度用bd-fascalibur(bd-biosciences)测定。用beckman-moflo-xdp(beckman-coulter)对非小细胞肺癌细胞进行流式细胞仪分析。用modfit软件(bdbiosciences)处理得到的流式细胞仪数据,以确定g0/g1期和亚g0期的细胞数量比率。
检测结果见图1中b。结果表明,凋亡细胞百分率的增加出现在照射后12h,并在重离子照射后24-48小时或x射线照射后24小时达到峰值。
此外,本发明的发明人还进行了细胞增殖实验。根据细胞增殖时间(a549,细胞数量增殖一倍所需时间为18小时;nci-h460,14小时;h1299,18小时),选择了照射后2或12小时作为dna或蛋白表达分析的时间点。
4、为了确定重离子辐射诱导的mrna表达改变的潜在靶点,使用affymetrixprimeviewtm分别分析a549细胞和nci-h460细胞的人类基因表达阵列。
分析结果见图1中c:a549细胞或nci-h460细胞中mdm2mrna在辐射照射后12h,与对照组(指的是没有经过任何处理的细胞)相比,a549x射线组、a549重离子照射组和nci-h460x射线组的mdm2表达显著上调,依次为3倍、2.4倍和2.8倍;与nci-h460x射线组相比,nci-h460重离子照射组中mdm2表达显著抑制;p53/mdm2通路反馈环的变化最为显著。
5、为了验证实验结果,分别使用实时定量pcr和westernblotting检测a549细胞和nci-h460细胞中mdm2和p53的mrna和蛋白质表达。
实验结果见图1中d和e。结果表明,与对照组(指的是没有经过任何处理的细胞)相比,x射线照射后a549细胞、重离子照射后a549细胞和x射线照射后的nci-h460细胞中mdm2的表达上调;与x射线照射a549细胞组相比,重离子照射nci-h460细胞的mdm2表达下调。p53基因在a549细胞和nci-h460细胞中的表达没有明显变化。
上述结果表明,mdm2可能参与重离子辐射诱导的癌细胞损伤。
实施例2、mdm2参与重离子辐射诱导的dna损伤
为了检测mdm2是否参与dna损伤作用,在h1299细胞中过表达mdm2。所有dna标本在照射后2h采集。
1、使用克隆形成法评估细胞存活率。
h1299细胞经不同剂量的x射线或重离子照射后的存活率见图2中a。
2、采用细胞克隆法确定半数致死剂量(ld50)。
结果表明,h1299细胞的重离子辐射半数致死剂量为0.4gy,x射线辐射半数致死剂量为1.3gy。因此,选择上述剂量作为后续治疗的剂量点。
图2中b显示0.4gy的重离子照射能够抑制h1299细胞mdm2表达。
3、琼脂糖凝胶电泳
dna标本在照射后2h采集。所有dna样本均按照制造商的说明使用天安基因dna试剂盒(中国北京天根生物技术有限公司)提取。如前所述,使用静态场凝胶电泳检测dna损伤情况。简言之,dna样本在1%琼脂糖凝胶(invitrogen,thermofisherscientific,waltham,ma)中,在4℃下电泳30min。dna分子长度标准包括lambdadnahindшdigest和fastdnaladder(美国新英格兰生物实验室)。在成像系统中加入乙醚/溴化物的最终浓度。使用georgakilas方法计算复杂dna双链断裂(dnadouble-strandsbreak,dsb)的频率以获得dna分散曲线。
每个样本dna群体的平均分子长度(ln)表示为:
辐照诱发的dna双链断裂频率表示为:
l表示迁移到x位置的dna分子的长度,f(x)表示dna分子迁移区域内的荧光强度。以标准dna分子为对照,计算了dna双链断裂的损伤频率。根据长度标准的dna通道构建了dna扩散曲线(凝胶上的迁移位置与分子长度的关系)。
凝胶电泳结果如图2中c所示。与对照组(指的是没有经过任何处理的细胞)相比,pcdna和pcdna+mdm2组的dna无明显变化。重离子照射、sirna+mdm2、pcdna+重离子照射组dna损伤较对照组明显增加。与pcdna+重离子照射组相比,pcdna+mdm2+重离子照射组dsb积累较少。
4、为了评价mdm2对dna损伤修复的影响,定量分析了γh2ax和53bp1在照射后2h在核内聚集情况。
检测结果见图2中d。结果表明,与对照组相比,mdm2过度表达组中γн2аx和53bp1病灶数量分别约高出对照组的70倍和5倍(р<0.001)。重离子照射组γн2аx和53bp1病灶数量无明显变化。pcdna+mdm2+重离子照射组γн2аx灶数比对照组高5倍。这一结果表明mdm2与γн2аx和53bp1病灶形成的动力学有关。
5、为了研究mdm2在dna损伤中的作用,用western印迹法分析了mdm2、ku70、rad51和xrcc1的表达。
结果表明,pcdna+mdm2组mdm2表达较pcdna组升高(图2中e)。与对照组比较,pcdna+重离子组ku70的表达明显降低,pcdna+mdm2组比pcdna+重离子照射组ku70蛋白表达增加30.6%,pcdna+mdm2+重离子照射组比单纯照射组增加60.7%。xrcc1和rad51的表达无显著性差异(p>0.05)。这些结果表明,mdm2的表达可能与ku70蛋白的表达有关。
实施例3、mdm2在重离子辐射诱导细胞发生凋亡中的作用
1、使用克隆形成法评估细胞存活率。
结果见图3中a。结果表明,pcdna和sirna组的细胞存活率与对照组相比没有显著变化。与对照组相比,所有的重离子照射组的存活率下降。pcdna-mdm2+重离子照射组细胞存活率较pcdna+重离子照射组增加,sirna+mdm2+重离子照射组细胞存活率较单纯照射组明显降低。在h1299细胞中,mdm2的敲除降低了细胞存活率,而转染mdm2则逆转了这种作用。说明mdm2的过表达增强了h1299癌细胞的抗辐射能力。
2、利用pi染色和流式细胞仪检测细胞凋亡。
检测结果见图3中b。结果表明,pcdna、sirna和对照组之间的凋亡水平没有显著变化。与对照组相比,所有的重离子照射组比对照组凋亡百分率上升,mdm2表达下调可增加h1299细胞的凋亡水平,mdm2表达增加可抑制细胞凋亡,表明转染mdm2可逆转h1299细胞凋亡。上述结果表明,mdm2低表达可促进h1299细胞凋亡。
3、用免疫印迹分析法检测fas、fasl、cleaved-caspase-12、caspase-12、cleaved-caspase-9、caspase-9、cleaved-caspase-8、caspase-8、cleaved-caspase-3、e2f1、p21、p53、bcl-2、bax、β-actin、mdm2和gapdh的表达。
检测结果见图3中c、d、e和f。结果表明,sirna+mdm2转染细胞与sirna对照组相比,mdm2表达水平降低;与pcdna对照组相比,pcdna+mdm2组mdm2的表达水平增加;这些结果证实了重离子照射h1299细胞后,sirna+mdm2和pcdna+mdm2组bcl-2、p53、p21和caspase-8的表达没有变化。e2f1、caspase-3、cleaved-caspase-3、caspase-9、cleaved-caspase-9、fasl和fas的表达发生变化。此外,β-actin和caspase-12的表达水平因mdm2的下调而降低,而bax、裂解的caspase-8和裂解的caspase-12的表达水平随着mdm2表达的增加而降低。上述结果表明,mdm2表达的改变可以调节β-actin、bax、caspase-8和caspase-12蛋白活性和表达水平。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
- 还没有人留言评论。精彩留言会获得点赞!