一种具有抗炎活性的没食子酸衍生物及其制备方法和用途与流程
[0001]
本发明涉及一种具有抗炎活性的小分子活性物质,尤其是涉及一种具有抗炎活性的没食子酸衍生物及其制备方法和用途。
背景技术:
[0002]
炎症性肠炎(inflammatory bowel disease,ibd)是一类病因不明的常见慢性肠炎疾病,表现为炎症、腹痛腹泻、肠出血和消化不良等。近年来,我国炎症性肠炎发病率呈迅猛上升趋势,10年来总病例增长超过24倍,发病率达到3/10万。炎症性肠炎不易治愈、容易复发,给患者带来很多的痛苦,而长期的炎症性肠炎易进一步转化为结肠癌,严重威胁人民的生命质量和安全。目前,针对炎症性肠炎没有特效药物治疗,一般施以氨基水杨酸制剂、激素、免疫抑制剂或生物制剂治疗等,但是存在一定的副作用。因此,我们希望从食源性天然活性物质及其衍生物中寻找新型的、具有缓解炎症性肠炎效果的小分子化合物。
[0003]
肠道菌群是定植在人体肠道中的微生物的统称,包含超十万亿微生物,1000种已知细菌和300万个以上的基因。肠道菌群及其代谢物在维持肠道黏膜稳态和肠道动力调节等方面具有重要的作用,因此被称为“看不见的器官”。前期的研究已经表明,炎症性肠炎的发展伴随肠道菌群结构的变化,主要表现在大肠杆菌、拟杆菌含量增多,而厚壁菌门、益生菌及具有抗炎作用的梭菌属减少。进一步的研究表明,肠道菌群可能通过诱导肠道炎症反应、菌群功能异常和代谢紊乱、黏膜屏障功能及清除病原体功能障碍和宿主免疫调节能力受损等机制参与炎症性肠炎发病过程,而通过补充益生菌、益生元重建肠道菌群的方式一定程度上可以实现炎症性肠炎的缓解。因此,考察小分子活性物质对肠道菌群的调节功能,对筛选和寻找用于缓解炎症性肠炎的活性物质、揭示其分子机制具有重要的意义。
技术实现要素:
[0004]
本发明所要解决的技术问题是提供一种具有抗炎活性的没食子酸衍生物及其制备方法和用途,该化合物具有缓解结肠炎病症的抗炎活性和调节肠道菌群结构的功能。
[0005]
本发明解决上述技术问题所采用的技术方案为:1、一种具有抗炎活性的没食子酸衍生物,该化合物结构式如下:。
[0006]
2、上述具有抗炎活性的没食子酸衍生物的制备方法,包括以下步骤:(1)将3,4,5-三羟基苯甲酸按质量体积比10 mg:1 ml的比例溶于质量浓度为25%的氨水中,在室温有氧条件下搅拌反应60 min后,以热风加热挥发残余氨水后经真空旋转蒸发仪将反应液旋干,即得到没食子酸衍生物粗品;
(2)将步骤(1)得到的没食子酸衍生物粗品溶于丙酮中使其浓度为1g/ml,利用正向硅胶柱进行分离纯化,柱层析条件为:上样量2 ml,采用正己烷和乙酸乙酯混合溶液作为洗脱液进行梯度洗脱,依次采用乙酸乙酯体积比为0%、20%、50%、80%和100%的洗脱液进行洗脱,相应洗脱2、2、4、2和1个柱体积,以hplc监测柱层析收集到的组分,将出现4-氨基-3,5-二羟基苯甲酸样品峰的洗脱液组分合并,随后进行真空旋转干燥,即得到纯度>85%的4-氨基-3,5-二羟基苯甲酸样品。
[0007]
优选的,步骤(2)采用乙酸乙酯体积比为50%的洗脱液进行洗脱,收集洗脱液进行真空旋转干燥,即得到纯度>85%的4-氨基-3,5-二羟基苯甲酸样品。
[0008]
3、上述具有抗炎活性的没食子酸衍生物在制备缓解结肠炎病症药物方面的用途。
[0009]
4、上述具有抗炎活性的没食子酸衍生物在调节肠道菌群结构方面的用途。
[0010]
优选的,所述的肠道菌群与结肠炎表型具有强相关性,包括瘤胃球菌-1属(ruminococcus_1)、另枝菌属(alistipes)、拟杆菌属(bacteroides)、未分类的muribaculaceae、肠杆菌属(enterorhabdus)、乳酸杆菌属(lactobacillus)、毛螺菌ucg006(lachnospiraceae_ucg-006)、假单胞菌属(pseudomonas)、梭菌属(clostridium)、真杆菌属(eubacterium)、链球菌属(streptococcus)、parasutterella属、parabacteroides属、mucispirillum属、dorea属、未分类的mitochondria属、柠檬酸杆菌属(citrobacter)和proteus属。
[0011]
与现有技术相比,本发明的优点在于:本发明首次公开了一种具有抗炎活性的没食子酸衍生物及其制备方法和用途,其以3,4,5-三羟基苯甲酸为前体物,进行氨基化修饰,以带正电荷的氨基取代带负电的羟基,增强化合物对超氧离子ros的结合效率,获得新的衍生物。随后,通过质谱和nmr的手段,确定其氨基化取代发生在4位的羟基,最终得到的新型化合物为4-氨基-3,5-二羟基苯甲酸。同时,利用dss诱导的小鼠结肠炎模型,在体内验证了新型化合物具有缓解结肠炎的抗炎效果,并通过肠道菌群监测,明确该新型衍生物具有调节肠道菌群的功能,筛选得到了一系列与结肠炎表型具有强相关性的关键肠道微生物,推测可能是该化合物缓解结肠炎的生物学靶标,具有潜在的应用价值。
附图说明
[0012]
图1为3,4,5-三羟基苯甲酸和4-氨基-3,5-二羟基苯甲酸的lc-ms结果图谱;图2为4-氨基-3,5-二羟基苯甲酸的nmr结果图谱;a. h谱结果;b. c谱结果;图3为具体实施例二中动物实验流程示意图;图4为具体实施例二中对照组、dss组、ga组和nga组的疾病活动指数(a)、体重(b)和结肠长度(c)变化对照图;图5为具体实施例二中对照组、dss组、ga组和nga组血清中炎症因子浓度。a. 血清中il-1β的浓度;b. 血清中tnf-α的浓度;c. 血清中il-4的浓度;d. 血清中ifn-γ的浓度;图6为具体实施例三中小鼠肠道菌群α和β多样性的变化。a. chao1指数;b. shannon指数;c. pcoa分析结果;图7为具体实施例三中小鼠肠道菌群在门水平(a)和纲水平(b)的变化;图8为具体实施例三中经冗余分析(rda)得到的18种关键菌群与血清炎症因子间的关联分析。
具体实施方式
[0013]
以下结合附图实施例对本发明作进一步详细描述。
[0014]
具体实施例一4-氨基-3,5-二羟基苯甲酸化学合成、结构鉴定和大量制备1、4-氨基-3,5-二羟基苯甲酸化学合成将100 mg 3,4,5-三羟基苯甲酸底物溶于10 ml 质量浓度为25%的氨水中,在室温有氧条件下搅拌反应60 min后,以热风加热挥发残余氨水后经真空旋转蒸发仪将反应液旋干,即得到粗品;反应过程如下:。
[0015]
2、4-氨基-3,5-二羟基苯甲酸的初步检测将上述粗品溶解于去离子水中,按照稀释10
3-104倍后经0.22 μm水相滤膜过滤后用hplc-ms检测。采用色谱柱型号为(agilent zorbax phenyl,5 μm 4.6
×
250 mm),流动相a为0.1%甲酸水溶液,流动相b为乙腈,流速1 ml/min,检测波长210nm、254 nm和280 nm,流动相比例为98:2(a相:b相)。以3,4,5-三羟基苯甲酸作为标准品,检测产物中不属于3,4,5-三羟基苯甲酸的底物,并对其进行质谱分析。质谱分析条件为:负离子模式,离子喷雾电压3.6 kv,气体温度为350 ℃流速12l/min,雾化器压力30 psi,监测质荷比(m/z)范围为100-300。
[0016]
结果如图1所示,由图1可知,底物3,4,5-三羟基苯甲酸保留时间为19 min,在负离子模式下分子量为169;新产物保留时间为15 min,在负离子模式下分子量为168,与4-氨基-3,5-二羟基苯甲酸分子量一致。据此推测,在氨水体系中底物3,4,5-三羟基苯甲酸发生了化学反应,得到的新产物分子量减少1,推测可能是羟基被氨基取代导致。但是,3,4,5-三羟基苯甲酸中哪个羟基被氨基取代需要nmr结果进一步鉴定。
[0017]
3、4-氨基-3,5-二羟基苯甲酸的结构鉴定(nmr)通过正向硅胶柱利用正己烷和乙酸乙酯做为溶剂,最终得到纯度>95%的产物(负离子模式下分子量168)约12 mg,进行nmr鉴定,结果如图2所示。由图2可知,经nmr氢谱和碳谱分析,新化合物为4-氨基-3,5-二羟基苯甲酸,即4位的羟基被氨基取代。
[0018]
4、利用正向硅胶柱进行4-氨基-3,5-二羟基苯甲酸的大量制备首先,参照步骤1放大反应体系,大量制备4-氨基-3,5-二羟基苯甲酸粗品。随后,利用丙酮溶解粗品样品后使其浓度为1g/ml,利用正向硅胶柱进行分离纯化。柱层析条件为:上样量1.5-2.5ml,上样后利用正己烷和乙酸乙酯混合溶液进行顺次梯度洗脱,依次采用乙酸乙酯体积比为0%、20%、50%、80%和100%的洗脱液进行洗脱,相应洗脱2、2、4、2和1个柱体积,以hplc监测柱层析收集到的组分(在50%洗脱梯度中含量最高),将出现4-氨基-3,5-二羟基苯甲酸样品峰的洗脱液组分合并,随后进行真空旋转干燥,即得到纯度>85%的4-氨基-3,5-二羟基苯甲酸样品。
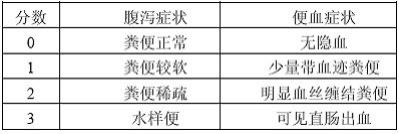
[0019] 具体实施例二4-氨基-3,5-二羟基苯甲酸的抗炎活性1、dss诱导的小鼠结肠炎模型建立葡聚糖硫酸钠盐(dextran sulfate sodium salt,dss)结肠炎模型因症状表现与人类炎症性肠炎极为相似,简单易行、建模成功率高且实验重复性强,被广泛用于研究炎症性肠炎。本实验采用2wt%的dss溶液取代雄性c56bl/6j小鼠的正常饮用水。每隔一天进行dss溶液的更换,持续7天,每天测定小鼠的体重,观察小鼠的粪便形状对、粪便质地以及有无便血情况,根据表1确定小鼠疾病活动指数(disease activity index,dai)。
[0020]
2、4-氨基-3,5-二羟基苯甲酸和3,4,5-三羟基苯甲酸的干预实验选用的是4-6周龄的雄性c56bl/6j小鼠30只,适应一周后均分为4组,每组小鼠饲养在一个大笼内,分别命名为对照组、dss组、ga组和nga组。其中,ga组为3,4,5-三羟基苯甲酸干预组,nga组为4-氨基-3,5-二羟基苯甲酸干预组。如图3所示,整个实验周期为14天,各组具体实验方案如下:(1)对照组:14天均摄入正常饮用水,正常摄食;(2)dss组:第1-3天摄入正常饮用水,4-14天以2wt%dss溶液取代正常饮用水,正常摄食;(3)ga组:第1-3天在正常饮用水中加入终浓度为0.04wt%的3,4,5-三羟基苯甲酸,4-14天在2wt%dss溶液中加入终浓度为0.04wt%的3,4,5-三羟基苯甲酸,正常摄食;(4)nga组:第1-3天在正常饮用水中加入终浓度为0.04wt%的4-氨基-3,5-二羟基苯甲酸,4-14天在2wt%dss溶液中加入终浓度为0.04wt%的4-氨基-3,5-二羟基苯甲酸,正常摄食。14天末单独收集每个小鼠的粪便,随后将小鼠眼球取血处死,离心3500 rp/min,10 min分离血清,保存于-80 ℃;分离小鼠的结肠,测定其长度后保存于-80℃。
[0021]
3、小鼠疾病指标的测定每天测定小鼠的体重,观察小鼠的粪便形状对、粪便质地以及有无便血情况,根据表1确定小鼠疾病活动指数(dai);测定小鼠的结肠长度评价不同化合物对疾病的缓解效果;利用elisa试剂盒对小鼠血清中的il-1β、tnf-α、il-4和ifn-γ等进行检测。
[0022]
表1. 小鼠结肠炎评分标准由表1可知,与对照组相比,dss组从第7天开始产生结肠炎dai,11天以后基本维持稳定;而ga和nga均可以有效缓解dss诱导的结肠炎dai,从第10天开始基本维持稳定(图4a),但是从第10天开始nga处理组的dai较ga组更低。ga和nga处理对体重减少的缓解作用并不显著,dss组、ga组和nga组的体重变化基本一致(图4b)。此外,ga和nga处理均可以有效增加因dss处理导致的结肠缩短,增幅分别为7.8%和20%,分别达到对照组结肠长度的64%和71.3%,nga在恢复dai指数和增加结肠长度方面效果更好(图4c)。
[0023]
另外,由图5可知,dss处理导致血清中促炎因子(il-1β、tnf-α和ifn-γ )浓度升高而抑炎因子(il-4)浓度降低,而ga和nga的处理均可以有效缓解小鼠的炎症反应,将促炎
因子和抑炎因子的浓度向对照组水平恢复。同时,nga组可以使得上述四个炎症因子恢复到更加接近对照组的水平,说明其抗炎活性更佳。
[0024]
具体实施例三4-氨基-3,5-二羟基苯甲酸对肠道菌群的调节作用:利用收集的小鼠粪便抽提基因组dna后,利用通用引物319f和806r对16s rdna的v3+v4区域进行pcr扩增和产物纯化,随后进行illunima miseq高通量测序。采用qiime平台对高通量测序数据进行减噪、比对等分析,对肠道群落组成进行统计分析,计算群落的多样性指数。利用canoco进行冗余分析,筛选丰度变化显著响应低聚肽干预的关键菌群。
[0025]
利用illunima miseq高通量测序技术,对小鼠粪便抽提基因组dna中的16s rdna的v3+v4区域进行pcr扩增和测序。与对照组相比,dss处理增加了肠道菌群的丰富度(richness)和多样性(diversity),但是nga的处理可以进一步的增加这两个指数(图6a和图6b)。同时,pcoa分析发现,dss处理可以有效改变肠道菌群的全局性结构,使其与对照组完全区分开,而nga处理在一定程度上将被dss改变的菌群结构恢复到与对照组更相似的结构(图6c)。
[0026]
此外,dss处理增加了firmicutes门和proteobacteria门的丰度,但是降低了bacteroidetes门和actinobacteria门的丰度,而nga处理可以恢复firmicutes门和bacteroidetes门的丰度,但是进一步加剧了proteobacteria门和actinobacteria门的变化(图7a和表2);在纲水平,dss处理增加了clostridia、gammaproteobacteria、erysipelotrichia和deferribacteres的丰度,但是降低了bacteroidia、bacilli和coriobacteriia的丰度;而nga的处理只恢复了bacteroidia的丰度,但是进一步加剧了clostridia、bacilli、gammaproteobacteria、erysipelotrichia、deferribacteres和coriobacteriia等纲的变化(图7b和表3)。
[0027]
表2. 肠道菌群门水平丰度其中,数据以平均值
±
标准差形式表示。
[0028]
表3. 肠道菌群纲水平丰度
其中,数据以平均值
±
标准差形式表示。
[0029]
随后,为了进一步分析得到响应nga处理的关键肠道菌群种类,利用冗余分析(rda)方法,将对照组、dss组和nga处理的不同分组做为环境因子,筛选得到响应dss和nga处理的关键肠道菌群(属水平)18个,不同的分组可以很好的聚类在一起,证明这18个肠道菌群具有很强的组特异性(图7和表4)。利用spearman 关联分析对18个关键菌群丰度和4个关键血清炎症因子进行关联分析,以≥0.667或者≤-0.667做为强相关性的筛选标准,则血清炎症因子il-1β、tnf-α、il-4和ifn-γ对应的强相关菌群数量分别是13、9、4和5(图8和表4)表4. rda筛选得到的响应nga处理的关键菌群信息
其中,数据以平均值
±
标准差形式表示。
[0030]
上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1