一种手性含硅聚酯及其合成方法
1.本发明属于含硅高分子合成技术领域,具体涉及一种手性含硅聚酯及应用铜的双噁唑啉配体配合物催化合成结构新颖的手性含硅聚酯的方法。
背景技术:
2.受到自然界中天然手性聚合物的启发,关于人工合成手性聚合物的研究逐渐引起人们的注意。目前,人工合成手性聚合物已被应用于手性催化、分离介质、生物材料和非线性光学材料等领域(参考文献一:itsuno,s.polymeric chiral catalyst design and chiralpolymer synthesis[m].new jersey:john wiley&sons,inc.2011.)。
[0003]
手性单体的聚合反应是一种合成光学活性聚合物简单、直接的方法(参考文献二: ciardelli,f.;altomare,a.;carlini,c.prog.polym.sci.1991,16,259-277)。然而该方法也存在着一些缺点,例如手性单体的高成本和商业不可得性。相比之下,利用非手性单体的不对称聚合来合成手性聚合物更加实用和经济(参考文献三:(a)nagata,y.;takeda,r.; suginome,m.acs cent.sci.2019,5,1235-1240.(b)chu,j.-h.;xu,x.-h.;kang,s.-m.; liu,n.;wu,z.-q.j.am.chem.soc.2018,140,17773-17781.(c)nozaki,k.;sato,n.; takaya,h.j.am.chem.soc.1995,117,9911-9912.)。到目前为止,不对称聚合已被成功应用于各类手性聚合物的合成。然而,大多数手性聚合物的光学纯度仍是依靠旋光和圆二色谱来表征,而这两种手段并不能实现光学纯度的精确表征。因此,手性聚合物光学纯度的精确表征仍然是具有挑战性的研究课题(参考文献四:(a)lu,x.-b.;darensbourg, d.j.chem.soc.rev.2012,41,1462-1484.(b)childers,m.i.;longo,j.m.;zee,n.j.v.; lapointe,a.m.;coates,g.w.chem.rev.2014,114,8129-8152.)。
[0004]
作为一种构建碳-碳键和碳-杂键的有效方法,卡宾插入反应已被广泛应用于有机合成中(参考文献五:ford,a.;miel,h.;ring,a.;slattery,c.n.;maguire,a.r.;mckervey, m.a.chem.rev.2015,115,9981-10080.)。这种方法也逐渐被用于具有新颖主链结构聚合物的合成。2010年,ihara小组使用rh2(oac)4作为催化剂,实现了重氮羰基化合物、酚和四氢呋喃的三组分缩聚反应,得到新型的聚醚酮(参考文献六:ihara,e.;saiki,k.; goto,y.;itoh,t.;inoue,k.macromolecules 2010,43,4589-4598.)。之后,二羧酸也被应用于该三组分缩聚反应(参考文献七:ihara,e.;hara,y.;itoh,t.;inoue,k.macromolecules 2011,44,5955-5960.)。此外,yan小组报道了铑催化的重氮化合物与羧酸的氧-氢键插入聚合,合成了一系列聚酯(参考文献八:wang,x.;ding,y.;tao,y.;wang,z.;wang,z.;yan,j.polym.chem.2020,11,1708-1712.)。最近,ihara小组利用钌催化剂,也成功实现了重氮化合物与芳胺的氮-氢键插入聚合反应(参考文献九:shimomoto,h.;mukai,h.; bekku,h.;itoh,t.;ihara,e.macromolecules 2017,50,9233-9238.)。尽管卡宾的硅-氢键插入反应已经被发展的很完善,但该方法还未被应用于聚合物的合成。
技术实现要素:
[0005]
本发明的目的是提供一种手性含硅聚酯及其合成方法,是以廉价金属铜与双噁唑啉配体的配合物作为催化剂,催化硅烷单体与重氮化合物的对映选择性插入聚合制备所述手性含硅聚酯的方法。本发明将不对称硅-氢键插入反应用于光学活性聚合物的合成。同时,为了精确表征手性聚合物的光学纯度,将酯基引入重氮化合物的结构中以便于对聚合产物进行降解以及聚合反应立体选择性的表征。
[0006]
为实现上述目的,本发明采用的技术方案如下:
[0007]
一种手性含硅聚酯,具有如通式ⅲ所示的结构:
[0008][0009]
式中:r1和r2均为芳基,优选为含有各种取代基的芳基,如苯基、4-氟苯基、4
-ꢀ
甲氧基苯基、2-氯苯基和2-萘基等。
[0010]
一种上述手性含硅聚酯的合成方法,以铜与双噁唑啉配体的配合物为催化剂,催化单体ⅰ(重氮化合物)和单体ⅱ(硅烷)发生对映选择性插入聚合制备所述手性含硅聚酯;
[0011]
所述铜的双噁唑啉配体配合物与单体ⅰ或单体ⅱ的摩尔比为:0.005~0.050:1,优选为0.010~0.030:1,更优选为0.010~0.020:1;且所述单体ⅱ与单体ⅲ的摩尔比为1:1~ 1:1.2,优选为1:1;
[0012]
所述具体的反应式如下:
[0013][0014]
式中:r1和r2均为芳基,优选为含有各种取代基的芳基,如苯基、4-氟苯基、4
-ꢀ
甲氧基苯基、2-氯苯基和2-萘基等。
[0015]
基于以上技术方案,优选地,所述r1和r2优选为含有不同取代基的芳基。
[0016]
基于以上技术方案,优选的,所述反应温度为-20~80℃,优选为0~40℃。
[0017]
基于以上技术方案,优选的,所述反应时间为24-48小时。
[0018]
基于以上技术方案,优选的,所述合成手性含硅聚酯的方法步骤如下:
[0019]
在氮气保护下,将单体ⅰ和单体ⅱ加入所述催化剂溶液中反应,得到所述手性含硅聚酯;
[0020]
所述催化剂溶液为所述催化剂溶于有机溶剂形成。
[0021]
基于以上技术方案,优选地,待反应结束,除去有机溶剂后加入二氯甲烷溶解产物,滴加冷甲醇使产物析出,去除上层有机溶剂,抽干得到手性含硅聚酯。
[0022]
基于以上技术方案,优选地,除去有机溶剂的方法为减压除去溶剂。
[0023]
基于以上技术方案,优选地,所述插入聚合反应中使用的有机溶剂选自均三甲苯 (mesitylene)、氯苯(phcl)、氯仿(chcl3)、二氯甲烷(dcm)、叔丁基甲醚(
t
bme)、乙腈(mecn)、四氢呋喃(thf)中的至少一种,优选为氯苯。
[0024]
基于以上技术方案,优选地,所述铜的双噁唑啉配体配合物是通过铜的前驱体与双噁唑啉配体在有机溶剂中搅拌反应得到,所述反应温度为20-40℃,反应时间为两小时。
[0025]
基于以上技术方案,优选地,所述铜的前驱体为三氟甲磺酸铜(ⅱ)cu(otf)2、四乙腈四氟硼酸铜(ⅰ)cu(mecn)4bf4、环己丁酸铜(ⅱ)cur2、四乙腈六氟磷酸铜(ⅰ) cu(mecn)4pf6中的至少一种,优选为三氟甲磺酸铜(ⅱ)cu(otf)2。
[0026]
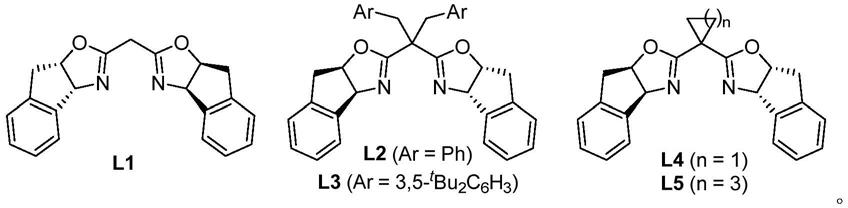
基于以上技术方案,优选地,所述双噁唑啉配体为l1-l5中的至少一种,优选为 l1,所述l1-l5的结构式如下:
[0027][0028]
基于以上技术方案,优选地,所述铜的前驱体与双噁唑啉配体的摩尔比为1:1.0至 1:1.5,优选为1:1.2。
[0029]
基于以上技术方案,优选地,所述铜的双噁唑啉配体配合物所使用的有机溶剂选自均三甲苯(mesitylene)、氯苯(phcl)、氯仿(chcl3)、二氯甲烷(dcm)、叔丁基甲醚(
t
bme)、乙腈(mecn)、四氢呋喃(thf)中的至少一种,优选为氯苯。
[0030]
基于以上技术方案,优选地,所述插入聚合反应中使用的有机溶剂与所述铜的双噁唑啉配体配合物所使用的有机溶剂相同。
[0031]
基于以上技术方案,优选地,所述单体ⅰ和单体ⅱ在所述催化剂溶液的浓度分别为 0.1~1.0mmol/ml。
[0032]
作为优选的技术方案,所述聚合物的光学纯度表征步骤为:
[0033]
向反应瓶中加入手性聚酯(80mg)、甲苯(3ml)、二异丙基氢化铝甲苯溶液(0.5ml, 1.5m),于零下78℃下搅拌反应0.5小时后逐渐升至室温继续反应3小时,分离目标产物二醇,通过核磁确定结构,hplc确定光学纯度。
[0034]
本发明以廉价金属铜的双噁唑啉配体配合物作为催化剂,催化重氮化合物(单体ⅰ) 与硅烷(单体ⅱ)的对映选择性插入聚合制备所述手性聚酯的方法。
[0035]
1.反应活性高,手性含硅聚酯的数均分子量最高为1.42
×
104;
[0036]
2.反应立体选择性高,其对映选择性可达99.2%,非对映选择性可达9.1:1;
[0037]
3.手性含硅聚酯的光学纯度高、热稳定性好;
[0038]
4.催化剂商业可得,反应操作简便实用;
[0039]
5.反应条件温和,底物范围广。
具体实施方式
[0040]
下面通过实施例详述本发明,但本发明并不限于下述的实施例。
[0041]
本文单独或组合使用的术语“芳基”是指任取代的芳香烃基,其具有6-约20个,如6-12个或6-10个成环碳原子,其可以是单环芳基、双环芳基或更多环芳基。双环芳基或更多环芳基可以是一个单环芳基与其它独立环,如脂环、杂环、芳环、芳杂环或更多环芳基。单环芳基的非限定性实施例包括6至约12个、6至约10个或6至约8个成环碳原子的单环芳基,例如苯基;双环芳基例如萘基;多环芳基例如菲基、蒽基、薁基。
1.824g,12.0mmol)的乙腈溶液(10ml),室温反应12小时,减压除去溶剂,硅胶柱层析纯化(石油醚/乙酸乙酯=50/1到10/1)得到单体2d和2e。
[0053]
实施例6-18
[0054]
铜催化硅氢键插入聚合反应条件的优化
[0055]
手套箱中,将铜的前驱体[cu](底物用量的2mol%)、双噁唑啉配体l(底物用量的2.4mol%)、nabarf(底物用量的2.4mol%)和反应溶剂(1.5ml)加入反应瓶,室温搅拌2小时。氮气保护下,加入单体1a(0.3mmol)和单体2a(0.3mmol),20℃下反应 24小时,聚合反应结束后,通过沉淀法(二氯甲烷/甲醇,具体为:减压除去溶剂后加入2毫升二氯甲烷溶解产物,滴加15毫升冷甲醇使产物析出,去除上层溶剂,抽干得到聚合产物)纯化聚合产物(手性含硅聚酯)3a。
[0056]
向反应瓶中加入手性含硅聚酯3a(80mg)、甲苯(3ml)、二异丙基氢化铝(dibal-h) 甲苯溶液(0.5ml,1.5m),于-78℃下搅拌反应0.5小时后逐渐升至室温继续反应3小时,分离目标产物二醇4a,通过核磁确定结构,hplc确定光学纯度,反推聚合物的光学纯度。
[0057]
反应式和配体结构如下:
[0058][0059]
聚合物的数均分子量(mn)和分子量分布(pdi)通过凝胶色谱仪(gpc)测定,产率为分离收率,改变反应温度和溶剂种类以及催化剂和底物的比例,制备得到分子量不同的产物,详见表1。
[0060]
表1.铜催化卡宾的不对称硅-氢键插入聚合条件优化a[0061][0062]
实施例18-27
[0063]
铜催化硅氢键插入聚合合成手性含硅聚酯3a-j
[0064]
手套箱中,将cu(otf)2(底物用量的2mol%)、双噁唑啉配体l1(底物用量的2.4 mol%)、nabarf(底物用量的2.4mol%)和氯苯(1.5ml)加入反应瓶,室温搅拌2小时。氮气保护下,加入单体1(0.3mmol)和单体2(0.3mmol),20℃下反应24小时,聚合反应结束后,通过沉淀法(二氯甲烷/甲醇,具体为:减压除去溶剂后加入2毫升二氯甲烷溶解产物,滴加15毫升冷甲醇使产物析出,去除上层溶剂,抽干得到聚合产物) 纯化聚合产物(手性含硅聚酯)3。
[0065]
向反应瓶中加入手性含硅聚酯3(80mg)、甲苯(3ml)、二异丙基氢化铝(dibal-h) 甲苯溶液(0.5ml,1.5m),于-78℃下搅拌反应0.5小时后逐渐升至室温继续反应3小时,分离目标产物二醇4,通过核磁确定结构,hplc确定光学纯度,反推聚合物的光学纯度。
[0066]
反应式和底物结构如下:
[0067][0068]
聚合物的数均分子量(mn)和分子量分布(pdi)通过凝胶色谱仪(gpc)测定,产率为分离收率,详见表2。
[0069]
表2.铜催化卡宾的不对称硅-氢键插入聚合底物拓展a[0070]
[0071][0072]
实施例28-32
[0073]
热分析
[0074]
手性含硅聚酯的热稳定性,如质量分解5%时的温度(t5)和分解50%时的温度(t
50
) 通过同步热分析仪(tga)测定,玻璃化转变温度(tg)通过差示扫描量热仪(dsc)测定,详见表3。
[0075]
表3.手性含硅聚酯的热分析a[0076][0077]
ethane-1,2-diyl bis(2-diazo-2-phenylacetate)(2a):16mmol scale,3.997g,71%overall yield,yellow solid,mp=82-84℃,new compound,rf=0.50(hexanes/ethyl acetate=30/1). 1
h nmr(400mhz,cdcl3)δ7.52-7.43(m,4h),7.42-7.35(m,4h),7.23-7.16(m,2h),4.55 (s,4h).
13
c nmr(100mhz,cdcl3)δ165.0,129.2,126.2,125.4,124.2,63.7,62.7. hrms-esi calculated for c
18h14
kn4o4[m+k]
+
,389.0647;found,389.0646.
[0078]
ethane-1,2-diyl bis(2-diazo-2-(4-fluorophenyl)acetate)(2b):10mmol scale,1.544g, 41%overall yield,yellow solid,mp=120-122℃,new compound,rf=0.60(hexanes/ethyl acetate=30/1).1h nmr(400mhz,cdcl3)δ7.55-7.38(m,4h),7.18-7.02(m,4h),4.54(s, 4h).
13
c nmr(100mhz,cdcl3)δ165.0,161.3(d,1j
f-c
=246.5hz),126.1(d,3j
f-c
=7.9 hz),121.1(d,4j
f-c
=3.3hz),116.3(d,2j
f-c
=21.9hz),62.9,62.8.
19
f nmr(376mhz, cdcl3)δ-115.88.hrms-esi calculated for c
18h12
f2kn4o4[m+k]
+
,425.0458;found, 425.0455.
[0079]
ethane-1,2-diyl bis(2-diazo-2-(naphthalen-2-yl)acetate)(2c):4mmol scale,0.986g, 60%overall yield,yellow solid,mp=171-173℃,new compound,rf=0.40(hexanes/ethyl acetate=30/1).1h nmr(400mhz,cdcl3)δ8.00(s,2h),7.89-7.62(m,6h),7.61-7.30(m, 6h),4.63(s,4h).
13
c nmr(100mhz,cdcl3)δ165.1,133.8,131.7,128.9,
compound,99.1%ee, 9.0:1dl/meso,[α]
20d
=+51.25(c 1.04,thf),rf=0.30(hexanes/ethyl acetate=3/1).1h nmr(400mhz,cdcl3)δ7.41-7.33(m,4h),7.28-7.24(m,4h),7.20-7.12(m,2h), 7.07-6.96(m,4h),4.09(t,j=11.2,2h),4.01-3.88(m,2h),2.66(dd,j=11.3,4.4hz,2h), 1.35(brs,2h),0.26(s,6h),0.23(s,6h).
13
c nmr(100mhz,cdcl3)δ140.0,138.1,133.4, 128.7,128.3,125.6,63.2,41.6,-3.7,-4.8.hplc:chiracel od-3 column,230nm,30℃, n-hexane/i-proh=85/15,flow=0.8ml/min,retention time 19.7min,22.1min(meso)and 24.3min(major).hrms:calculated for c
26h38
no2si2[m+nh4]
+
452.2436,found: 452.2432.
[0094]
2,2'-(1,4-phenylenebis(dimethylsilanediyl))bis(2-(4-fluorophenyl)ethan-1-ol)(4b):60 mg,83%yield,colorless viscous liquid,new compound,98.9%ee,8.0:1dl/meso,[α]
20d
=+47.76(c 1.16,thf),rf=0.45(hexanes/ethyl acetate=3/1).1h nmr(400mhz,cdcl3) δ7.41-7.29(m,4h),7.03-6.87(m,8h),4.01(t,j=11.1hz,2h),3.92(dd,j=11.3,4.5hz, 2h),2.62(dd,j=11.0,4.5hz,2h),1.44(brs,2h),0.26(s,6h),0.24(s,6h).
13
c nmr(100 mhz,cdcl3)δ161.1(d,1j
f-c
=243.4hz),138.0,135.7(d,4j
f-c
=2.8hz),133.4,129.4(d, 3jf-c
=7.5hz),115.5(d,2j
f-c
=21.1hz),63.3,40.7,-3.8,-4.8.
19
f nmr(376mhz,cdcl3) δ-117.99.hplc:chiracel od-h column,230nm,30℃,n-hexane/i-proh=93/7,flow= 0.8ml/min,retention time 22.8min(major),25.7min(meso)and 31.2min.hrms: calculated for c
26h36
f2no2si2[m+nh4]
+
488.2247,found:488.2247.
[0095]
2,2'-(1,4-phenylenebis(dimethylsilanediyl))bis(2-(naphthalen-1-yl)ethan-1-ol)(4c):70 mg,96%yield,colorless viscous liquid,new compound,99.2%ee,9.1:1dl/meso,[α]
20d
= +41.71(c 1.34,thf),rf=0.20(hexanes/ethyl acetate=3/1).1h nmr(400mhz,cdcl3)δ 7.81(d,j=7.5hz,2h),7.77-7.67(m,4h),7.50-7.36(m,10h),7.16(dd,j=8.4,1.8hz, 2h),4.20(t,j=11.3hz,2h),4.02(dd,j=11.4,4.4hz,2h),2.85(dd,j=11.3,4.4hz,2h), 1.52(brs,2h),0.30(s,6h),0.28(s,6h).
13
c nmr(100mhz,cdcl3)δ138.1,137.7,133.8, 133.5,131.9,128.3,127.8,127.5,127.2,126.2,126.2,125.2,63.2,41.8,-3.6,-4.7.hplc: chiracel od-h column,230nm,30℃,n-hexane/i-proh=60/40,flow=0.7ml/min, retention time 16.0min,20.3min(meso)and 26.8min(major).hrms:calculated for c
34h42
no2si2[m+nh4]
+
552.2749,found:552.2746.
[0096]
2,2'-(1,4-phenylenebis(dimethylsilanediyl))bis(2-(2-chlorophenyl)ethan-1-ol)(4d):60 mg,83%yield,colorless viscous liquid,new compound,98.0%ee,6.0:1dl/meso,[α]
20d
=
ꢀ-
22.92(c 1.20,thf),rf=0.40(hexanes/ethyl acetate=3/1).1h nmr(400mhz,cdcl3)δ 7.47-7.40(m,4h),7.39-7.35(m,2h),7.24-7.15(m,2h),7.13-7.03(m,4h),4.07-3.91(m, 4h),3.41(dd,j=10.6,5.0hz,2h),1.34(brs,2h),0.29(s,6h),0.27(s,6h).
13
c nmr(100 mhz,cdcl3)δ138.5,138.0,134.8,133.5,130.0,127.6,127.1,126.5,63.4,36.7,-3.4,-5.1. hplc:chiracel od-h column,230nm,30℃,n-hexane/i-proh=90/10,flow=0.9 ml/min,retention time 20.2min,23.2min(meso)and 26.4min(major).hrms:calculated for c
26h36
cl2no2si2[m+nh4]
+
520.1656,found:520.1653(
35
cl+
35
cl),522.1627(
35
cl+
37
cl) and 524.1609(
37
cl+
37
cl).
[0097]
2,2'-([1,1'-biphenyl]-4,4'-diylbis(dimethylsilanediyl))bis(2-(2-chlorophenyl)ethan-1-ol) (4e):62mg,85%yield,colorless viscous liquid,new compound,97.4%ee,5.6:1dl/meso, [α]
20d
=-25.34(c 1.18,thf),rf=0.20(hexanes/ethyl acetate=3/1).1h nmr(400mhz, cdcl3)δ7.63(d,j=8.0hz,4h),7.56(d,j=8.0hz,4h),7.42-7.36(m,2h),7.23-7.17(m, 2h),7.13-7.05(m,4h),4.11-3.97(m,4h),3.45(dd,j=10.5,5.1hz,2h),1.47(brs,2h), 0.33(s,6h),0.31(s,6h).
13
c nmr(100mhz,cdcl3)δ141.9,138.5,135.8,134.8,134.7, 130.0,127.6,127.0,126.6,126.5,63.3,36.7,-3.2,-5.0.hplc:chiracel ad-h column,230 nm,30℃,n-hexane/i-proh=75/25,flow=0.9ml/min,retention time 9.8min(major), 13.1min(meso)and 15.6min.hrms:calculated for c
32h40
cl2no2si2[m+nh4]
+
596.1969, found:596.1972(
35
cl+
35
cl),598.1950(
35
cl+
37
cl)and 600.1940(
37
cl+
37
cl).
[0098]
2,2'-(1,3-phenylenebis(dimethylsilanediyl))bis(2-(2-chlorophenyl)ethan-1-ol)(4f):62 mg,86%yield,colorless viscous liquid,new compound,98.4%ee,5.5:1dl/meso,[α]
20d
=
ꢀ-
11.81(c 1.16,thf),rf=0.40(hexanes/ethyl acetate=3/1).1h nmr(400mhz,cdcl3)δ 7.55-7.44(m,3h),7.41-7.30(m,3h),7.22-7.13(m,2h),7.12-6.96(m,4h),4.06-3.85(m, 4h),3.37(dd,j=10.4,5.2hz,2h),1.59(brs,2h),0.27(s,12h).
13
c nmr(100mhz, cdcl3)δ139.8,138.6,135.9,135.2,134.7,130.0,127.6,127.3,127.0,126.4,63.3,36.7,-3.3,
ꢀ-
3.4,-4.9,-4.9.hplc:chiracel ad-h column,230nm,30℃,n-hexane/i-proh=90/10, flow=0.8ml/min,retention time 15.6min(major),17.3min(meso)and 23.2min.hrms: calculated for c
26h36
cl2no2si2[m+nh4]
+
520.1656,found:520.1657(
35
cl+
35
cl),522.1630 (
35
cl+
37
cl)and 524.1603(
37
cl+
37
cl).
[0099]
2,2'-((2,5-dimethyl-1,4-phenylene)bis(dimethylsilanediyl))bis(2-(2-chlorophenyl)ethan
ꢀ-
1-ol)(4g):68mg,94%yield,colorless viscous liquid,new compound,94.9%ee,4.0:1 dl/meso,[α]
20d
=+3.60(c 1.36,thf),rf=0.40(hexanes/ethyl acetate=3/1).1h nmr(400 mhz,cdcl3)δ7.38(dd,j=7.9,1.2hz,2h),7.25-7.06(m,8h),4.04(t,j=11.1hz,2h), 3.88(dd,j=11.3,4.6hz,2h),3.60-3.48(m,2h),2.39(s,6h),1.43(br,2h),0.36(s,6h), 0.27(s,6h).
13
c nmr(100mhz,cdcl3)δ140.1,138.6,136.9,136.6,134.8,130.0,127.8, 127.0,126.4,63.3,36.4,23.2,-1.9,-2.0,-3.1,-3.1.hplc:chiracel ad-h column,230nm, 30℃,n-hexane/i-proh=85/15,flow=0.9ml/min,retention time 7.3min(major),8.8min (meso)and 10.7min.hrms:calculated for c
28h40
cl2no2si2[m+nh4]
+
548.1969,found: 548.1968(
35
cl+
35
cl),550.1942(
35
cl+
37
cl),552.1928(
37
cl+
37
cl).
[0100]
2,2'-([1,1'-biphenyl]-4,4'-diylbis(dimethylsilanediyl))bis(2-(4-methoxyphenyl)ethan-1
-ꢀ
ol)(4h):67mg,92%yield,colorless viscous liquid,new compound,98.4%ee,5.6:1dl/meso, [α]
20d
=+27.54(c 1.22,thf),rf=0.20(hexanes/ethyl acetate=3/1).1h nmr(400mhz, cdcl3)δ7.60(d,j=8.1hz,4h),7.50(d,j=8.1hz,4h),6.97(d,j=8.7hz,4h), 6.87-6.78(m,4h),4.05(t,j=11.2hz,2h),3.96(dd,j=11.2,4.5hz,2h),3.79(s,6h), 2.63(dd,j=11.2,4.6hz,2h),1.52(brs,2h),0.30(s,6h),0.27(s,6h).
13
c nmr(100mhz, cdcl3)δ157.6,141.8,136.1,134.7,131.7,129.2,126.5,
114.2,63.4,55.4,40.5,-3.5,-4.7. hplc:chiracel ia column,230nm,30℃,n-hexane/i-proh=65/35,flow=0.7ml/min, retention time 14.8min(major),20.3min(meso)and 22.7min.hrms:calculated for c
34h46
no4si2[m+nh4]
+
588.2960,found:588.2964.
[0101]
2,2'-([1,1'-biphenyl]-4,4'-diylbis(dimethylsilanediyl))bis(2-phenylethan-1-ol)(4i):69 mg,96%yield,white solid,mp=76-78℃,new compound,99.0%ee,7.2:1dl/meso,[α]
20d
= +36.47(c 1.36,thf),rf=0.30(hexanes/ethyl acetate=3/1).1h nmr(400mhz,cdcl3)δ 7.58(d,j=8.1hz,4h),7.48(d,j=8.1hz,4h),7.27-7.22(m,4h),7.17-7.10(m,2h), 7.09-6.98(m,4h),4.10(t,j=11.3hz,2h),3.96(dd,j=11.3,4.4hz,2h),2.68(dd,j= 11.2,4.5hz,2h),1.46(brs,2h),0.29(s,6h),0.25(s,6h).
13
c nmr(100mhz,cdcl3)δ 141.8,140.0,135.9,134.7,128.7,128.3,126.6,125.6,63.3,41.7,-3.5,-4.7.hplc:chiracelad-h column,230nm,30℃,n-hexane/i-proh=70/30,flow=0.9ml/min,retention time 9.4min(major),16.0min and 18.4min(meso).hrms:calculated for c
32h42
no2si
2 [m+nh4]
+
528.2749,found:528.2751。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1