抗PCSK9单克隆抗体的生产工艺的制作方法
抗pcsk9单克隆抗体的生产工艺
技术领域
1.本发明涉及生物医药领域,特别涉及一种抗pcsk9单克隆抗体的生产工艺。
背景技术:
2.pcsk9又称为神经细胞凋亡转化酶-1(neural apoptosis-regulated convertase-1,narc-1),属于前蛋白转化酶家族,蛋白酶k亚家族。由信号肽前结构域,催化结构域及羧基末端结构域三部分组成,主要在人肝脏细胞、小肠和肾表达。pcsk9能够与低密度脂蛋白-胆固醇(ldl-c)的受体(ldlr)结合,并将其内化至溶酶体降解,抑制其再循环到肝细胞表面,故而减弱肝脏代谢血浆中ldl-c的能力。2003年,研究发现,pcsk9突变与家族性高血脂胆固醇相关,突变分为功能获得性(gain-of-function,gof)突变和功能缺失性(loss-of-function,lof)突变,其中功能获得性突变包括:d347y,r218s,f216l,s127r,l108r及d35y型,功能缺失性突变包括:c679x,y142x,g106r,δr97及r46l。功能获得性突变会减少肝细胞表面的可循环使用的ldlr的数量,上调ldl-c水平导致血脂异常,而功能缺失性突变则会使ldl-c水平相应降低。常染色体显性的家族性高胆固醇血症与早发心血管疾病风险的增加密切相关。因此通过抑制pcsk9从而达到降低ldl-c的水平,成为近年来研究的热点。
3.抗pcsk9抗体可有效阻断血液中pcsk9与ldl受体(ldlr)的结合,阻止psck9介导的ldlr降解,增加ldlr的数量以从血液中清除低密度脂蛋白(ldl-c),从而降低血液中ldl-c水平,可用于原发性高胆固醇血症(杂合子家族性(hefh)和非家族性)和混合型高血脂症、纯合子家族性高胆固醇血症(hofh),或患有动脉粥样硬化性心血管疾病(atherosclerosis cardio-vascular disease,ascvd)且需要进一步降低低密度脂蛋白(ldl-c)水平的患者的治疗。如专利申请号为201510895676.6的中国专利公开了一种抗pcsk9抗体及其应用,其成功制备了抗pcsk9抗体产品。为实现抗pcsk9抗体产品的广泛应用需要提供可靠的生产工艺,由于生产过程中涉及的工艺参数很多,通过工艺优化获得一个可靠的生产工艺成为了一个难点。
技术实现要素:
4.本发明所要解决的技术问题在于针对上述现有技术中的不足,提供一种抗pcsk9单克隆抗体的生产工艺。
5.为解决上述技术问题,本发明采用的技术方案是:一种抗pcsk9单克隆抗体的生产工艺,包括以下步骤:
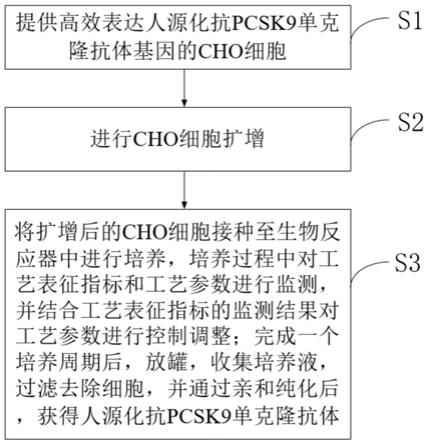
6.1)提供高效表达人源化抗pcsk9单克隆抗体基因的cho细胞;
7.2)进行cho细胞扩增;
8.3)将扩增后的cho细胞接种至生物反应器中进行培养,培养过程中对工艺表征指标和工艺参数进行监测,并结合工艺表征指标的监测结果对工艺参数进行控制调整;完成一个培养周期后,放罐,收集培养液,过滤去除细胞,并通过亲和纯化后,获得人源化抗
pcsk9单克隆抗体。
9.优选的是,所述步骤1)具体包括:
10.1-1)采用重组人pcsk9抗原免疫小鼠制备杂交瘤细胞,筛选阳性克隆,随后采用pcr的方法获取阳性杂交瘤细胞抗体轻链、重链的cdna序列;为降低或消除鼠源抗体的免疫原性,对获得的轻链和重链序列进行人源化;
11.1-2)选择驯化后的无血清悬浮培养的中国仓鼠卵巢癌细胞作为宿主细胞,通过基因合成获得人源化抗pcsk9单克隆抗体基因的重链和轻链的核苷酸序列:
12.将编码抗pcsk9单克隆抗体的重链的基因片段克隆到载体1上,同时将编码抗pcsk9单克隆抗体的轻链的基因片段克隆到携带gs抗性基因的载体2上,然后把重链和轻链载体分别通过酶切并连接,最终完成一个双基因表达载体的构建,得到人源化抗pcsk9单克隆抗体基因表达载体;
13.1-3)将人源化抗pcsk9单克隆抗体基因表达载体转到cho-k1宿主细胞中建立稳定表达细胞株;
14.用gs作为筛选因子对转染后的细胞进行筛选,通过elisa检测96孔板中多克隆细胞的表达量,挑选表达量高的多克隆先后扩增到24孔板和50ml离心管,最终挑选表达量最高的多个克隆通过补料分批培养的方法进一步筛选,通过elisa筛选出表达量最高的的细胞株;选取表达量最高细胞株进行有限稀释法筛选单克隆,经过96孔板、24孔板和50ml离心管的扩增及第一轮分批补料培养后,挑选表达量较高的若干株单克隆通过第二轮分批补料培养实验进一步筛选;最终选取表现最好的一株单克隆细胞株作为重组工程细胞;
15.1-4)取得到的重组工程细胞建立三级细胞库:原始细胞库、主细胞库、工作细胞库,通过工作细胞库提供所述高效表达人源化抗pcsk9单克隆抗体基因的cho细胞。
16.优选的是,所述步骤2)包括预先进行的细胞复苏步骤,具体为:从工作细胞库中取1支冻存管,迅速水浴直至细胞完全融化;在生物安全柜中进行无菌操作,离心去除上清后转入有摇瓶中,培养混匀后取样检测,再置于摇床中培养2-4天,之后用于后续的扩增培养。
17.优选的是,所述步骤2)具体包括:先将细胞复苏后得到的cho细胞转移至第一容器进行第一次扩增,培养2-4天,符合转种要求时,再转移至第二容器进行第二次扩增;培养2-4天,符合转种要求时,再转移至第三容器进行第三次扩增。
18.优选的是,所述步骤3)中,结合工艺表征指标的监测结果对工艺参数进行控制调整的方法具体包括:
19.1)将预设的培养周期t利用按时间先后顺序排列的n个时间结点分割成顺序排列的n个时间区间,n个时间结点为t1、t2、...、t
n-1
、tn,顺序排列的n个时间区间为:0-t1,t
1-t2,...,t
n-1-tn;
20.设置初始的工艺参数的控制数据集s0,数据集s0包括顺序排列的n个时间区间依次对应的初始的工艺参数范围:pp1、pp2、...、pp
n-1
、ppn,即t
n-1-tn时间区间内对应的初始工艺参数范围为ppn;
21.设置工艺表征指标的目标控制数据集q,数据集q包括顺序排列的n个时间区间依次对应的工艺表征指标的目标控制目标范围:k1、k2、...、k
n-1
、kn,即t
n-1-tn时间区间内对应的目标控制目标范围为kn;
22.2)培养过程中,在每个时间区间t
i-1-ti内,按照对应的初始工艺参数范围ppi进行
控制;同时每个时间区间t
i-1-ti内对工艺表征指标进行至少3次检测,当检测结果超出该时间区间的工艺表征指标的目标控制目标范围ki时,调节该工艺参数范围以使工艺表征指标的检测结果回归或靠近标控制目标范围ki,记录调整后的工艺参数范围ppi',并将该时间区间t
i-1-ti的设定的工艺参数范围ppi更新为调整后的工艺参数范围ppi';其中,i=1,2,...,n,且i=1时的t0表示开始的时间,即t
0-t1对应于0-t1;
23.3)完成一个周期的培养后,更新工艺参数的控制数据集为s1,将s1作为下一次培养的初始的工艺参数的控制数据集。
24.优选的是,其中,工艺参数至少包括培养温度、溶液ph值、搅拌速度和溶氧。
25.优选的是,其中,工艺表征指标至少包括细胞活率、活细胞密度、葡萄糖浓度、乳酸浓度。
26.优选的是,其中,通过使用二氧化碳通气和添加碳酸氢钠溶液调节控制溶液ph值,通过通入氧气或压缩空气控制溶氧。
27.优选的是,其中,通过vicell细胞计数仪检测细胞活率、活细胞密度,通过生化分析仪检测葡萄糖浓度、乳酸浓度。
28.优选的是,所述步骤3)中采用分批补料式方式进行培养,从第2天开始进行补料,每天补料直至放罐前一天。
29.本发明的有益效果是:本发明可实现抗pcsk9单克隆抗体的生产,生产的抗pcsk9单克隆抗体可用于家族性高胆固醇血症、心血管疾病等治疗的药物的制备;
30.本发明中通过将培养周期分割形成多个时间区间,每一个时间区间作为一个时间控制单元,在不同的时间控制单元内设定最适宜的工艺参数以及用于表征工艺参数优劣的工艺表征指标,并进行工艺参数的分时间段控制,从而能实现生产工艺的精细化控制,使得一个培养周期内,不同的时间区间内的工艺参数分别得到不断优化,并通过优化数据积累,使整体的生产工艺能得到更大程度的不断优化,从而能获得可靠的用于实现抗pcsk9单克隆抗体生产的工艺。
附图说明
31.图1为本发明的抗pcsk9单克隆抗体的生产工艺的流程图。
具体实施方式
32.下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
33.应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。
34.本发明提供了一种抗pcsk9单克隆抗体的生产工艺,包括以下步骤:
35.1)提供高效表达人源化抗pcsk9单克隆抗体基因的cho细胞;
36.2)进行cho细胞扩增;
37.3)将扩增后的cho细胞接种至生物反应器中进行培养,培养过程中对工艺表征指标和工艺参数进行监测,并结合工艺表征指标的监测结果对工艺参数进行控制调整;完成一个培养周期后,放罐,收集培养液,过滤去除细胞,并通过亲和纯化后,获得人源化抗
pcsk9单克隆抗体。
38.以下提供更为具体的实施例。
39.实施例1高效表达人源化抗pcsk9单克隆抗体基因的cho细胞
40.1-1)采用重组人pcsk9抗原免疫小鼠制备杂交瘤细胞,筛选阳性克隆,随后采用pcr的方法获取阳性杂交瘤细胞抗体轻链、重链的cdna序列;为降低或消除鼠源抗体的免疫原性,对获得的轻链和重链序列进行人源化;
41.1-2)选择驯化后的无血清悬浮培养的中国仓鼠卵巢癌细胞作为宿主细胞,通过基因合成获得人源化抗pcsk9单克隆抗体基因的重链和轻链的核苷酸序列:
42.将编码抗pcsk9单克隆抗体的重链的基因片段克隆到载体1上,同时将编码抗pcsk9单克隆抗体的轻链的基因片段克隆到携带gs抗性基因的载体2上,然后把重链和轻链载体分别通过酶切并连接,最终完成一个双基因表达载体的构建,得到人源化抗pcsk9单克隆抗体基因表达载体;
43.1-3)利用微穿孔技术将人源化抗pcsk9单克隆抗体基因表达载体转到cho-k1宿主细胞中建立稳定表达细胞株;
44.用gs作为筛选因子对转染后的细胞进行筛选,通过elisa检测96孔板中多克隆细胞的表达量,挑选表达量高的多克隆先后扩增到24孔板和50ml离心管,最终挑选表达量最高的多个克隆通过补料分批培养的方法进一步筛选,通过elisa筛选出表达量最高的的细胞株;选取表达量最高细胞株进行有限稀释法筛选单克隆,经过96孔板、24孔板和50ml离心管的扩增及第一轮分批补料培养后,挑选表达量较高的若干株单克隆通过第二轮分批补料培养实验进一步筛选;最终选取表现最好的一株单克隆细胞株作为重组工程细胞;对重组工程细胞的鉴定结果显示重组工程细胞株的基因序列与抗pcsk9单克隆抗体基因的理论基因序列一致,表达产物的氨基酸序列与理论氨基酸序列一致,表达产物与人pcsk9抗原有较好的结合活性。
45.1-4)为了保证生产的可持续性和产品质量的稳定,取得到的重组工程细胞建立三级细胞库:原始细胞库(pcb)、主细胞库(mcb)、工作细胞库(wcb),通过工作细胞库提供所述高效表达人源化抗pcsk9单克隆抗体基因的cho细胞。本实施例中对主细胞库、工作细胞库及生产终末细胞进行了全面的检定,用同工酶分析法对主细胞库和工作细胞库进行鉴别,为典型的cho细胞;细菌、真菌和支原体检查结果均为阴性,细胞内、外源病毒因子检定结果均符合要求。
46.本实施例中,通过工作细胞库的稳定性研究结果显示本品的工作细胞库贮存条件稳定,贮存6个月后复苏的细胞密度、活率和直径没有发生显著改变。工作细胞库的细胞连续传代后目的基因编码序列的表达框架正确,不同代次细胞的轻链和重链基因组拷贝数相对稳定,目的产物表达量无明显下降,目的表达产物的氨基酸序列与理论序列一致,表达产物的关键质量指标和效价均未发生显著变化,证明本品的工作细胞库具有良好的传代稳定性。
47.实施例2 cho细胞扩增级细胞培养,生产抗pcsk9单克隆抗体
48.1、细胞复苏:从工作细胞库中取1支冻存管,迅速水浴直至细胞完全融化;在生物安全柜中进行无菌操作,离心去除上清后转入有125ml摇瓶中,初始培养体积30ml,培养混匀后取样检测,再置于摇床中培养2-4天,之后用于后续的扩增培养。
49.2、摇瓶扩增:自复苏培养2~4天后,符合转种要求时,将细胞复苏后得到的cho细胞转移至1l摇瓶进行第一次扩增,培养2-4天,符合转种要求时,再转移至2.8l摇瓶中进行第二次扩增;培养2-4天,符合转种要求时,再转移至第3~4个2.8l摇瓶中进行第三次扩增。
50.4、5l生物反应器培养:
51.将扩增后的cho细胞接种至5l生物反应器中进行培养,接种当天初始培养体积为2.8l,采用分批补料式方式进行培养,从第2天开始进行补料,每天补料直至放罐前一天。培养过程中对工艺表征指标和工艺参数进行监测,并结合工艺表征指标的监测结果对工艺参数进行控制调整;完成一个培养周期后,放罐,收集培养液,过滤去除细胞,并通过亲和纯化后,获得人源化抗pcsk9单克隆抗体。
52.其中,工艺参数至少包括培养温度、溶液ph值、搅拌速度和溶氧。工艺表征指标至少包括细胞活率、活细胞密度、葡萄糖浓度、乳酸浓度。
53.其中,通过使用二氧化碳通气和添加碳酸氢钠溶液调节控制溶液ph值,通过通入氧气或压缩空气控制溶氧。通过vicell细胞计数仪检测细胞活率、活细胞密度,通过生化分析仪检测葡萄糖浓度、乳酸浓度。
54.其中,细胞培养过程中若发现有大量泡沫,需补加适量的消泡剂。
55.其中,收集培养液中的单克隆抗体采用蛋白a柱亲和纯化,收集洗脱的抗体,然后用pbs磷酸缓冲液透析过夜,收集透析后的抗体,再进行无菌过滤后得到纯化后的人源化抗pcsk9单克隆抗体。纯化后的抗体经蛋白浓度、纯度、内毒等检测分析后,结果表明其满足质量需求。
56.在一种优选的实施例中,结合工艺表征指标的监测结果对工艺参数进行控制调整,具体包括:
57.4-1、将预设的培养周期t利用按时间先后顺序排列的n个时间结点分割成顺序排列的n个时间区间,n个时间结点为t1、t2、...、t
n-1
、tn,顺序排列的n个时间区间为:0-t1,t
1-t2,...,t
n-1-tn;
58.设置初始的工艺参数的控制数据集s0,数据集s0包括顺序排列的n个时间区间依次对应的初始的工艺参数范围:pp1、pp2、...、pp
n-1
、ppn,即t
n-1-tn时间区间内对应的初始工艺参数范围为ppn;其中,初始的工艺参数范围根据前期实验或经验初步制定;
59.设置工艺表征指标的目标控制数据集q,数据集q包括顺序排列的n个时间区间依次对应的工艺表征指标的目标控制目标范围:k1、k2、...、k
n-1
、kn,即t
n-1-tn时间区间内对应的目标控制目标范围为kn;
60.理论上来说,一个培养周期内,在不同的时间段,最适宜的工艺参数范围并不相同,传统工艺中,是在整个培养周期内将工艺参数设定为固定不变的值,这样无法获得最优的生产工艺。本实施例中,将一个培养周期分割形成多个时间区间,在不同的时间区间内设定最适宜的工艺参数以及用于表征工艺参数优劣的工艺表征指标,并进行工艺参数的分时间段控制,使得该时间区间内的工艺表征指标落入设定的范围,从而能实现生产工艺的精细化控制,使得一个培养周期内,不同的时间区间内具有不同的最优工艺参数,通过分时间段优化生产工艺,以使整体的生产工艺能得到更大程度的优化。其中,时间区间的分割根据实际情况进行选择,可均匀分割也可非均匀分割;分割越细,更利于优化,但也会增加工作量,故需适当选择。例如,在一种实施例中,培养周期为14天,均匀分割时间区间,每个时间
区间的长度为2小时。
61.4-2、培养过程中,在每个时间区间t
i-1-ti内,按照对应的初始工艺参数范围ppi进行控制;同时每个时间区间t
i-1-ti内对工艺表征指标进行至少3次检测,当检测结果超出该时间区间的工艺表征指标的目标控制目标范围ki时,调节该工艺参数范围以使工艺表征指标的检测结果回归或靠近标控制目标范围ki(通过专业操作人员人工调整),记录调整后的工艺参数范围ppi',并将该时间区间t
i-1-ti的设定的工艺参数范围ppi更新为调整后的工艺参数范围ppi'(若检测结果在该时间区间的工艺表征指标的目标控制目标范围ki内,则工艺参数范围ppi保持不变);其中,i=1,2,...,n,且i=1时的t0表示开始的时间,即t
0-t1对应于0-t1;
62.4-3、完成一个周期的培养后,放罐,收集培养液,过滤去除细胞,并通过亲和纯化后,获得人源化抗pcsk9单克隆抗体;
63.更新工艺参数的控制数据集为s1,将s1作为下一次培养的初始的工艺参数的控制数据集;从而可实现下一次培养(或下一个培养周期)的工艺参数优化,且通过多次培养,能实现工艺参数优化数据的积累,使得工艺参数不断趋近与最优范围,以使得工艺表征指标满足预设范围或是不断接近预设范围,最终实现整体生产工艺的不断优化。
64.为方便理解,以培养温度这一工艺参数为例进行举例说明。
65.预先设定初始的温度控制数据集s
t
,数据集s
t
,包括顺序排列的n个时间区间依次对应的初始的工艺参数范围:t1、t2、...、tn;
66.培养过程中,每个时间区间t
i-1-ti内对工艺表征指标进行6次检测,当检测结果超出该时间区间的工艺表征指标的目标控制目标范围ki时,调节温度值,使得工艺表征指标的检测结果回归或靠近标控制目标范围ki,记录此时的温度ti',并将该时间区间t
i-1-ti的设定的温度范围更新为ti',从而实现该时间区间的培养温度的优化,完成一个周期的培养后,整个周期内的各个时间区间的培养温度得到了一次优化,经过若干次培养后,能实现培养温度数据的优化累计,使得每个时间区间的培养温度不断趋近与最后范围,从而使得整个周期内的培养温度的控制不断趋近与理论最优;同理,整个周期内的其他工艺参数:溶液ph值、搅拌速度、溶氧等的控制也能不断趋近与理论最优,从而实现整体生产工艺的不断优化。
67.尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1