产褐藻胶裂解酶菌株、褐藻胶裂解酶及其应用的制作方法
本发明涉及微生物技术领域,特别涉及产褐藻胶裂解酶菌株、褐藻胶裂解酶及其应用。
背景技术:
褐藻酸是由古罗糖醛酸(guluronicacid,g)及甘露糖醛酸(mannuronicacid,m)通过β-1,4糖苷键连接形成的线性高分子,是褐藻细胞壁的主要成分,广泛存在于海带、马尾藻、巨藻等褐藻细胞中。通过酶法降解制备的褐藻寡糖具有多种生理活性,如促生长、增强免疫、神经保护、抗炎、抗病毒等,在食品、药品、农业、保健品、化妆品等领域具有广泛的应用价值。酶解法反应条件温和、效率高、底物专一性强,不会产生对人体和环境有害的副产物,逐渐成为工业降解褐藻胶生产褐藻寡糖的主要手段。
褐藻胶裂解酶是多糖裂解酶的一种,可通过β-消除反应将褐藻胶降解为在非还原端具有双键的不饱和寡糖。根据底物特异性,褐藻胶裂解酶可分为g嵌段特异性裂解酶(polyg)、m嵌段特异性裂解酶(polym)及mg嵌段的双功能褐藻胶裂解酶(polymg)。褐藻胶裂解酶来源广泛,已经从多种海洋动物、海洋和陆地微生物体内分离得到,海洋细菌是褐藻胶裂解酶的重要来源,如假单胞菌、黄杆菌、交替假单胞菌、弧菌、芽胞杆菌等。
目前报道的产酶细菌依然存在着酶活性较低、降解位点单一等缺陷,限制了褐藻胶裂解酶以及酶解法制备褐藻寡糖的发展。因此,筛选高效降解褐藻胶的新型菌种资源,是开发褐藻胶资源,探索高值化利用新途径的必然要求。
技术实现要素:
有鉴于此,本发明提供了产褐藻胶裂解酶菌株及其应用。该菌株hb182678及其发酵制得的褐藻胶裂解酶能够用于降解褐藻。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了产褐藻胶裂解酶菌株mangrovicoccussp.,其保藏编号为gdmccno.61000。
基于上述研究,本发明还提供了所述产褐藻胶裂解酶菌株mangrovicoccussp.在制备褐藻胶裂解酶中的应用。
本发明还提供了所述产褐藻胶裂解酶菌株mangrovicoccussp.在降解褐藻中的应用。
本发明还提供了所述产褐藻胶裂解酶菌株mangrovicoccussp.发酵制得的褐藻胶裂解酶。
本发明还提供了所述褐藻胶裂解酶在降解褐藻中的应用。
此外,本发明还提供了制备褐藻胶裂解酶的方法,采用所述产褐藻胶裂解酶菌株mangrovicoccussp.,发酵制得褐藻胶裂解酶。
在本发明的一些具体实施方案中,包括以下步骤:
步骤1、菌株活化:将所述的产褐藻胶裂解酶菌株mangrovicoccussp.接种于固体培养基,于28~37℃培养24~48h,得活化的菌株;
步骤2、液体培养:将所述活化的菌株接种于液体种子培养基中,于28~37℃、120~200r/min振荡培养12~24h,制成种子液;
步骤3、发酵培养:将所述种子液接种于液体发酵培养基中,于28~37℃、150~200r/min振荡培养24~60h,收集发酵液,离心,收集上清液得褐藻胶裂解酶的粗酶液,纯化获得褐藻胶裂解酶。
在本发明的一些具体实施方案中,步骤1中所述固体培养基包括海藻酸钠3~12g/l,蛋白胨2~10g/l,酵母粉0.5~4g/l,氯化钠10~30g/l,琼脂粉18~20g/l,ph6.5~8.0。
在本发明的一些具体实施方案中,步骤2中所述液体种子培养基包括海藻酸钠3~12g/l,蛋白胨2~10g/l,酵母粉0.5~4g/l,氯化钠10~30g/l,ph6.5~8.0;步骤2中所述接种为:将菌体从平板上刮下一环,接种到装有30ml种子培养基的摇瓶中,28~37℃、120~200r/min振荡培养,使od600控制在0.8~1.2之间。
在本发明的一些具体实施方案中,步骤3中所述液体发酵培养基包括海藻酸钠5~12g/l,蛋白胨2~10g/l,酵母粉0.5~4g/l,氯化钠10~30g/l,三水合磷酸氢二钾0.5~2g/l,七水合硫酸镁0.1~0.4g/l,ph6.5~8.0;所述种子液接种浓度为od600=0.05。
本发明提供了一种产褐藻胶裂解酶菌株hb182678,该菌株的分类为红树林球菌属(mangrovicoccus),保藏号为gdmccno.61000,保藏日期为2020年4月17日,保藏单位为广东省微生物菌种保藏中心,保藏地址为:广州市先烈中路100号大院59号楼广东省微生物研究所。该菌所产的褐藻胶裂解酶具有较广泛的ph稳定性。本发明还提供了一种褐藻胶裂解酶及其制备方法,以及上述菌株hb182678和褐藻胶裂解酶在降解褐藻中的应用,具有良好的应用前景。
生物保藏说明
生物材料mangrovicoccussp.hb182678,分类命名:mangrovicoccussp.于2020年4月17日保藏在广东省微生物菌种保藏中心,地址为广州市先烈中路100号大院59号楼5楼广东省微生物研究所,保藏编号为gdmccno.61000。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
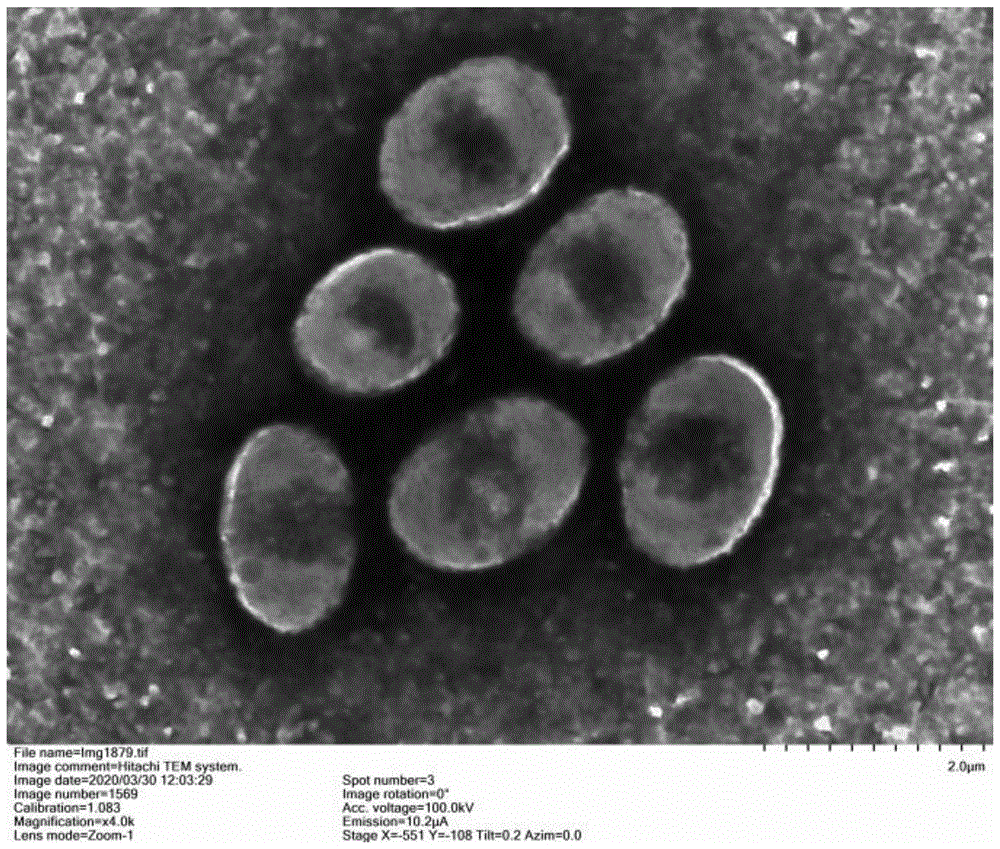
图1示本发明所述菌株hb182678的电镜照片;
图2示本发明所述菌株hb182678的基于16srdna的系统发育树;
图3示不同ph值对本发明所述菌株hb182678产生的粗酶液酶活力的影响。
具体实施方式
本发明公开了产褐藻胶裂解酶菌株及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明的目的在于提供一种红树林球菌属(mangrovicoccus)菌株hb182678,该菌株能够有效降解褐藻胶,还可作为一种新的褐藻胶裂解酶产生菌,也可直接用于褐藻生物降解的微生物资源。
本发明的目的还在于提供一种褐藻胶裂解酶及其制备方法,该褐藻胶裂解酶能有效降解褐藻胶,且工艺成熟。
本发明的第三个目的在于提供上述红树林球菌属(mangrovicoccus)菌株hb182678及褐藻胶裂解酶在降解褐藻中的应用。
本发明的上述第一个目的是通过以下技术方案来实现的:一种褐藻胶裂解酶产生菌株hb182678,该菌株的分类命名为红树林球菌(mangrovicoccussp.hb182678),保藏号为gdmccno.61000,保藏日期为2020年4月17日,保藏单位为:广东省微生物菌种保藏中心(gdmcc),保藏地址为:广州市先烈中路100号大院59号楼5楼广东省微生物研究所。
本发明所述的红树林球菌hb182678是从海南琼海近海海域采集的褐藻样品中分离筛选得到。经微生物多相分类鉴定,鉴定菌株hb182678属于细菌域、变形菌门、α变形菌纲、红细菌目、红杆菌科、红树林球菌属的新种,暂命名为mangrovicoccussp.hb182678。
本发明的上述第二个目的是通过以下技术方案来实现的:一种褐藻胶裂解酶,采用上述的红树林球菌hb182678gdmccno.61000发酵制得。
上述的褐藻胶裂解酶的制备方法,优选包括以下步骤:
(1)菌株活化:将上述的红树林球菌hb182678接种于固体培养基,于28~37℃培养24~48h,得活化菌株;
(2)液体培养:从已纯化的平板中,挑取一环菌体接入液体种子培养基中,于28~37℃、120~200r/min振荡培养12~15h至对数生长期,制成种子液;
(3)发酵培养:将种子液接种于液体发酵培养基中,于28~37℃、150~200r/min振荡培养24~60h,收集发酵液,8000r/min离心10min,收集上清液得褐藻胶裂解酶粗酶液。
在该褐藻胶裂解酶的制备方法中:
步骤(1)中所述的固体培养基配方为:海藻酸钠3~12g/l,蛋白胨2~10g/l,酵母粉0.5~4g/l,氯化钠10~30g/l,琼脂粉18~20g/l,ph6.5~8.0,以蒸馏水配制。
步骤(2)中所述的液体种子培养基组成为:海藻酸钠3~12g/l,蛋白胨2~10g/l,酵母粉0.5~4g/l,氯化钠10~30g/l,ph6.5~8.0,以蒸馏水配制。
步骤(3)中所述的液体发酵培养基组成为:海藻酸钠5~12g/l,蛋白胨2~10g/l,酵母粉0.5~4g/l,氯化钠10~30g/l,三水合磷酸氢二钾0.5~2g/l,七水合硫酸镁0.1~0.4g/l,ph6.5~8.0,以蒸馏水配制。
本发明的上述第三个目的是通过以下技术方案来实现的:上述的红树林球菌hb182678以及褐藻胶裂解酶在降解褐藻中的应用。褐藻包括海带、马尾藻等褐藻种类。
本发明提供的产褐藻胶裂解酶菌株及其应用中,所用原料及试剂均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1产酶菌株hb182678gdmccno.61000的分离筛选
褐藻样品采集于海南省琼海市近海海域。取10g样品,剪碎、溶浆,稀释成10-3~10-6的悬液,吸取系列悬液0.1ml,涂布于褐藻胶裂解酶分离培养基,置于30℃培养箱倒置培养2~5d。待菌落长出时,根据菌落形状、颜色、边缘状态、透明度、表面干湿状态等表型特征,挑取生长好、形态不同的菌落进行划线纯化。
对分离获得的菌株进行褐藻胶裂解酶活力测定,筛选出酶活性较强的菌株hb182678。
具体过程如下:
挑取待检测菌株点接到褐藻胶裂解酶活性检测培养基上,30℃培养2~3d。待平板上长出明显的菌落后,测量菌落直径(d)。在平板中加入1mol/l的cacl2溶液,静置30~60min。待平板上显现出酶解圈后,测量酶解圈直径(d),以酶解圈直径和菌落直径的比值(d/d)作为初筛指标。
其中菌株hb182678的酶解圈直径达到25mm,d/d值为9,活性明显。
所用培养基配方如下:
褐藻胶裂解酶分离培养基:海藻酸钠5g,酵母粉1g,蛋白胨5g,磷酸高铁0.01g,nacl20g,琼脂18g,以蒸馏水定容至1l,ph7.6。
褐藻胶裂解酶活性检测培养基:海藻酸钠5g,(nh4)2so45g,k2hpo42g,nacl20g,mgso4·7h2o1g,feso4·7h2o0.01g,琼脂18g,以蒸馏水定容至1l,ph7.6。
实施例2红树林球菌hb182678gdmccno.61000的鉴定
菌株hb182678gdmccno.61000在2216e琼脂培养基上生长良好,培养2d后可见清晰菌落,菌落呈圆形,乳白色,边缘整齐,表面光滑凸起,直径2~4mm。电镜下观察,细胞呈椭球形,长宽约为1.3-2.0μm×1.2-1.5μm,无鞭毛。革兰氏染色呈阴性。
通过pcr扩增、转化、测序获得hb182678的16srdna序列1425bp,其核苷酸序列如seqidno.1所示。将该序列与ezbiocloud数据库中的序列进行比对,发现菌株hb182678与mangrovicoccusximenensistlg56t同源性最高(96.3%)。选择同源性高的相关菌株,利用软件mega7.0采用neighbor-joining法构建系统发育树(图2),可以看出,菌株hb182678与mangrovicoccusximenensistlg56t处于同一分支上,二者亲缘关系较近。比较二者的基因组平均核苷酸相似性ani值,仅为83.5%,小于国际细菌系统分类学委员会规定的95%的种的界限。
比较两株菌的形态学、生理生化与分子特征,鉴定本发明中的菌株hb182678(gdmccno.61000)为mangrovicoccus(红树林球菌)属的一个新种,暂命名为mangrovicoccussp.hb182678。
该菌株已于2020年4月17日在广东省微生物菌种保藏中心(gdmcc)进行了菌种保藏,并证明存活,其保藏登记号为gdmccno.61000。保存地址为广州市先烈中路100号大院59号楼广东省微生物研究所。
实施例3褐藻胶裂解酶及其制备方法
本发明中的褐藻胶裂解酶是由实施例1中的保藏编号为gdmccno.61000的mangrovicoccussp.hb182678发酵制成的,具体方法包括以下步骤:
(1)菌株活化:将实施例1中的红树林球菌hb182678接种于固体培养基,于30℃培养48h,得活化菌株;
(2)液体培养:将活化的菌株接入液体种子培养基中,于30℃、180r/min振荡培养12~18h,制成种子液;使od600控制在0.8~1.2之间;
(3)发酵培养:将种子液接种于液体发酵培养基中,于30℃、180r/min振荡培养40h,收集发酵液,离心,收集上清液得褐藻胶裂解酶粗酶液;所述种子液接种浓度为od600=0.05。
步骤(1)中的固体培养基组成为:海藻酸钠5g/l,蛋白胨5g/l,酵母粉1g/l,氯化钠20g/l,琼脂粉18g/l,ph7.0,以蒸馏水配制。
步骤(2)中的液体种子培养基为:海藻酸钠3g/l,蛋白胨8g/l,酵母粉1.5g/l,氯化钠20g/l,ph7.0,以蒸馏水配制。
步骤(3)中的液体发酵培养基为:海藻酸钠7g/l,蛋白胨8g/l,酵母粉1.5g/l,氯化钠20g/l,三水合磷酸氢二钾1g/l,七水合硫酸镁0.2g/l,ph7.0,以蒸馏水配制。
实施例4褐藻胶裂解酶酶活测定
采用紫外吸收法进行褐藻胶裂解酶酶活力测定。过程如下:
收集发酵液,离心,以实施例3中的发酵上清液作为粗酶液。
取1.8ml底物(3.0g海藻酸钠溶于1l50mmph7.0磷酸盐缓冲液)于40℃预热5min,加入0.2ml待测粗酶液,40℃温浴10min,以灭活的酶液体系为空白对照,测定反应体系在od235下的紫外吸收值。定义在上述酶活测定方法下od235紫外吸收值每分钟增加0.01的酶量为酶的一个活力单位(1u)。
结果显示,菌株hb182678发酵40h时褐藻胶裂解酶酶活力最大,为132.2u/ml。
表1不同发酵时间对菌株hb182678产酶活力的影响
实施例5褐藻胶裂解酶的最适ph及ph稳定性
实验1:配制50mm不同ph值的缓冲液[[na2hpo4-citricacidbuffer(ph3~7)、tris-hclbuffer(ph8~9)、nahco3-naoh(ph10)]。在4℃条件下,将实施例4中收集的粗酶液在不同ph值(3、4、5、6、7、8、9、10)条件下保持24h后,分别测定褐藻胶裂解酶剩余活性,确定该酶稳定性大小。定义最适ph下测得的酶活力为100%。
实验2:测定粗酶液在含海藻酸钠3g/l的50mm的不同缓冲液中的酶活力,确定该酶最佳反应ph值。定义最佳ph下测得的酶活力为100%。
结果显示,粗酶液在ph为5~8条件下4℃保持24h,剩余酶活力均达到85%以上,ph4和ph9时酶活力仍达到70%以上,可见该酶具有较广泛的ph稳定性。
粗酶液在ph8时反应酶活性最高,在ph6~8区间内酶反应活性在80%以上,ph7时剩余酶活力最高。
表2ph值对本发明所述菌株hb182678产生的粗酶液酶活力的影响
实施例6mangrovicoccussp.hb182678对褐藻藻体的降解
将海带(laminariajaponica)、马尾藻(sargassumoligocystum)浸泡4~5h,清洗干净,剪成1cm×1cm的小块,分别加入250ml锥形瓶中,并加入适量无机盐水溶液,其成份是:(nh4)2so45g,k2hpo42g,nacl20g,mgso4·7h2o1g,feso4·7h2o0.01g,蒸馏水1l,ph7.5。得到含有不同种类的褐藻培养液。
接入按实施例3制备的mangrovicoccussp.hb182678种子液,接种浓度为od600=0.1。180rpm,30℃培养,观察培养基的浑浊度及海藻形状的变化。
观察发现,随着培养时间的延长,12h时海藻逐渐溶解,无色培养液颜色逐渐加深变为褐色,溶液开始变浑浊,海带、马尾藻固体重量分别剩余83.7%、91.6%,;24h时海藻块变小,碎屑增多,溶液浊度加深,变得不透明,海带、马尾藻固体重量分别剩余55.9%、62.3%;48h时海藻完全被降解,溶液变为浊液,海带、马尾藻固体藻块完全消失。这表明菌株hb182678能在短时间内高效降解海带和马尾藻,是褐藻资源化利用的优势菌种。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>中国热带农业科学院热带生物技术研究所
<120>产褐藻胶裂解酶菌株、褐藻胶裂解酶及其应用
<130>mp2019526
<160>1
<170>siposequencelisting1.0
<210>1
<211>1425
<212>dna
<213>人工序列(artificialsequence)
<400>1
agagtttgatcatggctcagaacgaacgctggcggcaggcctaacacatgcaagtcgagc60
gaacccttcggggttagcggcggacgggttagtaacgcgtgggaacgtgcccaaaggtag120
ggaatagcctcgggaaactgagagtaataccctatgtgcccttcgggggaaagatttatc180
gcctttggatcggcccgcgttagattaggtagttggtggggtaatggcctaccaagccta240
tgatctatagctggtttgagaggatgatcagcaacactgggactgagacacggcccagac300
tcctacgggaggcagcagtggggaatcttcggcaatgggcgcaagcctgaccgagccatg360
ccgcgtgagcgatgaaggccctagggttgtaaagctctttcgccagggatgataatgaca420
gtacctggtaaagaaaccccggctaactccgtgccagcagccgcggtaatacggaggggg480
ttagcgttgttcggaattactgggcgtaaagcgcacgtaggcggaccggaaagttggggg540
tgaaatcccggggctcaaccccggaactgccttcaaaactctcggtctggagttcgagag600
aggtgagtggaattccgagtgtagaggtgaaattcgtagatattcggaggaacaccagtg660
gcgaaggcggctcactggctcgatactgacgctgaggtgcgaaagcgtggggagcaaaca720
ggattagataccctggtagtccacgccgtaaacgatgaatgccagtcgtcgggttgcatg780
caattcggtgacacacctaacggattaagcattccgcctggggagtacggtcgcaagatt840
aaaactcaaaggaattgacgggggcccgcacaagcggtggagcatgtggtttaattcgaa900
gcaacgcgcagaaccttaccaacccttgacatcctcggaccgtcccagagatgggtcttc960
cacttcggtggccgagtgacaggtgctgcatggctgtcgtcagctcgtgtcgtgagatgt1020
tcggttaagtccggcaacgagcgcaacccacacccttagttgccagcagttcggctgggc1080
actctaggggaactgccgatgataagtcggaggaaggtgtggatgacgtcaagtcctcat1140
ggcccttacgggttgggctacacacgtgctacaatggcagtgacaatgggttaatcccaa1200
aaagctgtctcagttcggattggggtctgcaactcgaccccatgaagtcggaatcgctag1260
taatcgcgtaacagcatgacgcggtgaatacgttcccgggccttgtacacaccgcccgtc1320
acaccatgggagttggttctacctgacggccgtgcgctaacccctcgggggggcagcgga1380
ccacggtaggatcagcgactggggtgaagtcgtaacaaggtaacc1425
- 还没有人留言评论。精彩留言会获得点赞!