一种检测直肠癌放疗敏感性的环状RNA分子及其应用的制作方法
一种检测直肠癌放疗敏感性的环状rna分子及其应用
技术领域
[0001]
本发明涉及临床医学技术领域,具体涉及一种检测直肠癌放疗敏感性的环状rna分子及其应用。
背景技术:
[0002]
我国2018年结直肠癌新发病病例和死亡病例均居全球第5位,其中70%的非转移患者均为中期和局部晚期,这部分患者按照目前的国际指南均需进行术前放疗。直肠癌患者经过术前放疗,虽然大部分能够降期,但多数不能达到临床症状完全缓解(clinical complete remission,ccr),仍需要完成手术,而术前放疗一定程度上会使得手术的总体并发症有所增加,如果能提前预测出对放疗敏感的患者,可有助于优化治疗策略,合理利用医疗资源,精准施治,意义十分重大。
[0003]
非编码rna在肿瘤的发生、发展中具有重要作用,其中,micrornas(mirnas)以及长链非编码rnas(long ncrnas,lncrnas)已得到了大量的研究,部分非编码rna被证实与放疗敏感性密切相关。例如经研究发现,mirna-7可通过活化egfr相关信号传导提高放疗敏感性;通过对食管癌患者的组织标本检测发现,lncrna fam201a可通过与mir-101相互作用,调节atm和mtor的表达调控食管癌的放疗敏感性。然而,目前在直肠癌中尚缺少类似的特异性的分子标记物。
[0004]
除了mirnas和lncrnas,非编码rna中还有一类环状rna(circrnas),circrnas既不具有5’末端帽子也没有3’末端poly(a)尾巴,具有以共价结合的闭合环状的结构特征。circrna最早于1993年在小鼠精子决定基因sry中被偶然发现,然而直至近期才证实其在转录组中广泛大量地存在,逐渐被研究者认识并探索。在结直肠癌领域,研究发现circrna cirs-7在外泌体中富集,可用于区分结直肠癌患者与健康人,有潜力用于评价患者预后情况。这启示了circrna在结直肠癌的发生发展中扮演着重要角色。
[0005]
然而,尽管目前已有许多肿瘤疾病方面的特异性分子标记物,但在临床上,尤其是结直肠癌临床中,仍无可靠的分子标记物可用于预测放疗敏感性。
技术实现要素:
[0006]
本发明的目的在于提供一种检测直肠癌放疗敏感性的环状rna分子及其应用,所述环状rna分子为circdnajc3,其表达水平能够影响直肠癌放疗敏感性,当circdnajc3表达下调,可增强直肠癌的放疗敏感性。
[0007]
为此,本发明的第一方面,提供了一种检测结直肠癌放疗敏感性的分子标志物,所述分子标志物为circdnajc3。
[0008]
circdnajc3在circbank数据库中的信息如下:
[0009]
circbank id:hsa_circdnajc3_005,circbase id:hsa_circ_0101041
[0010]
host gene symbol:dnajc3
[0011]
position:chr13:96409897-96416207strand:+
[0012]
所述circdnajc3的序列如seq id no:1所示。
[0013]
本发明的第二方面,提供了检测所述分子标志物的产品。
[0014]
进一步,所述产品包括能够特异性结合circdnajc3的核酸;所述核酸能够检测circdnajc3的表达水平。
[0015]
本发明的检测circdnajc3的产品可基于使用核酸分子的已知方法来发挥其功能:如pcr、southern杂交、northern杂交、点杂交、荧光原位杂交(fish)、dna微阵列、高通量测序平台等。使用该产品能够定性地、半定量地或定量地实施分析。
[0016]
包含在上述产品中的核酸可以通过化学合成来获得,或通过从生物材料制备含有期望核酸的基因,然后使用设计用于扩增期望核酸的引物扩增它来获得。
[0017]
进一步,所述核酸包括扩增circdnajc3或其片段的引物,所述引物可以通过使用本领域技术人员知道的方法参考已知信息来适当地设计,并通过化学合成来制备。
[0018]
进一步,所述扩增为特异性扩增。
[0019]
进一步,所述核酸包括实时荧光定量pcr(qrt-pcr)中使用的特异扩增circdnajc3或其片段的引物。
[0020]
在具体的实施方式中,所述引物的序列如seq id no:2和seq id no:3所示。
[0021]
所述产品所检测的样品,为结直肠癌组织。在具体实施方式中,使用自活检受试者获得的结直肠癌组织样品。
[0022]
本发明的第三方面,提供了所述分子标志物在制备检测结直肠癌放疗敏感性的工具中的应用。
[0023]
具体地,本发明提供了检测circdnajc3的产品在制备检测结直肠癌放疗敏感性的工具中的应用。
[0024]
进一步,所述产品和/或工具通过检测样本中circdnajc3的表达水平来检测结直肠癌放疗敏感性。
[0025]
进一步,所述产品和/或工具包括能够特异性结合circdnajc3的核酸;所述核酸能够检测circdnajc3的表达水平。
[0026]
本发明的检测circdnajc3的产品和/或工具可基于使用核酸分子的已知方法来发挥其功能:如pcr、southern杂交、northern杂交、点杂交、荧光原位杂交(fish)、dna微阵列、高通量测序平台等。使用该产品和/或工具能够定性地、半定量地或定量地实施分析。
[0027]
包含在上述产品和/或工具中的核酸可以通过化学合成来获得,或通过从生物材料制备含有期望核酸的基因,然后使用设计用于扩增期望核酸的引物扩增它来获得。
[0028]
进一步,所述核酸包括扩增circdnajc3或其片段的引物,所述引物可以通过使用本领域技术人员知道的方法参考已知信息来适当地设计,并通过化学合成来制备。
[0029]
进一步,所述扩增为特异性扩增。
[0030]
进一步,所述核酸包括实时荧光定量pcr(qrt-pcr)中使用的特异扩增circdnajc3或其片段的引物。
[0031]
在具体的实施方式中,所述引物的序列如seq id no:2和seq id no:3所示。
[0032]
所述产品和/或工具所检测的样品,为结直肠癌组织。在具体实施方式中,使用自活检受试者获得的结直肠癌组织样品。
[0033]
本发明的第四方面,提供了所述分子标志物在制备结直肠癌放疗增敏治疗药物中
的应用。
[0034]
国际上对结直肠癌的放疗敏感性分子标记物研究尚无重大突破,目前尚缺乏可靠的预测工具,众多研究者均寄希望于通过对整体分子通路的认识寻找答案。本发明在国内外率先提出circrna的表达水平能够影响直肠癌放疗敏感性。并首次明确circdnajc3以mirna吸附机制和蛋白质相互作用调控直肠癌放疗敏感性。发明人以高质量执行的前瞻性临床研究为依托,从临床组织标本中发现了与放射治疗敏感性显著相关的circdnajc3,结合测序数据构建起circrna-mirna-mrna调控网络,筛选出广泛参与放射损伤修复的mir-21-5p为潜在靶点,深入研究circrna通过吸附mirna和结合蛋白质这两条途径影响肿瘤放疗敏感性的分子机理。
[0035]
与现有技术相比,本发明具有以下优点:
[0036]
(1)首次发现了环状rna:circdnajc3可作为检测结直肠癌放疗敏感性的分子标志物,利用该分子标志物可以方便快捷地辅助诊断患者的结直肠癌放疗敏感性,从而有助于优化治疗策略,合理利用医疗资源,精准施治。
[0037]
(2)目前公开的其他非编码rnas类分子标志物,均未实际应用于临床,其价值有待验证。而本发明提供的circdnajc3的应用以临床研究为依托,且其分子机理得到了研究和确认,临床应用价值极高。
[0038]
(3)在结直肠癌中,当今常用cea、ca199等肿瘤标志物进行疗效预测,然而其特异性不高。本发明提供的circdnajc3作为结直肠癌放疗敏感性标志物具有特异性高、检测准确的优点。
附图说明
[0039]
通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。在附图中:
[0040]
图1为放疗敏感组与放疗抵抗组的circdnajc3表达情况;
[0041]
图2为circdnajc3与mir-21-5p等多个micrornas之间的调控关系图;
[0042]
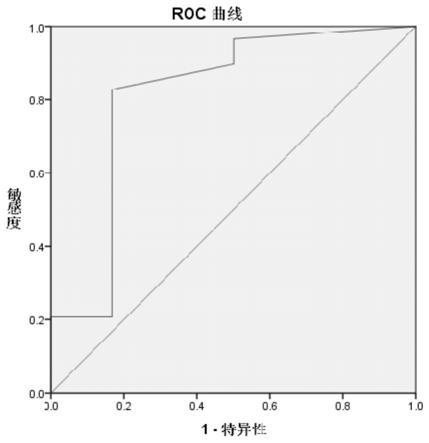
图3为circdnajc3预测放疗敏感性的roc曲线;
[0043]
图4为circdnajc3在2gy x光照射后不同时间点的表达情况;
[0044]
图5为circdnajc3在5gy x光照射后不同时间点的表达情况。
具体实施方式
[0045]
下面将参照附图更详细地描述本公开的示例性实施方式。虽然附图中显示了本公开的示例性实施方式,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
[0046]
实施例1筛选差异表达circrnas
[0047]
将12例直肠癌患者建模,其中5例经术前放疗达到病理完全缓解(放疗敏感组,代号g),7例术后病理分级为3-4级(mandard评级标准,放疗抵抗组,代号u)。分别取各患者的结直肠癌组织临床样本,将所有临床样品组织经trizol法提取总rna并质控合格后进行文
库构建与测序。具体步骤如下:
[0048]
(1)提取总rna:
[0049]
将组织从液氮中取出,转移至1.5ml rnase-free ep管中,立刻加入1ml trizol裂解液,用组织匀浆器进行组织细胞研磨裂解,待液体呈浑浊状且无明显组织块后12,000rpm离心5min,吸取上清至新1.5ml rnase-free ep管中。
[0050]
(2)文库构建
[0051]
circrna及mrna测序信息源自去核糖体rrna建库,而microrna由于片段长度较短,应用单独的单碱基分辨率切胶纯化并建库。
[0052]
(3)测序与表达水平评估
[0053]
测序平台:circrna及mrna测序信息源自hi-seq x ten平台,microrna测序信息源自ion proton平台。采用de-seq国际标准算法,treeview软件进行聚类分析,发现放疗敏感组和抵抗组间有119条circrnas表达水平存在显著差异(fdr<0.05)。
[0054]
实施例2 qrt-pcr测序验证
[0055]
基于实施例1得到的119条表达水平存在显著差异的circrnas,本实施例选择其中的circdnajc3进行验证。具体步骤如下:
[0056]
(1)提取组织rna
[0057]
按照实施例1的方法收集经术前放疗的28例患者(其中放疗敏感组14例,放疗抵抗组14例)的临床组织,分别提取rna。
[0058]
(2)cdna合成
[0059]
1、rna预变性:
[0060]
在微量离心管中加入以下反应液体,如表1所示:
[0061]
表1
[0062]
试剂用量rna2.0μgrandom/oligo primer1μlddh2o补至16μl
[0063]
65℃孵育5min,立刻将混合物置于冰上2min;
[0064]
2、rna逆转录:
[0065]
在微量离心管中按照表2加入以下反应试剂,配制得到反应体系:
[0066]
表2
[0067]
试剂用量rna混合物16μl5
×
buffer5μldntp mix1μl逆转录酶1μlrnase inhibitor1μl总体积25μl
[0068]
于25℃反应10min,然后于42℃反应60min,产物即为cdna。
[0069]
(3)real-time qpcr
[0070]
按照表3配制反应体系:
[0071]
表3
[0072]
试剂用量cdna0.5μl2
×
qpcr mix10μl正向引物(100μm)0.5μl反向引物(100μm)0.5μlddh2o补至20μl
[0073]
引物序列设计如下:
[0074]
circdnajc3:
[0075]
正向引物:aagctattagggtttgttc(seq id no:2)
[0076]
反向引物:ctgtgcttccttttcttc(seq id no:3)
[0077]
dnajc3(mrna):
[0078]
正向引物:gctagtcctggtggatctgc(seq id no:4)
[0079]
反向引物:acggcagcatgaaactgaga(seq id no:5)
[0080]
将混合好的体系加入到bio-rad qpcr管中,离心将液体离至管底;上机,执行表4所示程序:
[0081]
表4
[0082]
95℃30s预变性95℃5s变性60℃31s退火、延伸,40个循环65℃to 95℃increment 0.5℃/5sbio-rad cfx96预设溶解曲线程序
[0083]
导出数据,经过统计分析发现放疗敏感组与放疗抵抗组circdnajc3的表达有显著差异(p=0.023)(见图1)。
[0084]
实施例3转录组测序验证
[0085]
本实施例进一步扩展至35例独立标本(其中放疗敏感组6例,放疗抵抗组29例)中进行转录组测序,具体步骤如下:
[0086]
一:mirna测序实验流程
[0087]
(一)核酸抽提:按照实施例1的方法收集提取rna
[0088]
(二)文库构建
[0089]
1.试剂:multiplex small rna library prep kit
[0090]
2.仪器:2720thermal cycler(life technologies),agilent technologies 2200 tapestation(life technologies)
[0091]
3.mirna建库步骤:
[0092]
3.1 3’端接头连接:
[0093]
取total rna 100ng-1μg,总体积6μl。加入1μl 3’sr adapter for illumina吹打混匀,置于pcr仪中70℃反应2min。反应结束后向体系中加入10μl 3’ligation reaction buffer(2
×
)和3μl 3’ligation enzyme mix吹打混匀,置于pcr仪中25℃反应60min。
[0094]
3.2引物杂交:
[0095]
将pcr管从pcr仪中取出置于冰上,向体系中加入1μl nuclease-free water和4.5μl sr rt primer for illumina,吹打混匀,依照以下程序进行反应:75℃5min,37℃15min,25℃15min。
[0096]
3.3 5’端接头连接:
[0097]
将5’sr adapter for illumina从-80℃冰箱中取出溶解,取适当体积置于pcr仪中70℃2min使其变性。向上述反应体系中加入1μl 5’sr adapter for illumina(denatured)、1μl 5’ligation reaction buffer(10
×
)和2.5μl 5’ligation enzyme mix吹打混匀,置于pcr仪中25℃反应60min。
[0098]
3.4反转录:
[0099]
向上述体系中加入8μl first strand synthesis reaction buffer、1μl murine rnase inhibitor和1μl protoscipt ii reverse transcriptase吹打混匀,置于pcr仪中50℃反应60min。
[0100]
3.5pcr扩增及纯化:
[0101]
取上一步产物加入50μl longamp taq 2
×
master mix、2.5μl sr primer for illumina、2.5μl index(x)primer和5μl nuclease-free water吹打混匀,进行如表5所示:
[0102]
表5
[0103][0104]
反应结束后,取50μl扩增产物采用2.2x yeason dna beads进行纯化,15μl nuclease-free water洗脱。
[0105]
3.6切胶回收:
[0106]
使用hi density tbe sample buffer(5
×
)和6%tbe gel对文库进行切胶回收,切取140-160bp区间明亮条带。
[0107]
3.7agilent 2200质检:
[0108]
用d1000screentape,放agilent 2200检测仪检测。
[0109]
4.文库检测结果判定:
[0110]
140bp≤文库主峰长≤160bp,浓度≥3nm/μl,峰型单一,没有杂峰,则该文库符合后续上机要求。
[0111]
(三)上机测序
[0112]
1.仪器:cbot(illumina);hiseqxten(illumina);
[0113]
2.试剂:
[0114]
1)cbot operation for hd v2.5 reagent(illumina)
[0115]
a.hiseq x flow cell v2.5
[0116]
b.hiseq x pe cluster kit v2(box1 of 2)
[0117]
c.hiseq x pe cluster kit v2(box2 of 2)
[0118]
2)hiseq x operation for hd v2.5 reagent_v1.3(illumina)
[0119]
a.hiseq x hd sbs kit v2(box1 of 2)
[0120]
b.hiseq x hd sbs kit v2(box2 of 2)
[0121]
3.步骤:
[0122]
(1)根据文库浓度、片段大小计算合适的上机浓度,进行文库浓缩/稀释;
[0123]
(2)文库变性;
[0124]
(3)桥式扩增:上cbot,cluster生成/簇生成;
[0125]
(4)上机测序;
[0126]
(5)数据拆分,bcl to fastq。
[0127]
二:rrna-free双端测序实验流程
[0128]
(一)核酸抽提:按照实施例1的方法收集提取rna
[0129]
(二)文库构建
[0130]
1.试剂:ultra
tm
directional rna library prep kit;
[0131]
nebnext rrna depletion kit;
[0132]
nebnext multiplex oligos;d1000screentape.
[0133]
2.仪器:2720thermal cycler(life technologies),agilent technologies 2200 tapestation(life technologies)
[0134]
3.去核糖体建库步骤:
[0135]
3.1 rrna-free:
[0136]
取total rna 500ng-1μg,加入去核糖体探针,pcr反应25min左右,然后依次加入rna消化试剂37℃pcr反应30min,dna消化试剂37℃pcr反应30min,最后体系为50μl,用agencourt rnaclean xp beads磁珠纯化,取6μl在pcr仪进行7-8min.at 94℃打断。
[0137]
3.2cdna反转及纯化:
[0138]
取出pcr在溶液中加入一链反转试剂,进行pcr反应40min,再加入二链反转试剂,16℃pcr反应60min,最后用dna clean beads磁珠进行纯化。
[0139]
3.3da末端修复及加接头连接:
[0140]
取上一步溶液加入da试剂,进行rcr反应60min,再加入连接酶及adaptor,20℃pcr反应15min。
[0141]
3.4片段分选:
[0142]
用上一步100μl连接产物进行两次片段分选实验,用ampure xp beads磁珠纯化连接产物。
[0143]
3.5pcr扩增及纯化:
[0144]
取上一步纯化产物加入扩增试剂,共50μl进行pcr扩增反应,15个循环。最后用50μl agencourt ampure xp beads磁珠进行纯化,用23μl 0.1
×
te混匀后,室温静置2min,磁力架上5min,小心吸取20μl上清至一新的nuclease free离心管中。
[0145]
3.6 agilent 2200质检:
[0146]
用d1000screentape,放agilent 2200检测仪检测。
[0147]
4.文库检测结果判定:
[0148]
300bp≤库主峰长≤600bp,浓度≥2ng/μl,峰型单一,没有杂峰,则该文库符合后续上机要求。
[0149]
(三)上机测序
[0150]
1.仪器:cbot(illumina);hiseqxten(illumina);
[0151]
2.试剂:
[0152]
1)cbot operation for hd v2.5 reagent(illumina)
[0153]
a.hiseq x flow cell v2.5
[0154]
b.hiseq x pe cluster kit v2(box1 of 2)
[0155]
c.hiseq x pe cluster kit v2(box2 of 2)
[0156]
2)hiseq x operation for hd v2.5 reagent_v1.3(illumina)
[0157]
a.hiseq x hd sbs kit v2(box1 of 2)
[0158]
b.hiseq x hd sbs kit v2(box2 of 2)
[0159]
3.步骤:
[0160]
1)根据文库浓度、片段大小计算合适的上机浓度,进行文库浓缩/稀释;
[0161]
2)文库变性;
[0162]
3)桥式扩增:上cbot,cluster生成/簇生成;
[0163]
4)上机测序;
[0164]
5)数据拆分,bcl to fastq;
[0165]
通过分析circdnajc3对放疗敏感性预测能力,检测结果见图3所示,auc=0.813(95%ci:0.518-1.000,p=0.017),表明circdnajc3表达量具有良好的预测能力。
[0166]
实施例4细胞系水平验证
[0167]
本实施例在细胞系水平验证了circdnajc3的表达,具体步骤如下:
[0168]
(1)建立稳定表达circdnajc3的细胞系
[0169]
步骤一:细胞慢病毒感染
[0170]
1)病毒制备:慢病毒包装由外包公司完成,病毒滴度达1.0
×
108;
[0171]
2)感染前一天,将生长状态良好的细胞铺于培养皿中,使感染时细胞密度达到80%左右;
[0172]
3)计算moi值,将病毒用培养基按moi值进行稀释,加入促感染剂polybrene使终浓度达5μg/ml;
[0173]
4)移除原培养基,用无菌pbs洗涤1次;
[0174]
5)用移液枪移除残留pbs,加入含病毒的培养基,充分混匀;
[0175]
6)37℃,5%co2培养24h;
[0176]
7)移除含病毒培养基,加入新鲜培养基继续培养;
[0177]
8)感染48h后荧光检测或抗性筛选。
[0178]
步骤二:嘌呤霉素(puromycin)稳转细胞株筛选
[0179]
1)移除病毒感染48h后细胞原有培养基,加入含1-2μg/ml puromycin的培养基进
行筛选,同时准备一组野生型细胞以相同条件进行培养;
[0180]
2)24h后换新鲜含1-2μg/ml puromycin的培养基并观察细胞状态,如此反复直到野生型细胞全部死亡而稳转细胞不再死亡为止;
[0181]
3)用含0.5-1μg/ml puromycin的培养基进行扩大培养,大量扩增后冻存,以便后期使用。
[0182]
4)用筛选后的稳转细胞提取rna,检测目的基因的敲降效率。
[0183]
(2)x光照射处理
[0184]
将步骤(1)制备得到的细胞消化为单个细胞,按比例将细胞铺于中皿,使第二天细胞密度达到50%。培养24h后,换新鲜培养基,用ir辐射仪进行辐射(2gy/5gy),在照射后的不同时间点(每隔1h,共16h)收取细胞,并马上用trizol裂解细胞,置于-80℃备用。待细胞全部收集后,提取rna,对circdnajc3进行丰度检测。
[0185]
检测结果见图4和图5所示,可知,2gy剂量照射时,circdnajc3的表达量在2h时间点略有下降,而到4h和8h时间点则显著升高;5gy剂量照射时,circdnajc3的表达量在1h后就开始显著升高。circdnajc3的表达量在放疗后有显著升高的过程,并且快慢与剂量大小有关,表明其参与了直肠癌细胞放疗后的敏感性调控过程。
[0186]
实施例5
[0187]
本实施例完成了全转录组测序结果的生物信息学分析,基于mirnas及mrnas表达水平,构建了circrna-mirna-mrna调控网络。初步结果显示,circdnajc3在放疗敏感组中下调2倍以上(fdr=0.00001)。进一步充分利用测序得到的circrna和mrna表达信息,计算circrna-mrna表达相关性。同时基于mirna靶基因数据和circrna-mrna表达相关性(r2>0.5,p-value<0.05),发现circdnajc3与mir-21-5p等多个micrornas存在一定吸附作用,其调控关系见图2,而mir-21-5p广泛参与dna损伤修复,因此推测circdnajc3的作用靶点为mir-21-5p,其可通过吸附mir-21-5p参与直肠癌放疗敏感性调控。
[0188]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1