重组东亚钳蝎毒素多肽Makatoxin-3及其突变体的制备方法和应用与流程
本发明属于医药生物技术领域,具体涉及一种重组东亚钳蝎毒素多肽makatoxin-3及其突变体的制备方法和应用。
背景技术:
全蝎作为我国传统名贵中药,具有用药历史悠久,药用价值高,我国主要分布于山东、河北、河南、陕西、湖北等地。据2015版《中国药典》收载,东亚钳蝎以干燥整体入药,称为全蝎,其性辛、平、有毒、归肝经,具有息风镇痉、通络止痛、攻毒散结等功效,可用于治疗痉挛抽搐、小儿惊风、卒中、破伤风、疮疡、瘰疬、风湿顽痹、偏正头痛等症,为平肝熄风常用药。现代药理研究表明,全蝎对于各种风湿痹痛、三叉神经痛、头痛、牙痛、顽固性偏正头痛、癌痛均有有很好的镇痛作用。
通过小鼠疼痛模型,比较了全蝎不同部位镇痛活性的差异,发现蝎尾的镇痛活性是蝎身的5倍以上,并且通过进一步研究表明,全蝎毒腺中的蝎毒是全蝎发挥功效的主要成分,在小鼠疼痛模型中具有很强的镇痛作用。现代药理研究表明,蝎毒有很强的镇痛活性,刘崇明、裴国强(刘崇铭,裴国强,1989)采用小鼠扭体法、小鼠热辐射甩尾法、大鼠三叉神经诱发皮层电位法试验了蝎毒的镇痛作用,并与阿司匹林、安痛定和吗啡进行了比较,结果表明蝎毒对内脏痛、皮肤灼痛和三叉神经诱发皮层电位有较强的抑制作用。吴英亮等(yang,jproteomics,206,103435,2019)将炮制全蝎的尾部毒腺部分研磨成粉,用水浸取其中活性成分,发现全蝎药材尾部毒腺浸取液中仍然含有大量的活性毒素多肽。这说明经过炮制后的全蝎,其毒腺中部分多肽毒素依然能够保持活性,这提示我们,全蝎发挥镇痛功效的主要成分可能是来源于毒腺中的多肽毒素。
东亚钳蝎毒主要由蛋白质和非蛋白质两部分组成,非蛋白质部分主要包括脂类、游离氨基酸及其他有机酸等,蝎毒主要活性成分是蛋白质,主要由蝎毒素和酶组成。蝎毒素是一类由20-80个氨基酸组成的毒性蛋白,分子量主要在6000-9000da之间,有很高的专一性,其分子结构中含有3-4对二硫键,其中三对构成环状核心结构,对于保持稳定性和发挥神经毒性有重要意义。现代研究表明,蝎毒中的主要活性物质是大量作用于na+、k+、cl-、ca2+等离子通道的毒素多肽。近年来,研究人员已从东亚钳蝎毒液中分离出多条能够作用于离子通道的多肽毒素。研究表明,这些毒素多肽具有显著的镇痛、抗炎、抗肿瘤活性,具有巨大的药物开发价值。
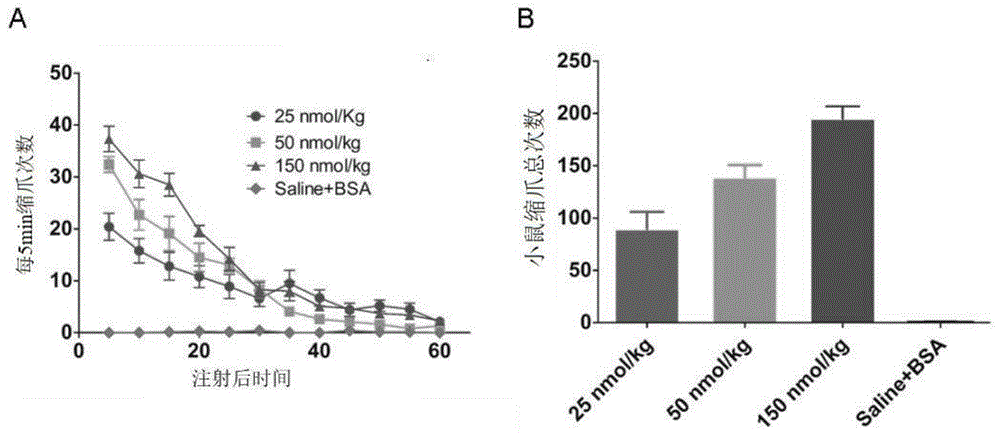
makatoxin-3是从蝎毒中分离出的一种钠通道毒素多肽。makatoxin-3可通过延迟钠离子通道nav1.7的失活产生强烈的致痛活性,如图1所示,其中,图a和图b为注射不同剂量的天然makatoxin-3后,小鼠每5min缩爪的次数,表明天然makatoxin-3可以剂量依赖的方式增加小鼠缩爪的总次数。尽管如此,makatoxin-3在多种炎性痛小鼠模型中显示出显著的镇痛活性(图2a-c)。并且与吗啡相比,makatoxin-3的镇痛活性不依赖于内源性阿片系统,不能被阿片受体抑制剂所逆转(图2d-f)。通过进一步的研究发现,makatoxin-3的k8,k9特别是r58是参与makatoxin-3-nav1.7相互作用的关键氨基酸残基(图3)。这些结果表明makatoxin-3具有潜在的新型镇痛药物开发价值。获得高活性的makatoxin-3及其突变体将有可能获得高效镇痛但无致痛活性的新型多肽镇痛药物前体。然而,makatoxin-3虽然具有很高的生物学活性和潜在的药用价值,但是在蝎粗毒中的含量极低(约占蝎毒总蛋白的0.5%),且分离纯化十分困难,远远不能满足药物研发的需求。因此迫切需要开发新型高效的多肽重组制备技术,以获得makatoxin-3及其突变体用于新型镇痛药物的研发。
由于蝎毒素多肽分子量小,且富含二硫键,目前围绕毒素多肽开发的以大肠杆菌为宿主的重组制备方法主要是包涵体变复性技术以及融合表达技术;但是由于毒素多肽及结构的多样性和差异,这些重组表达方法往往产量低、活性低(cao,biotechnolprog26,1240-1244,2010)(cao,biotechnollett37,2461-2466,2015)。如按照我们之前的专利(专利公开号:101591668a)所述的sumo融合表达方法制备本专利涉及的重组东亚钳蝎毒素多肽makatoxin-3及其突变体仍然无法获取高活性的可溶性蛋白(表1),此外,天然makatoxin-3具有致痛活性。因此需要针对makatoxin-3及其突变体的结构序列特征开发新型重组技术,以期获得高活性低毒的镇痛先导化合物。
技术实现要素:
发明目的:针对现有的蝎毒素多肽制备技术的不足,本发明的第一个目的是提供一种重组东亚钳蝎毒素多肽makatoxin-3及其突变体的制备方法。本发明的第二个目的是提供重组东亚钳蝎毒素多肽makatoxin-3及其突变体在镇痛中的应用。使用该种东亚钳蝎毒素多肽makatoxin-3及其突变体,具有良好的新型镇痛药物开发前景。
为实现上述第一目的,本发明提供了如下技术方案:
一种重组东亚钳蝎毒素多肽makatoxin-3及其突变体的制备方法,包括如下步骤:
步骤一:利用双酶切技术将makatoxin-3基因或其突变体经双酶切后与同样经过双酶切消化的mbp蛋白融合的周质腔表达载体连接,构建重组makatoxin-3或重组makatoxin-3突变体表达载体,其中mbp的n端含有his6标签,makatoxin-3基因位于mbp的c端,makatoxin-3的n端与his-mbp的c端连接;
步骤二:将步骤一得到的重组makatoxin-3或重组makatoxin-3突变体表达载体转入表达宿主,筛选出高拷贝转化子,将获得的高拷贝转化子转入培养基中培养,并用诱导剂诱导表达出可溶性his6-mbp融合的makatoxin-3及其突变体,上述融合蛋白中的makatoxin-3或makatoxin-3突变体即为重组毒素多肽makatoxin-3或其突变体;
步骤三:用物理方法或化学试剂裂解细胞,释放出可溶性重组mbp-makatoxin-3及其突变体融合蛋白,抽提重组融合蛋白质,his纯化融合蛋白,得到纯的mbp-makatoxin-3及其突变体融合蛋白,进行酶切反应,释放出makatoxin-3或其突变体,经过再次纯化得到纯净的makatoxin-3及其突变体蛋白质。
具体地,所述mbp蛋白融合的周质腔表达载体为周质腔表达载体plicc-mbp。
表达宿主优选适宜t7启动子调控的表达载体,优选的表达宿主包括大肠杆菌、酵母以及哺乳动物细胞中的任意一种。更优选地,所述表达宿主为大肠杆菌。
优选地,所述诱导剂为乳糖、半乳糖、异丙基半乳糖苷(iptg)中的任意一种,诱导温度15-37℃,诱导时间2-24h。
其中,编码毒素多肽makatoxin-3的核苷酸序列为seqidno.1,它具有seqidno.2氨基酸序列。
具体地,毒素多肽makatoxin-3的突变体包括makatoxin-1、makatoxin-3-r58a和makatoxin-1-d8k-d9k-r58a中的任意一种,其中,编码毒素多肽makatoxin-3突变体makatoxin-1的核苷酸序列seqidno.3,它具有seqidno.4所示的氨基酸序列;编码毒素多肽makatoxin-3突变体makatoxin-3-r58a的核苷酸序列seqidno.5,它具有seqidno.6所示的氨基酸序列;编码毒素多肽makatoxin-3突变体makatoxin-1-d8k-d9k-r58a的核苷酸序列seqidno.7,它具有seqidno.8所示的氨基酸序列。其中,makatoxin-3-r58a和makatoxin-1-d8k-d9k-r58a的两个多肽为进行突变后合成的,其名称是根据突变的位点来命名的,比如makatoxin-3-r58a是将makatoxin-3的第58位的氨基酸r突变为a,makatoxin-1-d8k-d9k-r58a是将makatoxin-1的第八位氨基酸d突变为k,第九位d突变为k,第58位r突变为a。
具体地,在makatoxin-3及其突变体基因编码的最后一个氨基酸后加上了终止密码子tga。
在一个优选的实施方式中,步骤(3)中,使用镍离子亲和层析纯化出mbp-makatoxin-3及其突变体融合蛋白,使用tev-protease特异蛋白酶进行酶切,融合蛋白中的mbp片段能够被tev-protease特异蛋白酶识别并高效切割,释放出mbp,进一步采用镍离子亲和层析分离含有his6标签的mbp蛋白和不含his6的重组蝎毒蛋白makatoxin-3及其突变体。
通过上述方法制备得到的重组蝎毒蛋白makatoxin-3及其突变体也在本发明的保护范围之内。
本发明进一步提出了上述的重组蝎毒蛋白makatoxin-3及其突变体在制备用于镇痛的药物上的应用。
有益效果:与现有技术相比,本发明具有如下优点:
(1)本发明的重组表达方法能够获得具有天然n端的重组多肽;所采用的周质腔表达系统以及mbp融合表达技术能够获得高表达量且正确折叠的makatoxin-3及其突变体;
(2)本发明获得的重组makatoxin-3及其突变体具有与天然分离的makatoxin-3相同的生物效价和生物作用;
(3)本发明通过重组makatoxin-3及其突变体并应用于镇痛中,使用该种makatoxin-3突变体能够有效克服天然makatoxin-3的致痛作用,并保留其镇痛活性;
(4)使用本发明的重组makatoxin-3及其突变体产生的镇痛活性不依赖于内源性阿片系统,不能被阿片受体拮抗剂纳洛酮所逆转,将可预见其无吗啡等阿片受体激动剂类镇痛药的药物耐受及成瘾性等副作用。
附图说明
图1为天然makatoxin-3的致痛作用,其中,图a为小鼠每5min缩爪的次数,图b显示天然makatoxin-3可以剂量依赖的方式增加小鼠缩爪的总次数;
图2为天然makatoxin-3的镇痛作用;其中,图a和图b为天然makatoxin-3对福尔马林引起的炎性痛具有剂量依赖式的镇痛作用,图c为在cfa诱导的痛觉超敏模型中,显示天然makatoxin-3具有显著的预防和治疗作用,图d,e为福尔马林试验结果图,图f为cfa诱导的痛觉超敏模型,显示纳洛酮没有逆转makatoxin-3的镇痛作用;
图3为makatoxin-3与钠离子通道nav1.7的相互作用模式,其中,a为天然makatoxin-3的同源模建结构,b为人类nav1.7通道的结构,c和d分别为makatoxin-3-nav1.7结合复合物的表面,nav1.7的负静电势面,c表明makatoxin-3与nav1.7通道的vsd4之间形成了广泛的极性相互作用;e-f显示makatoxin-3残基与nav1.7通道之间的特异性相互作用,极性相互作用显示为红色虚线;
图4为天然makatoxin-3与重组makatoxin-3的镇痛活性比较;
图5为makatoxin-3及其突变体载体构建图;
图6为rmakatoxin-3及其突变体hplc分析;
图7为sds-page分析mbp-makatoxin-3的纯化过程,其中,左图为sds-page分析mbp-makatoxin-3的纯化过程的组分;左图中l8为镍柱洗脱下的mbp-makatoxin3;l1为未诱导全菌,l2为诱导全菌,l3为破碎后菌体沉淀,l4为破碎后的离心上清液,l5为镍柱上样后的穿透,l6为akata平衡的穿透,l7为3%bufferb洗杂;右图为sds-page分析mbp-makatoxin-3酶切混合组分,其中l4为rmakatoxin-3;l1为酶切前的mbp-makatoxin-3,l2和l3为mbp-makatoxin-3的tevprotease酶切混合物,l5为100%bufferb洗脱下的mbp标签和tevprotease;
图8为sds-page分析mbp-makatoxin-1的纯化过程;左图为sds-page分析mbp-makatoxin-1的纯化过程的组分,其中l8为镍柱洗脱下的mbp-makatoxin-1;l1为未诱导全菌,l2为诱导全菌,l3为破碎后菌体沉淀,l4为破碎后的离心上清液,l5为镍柱上样后的穿透,l6为akata平衡的穿透,l7为3%bufferb洗杂;右图为sds-page分析mbp-makatoxin-1酶切混合组分,其中l3为rmakatoxin-1;l1为酶切前的mbp-makatoxin-1,l2为mbp-makatoxin-1的tevprotease酶切混合物,l4为100%bufferb洗脱下的mbp标签和tevprotease;
图9为sds-page分析mbp-makatoxin-3-r58a的纯化过程;左图为sds-page分析mbp-makatoxin-3-r58a的纯化过程的组分,其中l8为镍柱洗脱下的mbp-makatoxin-3-r58a;l1为未诱导全菌,l2为诱导全菌,l3为破碎后菌体沉淀,l4为破碎后的离心上清液,l5为镍柱上样后的穿透,l6为akata平衡的穿透,l7为3%bufferb洗杂;右图为sds-page分析mbp-makatoxin-3-r58a酶切混合组分,其中l3-6为rmakatoxin-3-r58a;l1为酶切前的mbp-makatoxin-3-r58a,l2为mbp-makatoxin-3-r58a的tevprotease酶切混合物,l7为100%bufferb洗脱下的mbp标签和tevprotease;
图10为sds-page分析mbp-makatoxin-1-k8d-k9d-r58a的纯化过程;左图为sds-page分析mbp-makatoxin-1-k8d-k9d-r58a的纯化过程的组分,其中l8为镍柱洗脱下的mbp-makatoxin-1-k8d-k9d-r58a;l1为未诱导全菌,l2为诱导全菌,l3为破碎后菌体沉淀,l4为破碎后的离心上清液,l5为镍柱上样后的穿透,l6为3%bufferb洗杂;右图为sds-page分析mbp-makatoxin-1-k8d-k9d-r58a酶切混合组分,其中l4为rmakatoxin-1-k8d-k9d-r58a;l1为酶切前的mbp-makatoxin-1-k8d-k9d-r58a,l2和l3为mbp-makatoxin-1-k8d-k9d-r58a的tevprotease酶切混合物,l5为100%bufferb洗脱下的mbp标签和tevprotease;
图11为rmakatoxin-3和rmakatoxin-3-r58a的圆二色谱;
图12为为rmakatoxin-3和rmakatoxin-3-r58a的致痛作用,其中,rmakatoxin-3(a、b)、rmakatoxin-1(c、d)、rmakatoxin-3-r58a(e、f)和rmakatoxin-1-k8dkd9d-r58a(g、h)在小鼠福尔马林模型中的镇痛作用;
图13为rmakatoxin-3和rmakatoxin-3-r58a的致痛作用;
图14为rmakatoxin-3、rmakatoxin-1和rmakatoxin-3-r58a在小鼠cfa模型中的镇痛作用;
图15为rmakatoxin-3与其他镇痛剂相比在小鼠福尔马林模型中的镇痛作用。
具体实施方式
下面结合具体实施例对本发明名做进一步详细说明。
下述实施例中使用的试剂均为市售试剂。bca蛋白浓度测定试剂盒(批号:p0012s)购自碧云天生物技术研究所;色谱级三氟乙酸(tfa)、乙腈(acn)购自德国merckdrugs&biotechnology公司;血蓝蛋白(keyholelimpethemocyanin,klh)、1-乙基-3-(3-二甲氨基丙基)碳二亚胺(edc:1-ethyl-3-(3-dimethylaminopropyl)购自sigma公司;hrp标记的羊抗兔anti-igg购自abcam公司;tris、丙烯酰胺、甲叉双丙烯酰胺购自上海捷瑞生物工程有限公司;sephadexg-50葡聚糖填料、xk26-1000层析柱购自美国gehealthcarelifesciences公司。
olympus倒置显微镜购自美国奥林巴斯公司;右手自动微操mp-225、电极拉制仪p97购自美国sutter公司;单探头超低噪声膜片钳放大器axon200b、数模转换器digidata1550购自美国moleculardevices公司;ala-vm8全自动灌流系统购自美国ala公司;mf-830电极抛光仪购自日本narishige公司;waters2695高效液相色谱仪(waters2996二极管阵列检测器,watersempowerpro色谱工作站)、高效液相c18反相高效液相色谱柱规格为sinochrom5μm购自美国waters公司。
实施例1重组东亚钳蝎毒素蛋白makatoxin-3的制备。
(1)编码蝎毒蛋白makatoxin-3的核苷酸序列seqidno.1,它具有seqidno.2氨基酸序列;对于编码makatoxin-3蛋白的核苷酸序列(seqidno.1),在第一个氨基酸之前加上限制性内切酶的识别位点,在最后一个氨基酸之后加上终止密码子tag和限制性内切酶的识别位点。
(2)编码蝎毒蛋白makatoxin-1的核苷酸序列seqidno.3,它具有seqidno.4氨基酸序列;对于编码makatoxin-1蛋白的核苷酸序列(seqidno.1),在第一个氨基酸之前加上限制性内切酶的识别位点,在最后一个氨基酸之后加上终止密码子tag和限制性内切酶的识别位点。
(3)分别利用双酶切技术构建makatoxin-3和makatoxin-1表达载体
根据ncbi上makatoxin-3的基因序列设计以下两条上下游引物:
rmakatoxin-3-f:cggggtaccgaaaatctgtattttcagggcaccgcatg和
rmakatoxin-3-r:ggagctcttattaatctgccggtgtac,根据ncbi上makatoxin-1的基因序列设计以下两条上下游引物:
rmakatoxin-1-f:cggggtaccgaaaatctgtattttcagggcaccgcatgtag和
rmakatoxin-1-r:ggagctcttattaatctgccggtgtacaac,在50μlpcr反应管中建立如下具体反应体系:q5high-fidelitydnapolymerasemastermix:25μl;ddh2o:23μl;forwardprimers:(10pm):1μl;reverseprimers:(10pm):1μl;cdnatemplate:500ng/μl,共计50μl。
具体反应程序如下:第一步98℃预热3min,第二步98℃30s,60℃20s,第二步循环30次。反应结束后,进行1.0%agarose电泳鉴定并割胶回收目的条带。
基因片段和载体的pcr酶切处理:选用plicc-mbp载体作为表达载体,选用kpni和saci作为酶切位点。pcr产物经过电泳分离后,切胶回收目的片段,然后分别建立的酶切反应体系如下:基因片段:16μl(1μg);nebsmartcutbuffer:2μl;kpni:1μl(15u);saci:1μl(15u)。
基因片段和plicc-mbp载体的连接处理:将双酶切处理好的基因片段和plicc-mbp载体建立相应的连接体系:10×ligationbuffer:3μl;基因酶切片段:15μl(0.2pmol);plicc-mbp线性化载体:2μl(0.03pmo);t4dnaligase:2μl(350u)。质粒示意图如图5所示。
(4)利用dpni点突变技术分别在plicc-mbp-makatoxin-3和
plicc-mbp-makatoxin-1质粒基础上构建plicc-mbp-makatoxin-3-r58a和
plicc-mbp-makatoxin-1-d8k-d9k-r58a突变表达载体。
根据基因序列设计上下游引物:
rmakatoxin-3-r58a-f:ggataaagttccgattgcaattccgggtccgtgtattggtcg和
rmakatoxin-3-r58a-r:caatacacggacccggaattgcaatcggaactttatccggcagatc;
rmakatoxin-1-d8k-d9k-f:gtgatgcttatattgccaaaaaggaaaactgtacctatttttgtgg和
rmakatoxin-1-d8k-d9k-r:aataggtacagttttcctttttggcaatataagcatcacgtcc,
rmakatoxin-1-r58a-f:cgataaggtaccgattgcaataccaggaccatgccgtggccg和
rmakatoxin-1-r58a-r:gcatggtcctggtattgcaatcggtaccttatcgggcaagtc,
按照下列方法将各试剂加入到pcr管中:q5hotstarthifipcrmastermix:25μl;ddh2o:23μl;forwardprimers:(10pm):1μl;reverseprimers:(10pm):1μl;plicc/mbp-makatoxin-3/1:500ng/μl,共计50μl。
具体反应程序如下:第一步94℃预热3min,第二步98℃20s,60℃30s,72℃6:30s,第二步循环30次。第一步72℃8min。反应结束后,将pcr产物回收后进行dpni酶切,按照以下配制反应混合液:回收的pcr产物:17μl(1μg);10×neb(cutsmart)buffer:2μl;dpnⅰ(20u/μl):1μl(15u)。反应条件:37℃4h,80℃15min。
(5)makatoxin-3及其突变体重组表达载体转入宿主细胞实现高效可溶性表达。
取制备好的bl21感受态细胞两管,一管作为空白对照,放在冰上预冷20min。然后在其中一管中加入重组mbp-makatoxin-3或其突变体质粒,另一管不做处理作为空白对照,放在冰上孵育20min。然后进行热激,将孵育好的两管bl21感受态,放在以及设定好42℃的水浴中,精确计时90s,90s后马上放在冰上降温5min后,加入已经37℃预热好的lb培养基,置于37℃摇床,220rpm震摇孵育1h。然后各取200μl孵育后的感受态,均与涂布在氨苄抗性的lb固体培养基中,放置在37℃培养箱过夜。从已经转化了质粒的lb固体平板中选择大小适中,边缘光滑的菌落克隆,用灭菌的10μl枪头挑取取克隆(一个枪头对应一个克隆),转接到灭菌的并且加入100μg/mlamp的3mllb培养液试管中,置于37℃摇床,220rpm振摇过夜(一般10-12h)。第二天早晨将3ml振摇好的菌液转接至500ml已灭菌的含100μg/mlamp(一只小管对应一瓶)中,置于37℃摇床,220rpm振摇至od600=0.8-1(约5小时),然后加入终浓度为1mmiptg(异丙基-β-d-硫代半乳糖苷),设置温度37℃,转速180rpm,诱导3.5h。将诱导好的菌液转移到250ml离心杯中,4500rpm,收集菌体,加入150mlbuffera(55mmnah2po4,200mmnacl,10%glycerol,40mm咪唑,ph8.0。)重悬。将重悬好的菌液进行高压破碎(设置条件为:功率1.5kbar,4℃)。最后将破碎好的菌液12000rpm,离心50min,收集上清,置于冰上备用。打开akata层析系统先将镍柱用buffera平衡3个柱体积,平衡后取下,将收集的上清液用蠕动泵上样,然后再将柱子接回akta,观察215nm/280nm紫外吸收峰,用buffera将吸收峰洗平,接着用100%bufferb(100mmnah2po4,500mmnacl,10%glycerol,500mm咪唑,ph8.0)进行洗脱,注意观察出峰情况,收集洗脱液获得重组的mbp-makatoxin-3或其突变体。
(4)重组mbp-makatoxin-3及其突变体分离和纯化
由于重组mbp-makatoxin-3及其突变体的洗脱液中含有大量的盐,不利于后续酶切的进行,所以先将收集的重组mbp-makatoxin-3及其突变体置换到盐浓度较低的溶液中,然后利用gehitrapdesalting(5ml)脱盐柱将蛋白脱盐至bufferc(25mmnah2po4,50mmnacl,10%glycerol,25mm咪唑,ph8.0)中。然后按照加入tev蛋白酶,及终浓度为3mmgsh(还原型谷胱甘肽)和0.3mmgssg(氧化型谷胱甘肽),在25℃保温箱内酶切12h。第三天早晨酶切完成之后,打开akta层析系统将镍柱先用buffera平衡3个柱体积,将酶切混合物通过仪器上样环上样,收集穿透液,上样结束后先用100%buffera平衡3个柱体积,再用100%的bufferb洗脱,收集洗脱液。下一步将收集的穿透液进行浓缩,5kd超滤膜使用前先用500ml双蒸水清洗,浓缩时最佳上样流速为30-50ml/min,蠕动泵的相应转速为70-90rpm,注意不要将ret管夹完全夹紧,稍微给予压力即可。最后将浓缩好的重组makatoxin-3及其突变体通过hplc上样(结果如图6所示),色谱条件如下:流动相a为含0.1%三氟乙酸的水溶液,流动相b为含0.1%的乙腈溶液。图7中左图的8道为纯化的mbp-makatoxin-3,右图4道为纯化后的rmakatoxin-3多肽;图8中左图的8道为纯化的mbp-makatoxin-1,右图3道为纯化后的rmakatoxin-1多肽;图9中左图的8道为纯化的mbp-makatoxin-3-r58a,右图3-6道为纯化后的rmakatoxin-3-r58a多肽;图10中左图的7道为纯化的mbp-makatoxin-1-k8d-k9d-r58a,右图4道为纯化后的rmakatoxin-1-k8d-k9d-r58a多肽。本研究制备得到的重组makatoxin-3及其突变体蛋白的空间结构接近(如图11所示)。本研究中以1l细菌培养物计算,最终可以获得可溶性的rmakatoxin-3蛋白为0.5mg,并且所获得的多肽具有较好的活性(表1)。
表1不同表达系统所获得的多肽比较
(5)重组makatoxin-3及其突变体的镇痛及致痛活性研究。
小鼠福尔马林炎性痛镇痛研究:选用全雄c57bl/6j雄性小鼠(20g±2g),每组6-9只。小鼠腹腔注射100μl/只,多肽注射浓度分别为150nmol/kg,300nmol/kg和450nmol/kg,空白组注射saline和1%的bsa,对照组注射5mg/kg的吗啡,30min后左后足底皮下注射10μl1%(v/v)福尔马林溶液。统计:小鼠左后足底皮下注射福尔马林后,观察记录小鼠每5min内发生疼痛行为(如:舔足,抖足等)的持续时间,并分别统计phasei(0-10min)和phaseii(10-40min)内发生疼痛行为的时间总和,实验时间为40min。如图12所示,在腹腔内注射不同高浓度重组makatoxin-3(rmakatoxin-3)后,小鼠5min内发生疼痛行为的持续时间显著下降,且注射量越高,下降越明显,尤其是在phaseii(10-40min)内,重组makatoxin-3疼痛行为的持续时间显著下降,且注射量越高,下降越明显。重组makatoxin-1与makatoxin-3-r58a具有类似的效果。此外,rmakatoxin-1-k8d-k9d-r58a的镇痛作用较rmakatoxin-3降低(图12)。
小鼠致痛研究:选用c57bl/6j雄性小鼠(20g±2g),采用足底注射的方式;注射体积:10μl每只;每组共有10只,各组剂量设置:rmakatoxin-3和rmakatoxin-3-r58a的注射浓度为50nmol/kg,空白组注射saline和1%的bsa,吗啡(morphine)注射浓度为5mg/kg。我们用摄像机采用720p清晰度来记录整个过程后通过回放统计小鼠的疼痛行为,记录120min。统计120min内总舔足次数;计算舔足持续时间。rmakatoxin-3具有明显的致痛作用(图13a和b),而经r58a突变后的rmakatoxin-3致痛作用明显下降。
小鼠机械痛阈值检测实验:c57bl/6j雄性小鼠(20g±2g),分组为每组10只,足底注射;10μl/只,rmakatoxin-3和rmakatoxin-3-r58a的注射浓度为50nmol/kg,空白组注射saline和1%的bsa,morphine注射浓度为5mg/kg。注射多肽后直至疼痛行为(舔足、抖腿、悬腿)明显减少或消失,蝎毒素疼痛一般持续时间约60min,后将小鼠置于plantartest(hargreavesmethod)glassstands中适应5-10min,然后用von-frey电子机械针刺仪对给药足底机械阈值进行测试,当小鼠受到机械针刺激后会产生自然缩足(迈步不计算在内)时的力量阈值为其缩足阈值(以重量单位g计算)每只小鼠共重复测试5次,并以平均值作为最终参考值。结果显示注射rmakatoxin-3后,小鼠的机械阈值明显降低,因此rmakatoxin-3具有明显的致痛作用(图14c),而经r58a突变后的rmakatoxin-3致痛作用明显下降。
小鼠cfa慢性痛镇痛研究:选用全雄c57bl/6j雄性小鼠(20g±2g),每组6-8只。给药方式:小鼠腹腔注射100μl/只,多肽注射浓度分别为300nmol/kg和450nmol/kg,空白组注射saline和1%的bsa,对照组注射5mg/kg的吗啡,给药后30min,给予小鼠左后足底皮下注射(10μl0.5mg/ml)cfa(完全弗氏佐剂),足底注射cfa后2h和24h后测量小鼠机械痛阈值,然后再次给药,2h后再次测量小鼠机械痛阈值。采用记录方式:小鼠足底皮下注射(10μl0.5mg/ml)cfa(完全弗氏佐剂)后,将小鼠放置于plantartest(hargreavesmethod)glassstands中,用电子vonfrey测痛仪记录小鼠左后足的机械痛阈值。rmakatoxin-3、rmakatoxin-1和rmakatoxin-3-r58a在cfa模型中都表现出明显的镇痛作用。吗啡在长期给药出现了镇痛效果减弱,然而rmakatoxin-3、rmakatoxin-1和rmakatoxin-3-r58a的镇痛效果与吗啡相比仍旧有较好的镇痛效果(图14)。此外,rmakatoxin-3与除吗啡外的其他镇痛剂的镇痛效果也进行了比较,发现rmakatoxin-3在小鼠福尔马林模型中具有更好的镇痛效果(如图15所示)。
本发明提供了一种重组蝎毒蛋白makatoxin-3及其突变体的制备思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
序列表
<110>江苏省中医药研究院
<120>重组东亚钳蝎毒素多肽makatoxin-3及其突变体的制备方法和应用
<130>20201014
<160>18
<170>siposequencelisting1.0
<210>1
<211>201
<212>dna
<213>编码蝎毒蛋白makatoxin-3的66个氨基酸的序列(artificialsequence)
<400>1
ggtcgtgatgcctatattgcaaaaaaggaaaattgtacctacttctgcgccctgaatccg60
tattgtaatgatctgtgcaccaaaaatggcgcaaaaagcggttattgtcagtgggcaggc120
cgctatggcaatgcctgttggtgcattgatctgccggataaagttccgattcgtattccg180
ggtccgtgtattggtcgctaa201
<210>2
<211>66
<212>prt
<213>蝎毒蛋白makatoxin-3的66个氨基酸残基的序列(artificialsequence)
<400>2
glyargaspalatyrilealalyslysgluasncysthrtyrphecys
151015
alaleuasnprotyrcysasnaspleucysthrlysasnglyalalys
202530
serglytyrcysglntrpalaglyargtyrglyasnalacystrpcys
354045
ileaspleuproasplysvalproileargileproglyprocysile
505560
glyarg
65
<210>3
<211>201
<212>dna
<213>编码蝎毒蛋白makatoxin-1的66个氨基酸的序列(artificialsequence)
<400>3
ggacgtgatgcttatattgccgacagcgaaaactgtacctatttttgtggttcaaatcca60
tattgcaacgatttatgtaccgagaacggtgctaagagtggctactgccaatgggcaggt120
agatatggaaatgcctgctggtgcatagacttgcccgataaggtaccgattagaatacca180
ggaccatgccgtggccgataa201
<210>4
<211>66
<212>prt
<213>蝎毒蛋白makatoxin-1的66个氨基酸残基的序列(artificialsequence)
<400>4
glyargaspalatyrilealaaspsergluasncysthrtyrphecys
151015
glyserasnprotyrcysasnaspleucysthrgluasnglyalalys
202530
serglytyrcysglntrpalaglyargtyrglyasnalacystrpcys
354045
ileaspleuproasplysvalproileargileproglyprocysarg
505560
glyarg
65
<210>5
<211>201
<212>dna
<213>编码蝎毒蛋白makatoxin-3-r58a的66个氨基酸的序列(artificialsequence)
<400>5
ggtcgtgatgcatatattgcaaaaaaagaaaattgtacctatttttgtgcactgaatccg60
tattgtaatgatctgtgtaccaaaaatggtgcaaaaagcggttattgtcagtgggcaggt120
cgttatggtaatgcatgttggtgtattgatctgccggataaagttccgattgcaattccg180
ggtccgtgtattggtcgttaa201
<210>6
<211>66
<212>prt
<213>蝎毒蛋白makatoxin-3-r58a的氨基酸残基序列(artificialsequence)
<400>6
glyargaspalatyrilealalyslysgluasncysthrtyrphecys
151015
alaleuasnprotyrcysasnaspleucysthrlysasnglyalalys
202530
serglytyrcysglntrpalaglyargtyrglyasnalacystrpcys
354045
ileaspleuproasplysvalproilealaileproglyprocysile
505560
glyarg
65
<210>7
<211>201
<212>dna
<213>编码蝎毒蛋白makatoxin-1-d8k-d9k-r58a的66个氨基酸的序列(artificialsequence)
<400>7
ggacgtgatgcttatattgccaaaaaggaaaactgtacctatttttgtggttcaaatcca60
tattgcaacgatttatgtaccgagaacggtgctaagagtggctactgccaatgggcaggt120
agatatggaaatgcctgctggtgcatagacttgcccgataaggtaccgattgcaatacca180
ggaccatgccgtggccgataa201
<210>8
<211>66
<212>prt
<213>蝎毒蛋白makatoxin-1-d8k-d9k-r58a的66个氨基酸残基的序列(artificialsequence)
<400>8
glyargaspalatyrilealalyslysgluasncysthrtyrphecys
151015
glyserasnprotyrcysasnaspleucysthrgluasnglyalalys
202530
serglytyrcysglntrpalaglyargtyrglyasnalacystrpcys
354045
ileaspleuproasplysvalproilealaileproglyprocysarg
505560
glyarg
65
<210>9
<211>38
<212>dna
<213>rmakatoxin-3上游引物(artificialsequence)
<400>9
cggggtaccgaaaatctgtattttcagggcaccgcatg38
<210>10
<211>27
<212>dna
<213>rmakatoxin-3下游引物(artificialsequence)
<400>10
ggagctcttattaatctgccggtgtac27
<210>11
<211>41
<212>dna
<213>rmakatoxin-1上游引物(artificialsequence)
<400>11
cggggtaccgaaaatctgtattttcagggcaccgcatgtag41
<210>12
<211>30
<212>dna
<213>rmakatoxin-1下游引物(artificialsequence)
<400>12
ggagctcttattaatctgccggtgtacaac30
<210>13
<211>42
<212>dna
<213>rmakatoxin-3-r58a上游引物(artificialsequence)
<400>13
ggataaagttccgattgcaattccgggtccgtgtattggtcg42
<210>14
<211>46
<212>dna
<213>rmakatoxin-3-r58a下游引物(artificialsequence)
<400>14
caatacacggacccggaattgcaatcggaactttatccggcagatc46
<210>15
<211>46
<212>dna
<213>rmakatoxin-1-d8k-d9k上游引物(artificialsequence)
<400>15
gtgatgcttatattgccaaaaaggaaaactgtacctatttttgtgg46
<210>16
<211>43
<212>dna
<213>rmakatoxin-1-d8k-d9k下游引物(artificialsequence)
<400>16
aataggtacagttttcctttttggcaatataagcatcacgtcc43
<210>17
<211>42
<212>dna
<213>rmakatoxin-1-r58a上游引物(artificialsequence)
<400>17
cgataaggtaccgattgcaataccaggaccatgccgtggccg42
<210>18
<211>42
<212>dna
<213>rmakatoxin-1-r58a下游引物(artificialsequence)
<400>18
gcatggtcctggtattgcaatcggtaccttatcgggcaagtc42
- 还没有人留言评论。精彩留言会获得点赞!