卵巢癌类器官3D培养方法与流程
卵巢癌类器官3d培养方法
技术领域
[0001]
本发明涉及器官培养领域,具体而言,涉及一种卵巢癌类器官3d培养方法。
背景技术:
[0002]
卵巢肿瘤是常见的妇科肿瘤之一,其病理生理学机制尚不清楚,经过手术及化疗后,70%至80%的患者会出现化疗耐药和肿瘤复发,致使治疗效果没有明显提高。卵巢癌类器官能够高度模拟原发肿瘤组织的生理结构和功能,可在体外长期培养,是一种新型体外研究模型,在卵巢癌功能性测试以及特异性药物筛选研究中具有广阔前景。
[0003]
然而,现有技术中的卵巢癌类器官培养成功率较低,极大地阻碍了对卵巢癌的研究。
技术实现要素:
[0004]
本发明的主要目的在于提供一种卵巢癌类器官3d培养方法,以至少解决现有技术中的卵巢癌类器官培养成功率较低的问题。
[0005]
为了实现上述目的,本发明提供了一种卵巢癌类器官3d培养方法,包括:在手术中获取新鲜切除的卵巢癌组织样本;对获取的卵巢癌组织样本进行清洗和消化操作以得到卵巢癌单细胞;对卵巢癌单细胞进行计数并按照接种所需的细胞数对卵巢癌单细胞进行重悬和稀释;按照预设比例将卵巢癌单细胞与基质胶混合,将混合物接种至多孔细胞培养皿中形成基质胶半球体并置于培养箱内进行培养以促进基质胶半球体聚合凝固;待基质胶半球体聚合凝固后,向基质胶半球体加入卵巢癌完全培养基后置于培养箱内培养预定时间得到卵巢癌类器官;对卵巢癌类器官以及得到所述卵巢癌类器官的原始肿瘤组织分别进行鉴定并将鉴定结果进行比较。
[0006]
进一步地,在手术中获取新鲜切除的卵巢癌组织样本时,从肿瘤块靠近边缘侧切取大小为0.5cm至2.0cm的卵巢癌组织样本,切取时避开坏死和出血部分。
[0007]
进一步地,对获取的卵巢癌组织样本进行清洗时,将卵巢癌组织样本置于30mm细胞培养皿中,用预冷的pbs缓冲液反复冲洗至少10遍以上。
[0008]
进一步地,对获取的卵巢癌组织样本进行消化时,将清洗过的标本剪碎,置于15ml离心管中,加入2.5mg/ml的i型胶原酶消化液3ml,再置于37℃培养箱孵育30min,每10min于显微镜下观察卵巢癌单细胞数量所占比例,待90%组织完全消化后,将消化产物用70μm的细胞筛过筛至50ml离心管中,加入30ml预冷的pbs缓冲液洗涤三次,每次洗涤过程中以1000rpm的转速离心3min,充分洗去胶原酶,最后用1ml预冷的pbs缓冲液重悬细胞;其中,卵巢癌组织样本消化时间不超过1小时。
[0009]
进一步地,对得到卵巢癌单细胞进行计数包括:取出10μl细胞悬液置于血细胞计数器上,在倒置显微镜下计数10μl样本中的细胞数量。
[0010]
进一步地,接种所需的细胞数为1ml细胞悬液中含有80,000-20,000个细胞;对卵巢癌单细胞进行重悬和稀释包括:吸取细胞悬液置于预冷的1.5ml离心管中,离心后收集细
胞,用dmem/f12培养基对细胞进行重悬和稀释。
[0011]
进一步地,按照预设比例将卵巢癌单细胞与基质胶混合,将混合物接种至多孔细胞培养皿中形成基质胶半球体并置于培养箱内进行培养以促进基质胶半球体聚合凝固包括:将基质胶置于冰上,使之完全溶解;将稀释过的细胞悬液置于冰上,加入等体积的基质胶,用预冷的枪头轻轻吹打混匀后接种至预热的无菌24孔细胞培养皿中,每孔接种50μl混合物,每孔中央形成基质胶半球体,然后置于37℃无菌培养箱内培养30min,促进基质胶半球体聚合。
[0012]
进一步地,细胞接种时避免枪尖接触到孔底,使混合物在细胞培养皿的孔中央形成一个半球体。
[0013]
进一步地,向基质胶半球体加入卵巢癌完全培养基后置于培养箱内培养预定时间得到卵巢癌类器官包括:将24孔细胞培养皿取出,每孔分别加入37℃预热的卵巢癌完全培养基500μl,确保培养基没过半球体,最后再置于37℃无菌培养箱中培养14天以得到卵巢癌类器官。
[0014]
进一步地,对卵巢癌类器官和得到类器官的原始肿瘤组织分别进行鉴定并将鉴定结果进行比较包括:对卵巢癌类器官和得到所述卵巢癌类器官的原始肿瘤组织进行h&e染色,免疫组化以及免疫荧光鉴定并将鉴定结果进行比较。
[0015]
应用本发明技术方案的卵巢癌类器官3d培养方法,包括在手术中获取新鲜切除的卵巢癌组织样本;对获取的卵巢癌组织样本进行清洗和消化操作以得到卵巢癌单细胞;对卵巢癌单细胞进行计数并按照接种所需的细胞数对卵巢癌单细胞进行重悬和稀释;按照预设比例将卵巢癌单细胞与基质胶混合,将混合物接种至多孔细胞培养皿中形成基质胶半球体并置于培养箱内进行培养以促进基质胶半球体聚合凝固;待基质胶半球体聚合凝固后,向基质胶半球体加入卵巢癌完全培养基后置于培养箱内培养预定时间得到卵巢癌类器官;对卵巢癌类器官以及得到所述卵巢癌类器官的原始肿瘤组织分别进行鉴定并将鉴定结果进行比较。采用本方法培养卵巢癌类器官具有较高的成活率和较好的品质,解决了现有技术中的卵巢癌类器官培养成功率较低的问题。
附图说明
[0016]
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
[0017]
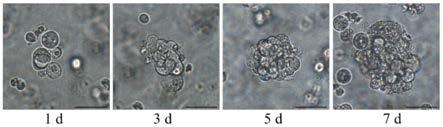
图1是采用本发明实施例的卵巢癌类器官3d培养方法培养的卵巢癌类器官的示意图;
[0018]
图2是采用本发明实施例的卵巢癌类器官3d培养方法培养的卵巢癌类器官以及原始肿瘤组织进行h&e染色鉴定的示意图;
[0019]
图3是采用本发明实施例的卵巢癌类器官3d培养方法培养的卵巢癌类器官以及原始肿瘤组织进行免疫组化鉴定的示意图;以及
[0020]
图4是采用本发明实施例的卵巢癌类器官3d培养方法培养的卵巢癌类器官以及原始肿瘤组织进行免疫荧光鉴定的示意图。
具体实施方式
[0021]
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本发明。
[0022]
根据本发明实施例的卵巢癌类器官3d培养方法,具体包括以下步骤:
[0023]
s102:在手术中获取新鲜切除的卵巢癌组织样本;
[0024]
s104:对获取的卵巢癌组织样本进行清洗和消化操作以得到卵巢癌单细胞;
[0025]
s106:对卵巢癌单细胞进行计数并按照接种所需的细胞数对卵巢癌单细胞进行重悬和稀释;
[0026]
s108:按照预设比例将卵巢癌单细胞与基质胶混合,将混合物接种至多孔细胞培养皿中形成基质胶半球体并置于培养箱内进行培养以促进基质胶半球体聚合凝固;
[0027]
s110:待基质胶半球体聚合凝固后,向基质胶半球体加入卵巢癌完全培养基后置于培养箱内培养预定时间得到卵巢癌类器官;
[0028]
s112:对卵巢癌类器官以及得到所述卵巢癌类器官的原始肿瘤组织分别进行鉴定并将鉴定结果进行比较。
[0029]
采用本方法培养卵巢癌类器官具有较高的成活率和较好的品质,解决了现有技术中的卵巢癌类器官培养成功率较低的问题。
[0030]
具体实施时,步骤s102中,在手术中获取新鲜切除的卵巢癌组织样本时,从肿瘤块靠近边缘侧切取大小为0.5cm3至2.0cm3的卵巢癌组织样本,切取时避开坏死和出血部分。
[0031]
步骤s104中,对获取的卵巢癌组织样本进行清洗时,将卵巢癌组织样本置于30mm细胞培养皿中,用预冷的pbs缓冲液反复冲洗至少10遍以上,从而保证将组织样本清洗干净。
[0032]
进一步地,对获取的卵巢癌组织样本进行消化时,采用眼科剪将清洗过的标本剪碎,置于15ml离心管中,加入2.5mg/ml的i型胶原酶消化液3ml,再置于预热好的37℃培养箱孵育30min,每10min于显微镜下观察卵巢癌单细胞数量所占比例,待90%组织完全消化后,将消化产物用70μm的细胞筛过筛至50ml离心管中,加入30ml预冷的pbs缓冲液洗涤三次,每次洗涤过程中以1000rpm的转速将消化产物离心3min,充分洗去胶原酶,最后用1ml预冷的pbs缓冲液重悬细胞;在消化过程中,卵巢癌组织样本消化时间不超过1小时,胶原酶消化时间过长会导致已消化的单细胞受损,活性降低,严重时会导致细胞死亡。
[0033]
步骤s106中,对得到卵巢癌单细胞进行计数包括:取出10μl细胞悬液置于血细胞计数器上,在倒置显微镜下计数10μl样本中的细胞数量,然后按照接种所需的细胞数对卵巢癌单细胞进行重悬和稀释;接种所需的细胞数为1ml细胞悬液中含有80,000-20,000个细胞;对卵巢癌单细胞进行重悬和稀释具体包括吸取细胞悬液置于预冷的1.5ml离心管中,离心后收集细胞,用dmem/f12培养基对细胞进行重悬和稀释。
[0034]
步骤s108具体包括:将基质胶置于冰上,使之完全溶解;将稀释过的细胞悬液置于冰上,加入等体积的基质胶,用预冷的枪头轻轻吹打混匀后接种至预热的无菌24孔细胞培养皿中,每孔接种50μl混合物,保证每孔中接种2000-5000个细胞,每孔中央形成基质胶半球体,然后置于预热的37℃无菌培养箱内培养30min,促进基质胶半球体聚合。在细胞接种时避免枪尖接触到孔底,从而保证混合物在细胞培养皿的孔中央形成一个半球体,该过程要迅速,避免混合物中的基质胶凝固。
[0035]
步骤s110具体包括待基质胶半球体聚合凝固后,将24孔细胞培养皿取出,每孔分别加入37℃预热的卵巢癌完全培养基500μl,确保培养基没过基质胶半球体,最后再置于37℃无菌培养箱中培养14天以得到卵巢癌类器官;刚聚合的基质胶半球体不是十分牢固,加培养基时枪头贴着孔壁,使培养基沿孔壁缓慢流入孔底,这样可以避免对半球体的冲击从而造成半球体裂解。如图1所示,在培养箱培养过程中每天拍照观察类器官生长情况,每隔两天进行培养基换液,图1中的标尺为50μm。
[0036]
步骤s112中具体包括对卵巢癌类器官和得到所述卵巢癌类器官的原始肿瘤组织进行h&e染色,免疫组化以及免疫荧光鉴定并将鉴定结果进行比较。免疫组化为anti-pax8免疫组化,免疫荧光为anti-pax8免疫荧光。具体结果如图2至图4所示。图2中原始肿瘤组织的标尺为100μm,卵巢癌类器官标尺为50μm;图3中,原始肿瘤组织的标尺为100μm,卵巢癌类器官标尺为50μm;图4中原始肿瘤组织和卵巢癌类器官的标尺均为100μm。
[0037]
本发明实施例的卵巢癌类器官3d培养方法具有以下进步效果:
[0038]
1)本法的实验操作流程更加简单,可建立与原发肿瘤组织生物学信息相一致的卵巢癌类器官标本库,与传统的组织标本库相比,类器官可传代培养,稳定存储肿瘤信息;
[0039]
2)建立的卵巢癌类器官标本库,可进行高通量筛选,基因编辑以及模拟人体发育及疾病模式,在卵巢癌特异性药物筛选研究中发挥功能;
[0040]
3)类器官培养成功率高,培养的卵巢癌类器官具有较高的成活率和较好的品质。
[0041]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1