单个浆细胞的筛选方法及其在小分子单克隆抗体制备中的应用与流程
[0001]
本发明涉及细胞生物学和免疫学领域,具体地说,涉及单个浆细胞的筛选方法及其在小分子单克隆抗体制备中的应用。
背景技术:
[0002]
单克隆抗体以其特异性强、纯度高、均一性好等优点,广泛应用于生物学、医学、环境检测和食品科学等领域的诊断和治疗。基于单克隆抗体的免疫分析技术是现代分析技术主要方向之一,其中高性能单克隆抗体的制备是关键,自1975年kohler和milstein建立杂交瘤技术后,基于细胞融合的鼠源单克隆抗体的研制及应用迅速发展,产生了巨大的经济效应。
[0003]
研究表明,鼠单克隆抗体对抗原表位的识别有限,尤其是对小分子化合物如抗菌药物、霉菌毒素、环境污染物等的亲和力远低于兔子、羊驼、马、猪等动物,因此相继发展了其他动物种类的杂交瘤单克隆抗体制备技术,但由于来源于其他动物种类的骨髓瘤细胞存在活性低、融合率低等缺陷,进展缓慢。兔源单克隆抗体拥有高特异性、高活性和高亲和力等优点,同时兔骨髓瘤细胞发展相对成熟,兔杂交瘤技术的研究较多。美国epitomics公司在转基因兔骨髓瘤样肿瘤成功构建了兔瘤细胞细胞株,使兔单克隆抗体技术有了突破性的进展,但该技术和兔骨髓瘤细胞受专利保护,同时与鼠源骨髓瘤细胞相比,兔骨髓瘤细胞的稳定性和分泌抗体能力较差,限制了其广泛应用。除了杂交瘤技术,还出现了一些b细胞体外无限增殖并分泌抗体技术如ebv转化b淋巴细胞技术,以及一些体外展示技术如噬菌体展示、核糖体展示、酵母展示等技术。这些重组单克隆抗体在保持了上述单克隆抗体优点的基础上,同时具备了高一致性和可重复性等优点。但这些技术由于无法实现单克隆抗体的轻链-重链的原始配对,导致筛选到高亲和力的抗体难度很大。
[0004]
单细胞制备抗体技术是近年来发展起来的新型单克隆抗体制备技术,该方法依赖于基于细胞表面抗原特异性受体的流式或微流控等分选技术,通过高通量测序技术、单细胞巢式pcr技术和抗体的重组表达技术,实现从单个b淋巴细胞中分离表达天然配对的特异性抗体。单细胞抗体制备技术,克服了传统体外展示技术制备抗体的缺点,实现了轻链和重链原始配对,能够筛选出高亲和力、特异性的稀有抗体。
[0005]
浆细胞是一种不具有分化增殖能力的终末细胞,与记忆b细胞等其他分泌抗体的b细胞相比,浆细胞分泌抗体的亲和力进一步成熟,因此,浆细胞来源的单克隆抗体比传统流式筛选记忆b细胞制备的抗体亲和力更高。目前,大多数特异性筛选技术对细胞表面受体的依赖性较高,因此对于表面缺乏抗原特异性受体的浆细胞,实现其特异性的精准筛选存在一定的挑战性。基于流体力学原理的微流控技术在高通量、大规模、高精准的单细胞研究领域受到广泛的关注。研究表明,基于微流控的微液滴技术可实现单个浆细胞的囊泡包裹,达到捕获、检测和筛选分泌抗体的目的。但该方法操作复杂,且会影响细胞的生理功能和蛋白的分泌能力。微阵列细胞分选技术是基于细胞原始培养环境和微孔特有结构,利用大量的
微孔完成高通量的细胞捕获,实现单个微孔中的单个细胞在微培养环境中分泌蛋白的分析和鉴定,操作简单且不损伤细胞,同时结合荧光标记和显微操作技术实现单个细胞分泌抗体的动态实时监测,提高整个系统筛选的精准度。但是,目前的单细胞挑选都是基于显微手动操作,导致微孔板单细胞的制备效率受到很大的限制。
[0006]
因此开发一种高效、精准、可视化、自动化、高通量且操作简单、易于推广的单个抗原特异性的浆细胞筛选及相关单克隆抗体的制备技术尤为重要。
技术实现要素:
[0007]
本发明的目的是提供单个浆细胞的筛选方法及其在小分子单克隆抗体制备中的应用。
[0008]
为了实现本发明目的,第一方面,本发明提供单个浆细胞的筛选方法,包括:
[0009]
1)针对小分子化合物m,设计并合成人工抗原;
[0010]
2)用人工抗原免疫实验动物,分离获得淋巴细胞;
[0011]
3)用包被有所述人工抗原的微孔板并向微孔板中加入荧光标记二抗对步骤2)的淋巴细胞进行分选,得到可特异性识别小分子化合物m的单个浆细胞。
[0012]
优选地,所述小分子化合物m为沙丁胺醇(sal)。
[0013]
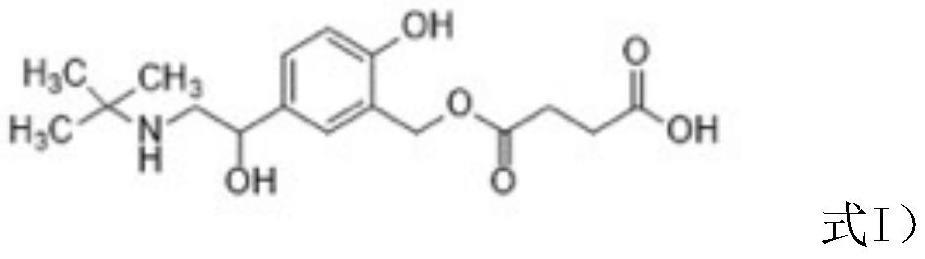
所述人工抗原是通过在沙丁胺醇结构中引入羧基,得到半抗原(sal-hs),然后将半抗原与载体蛋白以酰胺键偶联得到的。
[0014]
半抗原sal-hs的结构如式i)所示:
[0015][0016]
其制备方法如下:称取2mg sal,溶于500μl dmf,加入2.34g丁二酸酐,60℃下反应8h,所得反应物经浓缩即为sal-hs。
[0017]
所述载体蛋白可选自牛血清白蛋白(bsa)、血蓝蛋白(klh)、卵清蛋白、甲状腺蛋白、人血清白蛋白;优选牛血清白蛋白或血蓝蛋白。
[0018]
采用活泼酯法合成人工抗原sal-klh:1mg sal经活化生成sal-hs,活化后的sal-hs溶于400μl dmf,3mg nhs溶于200μl dmf、3mg edc溶于400μl dmf,将三者混匀,室温振荡孵育4h,将其中500μl反应液缓慢滴加到2mg klh,4℃振荡反应过夜,得到人工抗原sal-klh,可将其作为免疫原。
[0019]
前述的方法,所述实验动物优选为兔,更优选从兔脾脏中分离淋巴细胞。
[0020]
第二方面,本发明提供按照上述方法获得的单个浆细胞在制备单克隆抗体中的应用。
[0021]
前述的应用,以单个浆细胞的cdna为模板,利用巢式pcr反应,分别扩增得到编码单克隆抗体的重链和轻链可变区的核苷酸序列。
[0022]
第三方面,本发明提供抗沙丁胺醇单克隆抗体,其重链、轻链可变区的氨基酸序列分别如seq id no:1和2所示。
[0023]
第四方面,本发明提供由所述单克隆抗体制备的沙丁胺醇检测试剂或试剂盒。
[0024]
第五方面,本发明提供所述单克隆抗体的以下任一应用:
[0025]
(1)在检测沙丁胺醇中的应用;
[0026]
(2)在制备沙丁胺醇的检测试剂或试剂盒中的应用;
[0027]
(3)在制备沙丁胺醇的免疫层析试纸条中的应用。
[0028]
借由上述技术方案,本发明至少具有下列优点及有益效果:
[0029]
本发明提供的抗沙丁胺醇单链抗体与沙丁胺醇具有较高的亲和力,可特异性识别沙丁胺醇,检测灵敏度可达0.01ng/ml(0.014ppb),实用价值高,本发明在沙丁胺醇残留检测中具有良好的应用前景。
[0030]
目前沙丁胺醇的检测手段主要是试纸条及elisa检测试剂盒,由于沙丁胺醇的检测抗体主要是鼠单克隆抗体,其灵敏度达不到检测标准,而兔单克隆抗体更灵敏。且新型的单细胞抗体制备技术可以克服传统抗体制备技术的弊端,为制备更灵敏更特异的抗体提供新手段。
附图说明
[0031]
图1为本发明较佳实施例中免疫原sal-klh的合成路线图。
[0032]
图2为本发明较佳实施例中兔子血清效价变化图。
[0033]
图3为本发明较佳实施例中cellcollecter
tm
单个浆细胞捕获示意图。
[0034]
图4为本发明较佳实施例中浆细胞分泌抗体的荧光强度的变化;其中,a为明场;b-f依次为0h-10h的沙丁胺醇特异性浆细胞分泌抗体的荧光强度变化。
[0035]
图5为pgm-t fast vector结构示意图。
[0036]
图6为本发明较佳实施例中scfv的sds-page电泳条带图;其中,scfv的条带在20-45kda之间,约为37kda。从左到右依次为蛋白marker、sal-1-scfv、sal-2-scfv、sal-3-scfv、sal-4-scfv、sal-5-scfv。
[0037]
图7为本发明较佳实施例中利用兔scfv和单克隆全抗检测沙丁胺醇的elisa测定结果。其中,a、b分别表示抗体的竞争结合曲线,图中可知scfv的ic
50
为0.04ng/ml,全抗的ic
50
为0.01ng/ml。
具体实施方式
[0038]
本发明基于als cellcelector
tm
的自动化细胞成像技术和垂直高精度玻璃微毛细管的自动细胞显微操作系统,开发了一种可视化微孔板精准单细胞分选技术,结合浆细胞分泌抗体的特征,设计合理的试验方法,为制备单个浆细胞来源的单克隆抗体奠定基础。本发明以沙丁胺醇(式1)为模式分子,以新西兰大白兔为模式动物。
[0039][0040]
本发明的目的之一是提供一种沙丁胺醇免疫原免疫新西兰大白兔的方法。
[0041]
本发明的目的之二是提供一种兔脾脏细胞分离的方法。
[0042]
本发明的目的之三是提供一种兔脾脏淋巴细胞分离的方法。
[0043]
本发明的目的之四是提供一种基于微孔板技术的可视化、全自动抗原特异性单个兔源浆细胞的分选方法。
[0044]
本发明的目的之五是提供一种获取单个浆细胞体外cdna的方法。
[0045]
本发明的目的之六是提供一种单个兔源浆细胞重链可变区和轻链可变区的扩增方法。
[0046]
本发明的目的之七是提供一种通过ta克隆获得单个浆细胞抗体可变区序列的方法。
[0047]
本发明的目的之八是提供一种单个浆细胞来源的兔scfv的体外制备的方法。
[0048]
本发明的目的之九是提供一种浆细胞来源的兔scfv抗体的elisa鉴定方法。
[0049]
本发明是通过以下技术方案实现的:
[0050]
沙丁胺醇免疫原sal-klh的制备方法如下:采用活泼酯法合成sal人工抗原。
[0051]
1mg sal经活化生成sal-hs,活化后的sal-hs溶于400μl dmf,3mg nhs溶于200μl dmf、3mg edc溶于400μl dmf,三者混匀,室温振荡孵育4h,将其中500μl反应液缓慢滴加到2mg klh,4℃振荡反应过夜,制备sal-klh作为免疫原(图1)。
[0052]
免疫方式为颈背部多点注射免疫法。所述方法中,免疫的次数为8次,第一次免疫为初次免疫、采用弗氏完全佐剂,其他免疫均采用弗氏不完全佐剂。所述方法中,前5次免疫原sal-klh的剂量为1mg,后3次免疫剂量依次递减200μg。免疫周期为30天,每次免疫1周后,进行血清效价和亲和力的检测。
[0053]
免疫制剂的制备方法如下:将sal-klh(浓度为1mg/ml)与完全弗氏佐剂/不完全弗氏佐剂按等体积混合并乳化。
[0054]
兔脾细胞的分离方法如下:第8次免疫完,选取血清亲和力高的抗体,进行耳源静脉冲击免疫,加强免疫4天后的兔子,耳源静脉注射5ml空气处死,在无菌的条件下,取出脾脏,将脾脏分为4部分,放在0.45μm的滤网中,加入1ml红细胞裂解液,用灭菌的玻璃研杵,研磨,过滤离心后,定容于20ml培养基中,用于后续的脾脏淋巴细胞的分离。
[0055]
兔脾脏淋巴的分离方法如下:在细胞悬浮液上方轻轻加入等体积的淋巴细胞分离液,置于整体体积3倍的离心管中1000g水平离心30min,取中间层的淋巴细胞,洗涤三次后,用含5%血清的rpmi 1640培养基重悬,将脾脏细胞按照109/ml的细胞密度进行冻存,待后续试验使用。
[0056]
基于微孔板技术的可视化、全自动抗原特异性单个兔源浆细胞的筛选方法如下:首先选择孔径大小合适的h25-25纳米孔板(als,德国),经无水乙醇预处理之后,用100μg的sal-bsa抗原过夜包被,2%bsa,37℃封闭1小时。封闭后的纳米孔板用cb液(naco3缓冲液)洗涤3次,在1ml细胞密度为1
×
105兔脾脏淋巴细胞悬液加入1-2μg偶联红色荧光素pe的羊抗兔igg抗体,按照“z”型将细胞悬液均匀铺在纳米孔板上,1000g离心3min,使细胞沉降到纳米孔板底部,将纳米孔板中的细胞置于37℃,5%co2细胞培养箱中孵育,实时监测浆细胞的抗体分泌。采用cellcelector
tm
的荧光采集和分析系统,每2小时进行一次纳米孔的荧光信号的采集(即浆细胞分泌抗体量),连续扫描10h,观察和分析单个细胞所在的纳米孔的荧光强度随时间的变化,采用cellcelector
tm
的垂直高精度玻璃微毛细管的自动细胞显微操作系统,挑选分泌抗原特异性抗体能力强的浆细胞进行下一步实验。
[0057]
单个浆细胞cdna获取的方法如下:从h25-25纳米孔板中挑选出来的抗原特异性的浆细胞,立即加入到10μl含rnaase out的superscriptⅲcelldirect
tm cdna synthesis试剂盒的细胞裂解液,迅速放在-80℃冰箱中,待所有细胞挑选完成之后,将pcr管置于在70℃金属浴中,进行细胞的裂解,随后立即加入oligo d(t)等反转录试剂,设置合适的反转录条件,进行单个细胞mrna的反转录。
[0058]
单个浆细胞重链可变区和轻链可变区的扩增方法如下:用优化后的兔子重链可变区和轻链可变区的引物,用高保真pfu酶,在95℃5min;95℃20s,55℃40s,72℃2min,30个循环;72℃10min条件下进行pcr扩增,琼脂糖凝胶电泳结果显示,dna条带大小vh和vl分别为350bp左右。
[0059]
ta克隆获得单个浆细胞抗体可变区序列的方法:将条带大小正确的vh和vl分别进行切胶回收,通过ta克隆将plb载体与序列进行平末端连接,通过平板筛选,挑取阳性克隆,送测序,在imgt网站上进行比对,分析序列特征及种属来源。
[0060]
本发明基于高通量微孔板筛选单细胞的技术,建立一种高效自动化、可视化的抗原特异性浆细胞制备及相关抗体制备技术,此方法操作步骤简单、新颖,结合单个兔源浆细胞抗体可变区序列的体外扩增,为单个抗原特异性浆细胞抗体的制备提供新的平台和技术,可用于小分子兔源单克隆抗体的推广和应用。通过该方法制备高特异性、高灵敏度的兔单克隆抗体,克服了传统兔源杂交瘤不稳定,以及b细胞体外培养等技术壁垒,同时避免了噬菌体等传统展示筛选技术的重复性不高、抗体的灵敏度低的问题,将这种可视化的浆细胞筛选与单个浆细胞来源的巢式pcr技术结合,可以快速获得兔单克隆抗体序列,通过体外重组抗体的制备技术制备高特异性、高灵敏度和高稳定性的单克隆抗体,该技术在科研与实际生产应用中具有较为广阔的前景。
[0061]
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrook j&russell dw,molecular cloning:a laboratory manual,2001),或按照制造厂商说明书建议的条件。
[0062]
实施例1新西兰大白兔的免疫
[0063]
用pbs缓冲液将免疫原(sal-klh)的浓度调整为1mg/ml,用bicinchoninic acid法确定免疫原的浓度。
[0064]
取6只新西兰大白兔(2月龄,体重2.5kg),编号分别为sal-klh-1、sal-klh-2、sal-klh-3、sal-klh-4、sal-klh-5和sal-klh-6。对新西兰大白兔进行8次免疫,免疫方式为颈背部免疫4-8点。
[0065]
第一次免疫:每只免疫1ml首免制剂(每1ml首免制剂含有1mg sal-klh)。
[0066]
第二次至第八次免疫:从首次免疫开始计天数,每30天进行一次免疫,共进行7次加强免疫;前3次加强免疫,每次每只免疫1mg sal-klh;后3次加强免疫,分别为800μg、600μg和400μg。
[0067]
实施例2新西兰大白兔抗血清的筛选
[0068]
对免疫后一周所获得的抗血清进行效价和灵敏度的测定。测定方法为间接elisa。具体操作步骤如下:
[0069]
将包被原sal-bsa用碳酸盐缓冲液(ph9.6)稀释为0.1μg/ml,以100μl/孔的量包被elisa板,37℃孵育2h,然后用pbst溶液洗板3次。用含量为2%的脱脂奶粉封闭elisa板(150
20μg/ml,4℃放置过夜。
[0085]
4、h25-25纳米孔板的封闭:弃去包被液后,用cbs洗涤3次,每孔加入0.5ml的2%bsa,37℃封闭1h。
[0086]
5、兔脾脏淋巴细胞铺板:每个大孔加入0.5ml的细胞悬浮液(密度建议为105个/ml)和荧光标记的二抗(建议1-2μg/ml)混合液,铺板时需要均匀“z”型加液,室温下静置10min,300g离心3min。
[0087]
6、抗原特异性浆细胞荧光信号的采集:在cellcellector
tm
上,使用10倍物镜扫描,0h扫描一次荧光和明场,依次每隔2h扫描一次荧光(确保每次扫描细胞的位置不发生变化)(图3和图4)。
[0088]
7、抗原特异性浆细胞的捕获:在cellcellector
tm
上,选取30μm的垂直玻璃针,调整合适的高度和位置,将在20h内单个细胞所在的纳米孔壁荧光持续增强的细胞,挑选收集在含有裂解液的pcr管中,立刻置于-80℃保存。
[0089]
实施例6单个浆细胞cdna的制备
[0090]
1、将含有单个抗原特异性浆细胞的裂解液的pcr,由-80℃转移至70℃的金属浴中,裂解10min。
[0091]
2、在pcr管中加入dnase i(1u/μl)5μl,同时加入1μl的dnase i缓冲液,将pcr管上下混匀,轻轻离心后,放在室温下,静置5min(注意:静置的时间不能超过10min,否则会影响整个核酸产率)。
[0092]
3、加入1.2μl的25mm edta,上下颠倒,轻微离心,放在70℃的金属浴中静置5min,rna的提取完成。
[0093]
4、向上述pcr管中,继续加入2μl的oligo(dt)
20
(50mm)和1μl的10mm dntp mix,上下颠倒,轻微离心,于70℃的金属浴中静置5min。
[0094]
5、冰上静置2min后,依次加入6μl 5
×
rt buffer、1μl rnaseout
tm
(40u/μl)、1μl superscript
tm iii rt(200u/μl)、1μl 0.1m dtt,上下颠倒,轻微离心,放在pcr仪中,50℃50min,85℃5min。
[0095]
6、加入1μl rnase h(2u/μl),在37℃中静置20min,产物即为单个细胞的cdna,于-20℃保存。
[0096]
实施例7单个浆细胞vh和vl的扩增
[0097]
以单个浆细胞的cdna为模板,优化兔子的重链和轻链的可变区引物(表1),在95℃3min;95℃30s,55℃30s,72℃2min,30个循环;72℃10min。pcr反应结束后将产物进行1%琼脂糖凝胶电泳鉴定,回收目的片段,反应体系见表2。
[0098]
表1 pcr扩增引物序列
[0099][0100]
注:r=a/g,y=c/t,m=a/c,s=c/g,h=a/c/t。
[0101]
表2 pcr反应体系
[0102][0103]
注:插入片段用量ng=(3-10)
×
(插入片段长度/载体长度)
×
载体用量ng。
[0104]
实施例8 ta克隆获得单个浆细胞抗体可变区序列
[0105]
1、目的片段胶回收之后,按照表3在无菌离心管中加入各成分,轻轻弹动离心管以混匀内容物,短暂离心3-5s。将混合反应液置于室温反应5min。反应结束后,将离心管置于冰上,进行后续的转化反应。
[0106]
2、取部分连接产物加到50-100μl dh 5α感受态细胞中(感受态细胞应刚从-70℃冰箱取出放于冰浴上,待刚刚解冻时加入连接产物,连接产物的加入量不超过感受态细胞体积的十分之一),轻弹混匀,冰浴30min,将离心管置于42℃水浴90s,取出管后立即置于冰浴中放置2-3min,期间不要摇动离心管。向离心管中加入350μl,37℃预热的lb(不含抗生素)培养基,180rpm、37℃振荡培养45-60min。将离心管中的菌液混匀,吸取200μl加到含氨苄青霉素的lb固体琼脂培养基上,用无菌的弯头玻棒或玻璃珠轻轻的将细胞均匀涂开。待平板表面干燥后,倒置平板,37℃培养12-16h。
[0107]
3、将得到的白色菌落接种1-5ml 2
×
yt(含有终浓度为50-100μg/ml的氨苄青霉素)培养基,37℃摇床振荡培养过夜,将菌液送测序,确定序列信息。
[0108]
4、通过测序获得5个沙丁胺醇的vh和vl的序列,分别构建成5条scfv(sal-1-scfv、sal-2-scfv、sal-3-scfv、sal-4-scfv和sal-5-scfv,氨基酸序列分别如seq id no:3-7所示),便于后续研究。
[0109]
表3 ta克隆反应体系
[0110][0111]
注:pgm-t fast vector结构见图5。
[0112]
实施例9单个浆细胞来源的兔scfv的表达和鉴定
[0113]
1、将实施例8中构建的scfv连接到pjb33表达载体中,在无菌条件下纯水透析30min,将50μl rv308的电化学感受态(美国标准生物品收藏中心)从-80℃超低温冰箱中取出,置于冰上融化,将透析后的产物加入rv308感受态细胞中,轻轻混匀,转移至洁净、干燥、预冷的点击转化杯中,进行电击转化。电击转化后立即加入950μl2
×
yt培养基重悬菌体,37℃,250rpm震荡培养1h。取100μl菌液涂布于含氯霉素的34μg/ml的2
×
yt平板,37℃倒置过夜培养。
[0114]
2、从静置过夜的平板上挑取单菌落,37℃,250rpm震荡培养1h后进行菌液pcr鉴定。
[0115]
3、将阳性菌落以1:100的比例接种到100ml 2
×
yt培养基中,8h后测菌液的od
600nm
值,od
600nm
值介于0.6-0.8时,进行iptg的过夜诱导表达(iptg终浓度为0.25mm)。诱导后的菌液在4℃10000rpm离心10min,将菌体沉淀进行超声破碎,收集超声后的上清,即为scfv的粗提液,进行sds-page分析(图6)。
[0116]
实施例10兔scfv的elisa鉴定
[0117]
取表达量最佳的sal-5-scfv粗提液进行梯度稀释,与相应包被原(sal-bsa)梯度稀释溶液进行棋盘elisa,选择od
450nm
=1.5-2.0的scfv的最大稀释倍数为抗体最佳工作浓度,相应的包被原浓度为包被原最佳工作浓度。在上述最佳工作浓度情况下进行scfv的elisa鉴定,评价其生物活性。用origin 8.5软件绘制四参数方程标准曲线,以ic
10
为检测限,以ic
20-ic
80
为限性范围(图7a),获得的沙丁胺醇sal-5-scfv的ic
10
为0.01ng/ml,ic
50
值为0.04ng/ml(亲和力约为1
×
10-12
m)。
[0118]
实施例11兔全抗的表达和鉴定
[0119]
1、将sal-5-scfv的vh和vl通过酶切连接的方法(所用酶ecorv和xho1)克隆到带有兔子恒定区序列的pfusess-chig-rg*03和pfuse2ss-clig-rk1的真核表达载体中,通过测序挑选阳性质粒。
[0120]
2、用无血清的cd培养基传代培养hek293细胞,将要表达的质粒与转染试剂tf2混合后加入细胞中,转染后第1、3、5天添加293无血清加料液。摇瓶培养条件:5%co2,温度37℃,摇床转速175rpm。反应器培养条件:ph7.2,温度37℃,搅拌转数150rpm,溶氧40%,收集培养液上清,进行后续抗体纯化。
[0121]
3、用5倍柱体积纯水以0.75ml/min流速清洗ni
2+
填充柱,5倍柱体积平衡缓冲液(50mm tris,150mm nacl,ph8.0)以0.75ml/min流速平衡介质,样品经过0.45μm滤膜过滤以0.5ml/min流速上样,300mm咪唑洗脱目的蛋白。
[0122]
4、纯化后的兔全抗与相应包被原(sal-bsa)梯度稀释溶液进行elisa优化试验,评
价其生物活性(图7b),ic
50
值为0.014ng/ml。
[0123]
实施例12兔单克隆抗体耐受性的鉴定
[0124]
1、盐离子耐受浓度测定:配制不同nacl浓度的抗体稀释液,nacl的终浓度分别为0、0.375、0.75、1.5、2.0、3.0、4.0、5.0以及6.0m,用该系列稀释液将抗体分别稀释至最佳工作浓度,其余步骤按实施例10操作,读取各孔od值并并计算ic
50
值(表4)。由表可见该抗体可以耐受3.0m的nacl,具有良好的盐离子耐受性能。
[0125]
表4抗体对盐离子的耐受性测定
[0126]
nacl浓度(m)od值ic
50
值ic
50
/od02.0120.050.0250.3751.8650.040.0210.751.7860.020.0111.51.8020.060.0332.01.6230.080.0493.01.5650.090.0584.01.2310.030.0245.01.0230.050.0346.00.9870.060.043
[0127]
2、甲醇耐受含量测定:配制不同甲醇含量的抗体稀释液,使甲醇的终浓度分别为0%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%和70%,用该系列稀释液将纳米抗体分别稀释至最佳工作浓度,其余步骤按实施例10操作,读取各孔od值并并计算ic
50
值(表5)。由表可知,该抗体的甲醇耐受性优良,可耐受50%以上的甲醇。
[0128]
表5抗体对甲醇的耐受性测定
[0129][0130][0131]
3、ph耐受范围测定:将抗体稀释液的ph分别调至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0和9.5。用该系列稀释液将抗体分别稀释至最佳工作浓度,其余步骤按实施例10操作,读取各孔od值并并计算ic
50
值(表6)。由表可见,该抗体的ph耐受性良好,在ph4.5-8.5之间表现出良好的耐受性。
[0132]
表6抗体对ph值的耐受性测定
[0133]
phod值ic
50
值ic
50
/od
4.01.4750.020.0144.51.8200.040.0225.02.1010.060.0295.51.9530.080.0416.01.9010.060.0326.51.9530.070.0367.01.9100.030.0167.52.1010.050.0248.01.7540.040.0238.51.6520.020.0129.01.2470.240.1919.51.2030.210.173
[0134]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1