一种拮抗水稻黄单胞菌的高地芽孢杆菌ST15及其应用的制作方法
本发明属于生物技术领域,具体地,涉及一种拮抗水稻黄单胞菌的高地芽孢杆菌st15及其应用。
背景技术:
水稻黄单胞菌(xanthomonasoryzae),包括水稻白叶枯病菌(xanthomonasoryzaepv.oryzae)和水稻细菌性条斑病菌(xanthomonasoryzaepv.oryzicola)两个致病变种,分别引起水稻白叶枯病(bacterialblight,bb)和水稻细菌性条斑病(bacterialleafstreak,bls),是我国水稻生产上的两种主要细菌病害,常年发生面积在1000~1500万亩,危害面积达500~800万亩,通常造成产量损失5%~10%,严重时达50%以上,甚至绝产。近年来,由于水稻轻简化种植模式推广,种质资源交换频繁,病原菌致病性变异等原因,导致两种细菌病害不仅继续在南方籼稻区流行为害,而且快速向我国长江流域籼粳混栽区及北方粳稻区扩展蔓延,对我国水稻安全生产构成严重威胁。目前,水稻细菌病害的防控主要依靠化学农药,包括三氯异氰尿酸、氯溴异氰尿酸、噻菌铜、噻霉酮、噻唑锌等。然而,化学农药的长期不合理使用导致病原菌抗药性逐渐增强,施用剂量盲目增加,防治效果不理想,对病害的综合防治效果在50%~70%,同时残留农药对食品安全和生态环境构成严重威胁。另外,由于开发安全、高效化学杀菌剂的成本高昂,投资风险巨大,近年来,登记用于防治作物细菌病害的新型化学杀菌剂很少。
近年来,具有相对安全、无残留、环境友好等优点的生物农药产业不断增长,成为国际绿色农药发展的重点。基于微生物的生物防控技术被认为是未来控制作物细菌病害的主要发展方向之一。芽孢杆菌(bacillusspp.)属于革兰氏阳性细菌,广泛分布于土壤、植物表面、水体、农业废弃物等各种生境中,具有广谱的抗菌活性、较高的芽孢产率和较强的逆境适应性,被认为是最具有应用开发潜力的有益微生物之一,例如解淀粉芽孢杆菌(bacillusamyloliquefaciens)、枯草芽孢杆菌(b.subtilis)、多粘类芽孢杆菌(b.polymyxa)、坚强芽孢杆菌(b.firmus)、蜡状芽孢杆菌(b.cereus)等,是一类被科学家和消费者广泛认可的对人体安全的生防微生物,目前我国含芽孢杆菌活性成分的杀菌剂登记产品达137个。
相对上述芽孢杆菌,关于高地芽孢杆菌(bacillusaltitudinis)防治作物病害的研究报道较少,且来源不同菌株的生物学特性、抗菌谱等存在明显差异,具有菌株特异性。发明专利cn105820981a公开了一株高地芽孢杆菌对桃褐腐病、灰霉病、软腐病及青霉病等多种真菌病害表现较好生防效果;发明专利cn108865946a公开了一株高地芽孢杆菌对番茄根结线虫具有较好的防治效果。研究能够对水稻白叶枯病和水稻细菌性条斑病具有防治效果的菌株具有重要意义。
技术实现要素:
本发明的目的是提供一种对水稻白叶枯病和水稻细菌性条斑病具有显著防治效果的高地芽孢杆菌st15及其应用。本发明的高地芽孢杆菌菌株具有生长速度快、拮抗活性强、生防效果好、对化学杀菌剂耐受性强,且具有促生和提高水稻抗旱特性。
为解决上述问题,本发明采取的技术方案如下:
本发明采用稀释涂布分离法和平板拮抗法从梨园根际土壤分离筛选获得一种对水稻白叶枯病菌和水稻细菌性条斑病菌均具有较强拮抗活性的生防菌株st15,采用菌落形态观察、菌体形态观察、生化指标和gyrb基因序列测定相结合的方法,将该菌株鉴定为高地芽孢杆菌(bacillusaltitudinis)。该菌株已于2020年6月28日保藏在中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),菌种保藏编号为cgmccno.20156。
高地芽孢杆菌菌株st15在na固体培养基平板上,28℃条件下培养48h后的菌落特征:单菌落为乳白色,扁平,圆形或近圆形,直径2.0mm~4.0mm,菌落表面皱缩,边缘整齐;其菌体形态为杆状,直径约0.5μm~0.6μm,长度约1.5μm~2.0μm,芽孢呈梭状。所使用的na固体培养基成分为:蛋白胨5g,蔗糖10g,酵母提取物1g,牛肉浸膏3g,琼脂粉15g,加水定容至1000ml,ph6.8~7.2,121℃条件下灭菌20min。
本发明采用室内na固体培养基平板生测法测定了高地芽孢杆菌st15对噻唑锌、噻霉酮、三氯异氰尿酸的耐受性。
本发明提供所述高地芽孢杆菌st15的发酵产物。本发明所述的发酵产物可以为本领域常规的任何一种发酵后的产物形式,例如包括但不限于可以为含有菌体的发酵液,也可以为过滤除菌后的无菌发酵滤液,或者为菌株发酵后提取获得的有效成分。
在本发明的一些实施例中,本发明提供所述高地芽孢杆菌st15的发酵液,此处的发酵液可以指含有菌体的发酵液;在本发明的另一些实施例中,本发明提供所述高地芽孢杆菌st15的无菌发酵滤液,可以指发酵液过滤除去菌体后的液体。
本发明还提供含有所述高地芽孢杆菌st15的菌悬液,可以是离心获得的菌体按照本领域常规方法和常规试剂重悬获得的溶液。
本发明还提供包含所述高地芽孢杆菌st15或高地芽孢杆菌st15发酵产物的生防菌剂。
本发明所述的发酵产物、发酵液、无菌发酵滤液、生防菌剂可以按照本领域常规的方法进行制备,例如将高地芽孢杆菌st15制备成种子液后,接种到发酵培养基中发酵获得发酵液;发酵液离心过滤后获得无菌发酵滤液;发酵液加入本领域允许的助剂后形成生防菌剂。
在一种具体的实施例中,本发明提供包含所述高地芽孢杆菌st15和/或高地芽孢杆菌st15发酵产物的生防菌剂的制备方法:
(1)活化培养:取本发明高地芽孢杆菌st15的甘油菌种,划线接种至新鲜na固体平板上,在26℃~30℃条件下培养24h~36h;
(2)种子液制备:挑取一个单菌落接种nb液体培养基中,26℃~30℃下振荡培养16h~24h,振荡频率为100r/min~200r/min;
(3)生防菌液的制备:将步骤(2)所得的种子液以1%~5%(v/v)的比列接种到40%~60%nb培养基中进行发酵,发酵温度为27℃~30℃,装料量为200~400ml/1000ml,培养基的初始ph为6.8~7.2,搅拌速度为100r/min~180r/min,发酵时间为48h~72h,经平板涂布法计数,发酵液菌体密度大于1.95×109cfu/ml;
(4)制备高地芽孢杆菌菌体悬浮液:将上述步骤(3)制备得到的st15发酵液离心10min~15min,去除上清,收集菌体,用无菌水悬浮菌体,并将菌体密度调整到1.0×107~1.0×109cfu/ml,添加总体积0.05%~0.15%(v/v)的吐温80;
(5)制备发酵液滤液:将上述步骤(3)制备得到的st15发酵液离心10min~15min,取上清,利用细菌过滤器过滤,得到无菌发酵滤液。
(6)生防菌剂的制备:在上述步骤(3)中制备的发酵液中添加本领域常规的助剂,将ph值调整到4~5,然后无菌灌装,室温保存。
本发明生防菌剂制备中常规的助剂可以按照本领域的常规方法进行选择,例如,本发明一种具体的实施例中,是添加表面活性剂脂肪醇聚氧乙烯醚,增稠剂黄原胶,消泡剂聚二甲氧基烷,防腐剂苯甲酸钠,在本发明的一些更具体的实施中,生防菌剂的制备中,助剂加入的质量百分比为脂肪醇聚氧乙烯醚1.0%~2.0%,黄原胶0.2%~0.3%,聚二甲氧基烷0.2%~0.5%,苯甲酸钠0.1%~0.15%。此处仅是对一种实施例的列举,但并不限于这种助剂添加方法,其他可以形成菌剂剂型的方案均可。
在本发明的一些实施中,50%nb培养基组分为:蛋白胨2.5g,蔗糖5g,酵母提取物0.5g,牛肉浸膏1.5g,加水定容至1000ml,ph6.8~7.2,121℃条件下灭菌20min。
在本发明的一些实施中,na固体培养基组分为:蛋白胨5g,蔗糖10g,酵母提取物1g,牛肉浸膏3g,琼脂粉15g,加水定容至1000ml,ph6.8~7.2,121℃条件下灭菌20min。
本发明所述高地芽孢杆菌st15发酵液无菌上清抗菌活性对高温、紫外线、胰蛋白酶、蛋白酶k、胃蛋白酶、酸碱环境的耐受性高。
本发明还提供所述高地芽孢杆菌st15或其发酵产物在浸种处理水稻种子,促进水稻生长或/和提高水稻幼苗抗旱中的应用。
本发明还提供所述高地芽孢杆菌st15、菌悬液、发酵产物、发酵液或无菌发酵滤液在促进水稻生长或/和提高水稻幼苗抗旱中的应用。
在一种实施例中,本发明所述的促进水稻生长的应用,具体为:在25℃~30℃条件下,利用本发明所述高地芽孢杆菌st15、菌悬液、发酵产物、发酵液或无菌发酵滤液处理水稻种子36h~48h。
在一种实施例中,本发明所述的提高水稻幼苗抗旱的应用,具体为:在25℃~30℃条件下,利用本发明所述高地芽孢杆菌st15、菌悬液、发酵产物、发酵液或无菌发酵滤液处理水稻种子36h~48h。
本发明的水稻种子处理,可以为浸泡处理,在一些实施例中,浸泡所用的液体高地芽孢杆菌st15的菌体密度可以为1.0×107~1.0×109cfu/ml。
本发明还提供所述高地芽孢杆菌st15、发酵产物、发酵液、无菌发酵滤液、菌悬液或所述生防菌剂在防治水稻白叶枯病和/或水稻细菌性条斑病中的应用。
在一种实施例中,本发明所述防治水稻白叶枯病的应用,具体为:在水稻感染白叶枯病菌前或水稻感染白叶枯病菌后喷雾处理。
在一种实施例中,本发明所述防治水稻细菌性条斑病的应用,具体为:在水稻感染细菌性条斑病之前或感染发生初期进行喷雾处理,间隔7~10d再喷施处理1~2次。
在一些具体的实施例中,喷雾处理所用液体中高地芽孢杆菌st15的菌体密度为1.0×107~1.0×109cfu/ml。
相对于现有技术,本发明的优点如下:
本发明提供的高地芽孢杆菌st15是一种新发现的芽孢杆菌生防资源,对水稻白叶枯病菌和水稻细菌性条斑病菌均具有较高的拮抗活性,对防治水稻细菌病害的化学杀菌剂表现较强耐受性;利用本发明制备的菌悬液处理水稻种子能够显著促进水稻生长和提高水稻幼苗的抗旱能力,利用本发明菌株制备的生防菌剂对水稻白叶枯病和水稻细菌性条斑病均表现较高生防效果,可以替代或减少化学农药用量,提高食品和生态环境安全,具有较好的经济和社会效益。
附图说明
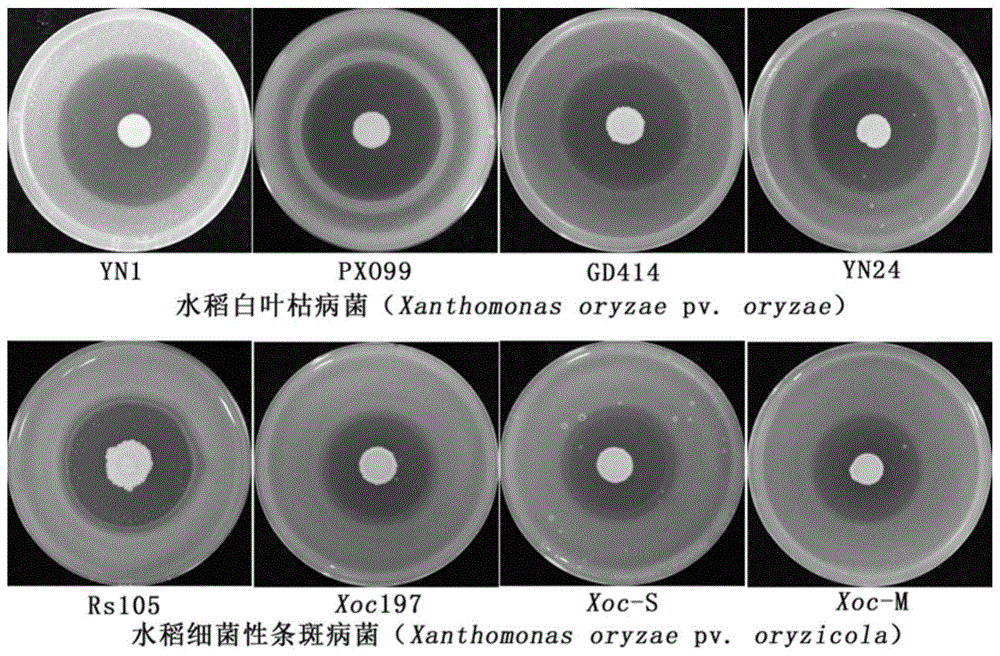
图1为1株初步鉴定的生防菌对水稻白叶枯病菌和细菌性条斑病菌的平板拮抗活性;
图2为1株初步鉴定的生防菌对水稻白叶枯病菌和细菌性条斑病菌的拮抗圈直径;
图3为高地芽孢杆菌st15在na培养基平板上的菌落、菌体及芽孢形态;
图4为基于高地芽孢杆菌st15的gyrb基因序列的进化树分析;
图5为高地芽孢杆菌st15在nb培养基中的生长动态;
图6为高地芽孢杆菌st15发酵液上清的抗菌活性及其稳定性分析;
图7为高地芽孢杆菌st15对3种化学杀菌剂的耐受性;
图8为高地芽孢杆菌st15对水稻的促生作用;
图9为高地芽孢杆菌st15对水稻芽和根的促生作用统计分析;
图10为高地芽孢杆菌st15显著提高水稻幼苗抗旱能力;
图11为高地芽孢杆菌st15菌悬液对水稻白叶枯病病斑扩展的抑制效果;
图12为高地芽孢杆菌st15菌悬液对水稻白叶枯病的防治效果。
具体实施方式
本发明所涉及的高地芽孢杆菌菌株st15,已于2020年6月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),分类命名为bacillusaltitudinis,菌种保藏编号为cgmccno.20156。本发明所用的水稻白叶枯病菌(xanthomonasoryzaepv.oryzae)菌株yn1、yn24、gd414、pxo99、水稻细菌性条斑病菌(xanthomonasoryzaepv.oryzicola)菌株rs105、xoc197、xoc-s、xoc-m均为本研究室保存菌株,其他单位或个人可以向本研究室索取以上8个病原细菌菌株。
以下实施例用于说明本发明,但并不限定于本发明。若无特殊说明,下述实施例中所用技术方法均为常规方法;若无特殊说明,下述实施例中所用实验材料,均为常规化学试剂和生化试剂。
以下所述的nb培养基组分为:蛋白胨5g,蔗糖10g,酵母提取物1g,牛肉浸膏3g,加水定容至1000ml,ph6.8~7.2,121℃条件下灭菌20min;na为固体培养基,为nb培养基添加琼脂粉15g/l。
以下所述的50%nb培养基组分为:蛋白胨2.5g,蔗糖5g,酵母提取物0.5g,牛肉浸膏1.5g,加水定容至1000ml,ph6.8~7.2,121℃条件下灭菌20min。
以下所述实施例仅为本发明部分较好的实施例,仅用于描述本发明,不能理解为对本发明范围的限制。应当指出的是,凡在本发明的精神和原则之内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
实施例1:
高地芽孢杆菌菌株st15的分离与鉴定
(1)待筛选菌种资源的分离:从梨园根际随机取土壤50g,共取10份土壤样品,混合均匀,取10g土壤放入含有20粒细玻璃珠和100ml灭菌去离子水的250ml锥形瓶中,置于摇床上150r/min、28℃条件下震荡培养1h。静置10min,取上清1ml,利用灭菌去离子水10倍梯度稀释,吸取100μl每个浓度梯度稀释液凃布于na固体平板,28℃条件下静置培养36h。利用接种环挑取单菌落在na固体培养基上划线纯化2次,将纯化的不同形态单菌落转接到na固体平板上,28℃条件下倒置培养48h,保存于4℃备用。
(2)生防菌株的平板拮抗筛选:将保存于na固体平板上纯化的各菌株在nb液体培养基中培养,培养条件为150r/min、28℃、36h,作为种子液备用;另外,将水稻白叶枯病菌yn1和水稻细菌性条斑病菌rs105的甘油菌种分别划线接种到na固体平板上,28℃条件下培养48h,然后挑取单菌落接种到含有50mlnb液体培养基的250ml锥形瓶中,150r/min、28℃条件下培养36h,将培养液(od600≈1.0)添加到液态的低温na琼脂培养基中,迅速混匀,制备na固体营养平板;将待测菌株种子液2μl点到制备的na固体营养平板上;将处理好的拮抗平板放置在28℃条件下培养48h,通过拮抗圈的直径评估待测定菌株对水稻白叶枯病菌yn1和水稻细菌性条斑病菌rs105的拮抗活性;然后,选取拮抗圈直径大于2.0cm的菌株,按照上述方法测定初选拮抗菌株对致病性不同的水稻白叶枯病菌yn24、pxo99、gd414和水稻细菌性条斑病菌xoc197、xoc-s、xoc-m的拮抗活性。结果发现,在测定的652个菌株中,编号为st15的菌株表现最好,其对4株水稻白叶枯病菌的拮抗圈直径为2.97cm~3.50cm,对4株水稻细菌性条斑病菌的拮抗圈直径为2.17cm~2.87cm,如图1和图2所示。每个菌株3个重复。
(3)生防菌株st15的形态观察:利用无菌接种环从4℃保存的st15平板上挑取菌体,在na固体平板上划线培养,培养条件为28℃、48h,单菌落为乳白色,扁平,圆形或近圆形,直径2.0mm~4.0mm,菌落表面皱缩,边缘整齐;挑取培养24h的菌体,利用透射电镜进行观察,菌体为杆状,直径约0.5μm~0.6μm,长度约1.5μm~2.0μm;从na固体平板上挑取48h的培养物,利用透射电镜进行观察,菌体大部分转化为芽孢,芽孢呈梭状,直径约0.5μm~0.6μm,长度约1.0μm~1.5μm,如图3所示。
(4)生防菌株st15的理化实验分析
生防菌株st15的理化实验分析结果如表1所示。
表1生防菌株st15的理化实验分析结果
(5)生防菌株st15的分子鉴定:利用灭菌牙签挑取st15单菌落于含有50mlnb液体培养基的250ml锥形瓶中,150r/min、28℃条件下培养36h,利用细菌基因组dna提取试剂盒提取st15的总基因组dna。利用细菌gyrb基因的通用引物up-1(5’-gaagtcatcatgaccgttctgcaygcnggnggnaarttyga-3’)和up-2r(5’-agcagggtacggatgtgcgagccrtcnacrtcngcrtcngtcat-3’)pcr扩增dna片段;利用测序引物up-1s(5’-gaagtcatcatgaccgttctgca-3’)和up-2sr(5’-agcagggtacggatgtgcgagcc-3’)对pcr产物进行测序,st15gyrb基因序列如seqidno.1所示。基于获得的gyrb基因序列和genbank数据库,利用mega7.0软件对st15进行进化树分析,该菌株与高地芽孢杆菌(bacillusaltitudinis)聚合在一起,如图4所示。
基于上述菌落形态、菌体形态、芽孢形态、理化实验分析和分子鉴定结果,生防菌株st15属于高地芽孢杆菌(bacillusaltitudinis)。
实施例2:
高地芽孢杆菌st15在nb培养基中的生长动态
从-70℃超低温冰箱取出甘油保存的st15菌株,划线接种到na固体平板上,28℃条件下培养36h;利用灭菌牙签挑取st15单菌落接种到含有50mlnb液体培养基的250ml锥形瓶中,150r/min、28℃条件下培养36h,作为种子液;将种子液按照1%(v/v)的比例接种到含有50mlnb液体培养基的250ml锥形瓶中,180r/min、28℃条件下培养84h,于接种后每间隔6h测定1次发酵液的吸光值(od600)。于接种后60h测定菌体密度,具体方法:在上述时间点取样,利用灭菌水进行10倍梯度稀释,吸取100μl每个浓度梯度稀释液涂布于na固体平板,28℃条件下培养48h进行菌落计数;于接种后60h调查芽孢形成密度,具体方法:于上述时间点取样,80℃热水浴30min,然后利用灭菌水进行10倍梯度稀释,吸取100μl每个浓度梯度稀释液涂布于na固体平板,28℃条件下培养48h进行菌落计数。结果发现,接种后60h时发酵液的od600吸光值达到最高6.984,如图5所示;接种后60h时菌体密度达到3.08×109cfu/ml,接种后60h时芽孢密度达到1.31×109cfu/ml。每个处理三个重复。
实施例3:
高地芽孢杆菌st15发酵液上清的抗菌活性及其稳定性分析
按照上述实施例2的方法制备生防菌st15的种子液,以2%(v/v)的比例接种到含50ml50%nb培养基的250ml锥形瓶中,28℃、150r/min条件下振荡培养,于接种后48h测定发酵次生代谢产物的抗菌活性,具体方法:于上述时间点收集样品,10,000g离心15min,利用0.22μm细菌过滤器过滤除菌,取1ml无菌滤液分装与1.5ml无菌离心管中,贮藏于-70℃备用。为了测定st15次生抗菌物质的稳定性,分别按照下述方法处理无菌滤液,具体为:(1)取分装的无菌滤液,分别85℃水浴处理30min、100℃水浴处理5min;(2)取分装的无菌滤液,分别利用终浓度为100μg/ml的胰蛋白酶、蛋白酶k、胃蛋白酶,37℃水浴处理6h;(3)取5ml无菌滤液,放入无菌培养皿,打开皿盖,置于超净工作台25w紫外灯下60cm处,垂直向下照射处理1h;(4)将5ml无菌发酵液于10ml离心管,分别调ph值至3.0、5.0、7.0、9.0、11.0,室温放置1h,再将ph值调至7.0,最后用0.22μm细菌过滤器过滤。将水稻细菌性条斑病菌rs105培养液(od600≈1.0)按照1%(v/v)的比例添加到液态的低温na培养基中,迅速混匀,制备na固体营养平板;待平板凝固后,在平板中心利用灭菌打孔器打1个孔,孔径4mm,每孔添加上述不同处理的无菌发酵滤液30μl,28℃条件下培养48h。以未处理的无菌发酵滤液为对照,每个处理3个重复。结果发现,在上述不同处理条件下,无菌发酵滤液的抗菌活性表现稳定,与未处理对照无明显差异,如图6所示。
实施列4:
高地芽孢杆菌st15对3种化学杀菌剂的耐受性
噻唑锌、噻霉酮和三氯异氰尿酸是目前生产上防治水稻白叶枯病和水稻细菌性条斑病的三种主要化学杀细菌剂。本实验在室内测定了高地芽孢杆菌st15对三种化学杀菌剂的耐受性,并以水稻细菌性条斑病菌rs105为对照,具体方法如下:首先,分别将噻唑锌和噻霉酮溶于dmso,配置20mg/ml噻唑锌和6.4mg/ml噻霉酮母液;将三氯异氰尿酸溶于无菌水,配置7.1mg/ml母液;然后,分别制备噻唑锌终浓度为0μg/ml、8μg/ml、16μg/ml、32μg/ml的na固体平板,噻霉酮终浓度为0μg/ml、0.125μg/ml、0.25μg/ml、0.5μg/ml的na固体平板,三氯异氰尿酸终浓度为0μg/ml、64μg/ml、128μg/ml、256μg/ml的na固体平板。将高地芽孢杆菌st15培养液(od600≈1.0)和水稻细菌性条斑病菌rs105培养液(od600≈1.0)分别稀释5倍、25倍、125倍,分别将st15和rs105原液及各浓度稀释液2μl点在上述含杀菌剂的na固体平板上,28℃条件下培养48h。结果发现,相比于水稻细菌性条斑病菌rs105,高地芽孢杆菌st15对三种化学杀菌剂表现较强的耐受性,如图7所示。本发明所述高地芽孢杆菌st15对3种化学杀菌剂的耐受性使之可以与化学杀菌剂联合使用。
实施例5:
高地芽孢杆菌st15对水稻的促生试验
按照上述实施例2的方法制备st15种子液,将st15种子液按照1%(v/v)的比例接种到含50ml50%nb液体培养基的250ml锥形瓶中,180r/min、28℃条件下培养48h;将上述制备得到的st15发酵液在10,000r/min下离心10min,去除上清,收集菌体,用无菌水悬浮菌体,并将菌体密度调整到1.0×108cfu/ml左右,添加终浓度为0.1%(v/v)的吐温80;在25℃~30℃条件下,利用上述高地芽孢杆菌st15菌悬液浸泡处理水稻种子36h,捞出后放在铺垫滤纸片的培养皿上,在28℃条件下保湿催芽72h,然后测定发芽率、芽长和根长。以无菌水浸种处理为对照,每个处理浸种处理120粒种子。结果发现,与无菌水对照相比,st15菌悬液能够既显著的促进水稻根生长(p<0.01),显著地促进芽生长,但两个处理的种子萌发率无差别,如图8和图9所示。
实施例6:
高地芽孢杆菌st15能够提高水稻幼苗的抗旱能力
按照上述实施例2的方法制备st15种子液,将st15种子液按照1%(v/v)的比例接种到含50ml50%nb液体培养基的250ml锥形瓶中,180r/min、28℃条件下培养48h;将上述制备得到的st15发酵液在10,000r/min下离心10min,去除上清,收集菌体,用无菌水悬浮菌体,并将菌体密度调整到1.0×108cfu/ml左右,添加终浓度为0.1%(v/v)的吐温80;在25℃~30℃条件下,利用上述高地芽孢杆菌st15菌悬液浸泡处理水稻种子36h,捞出后放在铺垫滤纸片的培养皿上,在28℃条件下保湿催芽48h,然后室温放置120h,观察水稻幼苗叶片和根系的生长势。结果发现,室温放置120h后,培养皿内的滤纸片变得比较干燥,水稻幼苗干旱缺水,此时无菌水处理水稻种子萌发的幼苗根系稀少,芽瘦弱,无展开叶片,干旱显著限制了幼苗生长;st15菌悬液处理水稻种子萌发的幼苗根系较多,幼苗处于1叶或1叶1心期,幼苗表现较强的抗旱能力,如图10所示。
实施例7:
高地芽孢杆菌st15菌悬液对水稻白叶枯病的温室防治试验
从-70℃超低温冰箱取出甘油保存的水稻白叶枯病菌菌株pxo99,划线接种到na固体平板上,28℃条件下培养48h;利用灭菌牙签挑取pxo99单菌落接种到含有50mlnb液体培养基的250ml锥形瓶中,150r/min、28℃条件下培养48h,利用无菌水将菌体浓度调整到1.0×108cfu/ml左右,添加终浓度为0.1%(v/v)的吐温80,作为病原菌种子液。按照上述实施例2的方法制备st15种子液,将st15种子液按照1%(v/v)的比例接种到含有50ml50%nb液体培养基的250ml锥形瓶中,180r/min、28℃条件下培养48h;将上述制备得到的st15发酵液在10,000r/min下离心10min,去除上清,收集菌体,用无菌水悬浮菌体,并将菌体密度调整到1.0×108cfu/ml左右,添加终浓度为0.1%(v/v)的吐温80,作为生防菌菌悬浮液。
选取分蘖末期的感病水稻品种ir24,设置3个生防试验处理:处理1,首先喷施1.0×108cfu/ml的st15生防菌菌悬液,24h后剪叶接种水稻白叶枯病菌pxo99种子液,标记为st15+pxo99;处理2,首先剪叶接种水稻白叶枯病菌pxo99种子液,24h后喷施1.0×108cfu/ml的st15生防菌菌悬液,标记为pxo99+st15;处理3,剪叶接种水稻白叶枯病菌pxo99种子液,标记为pxo99,作为对照处理。每个处理接种10株水稻,每株剪叶接种上部2张叶片,接种后14天调查病斑长度。结果发现,相对于仅接种病原菌pxo99的对照处理,生防处理1和处理2的叶片病斑长度均显著下降(p<0.05),分别下降60.2%和51.1%,但两个生防处理之间差异不显著(p>0.05),如图11和图12所示。
实施列8:
高地芽孢杆菌st15生防菌剂制备及其对水稻细菌性条斑病菌的防治
取本发明高地芽孢杆菌st15的甘油菌种,划线接种到na固体平板上,28℃条件下培养36h;利用灭菌牙签挑取st15单菌落接种到含有50ml50%nb液体培养基的250ml锥形瓶中,180r/min、28℃条件下培养16h,作为种子液;将种子液以2%(v/v)的比列接种到装有200ml50%nb培养基德1000ml锥形瓶中,180r/min、28℃条件下培养48h。在发酵液中添加脂肪醇聚氧乙烯醚1.0%,黄原胶0.2%,聚二甲氧基烷0.3%,苯甲酸钠0.1%,利用稀盐酸将ph值调整到4.5左右,即为st15生防菌剂,然后无菌分装,室温保存。
生防菌剂在防治水稻细菌性条斑病中的应用方法:将生防菌剂稀释40~60倍,在水稻细菌病条斑病的发生初期进行喷雾处理,间隔7~10d再喷施1次,可取得良好的防治效果。
应用案例:
于2020年度,利用st15生防菌剂进行田间防治水稻细菌性条斑病小区试验,考察其试验剂量下对水稻细菌性条斑病防治效果,试验设置4个处理:st15生防菌剂667ml/亩、st15生防菌剂1000ml/亩、3%噻霉酮悬浮剂100ml/亩、清水对照,每亩用水40kg,均匀喷雾。水稻品种为c两优0861,于8月7日(水稻孕穗期)调查见病。于8月10日第1次施药并调查病情基数,8月19日第2次施药,于第2次用药后第11d调查病情指数,统计分析防治效果。结果如表2所示,第2次用药后第11d,st15生防菌剂1000ml/亩剂量的防效为63.8%,与化学药剂3%噻霉酮悬浮剂的防效相近(66.2%);st15生防菌剂667ml/亩剂量的防效为55.1%。
表2st15生防菌剂防控水稻细菌性条斑病田间试验结果
上述实施例说明本发明涉及的高地芽孢杆菌菌株st15对水稻白叶枯病菌和水稻细菌性条斑病菌具有较强的拮抗活性,对水稻具有促生和提高抗旱能力的特性,对防治水稻细菌病害的3种主要化学杀菌剂具有较强耐受性,对水稻白叶枯病和水稻细菌性条斑病具有较好的防控效果,可以替代或减少化学农药使用量,提高食品和生态环境安全,具有良好的开发应用前景。
序列表
<110>江苏省农业科学院
<120>一种拮抗水稻黄单胞菌的高地芽孢杆菌st15及其应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>930
<212>dna
<213>高地芽孢杆菌(bacillusaltitudinis)
<400>1
tacggtgcgtgctagtcgacggcagcggttataaagtatctggcggtctgcatggtgtag60
gggcatctgttgttaatgcgttatctacgaccttagacgtgaccgtataccgtgatggaa120
aaattcattaccagcaattcaaacgcggcgttccagttggagatttagaggtcattggtg180
aaacagatgtaacagggacaacgactcattttgtgccagatccagaaattttcactgaaa240
ccattgaatttgattacgacacacttgctaaccgtgtacgtgagttagctttcttaacaa300
aaggcgtcaacatcatcattgaagacttacgtgaaggcaaagagcgaagaaacgaatact360
gctatgaaggcggtattaagagctatgtagaacatttgaatcgctcgaaggaagtcgttc420
atgaagaaccagtttacatcgagggtgaaaaagacggaatcaccgttgaagtggcactgc480
aatacaacgattcctatacaagcaatatttattctttcgccaacaacatcaacacatatg540
aaggcggaacacacgaagctggctttaaaaccggtctgacgcgtgtcatcaatgattatg600
ctcgtaaaaatggcgtattcaaagatggagactcgaatttgagcggtgaagatgtacgag660
aaggcttaacagccattatctctatcaaacatccagaccctcaattcgaaggacaaacga720
agacaaagctcggtaactcagaagcaagaaccattaccgactccctcttctccgaagcac780
ttgagaaattcctcttagagaaccctgatgctgcaaagaaaattgtggagaaaggtgtga840
tggcagctcgtgcaagaatggcctgccaaaaaaggcacgtgagctgacaagacgtaaaag900
tgcactggaagtctctagcttgcctgcaaa930
- 还没有人留言评论。精彩留言会获得点赞!