LENG8作为mRNA转录调控蛋白及线粒体活性调控蛋白的应用的制作方法
leng8作为mrna转录调控蛋白及线粒体活性调控蛋白的应用
技术领域
[0001]
本发明属于生物医药技术领域,具体涉及leng8作为mrna转录调控蛋白及线粒体活性调控蛋白的应用。
背景技术:
[0002]
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
[0003]
在真核生物中,遗传信息从dna到蛋白质的流动需要rna转录和随后的 mrna处理的正确配对,包括5'端帽化、剪接、3'端裂解、聚腺苷酸化以及rna 出核等步骤。当新生的pre-mrna从rna聚合酶ii(rnapii)中出现时,它被包装在信使核糖核酸(mrnp)中,其最佳配置对于正常的pre-mrna加工和mrna 输出至关重要。mrnp的生物发生受到tho复合物的严格调控,并且从无论酵母还是哺乳动物,上述调控作用都是高度保守的。在酵母中,tho复合物由四个紧密相互作用的亚基——hpr1、tho2、mft1和thp2组成。上述四种亚基中任意一种的突变或缺失都会导致mrna出核的缺陷;因此,tho复合物在mrna 加工过程中发挥着重要的作用。
[0004]
此外,核心的tho复合物与两个额外的输出因子——aly/yra1和rna依赖的atp酶sub2/uap56通过物理结合,并将它们召集到新生的mrna上,形成一个更大的rna-蛋白复合物,称为trex(转录输出)。除trex外,trex-2 被证实是另一种参与调控mrna加工的蛋白复合物,由thp1、sac3、sus1和 cdc31组成。与tho复合物相似,酵母中trex-2组分的缺失也会导致mrna 输出缺陷。tho复合物主要与活性染色质相关,trex-2复合物作用则不相同,主要位于核外周,处于mrna加工的相对下游阶段,与核孔复合物相关。目前,通过生物化学和遗传分析研究,除了tho和trex-2复合物外,还发现了一些其他蛋白作为mrna处理的中介,包括连接tho和trex-2复合物的mex67 和mtr2。
[0005]
无论酵母还是人类,trex和trex-2复合物在基因中的表达是高度保守的。tho亚基hpr1、tho2和tex1的人类同源体相应的被命名为thoc1、thoc2 和thoc3。然而,人类的tho还有另外三个亚基thoc5、thoc6和thoc7,它们没有酵母同源物。此外,与酵母菌中的yra1一样,值得注意的是,人类同源物thoc4/alyref也对mrna的成熟起着重要的调节作用。然而,在哺乳动物细胞中,mrna的加工过程是如何实现精确调控的,目前仍然不明确。
技术实现要素:
[0006]
本发明首先通过生物信息学比对,确定leng8是thp3的哺乳动物同源蛋白,进一步明确了leng8能够与mrna结合,与mrna的加工机制相关,具有调节mrna输出的作用。并且,leng8优先结合编码线粒体定位蛋白的 mrna,对于维持线粒体形态和功能具有重要作用。本发明的研究揭示了一种保守进化的mrna加工机制,及其控制线粒体活动的方式。
[0007]
根据上述研究结论,本发明提供以下技术方案:
[0008]
本发明第一方面,提供leng8和/或leng8蛋白复合物作为mrna转录调控蛋白的应用。
[0009]
目前,本领域通过遗传及生物化学的方法,已经明确了诸多mrna的加工过程中的调控因子,其中一些通过识别和鉴定在哺乳动物中找到了对应因子。然而,哺乳动物细胞对mrna的加工过程是如何被调节的仍然是知之甚少。现有研究已经证实了thp3-csn12蛋白复合物在酵母中负责调节转录延伸和mrna成熟,但其具体机制以及在哺乳动物中是否存在同源蛋白尚不清楚。本发明的发现确定了leng8-pcid2复合物,是哺乳动物thp3-csn12的同源物。leng8是一种新型的mrna加工调控因子,它与mrna的加工机制相结合,并调控mrna 的输出。进一步的,leng8优先结合编码线粒体定位蛋白的mrna,其活性是维持线粒体形态和功能所必需的。
[0010]
基于上述发现,本发明第二方面,提供leng8作为线粒体活性调控蛋白的应用。
[0011]
本发明研究表明leng8是线粒体活性的基础,这与liu y.et al.在c.elegans 研究中,线虫中leng8/thp3的同源基因hpo-10是线粒体未折叠蛋白反应的候选调控因子的发现是一致的。此外,还发现thoc-1在其反遗传筛选中调控 mitoupr。总的来说,这些发现表明,trex/t介导的mrna成熟在不同物种的线粒体稳态调节中发挥了重要作用。
[0012]
本发明第三方面,提供一种药物组合物,所述药物组合物包括leng8抑制剂或leng8激动剂。
[0013]
以上一个或多个技术方案的有益效果是:
[0014]
本发明研究结果表明,leng8调控的mrna加工在维持线粒体活性中发挥重要作用。虽然线粒体有自己的基因组,但大多数构成线粒体的蛋白质是由核基因编码的,本领域目前虽然广泛认同线粒体的功能是由核基因的表达控制的。然而,据发明人所知,本发明的结论首次将核基因mrna的成熟过程与线粒体活性的调节进行联系,为上述观点提供的相应的支撑。
附图说明
[0015]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0016]
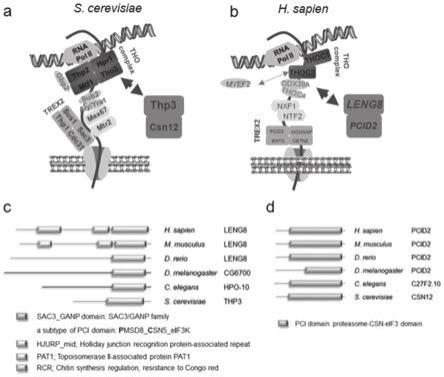
图1为实施例1中所述leng8和pcid2同源物鉴定结果图;
[0017]
其中,图1a为酵母中thp3-csn12复合物位点示意图;
[0018]
图1b为哺乳动物中leng8位点示意图;
[0019]
图1c为thp3在哺乳动物、果蝇和线虫中的同源基因位点示意图;
[0020]
图1d为cpe结构域的氨基酸序列相似性比对结果。
[0021]
图2为实施例1中所述leng8也与pcid2关系验证结果图;
[0022]
图2a为flag-leng8的免疫共沉淀结果图;
[0023]
图2b为生物素标记的寡聚-dt和链锁亲和素偶联珠纯化poly(a)rnp复合物并进行western blot分析结果;
[0024]
图2c为poly(a)mrna的荧光原位杂交(fish)分析结果;
[0025]
图2d为shrnas抑制leng8海拉细胞fish分析结果;
[0026]
图2e为pcid2抑制的海拉细胞fish分析结果;
[0027]
图2f为leng8+/-成纤维细胞的fish分析结果。
[0028]
图3为实施例1中leng8与mrna加工因子相关性研究结果;
[0029]
图3a为flag peptide洗脱物质谱分析结果图;
[0030]
图3b为leng8富集的243个蛋白功能饼图;
[0031]
图3c为leng8关联剪接体条形图;
[0032]
图3d为leng8相关mrna功能分布图;
[0033]
图3e为leng8还与trex/tho复合物相互作用靶点图。
[0034]
图4为实施例1中leng8是否是tho复合物的潜在关联蛋白验证结果图;
[0035]
图4a为flag-leng8的颗粒分数western blot检测结果图;
[0036]
图4b为rnase孵育后leng8与thoc1的western blot检测结果;
[0037]
图4c为rnase孵育后leng8与thoc5的western blot检测结果;
[0038]
图4d为leng8与thoc1、alyref和thoc5共定位结果图。
[0039]
图5为实施例1中leng8和thoc1结合的rna类型的特异性结果图;
[0040]
其中,图5a为leng8和thoc1相关基因重合数量图;
[0041]
图5b为thoc1与leng8 rnas定位重合度图;
[0042]
图5c为leng8丰富rna分类图;
[0043]
图5d为leng8丰富rna分类图;
[0044]
图5e为leng8富集相关rna分布条形图;
[0045]
图5f为leng8富集相关rna分布条形图;
[0046]
图5g为homer基序分析结果。
[0047]
图6为实施例1中所述leng8相关mrna测定结果;
[0048]
其中,图6a为vdac1和vdac2与leng8、thoc1的结合量示意图;
[0049]
图6b为置信结果散点图;
[0050]
图6c为leng8与thoc1丰富rna分类情况;
[0051]
图6d为不同类型的海拉细胞核及细胞中相关mrna的表达情况。
[0052]
图7为实施例1中所述leng8于线粒体活性测定结果;
[0053]
图7a为leng8缺陷的海拉细胞中ros生成结果;
[0054]
图7b为leng8缺陷的海拉细胞中线粒体损伤测定结果;
[0055]
图7c为线粒体染色的共聚焦显微镜成像;图7d为leng8敲低的hela细胞的耗氧率检测结果图;图7e为leng8敲除的hela细胞的耗氧率检测结果图。
具体实施方式
[0056]
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
[0057]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包
括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
[0058]
正如背景技术所介绍的,现有研究证实了thp3在酵母中发挥调节mrna转录、延伸及mrna成熟的作用,目前尚不明确其具体调节机制,以及在哺乳动物是否存在thp3的同源蛋白,为了解决如上的技术问题,本发明首先通过生物信息学技术确定了leng8是thp3在哺乳动物中的同源蛋白,与mrna的加工机制紧密相关,并且对于维持线粒体的活性具有重要意义。
[0059]
本发明第一方面,提供leng8和/或leng8蛋白复合物作为mrna转录调控蛋白的应用。
[0060]
优选的,所述leng8蛋白复合物包括但不限于leng8-pcid2复合物及 leng8-trex/tho复合物。
[0061]
进一步的,所述leng8-trex/tho复合物包括但不限于leng8-thoc1、 leng8-thoc2、leng8-alyref或leng8-ddx39b蛋白复合物。
[0062]
优选的,所述应用中,leng8作为mrna转录延伸及核输出激动剂。
[0063]
本领域公知,mrna转录作用对于真核生物的生理机能及遗传信息的传达具有重要的意义。依据上述应用,本领域技术人员可以依据常规研究思路将其转化为能够工业化的技术方案,如通过抑制病灶组织细胞中的leng8的表达从而抑制对病灶组织的发展,实现治疗作用;另一方面,还可以通过增加病灶组织中 leng8的表达实现对病灶组织中受损细胞的修复作用。
[0064]
本发明第二方面,提供leng8作为线粒体活性调控蛋白的应用。
[0065]
根据本发明研究结论,leng8敲除导致哺乳细胞中自噬相关因子增加,同时线粒体损伤增加。基于该研究结论,本领域技术人员可依据临床治疗需求选择上调或下调病灶组织中leng8的表达含量。
[0066]
该方面中,本发明优选的,提供leng8作为自噬抑制剂的应用。
[0067]
优选的,本发明还提供leng8抑制剂作为线粒体修复制剂的应用。
[0068]
本发明第三方面,提供一种药物组合物,所述药物组合物包括leng8抑制剂或leng8激动剂。
[0069]
优选的,所述leng8抑制剂为包括但不限于用于抑制leng8蛋白本身、抑制leng8上游合成通路的物质;进一步的,所述物质可能是化学实体小分子,还可能是核酸或基于基因工程手段对leng8表达具有抑制作用的物质。通过抑制病灶组织细胞中leng8的表达,从而抑制病灶组织细胞的增殖行为。
[0070]
上述优选的技术方案的一些具体实施方式中,所述药物组合物为抗肿瘤药物。所述leng8抑制剂应用于抗肿瘤药物的开发,一方面通过抑制肿瘤细胞中遗传物质的转录从而阻断其增殖行为,同时还可以通过激活肿瘤细胞中自噬相关通路促进肿瘤细胞自噬作用。
[0071]
上述优选的技术方案的一些具体实施方式中,所述药物组合物为抗炎药物。所述leng8抑制剂应用于抗炎药物的开发,通过阻断炎性细胞的增殖而降低炎性组织对正常组织的侵袭、浸润等作用。
[0072]
优选的,所述leng8激动剂为包括但不限于用于合成leng8蛋白本身、激动leng8上游合成通路的物质;进一步的,所述物质可能是化学实体小分子,还可能是核酸类物质或基
于基因工程手段对leng8表达具有抑制作用的物质。
[0073]
在上述优选的技术方案的一些具体实施方式中,所述药物组合物为修复氧化应激损伤的药物。
[0074]
优选的,所述leng8抑制剂或leng8激动剂还包括对leng8复合物具有抑制或激动作用的物质。
[0075]
优选的,所述药物组合物中,还包括其他具有治疗活性的物质。
[0076]
进一步优选的,所述其他治疗活性成分包括但不限于抗肿瘤活性成分、抗炎活性成分,抗氧化应激成分和/或提高免疫力成分。
[0077]
优选的,所述药物组合物中,还包括辅料。
[0078]
上述优选的技术方案中,所述药物组合物中,所述leng8抑制剂或leng8 激动剂占活性药物总量的1~99%,所述药物组合物为适合单次施予精确剂量的单位剂型。
[0079]
在其它实施方式中,所述leng8抑制剂或leng8激动剂的量在约 0.001mg/kg体重/天-约1000mg/kg体重/天的范围内。
[0080]
在其它实施方式中,所述leng8抑制剂或leng8激动剂的量的范围为约 0.5mg/kg体重/天-约50mg/kg体重/天。
[0081]
在一些实施方式中,所述leng8抑制剂或leng8激动剂的量为约0.001g/天
-ꢀ
约7g/天。
[0082]
在其它实施方式中,所述leng8抑制剂或leng8激动剂的量为约0.002g/天
-ꢀ
约6g/天。
[0083]
在其它实施方式中,所述leng8抑制剂或leng8激动剂的量为约0.005g/天
-ꢀ
约5g/天。
[0084]
在其它实施方式中,所述leng8抑制剂或leng8激动剂的量为约0.01g/天
-ꢀ
约5g/天。
[0085]
在其它实施方式中,所述leng8抑制剂或leng8激动剂的量为约0.02g/天
-ꢀ
约5g/天。
[0086]
在其它实施方式中,所述leng8抑制剂或leng8激动剂的量为约0.05g/天
-ꢀ
约2.5g/天。
[0087]
在其它实施方式中,所述leng8抑制剂或leng8激动剂的量为约0.1g/天-约 1g/天。
[0088]
在其它实施方式中,低于上述范围下限的剂量水平可能已经是足够的。
[0089]
在其它实施方式中,可能需要高于上述范围上限的剂量水平。
[0090]
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
[0091]
实施例1
[0092]
一、材料与方法
[0093]
1、构建体和抗体
[0094]
用于leng8,pcid2,thoc1,thoc2,thoc3,thoc5,thoc6,thoc7 过表达的核苷酸序列是nm_052925.3,bc016614,bc010381,nm_001081550.1, nm_032361.3,nm_003678.4,nm_001142350.1和nm_025075。3。所有这些构建体均购自北京中生物学。
kcl,5mm mgcl
2
、25mm edta,0.5%(v/v) nonidet-p40、1mm二硫苏糖醇,蛋白酶抑制剂混合物(edta)中裂解(不含, beyotime)在100u ml-1rnase抑制剂(sangon)存在下于冰上静置30分钟,并通过在9000转和4℃下离心10分钟使澄清的裂解液溶解。将澄清的裂解物与终浓度为0.2ug ml-1的抗gfp孵育,并在4℃下连续轻柔旋转2小时进行结合反应。将反应混合物在4℃以2000
×
g离心5分钟以除去碎屑。chip级蛋白a/g磁珠用含有 25μmmedta,蛋白酶抑制剂的rip结合/洗涤缓冲液(50μmtris ph 7.4、150μmnacl,1μmmgcl
2
、0.05%(v/v)nonidet-p40)洗涤和100u ml-1rnase抑制剂 3次。将rna-蛋白质复合物的混合物添加到40μl的100%珠子中,然后在4℃的转轮上进行过夜的结合,然后用rip结合/洗涤缓冲液洗涤五次。然后将珠子重悬于 trizol(invitrogen)中,并根据制造商的说明分离rna。每个诱饵平行进行两次 rna免疫沉淀。在遗传分析仪(安捷伦)上评估rna质量,并由联川生物技术公司(浙江杭州)进行truseq rna库的构建和下一代测序。所有样品均在illuminahiseq2500平台上测序,每个样品1500万个100bp单读。在对测序文库进行质量控制后,使用tophat2对读数进行修整并针对ensembl基因组注释和人类基因组装配(hg19/grch38)进行定位。删除了映射到核糖体rna或线粒体基因组的读段。使用来自袖扣包装的袖扣,通过对ensembl基因组注释的差异定量(诱饵高于对照)鉴定了与thoc1或leng8结合的rna。倍数变化>2,fdr校正的p值 <0.01和最小读取计数10的rna被认为是富集的。为了发现thoc1和leng8对于不同rna种类的偏好,本实施例从ensembl注释中提取了rna类型和基因模型相关特征,并使用自定义脚本对其进行了绘制。
[0107]
6、亲和纯化
[0108]
为了用生物素标记的mrna进行亲和纯化,将hela细胞沉淀并在等体积的ap 裂解缓冲液(10mm hepes ph 7.0、150mm kcl,5mm mgcl
2
、25mm edta, 0.5%(v/v)nonidet中裂解-p40,1μmm二硫苏糖醇,蛋白酶抑制剂混合物(无 edta,beyotime)在100uml-1 rnase抑制剂(sangon)存在下于冰上放置30min,并在9000g和4℃下离心澄清裂解液10分钟将澄清的裂解物与生物素缀合的 oligo-dt(25)或非生物素缀合的对照寡聚dt(终浓度为5μm)孵育,并在4℃下连续轻柔旋转2小时进行结合反应。将反应混合物在4℃以2000
×
g离心5分钟以除去碎屑。链霉亲和素亲和磁珠用含有25μmmedta,蛋白酶抑制剂和100μmuml 的ap结合/洗涤缓冲液(50μmmtris ph 7.4、100μmm nacl,1μmmmgcl2、0.02% (v/v)nonidet-p40)洗涤-1rnase抑制剂3次。将rna-蛋白质复合物的混合物添加到20μl的100%珠子中,然后在4℃的转轮上进行过夜的结合,然后用ap结合 /洗涤缓冲液洗涤五次。将涂有rna蛋白的珠子在50μl1 x sds上样缓冲液中煮沸,然后进行sds-聚丙烯酰胺凝胶电泳和western blot分析。
[0109]
7、leng8复合物的串联亲和纯化
[0110]
如下进行串联亲和纯化策略以从hela细胞中分离leng8复合物。获得了能够表达zz-leng8-3xflag的稳定细胞系。因此,使细胞在具有10%fbs加1%p/s 的dmem中生长,并在接近汇合时收获。用冷的pbs洗涤细胞沉淀3次,然后在等体积的tap裂解缓冲液(50μmmtris-cl ph 7.4、100μmm kcl,5μmmmgcl
2
、 25μmm edta,0.5%(v/v)nonidet中裂解-p40,1μmm二硫苏糖醇,蛋白酶抑制剂混合物(无edta,beyotime)在冰上放置30分钟,匀浆以10,000x g离心20 分钟,将上清液转移至新的试管中,然后加入50μl包装的igg将珠子加入到4mg 蛋白提取物中,然后在4℃温和旋转过夜,然后用50mm kcl的tap裂解缓冲液洗涤3
次,结合的蛋白通过tev蛋白酶切割洗脱,并进一步通过抗flag纯化含有 flag肽的flag珠的最终洗脱液通过sds/page在4
–
12%的梯度凝胶上分离,并通过银染显色,切掉特定的条带并进行质谱分析。使用qiagen的创造力路径分析(qiagen的inge nuity路径分析,ingenuity systems,http://www.qiagen.com/ingenuity,版本52912811)。
[0111]
8、核质分离,rna分离和测序。
[0112]
用冷pbs洗涤细胞,然后在-20℃下孵育5分钟。随后,加入含有10mm hepes (ph 7.9),1.5mm mgcl
2
、10mm kcl,0.5mm二硫苏糖醇(dtt)和1mm pmsf 的缓冲液a。通过在4℃下以17,000
×
g离心30分钟来分离细胞质和细胞核级分。然后将细胞质和细胞核级分均重悬于trizol(invitrogen)中,并根据制造商的说明分离rna。所有样品均在illumina hiseq2500平台上测序,每个样品1500万个100 bp单读。在对测序文库进行质量控制后,使用tophat2对读数进行修整并针对 ensembl基因组注释和人类基因组装配(hg19/grch38)进行定位。删除了映射到核糖体rna或线粒体基因组的读段。
[0113]
9、免疫印迹
[0114]
使用含有10mm tris-cl,ph 8.0、150mm nacl,1%triton x-100、1%na
-ꢀ
脱氧胆酸盐,1mm edta,0.05%sds和新鲜的1x蛋白酶抑制剂的ripa缓冲液从细胞中裂解蛋白质。在使用均等负载并在聚丙烯酰胺凝胶中分离蛋白质之前,使用bio-rad蛋白质测定法通过bradford方法确定蛋白质浓度。然后将蛋白质转移到硝酸纤维素滤膜(millipore)上,并与所示的一抗孵育过夜。然后将结合hrp 的二抗应用于膜,在与ecl(ge healthcare)或supersignal west dura试剂(thermoscientific)孵育后,使用放射自显影胶片检测western blot信号。
[0115]
10、定量pcr
[0116]
为了检测leng8和pcid2,根据制造商的说明(invitrogen),用trizol试剂提取了hela细胞的总rna。根据制造商的说明,使用reverqpcr rt试剂盒(toyobo,fsq-101)将一微克总rna反转录。sybr rt-pcr试剂盒(toyobo, qpk-212)用于定量实时pcr分析。通过使用2
-△△
ct法与对照基因gapdh(编码gapdh)进行比较,计算出不同基因的相对mrna表达。
[0117]
11、线粒体活性研究。
[0118]
对于ocar测量,使用xfe24细胞外通量分析仪(安捷伦)确定野生型和 leng8缺失的hela细胞的生物能谱。在进行mito压力测试之前,将hela细胞以每孔1,000,000个细胞的量接种在xfe24板24中。所有测定均按照制造商的规程进行。将结果标准化为细胞数。
[0119]
为了测定线粒体质量,将野生型和leng8缺陷的hela细胞与线粒体绿色和线粒体深红色在50nm下于37℃孵育30分钟。线粒体相关的ros水平通过在37℃下用2.5μm的mitosox染色细胞30分钟来测量。使用invitrogen的试剂盒测量线粒体膜电位,并根据制造商的说明进行操作。然后将细胞用pbs溶液洗涤并重悬于含有1%fbs的冷pbs溶液中以进行facs分析。
[0120]
12、统计分析
[0121]
结果表示为平均值
±
s.m。组间的统计学显着性使用未配对的t检验或 mann-whitney u检验确定。所有分析均使用graphpad prism软件8.0,*p<0.05被认为具有统计学意义。
[0122]
二、研究结论
[0123]
1、鉴定leng8和pcid2为酵母thp3-csn12复合物的哺乳动物同源物
[0124]
为了进一步了解mrnp的生物发生过程,本实施例对酵母mrna的mrnp 成熟因子进行了生物信息学分析,并对其哺乳动物同源基因进行了鉴定(图1a)。酵母中thp3-csn12复合物是一种新发现的蛋白复合物,其活性需要转录延长和 mrna加工。然而,在mrnp生物发生中,thp3-csn12复合物或其对应哺乳动物的确切作用尚不清楚。pcid2之前被鉴定为酵母trex2复合物的thp1或 sus1亚基的哺乳动物同源蛋白,它与csn12的相似性更大,也含有pci结构域 (图1a)。此外,通过生物信息学比对,本实施例发现白细胞受体簇成员8(leng8)、 cg6700和对成孔毒素过敏(hpo-10)分别是thp3在哺乳动物、果蝇和线虫中的同源基因(图1a、c)。哺乳动物的leng8包含三个已知结构域:n-末端pat1(拓扑异构酶ii相关蛋白)结构域、中hjurp(holliday junction recognitionprotein-associated repeats)结构域和c-末端cpe(csn8_psd8_eif3k)结构域。所有的thp3同源基因均含有cpe结构域,算法分析显示,在真核生物中,thp3 和leng8之间的cpe结构域的氨基酸序列相似性为71%(图1d),表明leng8 在真核生物中是保守的。cpe结构域是在csn8(cop9信号体)、真核翻译起始因子3亚基k(eif3k)和26s蛋白酶体非atp酶调节亚基8(psmd8)中发现的一个标志性蛋白基序,被认为是蛋白-蛋白相互作用或蛋白-rna结合的支架。异位表达leng8以及内生leng8是主要位于细胞核,特别是核小体和斑点,然而截断突变leng8(1-556),缺乏cpe域是位于细胞溶质,表明leng8 cpe域是关键的核本地化。尽管明确了上述信息,leng8和pcid2在这一领域的功能相关性目前仍不清楚。
[0125]
发明人推测,leng8也与pcid2相关,并参与mrna的输出。为了验证这一点,本实施例将flag-tagged leng8与myc-tagged pcid2在hek293t细胞中共表达,并通过共免疫沉淀(coip)实验检测了leng8与pcid2的相互作用,结果显示在flag-leng8的颗粒部分检测到了pcid2(图2a)。因此,本实施例使用cy3标记的oligo-dt对poly(a)mrna进行了荧光原位杂交(fish)分析,结果显示leng8和picd2与mrnps共定位。此外,本实施例还利用生物素标记的寡聚-dt和链锁亲和素偶联珠纯化poly(a)rnp复合物并进行western blot分析,结果显示,在mrnp的pallet fraction中检测到leng8、pcid2以及thoc1 和alyref这两种主要tho组分,进一步验证leng8在mrnp出核具有重要作用。本实施例使用稳定表达的shrnas抑制leng8海拉细胞中thoc1及 leng8的表达,fish分析结果表明,相比wt细胞,thoc1及leng8敲除的细胞中,胞质mrnps明显降低(图2d)。然后,本实施例通过crispr-cas9基因敲除小鼠基因组编辑方法制备leng8缺失的动物模型,并从野生型和leng8 +/-小鼠分离得到尾巴成纤维细胞。同样,与野生型细胞相比,leng8+/-成纤维细胞在细胞核中显示出poly(a)mrnps的积累(图2f)。此外,转染靶向pcid2 的小干扰rna的hela细胞在细胞核中显示出了异常的polya mrna的积累。综上所述,这些结果表明,leng8和pcid2是进化保守的mrna加工因子,在哺乳动物细胞中调控mrnps输出。
[0126]
2、leng8与mrna加工因子相关。
[0127]
为了鉴定mrna因子中的长度相关蛋白,本实施例从稳定转染zzl-leng8
-ꢀ
flag的人hela细胞中制备了一株细胞系。通过亲和层析从细胞提取物中纯化带标记的leng8,最后用4-12%梯度的sds/page对最终的flag peptide洗脱物进行银染色,切下指示条带并进行质谱分析(图3a)。
[0128]
串联亲和结果显示,leng8显著富集了243个蛋白(图3b),这些蛋白主要是核定位蛋白,与mrna的加工有关,特别是mrna的剪接和转运。除了pcid2 之外,leng8还与trex/tho复合物的组分如thoc1、thoc2、alyref、 ddx39b等有显著的相互作用,这与酵母中发现的thp3与trex/tho复合物相关的结果一致。此外,根据ipa通路分析,leng8关联了许多剪接体成分(如 snrnp200、snrpa、u2af1、srsf1、hnrnpa1等)并与剪接体周期相关。此外,leng8析出物还含有paraspeckle成分sfpq和nono,或几个先前鉴定的 pre-mrna加工因子(例如pre-mrna capping因子ncbp2,thrap3,rna解旋酶 dhx9),或dna修复因子。考虑到pci域作为蛋白复合体组装的支架的功能, leng8最有可能的功能是作为一个平台,促进pre-mrna的多步骤加工。
[0129]
然后,本实施例验证了leng8是否是哺乳动物细胞中tho复合物的潜在关联蛋白。将flag标记的leng8与ha标记的thos蛋白thoc1/3/5/6/7在 hek293t细胞中共表达,通过共免疫沉淀(coip)实验检测leng8与thoc组分的相互作用。转染48小时后,制备细胞裂解液,用anti-flag m2珠进行ip检测。western blot结果显示,在flag-leng8的颗粒分数中检测到thoc1、 thoc5和thoc6,而没有检测到thoc3和thoc7(图4a)。然后,本实施例再次对ha-leng8和flag-thoc1或thoc5之间进行co-ip分析,将托盘与 rnase孵育,western blot结果显示,rnase处理显著减弱了leng8与thoc1 或thoc5之间的相互作用。提示leng8与thocs的关联依赖于rna的存在。随后,免疫荧光显微镜分析也显示,异位表达或内源性的leng8与thoc1、 alyref和thoc5共定位(图4d)。综上所述,所有这些结果表明,leng8是 tho复合物相关蛋白的一个新成员。
[0130]
3、leng8和thoc1结合的rna类型的特异性
[0131]
鉴于leng8与tho复合物相关,并且是mrna加工所必需的,为了确定与leng8结合的rna的特定类型,并测试不同类型的rna与leng8或thoc1 相关的可能性,本实施例沉淀了带有gfp标签的thoc1,leng8或对照gfp,并通过深度测序(rna免疫沉淀后再进行深度测序,rip-seq)对结合的rna 进行了测序。相比之下,leng8和thoc1几乎不结合假基因(分别为0.6%和 0.2%),ncrna(分别为0.1%和0.1%)和tec(有待实验确认)(分别为0.1%和0.1%)(图5c)。metagene分析表明,与thoc1相比,leng8结合位点更多地位于mrna的5'utr(27.1%vs 13.4%)和3'utr(36.9%vs 28.2%)区域,但在外显子中较少(30.9%vs。39.6%)和内含子区域(4.7%对17.7%)(图5d)。基因本体分析表明,leng8优先富集编码主要位于胞质细胞器(尤其是线粒体) 中并参与线粒体膜组装,线粒体翻译和代谢的生物过程的蛋白质的mrna(图 5e)。相反,由富集thoc1的mrna编码的蛋白质优先位于染色质和核小体中,并参与调节基因沉默和染色质功能(图5f)。homer基序分析表明,leng8 优先结合到mrna和lncrna中都包含的“c(u/a)gg(a/u)g”共有序列 (图5g),而thoc1在这两个mrna中均倾向于“cagcag”共有序列和 lncrna。综上所述,这些数据表明leng8和thoc1可能具有不同的功能,并与mrna加工中的不同步骤相关。
[0132]
使用沉淀和定量rt-pcr验证了具有高置信度靶标vdac1和vdac2的 leng8和thoc1的结合(图6a)。为了了解leng8对影响了哪些mrna的输出,本实施例从稳定表达leng8 shrna的hela细胞中提取了细胞质和核 mrna,然后进行深度测序。在leng8基因敲低后,从细胞核或细胞质部分进行测序的个体rna图谱显示出3839个转录本(占全部转录本序列的32.3%),可以看出,由于leng8基因敲低,输出的转录本出现下调(fold change>2)(图6b)。
通过ipa信号通路分析,抑制leng8丰富了与自噬和线粒体损伤反应相关的信号通路。此外,leng8缺失导致被hela细胞核保留的leng8结合的mrna的 68.3%或thoc1结合的mrna的52.5%(图6c)。此外,定量rt-pcr验证了 vdac1和vdac2(leng8和thoc1的两个高可信度靶标)的异常核保留。因此,该数据与fish检测mrna输出结果高度一致。
[0133]
4、leng8控制线粒体活性
[0134]
鉴于leng8优先结合编码线粒体蛋白的mrna,发明人推测leng8对于维持线粒体活性具有重要作用。为了验证这一点,本实施例通过shrna介导的基因敲除或guiderna-cas9/crispr介导的基因敲除从hela细胞生成了leng8缺陷细胞(图5),然后检查了线粒体的形态和呼吸活性。线粒体活性的测定使用了三种线粒体特异性标签,分别是呼吸(mitotracker)、总(mitotracke)和生成ros 的线粒体(mitosox)。hela的敲低或敲除leng8都会导致ros生成的减少和线粒体膜电位的损失(图7a和b)。
[0135]
根据线粒体染色的共聚焦显微镜成像,leng8的rnai导致线粒体网络的破坏,以及线粒体的分离和去极化。缺乏leng8的hela细胞的电子显微镜检查未显示正常的线粒体,但确实包括一些似乎肿胀的线粒体,其中一些还显示了水泡形态,线粒体嵴明显减少(图7c)。与形态学变化一致,缺乏或缺乏寡霉素的情况下,leng8缺失的hela细胞的耗氧率(ocr)显着降低(图7d)。综上,本实施例的发现表明leng8在维持线粒体活性中起着至关重要的作用。
[0136]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1