(S)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法与流程
(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法
技术领域
[0001]
本发明涉及有机合成技术领域,特别是涉及(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法。
背景技术:
[0002]
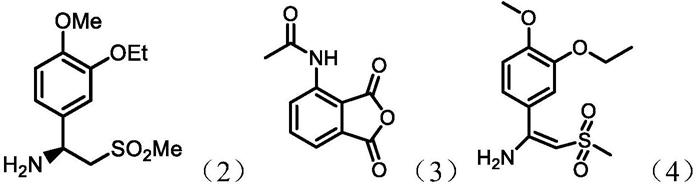
阿普斯特(apremilast),化学名为(s)-2-[1-(3-乙氧基-4-甲氧基苯基)-2-甲磺酰基乙基]-4-乙酰基氨基异吲哚啉-1,3-二酮,结构如下式(1)所示,是由celgene公司开发的一种选择性pde4抑制剂,于2014年3月获美国fda批准作为治疗银屑病性关节炎的口服药物上市,2014年9月再获美国fda批准用于治疗中度至重度牛皮癣(又称斑块型银屑病)。
[0003][0004]
阿普斯特的合成方法通常是以(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺(式(2),以下简称手性胺中间体)与酸酐中间体(式(3))为原料制备而成,工艺简便快速,适合工业化生产。实验表明,s-构型的阿普斯特比r-构型的阿普斯特对pde-4的抑制活性高5倍,手性胺中间体是合成s-构型的阿普斯特的关键,其生产工艺优劣直接影响到该药物的合成成本和手性纯度。另外,从合成路线可知阿普斯特手性胺是制备阿普斯特原料药最后一步的原料,对其质量标准特别是其中的重金属杂质要求趋严,需要最大程度降低重金属的残留风险。
[0005][0006]
目前,主要通过以下几种方法合成(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺。(1)在碱性条件下通过不对称还原1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙酮为醇,再经过磺酰化,叠氮化,最后氢化还原得到手性胺中间体,不对称转化率可达到98%以上,但该合成方法步骤繁琐。
[0007]
(2)利用3-乙氧基-4-甲氧基-苯甲酸酯作为原料,采用常规的碱性催化剂,使得二甲基砜在碱性条件下缩合,得到1-(3-乙氧基-4-甲氧基)苯基-2-甲磺酰基乙酮,再与胺试剂在酸性催化剂存在下烯胺化反应得到1-(3-乙氧基甲氧基)苯基-2-甲磺酰基乙烯的胺基取代物,后经氢化反应得到1-(3-乙氧基-4-甲氧基)苯基-2-甲磺酰基乙胺。该合成方法使
用的3-乙氧基-4-甲氧基-苯甲酸酯价格昂贵,成本过高,并且反应涉及较多的温度变化步骤,不易控制。
[0008]
(3)先制备1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(如式(4)所示),再通过硼氢化物还原,最后通过拆分剂进行拆分获得,如n-乙酰-l-亮氨酸。该合成方法存在手性胺中间体收率偏低,阿普斯特的合成成本价格偏高的问题。
技术实现要素:
[0009]
基于此,有必要提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法。该合成方法可以一步生成高手性纯度的(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺,同时产物易于分离纯化,且产物易于分离纯化,收率高。
[0010]
一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,包括如下步骤:
[0011]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺、手性催化剂、酸和溶剂混合,反应;
[0012]
所述手性催化剂的结构式如式(i)所示:
[0013][0014]
r选自氢原子、具有1-20个碳原子直链烷基、具有3-20个碳原子的支链烷基、具有3-10个碳原子的环烷基、具有3-10个环原子的杂环基、具有1-20个碳原子的烷氧基、三氟甲基、卤素、氨基、氰基、羟基、硝基、酯基、酰胺基、取代或未取代具有6-20个环原子的芳基、取代或未取代具有5-20个环原子的杂芳基。
[0015]
在其中一个实施例中,所述r选自氢原子、具有1-12个碳原子的直链烷基、具有3-7个碳原子的直链烷基、具有3-7个碳原子的环烷基、具有1-6个碳原子的直链烷氧基、异丙氧基、叔丁氧基、氨基、氰基、羟基、被取代或未被取代的具有6-20个环原子的芳基、被取代或未被取代的具有5-15个环原子的杂芳基。
[0016]
在其中一个实施例中,所述的烷基选自甲基、乙基、异丙基或叔丁基;所述的环烷基选自环丙基、环戊基和环己基。
[0017]
在其中一个实施例中,所述被取代的具有6-20个环原子的芳基中的取代基选自卤原子、硝基、氰基、甲基、乙基、丙基、异丙基、丁基、叔丁基、异丁基、戊基、异戊基、新戊基、环丙基、环丁基、环戊基、环已基、甲氧基、三氟甲氧基或三氟甲基。
[0018]
在其中一个实施例中,所述被取代的具有5-15个环原子的杂芳基中的取代基选自卤原子、硝基、氰基、甲基、乙基、丙基、异丙基、丁基、叔丁基、异丁基、戊基、异戊基、新戊基、环丙基、环丁基、环戊基、环已基、甲氧基、三氟甲氧基或三氟甲基。
[0019]
在其中一个实施例中,所述的r选自氢原子、甲基、乙基、异丙基、叔丁基、环丙基、
环己基、甲氧基、乙氧基、异丙氧基、叔丁氧基、氨基、氰基、羟基、苯基、吡啶基、苯甲基或三氟甲基。
[0020]
在其中一个实施例中,所述r选自甲基、乙基、异丙基或叔丁基。
[0021]
在其中一个实施例中,所述1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与所述手性催化剂的摩尔比为1:0.8~1:1.5。
[0022]
在其中一个实施例中,所述1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与所述手性催化剂的摩尔比为1:1.0~1:1.3。
[0023]
在其中一个实施例中,所述的酸选自三氟乙酸、醋酸、苯甲酸、磺酸、盐酸和磷酸中的至少一种。
[0024]
在其中一个实施例中,所述1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与所述酸的摩尔比为1:0.2-1:0.6。
[0025]
在其中一个实施例中,所述1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与所述酸的摩尔比为1:0.3-1:0.4。
[0026]
在其中一个实施例中,所述反应的温度为30℃~80℃,时间为10h~45h。
[0027]
在其中一个实施例中,所述反应的温度为40℃~60℃,时间为15h~30h。
[0028]
在其中一个实施例中,所述的溶剂选自二氧六环、氯仿、二氯甲烷、甲苯、四氢呋喃和乙腈中的至少一种。
[0029]
在其中一个实施例中,在所述反应结束之后,还包括萃取、浓缩、精制的步骤。
[0030]
与现有技术相比,本发明具有如下有益效果:
[0031]
本发明提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,该方法以1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺作为反应原料,配合合适的手性催化剂以及酸进行氢化还原,在该氢化还原的过程中即可一步生成高手性纯度的(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺,同时产物易于分离纯化,产率高。并且,本发明使用的手性催化剂属于有机催化的范畴,非过渡金属催化剂,可以避免因使用过渡金属而引起过渡金属残留,尤其是有毒重金属的残留。
[0032]
另外,上述合成方法反应条件温和,工艺稳定,反应操作简便安全,生产成本低,三废处理简单易行,环境友好,反应过程中使用的设备简单,原料易得,生产成本低,适合于工业化生产。
具体实施方式
[0033]
以下结合具体实施例对本发明作进一步详细的说明。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明公开内容理解更加透彻全面。
[0034]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0035]
现有(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法要么产物收率较低,要么试剂昂贵、成本高,要么步骤繁琐,存在诸多问题。
[0036]
本发明提供了一种可以一步生成高手性纯度,同时产物易于分离纯化,且产物易于分离纯化,收率高的(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法。技术方案如下:
[0037]
一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,包括如下步骤:
[0038]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺、手性催化剂、酸和溶剂混合,反应;
[0039]
所述手性催化剂的结构式如式(i)所示:
[0040][0041]
r选自氢原子、具有1-20个碳原子直链烷基、具有3-20个碳原子的支链烷基、具有3-10个碳原子的环烷基、具有3-10个环原子的杂环基、具有1-20个碳原子的烷氧基、三氟甲基、卤素、氨基、氰基、羟基、硝基、酯基、酰胺基、取代或未取代具有6-20个环原子的芳基、取代或未取代具有5-20个环原子的杂芳基。
[0042]
本发明提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,该方法以1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺作为反应原料,配合合适的手性催化剂以及酸进行氢化还原,在该氢化还原的过程中即可一步生成高手性纯度的(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺,同时产物易于分离纯化,产率高。并且,本发明使用的手性催化剂属于有机催化的范畴,非过渡金属催化剂,可以避免因使用过渡金属而引起过渡金属残留,尤其是有毒重金属的残留。
[0043]
另外,上述合成方法反应条件温和,工艺稳定,反应操作简便安全,生产成本低,三废处理简单易行,环境友好,反应过程中使用的设备简单,原料易得,生产成本低,适合于工业化生产。
[0044]
反应路线包括:
[0045][0046]
在其中一个实施例中,所述r选自氢原子、具有1-12个碳原子的直链烷基、具有3-7个碳原子的直链烷基、具有3-7个碳原子的环烷基、具有1-6个碳原子的直链烷氧基、异丙氧基或叔丁氧基、被取代或未被取代的具有6-20个环原子的芳基、被取代或未被取代的具有5-15个环原子的杂芳基。
[0047]
在其中一个实施例中,所述的烷基选自甲基、乙基、异丙基或叔丁基;所述的环烷
基选自环丙基、环戊基和环己基。
[0048]
在其中一个实施例中,所述被取代的具有6-20个环原子的芳基中的取代基选自卤原子、硝基、氰基、甲基、乙基、丙基、异丙基、丁基、叔丁基、异丁基、戊基、异戊基、新戊基、环丙基、环丁基、环戊基、环已基、甲氧基、三氟甲氧基或三氟甲基。
[0049]
优选地,所述的芳基选自苯基、萘基、蒽基和芘基。
[0050]
在其中一个实施例中,所述被取代的具有5-15个环原子的杂芳基中的取代基选自卤原子、硝基、氰基、甲基、乙基、丙基、异丙基、丁基、叔丁基、异丁基、戊基、异戊基、新戊基、环丙基、环丁基、环戊基、环已基、甲氧基、三氟甲氧基或三氟甲基。
[0051]
优选地,所述的杂芳基选自吡啶基、噻吩基、呋喃基、嘧啶基。
[0052]
优选地,所述的r选自氢原子、甲基、乙基、异丙基、叔丁基、环丙基、环己基、甲氧基、乙氧基、异丙氧基、叔丁氧基、氨基、氰基、羟基、苯基、吡啶基、噻吩基、苯甲基或三氟甲基。
[0053]
在本发明中,所述的手性催化剂可选自以下化合物中的一种:
[0054][0055]
优选地,所述的手性催化剂选自催化剂i-v。
[0056]
本发明所述的手性催化剂反应通式如下式所示:
[0057][0058]
上述的手性催化剂,其制备方法,包括以下步骤:
[0059]
s1.以甲苯为溶剂,以手性α-羟基苯乙酰胺与2,2,6-三甲基-1,3-二噁英-4-酮为反应原料且二者摩尔比1:(0.5-2),反应得到手性α-羟基苯乙酰胺衍生物;
[0060]
s2.在50℃-180℃下,以手性α-羟基苯乙酰胺衍生物与六次甲基四胺和醋酸铵为反应原料且三者摩尔比2:(0.5-2):(0.5-2),反应2-24h,得到本发明所述的手性催化剂。
[0061]
在其中一个实施例中,所述1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与所述手性催化剂的摩尔比为1:0.8~1:1.5。可以理解,在本发明中,所述1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与所述手性催化剂的摩尔比为可以设为但不限于:1:0.8、1:0.82、1:0.85、1:0.88、1:0.9、1:0.92、1:0.95、1:0.98、1:1.0、1:1.05、1:1.1、1:1.12、1:1.15、1:1.18、1:1.2、1:1.21、1:1.23、1:1.25、1:1.3、1:1.38、1:1.4、1:1.45、1:1.18和1:1.5。优选地,所述1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与所述手性催化剂的摩尔比为1:1.0~1:1.3。
[0062]
在其中一个实施例中,所述的酸选自三氟乙酸、醋酸、苯甲酸、磺酸、盐酸和磷酸中的至少一种。优选地,所述的酸为三氟乙酸或磺酸。
[0063]
在其中一个实施例中,所述1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与所述酸的摩尔比为1:0.2-1:0.6。可以理解,在本发明中,所述1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与所述酸的摩尔比为可以设为但不限于:1:0.2、1:0.25、1:0.28、1:0.3、1:0.31、1:0.32、1:0.333、1:0.35、1:0.38、1:0.40、1:0.45、1:0.48、1:0.5、1:0.51、1:0.55和1:0.6。优选地,所述1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与所述酸的摩尔比为1:0.3-1:0.4。
[0064]
在其中一个实施例中,所述反应的温度为30℃~80℃,时间为10h~45h。
[0065]
在其中一个较为优选的实施例中,所述反应的温度为40℃~60℃,时间为15h~30h。
[0066]
在其中一个实施例中,所述的溶剂选自二氧六环、氯仿、二氯甲烷、甲苯、四氢呋喃和乙腈中的至少一种。优选地,所述的溶剂为四氢呋喃,反应效率较高。
[0067]
在本发明中,所述反应是在搅拌状态下进行的。优选地,所述搅拌为剧烈搅拌,通过剧烈搅拌,使1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与手性催化剂、酸充分接触。
[0068]
在其中一个实施例中,在所述反应结束之后,还包括萃取、浓缩的步骤。
[0069]
优选地,淬灭反应使用的溶剂是水。萃取操作使用的溶剂是乙酸乙酯。
[0070]
优选地,本发明所述的(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,包括如下步骤:
[0071]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺、手性催化剂、三氟乙酸溶于四氢呋喃中,于50℃中剧烈搅拌反应24小时,加水淬灭反应后,用乙酸乙酯萃取。有机相浓缩后,得白色粗产品。
[0072]
在其中一个实施例中,在所述浓缩之后,还包括精制的步骤。
[0073]
精制指对粗产品进行重结晶操作,例如:将上述粗品加热溶解于二氯甲烷中,二氯甲烷的加入量为1.5倍-1.6倍粗产品的质量,降至室温析晶,抽滤,得到精品产物。
[0074]
以下为具体实施例。
[0075]
若无特殊说明,本发明所使用的原料均来源于市售产品。
[0076]
实施例1
[0077]
本实施例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法。
[0078]
(1)制备手性催化剂i:
[0079]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-n-甲基-2-苯乙酰胺(165.1mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却至50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到187.0mg白色固体化合物,产率75%。
[0080]
将上述白色固体化合物(498.6mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得368.7mg淡黄色手性催化剂i,产率75%。
[0081]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0082]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、手性催化剂i(1.2当量)、三氟乙酸(0.3当量),溶于200ml四氢呋喃中,于50℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为90%,ee值为97%。
[0083]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为85%,ee值为99%。
[0084]
实施例2
[0085]
本实施例一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,步骤同实施例1,区别在于:采用的手性催化剂为催化剂ii。
[0086]
(1)制备手性催化剂ii:
[0087]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-n-乙基-2-苯乙酰胺(179.2mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却至50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到243.0mg白色固体化合物,产率82%。
[0088]
将上述白色固体化合物(526.6mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得426.1mg淡黄色手性催化剂ii,产率82%。
[0089]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0090]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂ii(1.2当量)、三氟乙酸(0.3当量),溶于200ml四氢呋喃中,于50℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为87%,ee值为96%。
[0091]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为83%,ee值为98%。
[0092]
实施例3
[0093]
本实施例一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,步骤同实施例1,区别在于:采用的手性催化剂为催化剂iii。
[0094]
(1)制备手性催化剂iii:
[0095]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-n-异丙
基-2-苯乙酰胺(193.2mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却至50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到230.2mg白色固体化合物,产率83%。
[0096]
将上述白色固体化合物(554.2mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得441.8mg淡黄色手性催化剂iii,产率83%。
[0097]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0098]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂iii(1.2当量)、三氟乙酸(0.3当量),溶于200ml四氢呋喃中,于50℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为88%,ee值为95.7%。
[0099]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为83%,ee值为98%。
[0100]
实施例4
[0101]
本实施例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,步骤同实施例1,区别在于:采用的手性催化剂为催化剂vi。
[0102]
(1)制备手性催化剂vi:
[0103]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-2-苯乙酰胺(151.1mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却至50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到192.9mg白色固体化合物,产率82%。
[0104]
将上述白色固体化合物(470.4mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得394mg淡黄色手性催化剂vi,产率85%。
[0105]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0106]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂vi(1.2当量)、三氟乙酸(0.3当量),溶于200ml四氢呋喃中,于50℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为83%,ee值为94%。
[0107]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为83%,ee值为98%。
[0108]
实施例5
[0109]
本实施例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,步骤同实施例1,区别在于:采用的手性催化剂为催化剂vii。
[0110]
(1)制备手性催化剂vii:
[0111]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-n-甲氧基-2-苯乙酰胺(181.1mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却
至50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到212.2mg白色固体化合物,产率80%。
[0112]
将上述白色固体化合物(530.4mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得413.6mg淡黄色手性催化剂vii,产率79%。
[0113]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0114]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂vii(1.2当量)、三氟乙酸(0.3当量),溶于200ml四氢呋喃中,于50℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为80%,ee值为95%。
[0115]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为81%,ee值为97%。
[0116]
实施例6
[0117]
本实施例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,步骤同实施例1,区别在于:(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与手性催化剂的摩尔比不同。
[0118]
(1)制备手性催化剂i:
[0119]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-n-甲基-2-苯乙酰胺(165.1mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却至50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到187.0mg白色固体化合物,产率75%。
[0120]
将上述白色固体化合物(498.6mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得368.7mg淡黄色手性催化剂i,产率75%。
[0121]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0122]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂i(1.4当量)、三氟乙酸(0.3当量),溶于200ml四氢呋喃中,于30℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为83%,ee值为95%。
[0123]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为80%,ee值为98%。
[0124]
实施例7
[0125]
本实施例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,步骤同实施例1,区别在于:(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺与酸的摩尔比不同。
[0126]
(1)制备手性催化剂i:
[0127]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-n-甲基-2-苯乙酰胺(165.1mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却至
50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到187.0mg白色固体化合物,产率75%。
[0128]
将上述白色固体化合物(498.6mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得368.7mg淡黄色手性催化剂i,产率75%。
[0129]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0130]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂i(1.2当量)、三氟乙酸(0.6当量),溶于200ml四氢呋喃中,于30℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为85%,ee值为94%。
[0131]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为80%,ee值为97%。
[0132]
实施例8
[0133]
本实施例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,步骤同实施例1,区别在于:酸的种类不同。
[0134]
(1)制备手性催化剂i:
[0135]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-n-甲基-2-苯乙酰胺(165.1mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却至50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到187.0mg白色固体化合物,产率75%。
[0136]
将上述白色固体化合物(498.6mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得368.7mg淡黄色手性催化剂i,产率75%。
[0137]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0138]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂ix(1.2当量)、醋酸(0.3当量),溶于200ml四氢呋喃中,于30℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为87%,ee值为95%。
[0139]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为82%,ee值为97%。
[0140]
实施例9
[0141]
本实施例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,步骤同实施例1,区别在于:酸的种类不同。
[0142]
(1)制备手性催化剂i:
[0143]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-n-甲基-2-苯乙酰胺(165.1mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却至50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到187.0mg白色固体化合物,产率75%。
[0144]
将上述白色固体化合物(498.6mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺
(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得368.7mg淡黄色手性催化剂i,产率75%。
[0145]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0146]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂ix(1.2当量)、磺酸(0.3当量),溶于200ml四氢呋喃中,于30℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为87%,ee值为97%。
[0147]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为82%,ee值为99%。
[0148]
实施例10
[0149]
本实施例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,具体步骤如下:
[0150]
(1)制备手性催化剂i:
[0151]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-n-甲基-2-苯乙酰胺(165.1mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却至50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到187.0mg白色固体化合物,产率75%。
[0152]
将上述白色固体化合物(498.6mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得368.7mg淡黄色手性催化剂i,产率75%。
[0153]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0154]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂i(1.2当量)、磷酸(0.5当量),溶于200ml二氯甲烷中,于30℃中剧烈搅拌反应15h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为80%,ee值为92%。
[0155]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为75%,ee值为96%。
[0156]
实施例11
[0157]
本实施例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,具体步骤如下:
[0158]
(1)制备手性催化剂vi:
[0159]
将2,2,6-三甲基-1,3-二噁英-4-酮(142.2mg,1mmol)滴加到(s)-α-羟基-2-苯乙酰胺(151.1mg,1mmol)的甲苯(0.5ml)溶液中。搅拌回流过夜,将反应混合液冷却至50℃,真空除去溶剂。粗产品经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为20:1)分离纯化得到192.9mg白色固体化合物,产率82%。
[0160]
将上述白色固体化合物(470.4mg,2mmol),醋酸铵(77.1mg,1mmol),六次甲基四胺(140.2mg)溶于5ml二氧六环中,在100℃加热反应30分钟。冷却至常温,加水,用二氯甲烷萃取,收集有机相。有机相浓缩后,经硅胶柱层析纯化(正己烷:乙酸乙酯的体积比为10:1)得394mg淡黄色手性催化剂vi,产率85%。
[0161]
(2)制备(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺:
[0162]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂vi(0.8当量)、盐酸(0.2当量),溶于200ml甲苯中,于70℃中缓慢搅拌反应10h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为85%,ee值为90%。
[0163]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为74%,ee值为96%。
[0164]
对比例1
[0165]
本对比例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,步骤同实施例1,区别在于:采用的手性催化剂
[0166]
的结构式如式(ii)所示。
[0167][0168]
具体步骤如下:
[0169]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、式(ii)所示的催化剂(1.2当量)、三氟乙酸(0.3当量),溶于200ml四氢呋喃中,于30℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为74%,ee值为60%。
[0170]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为70%,ee值为80%。
[0171]
对比例2
[0172]
本对比例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成方法,步骤同实施例1,区别在于:采用的手性催化剂的结构式如式(iii)所示。
[0173][0174]
具体步骤如下:
[0175]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、式(iii)所示的催化剂(1.2当量)、三氟乙酸(0.3当量),溶于200ml四氢呋喃中,于30℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为73%,ee值为77%。
[0176]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为65%,ee值为85%。
[0177]
对比例3
[0178]
本对比例提供一种(s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙胺的合成
方法,步骤同实施例1,区别在于:省略三氟乙酸。
[0179]
具体步骤如下:
[0180]
将1-(3-乙氧基-4-甲氧基苯基)-2-(甲磺酰基)乙烯胺(1.0当量)、催化剂i(1.2当量)溶于200ml四氢呋喃中,于50℃中剧烈搅拌反应24h,加水淬灭反应,用乙酸乙酯萃取,收集有机相。有机相浓缩后,得白色粗产品,产率为70%,ee值为95%。
[0181]
将上述粗产品用1.5倍质量的二氯甲烷加热溶解,降至室温析晶,抽滤,得到精品产物,收率为82%,ee值为98%。
[0182]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0183]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1