一种纤维素降解复合菌剂及应用的制作方法
[0001]
本发明涉及农业集约化生产技术领域,更具体的说是涉及一种纤维素降解复合菌剂及应用。
背景技术:
[0002]
目前,蔬菜废弃物中木质纤维素含量较高,导致就地还田过程中降解速度慢,腐解周期长,影响下茬作物,成为蔬菜废弃物就地还田的一大技术难题。通过在蔬菜废弃物腐解过程中接种高效木质纤维素降解菌可以改善这一问题。
[0003]
但是,现有菌剂鱼龙混杂,良莠不齐,在实际生产中效果难以保证。而自然界中存在很多具备木质纤维素降解能力的微生物,如芽孢杆菌、诺卡氏菌、高温放线菌、黑曲霉、青霉、木霉等,但其相互之间可能存在拮抗作用,无法直接组合使用,因此筛选出高效的纤维素降解菌剂并将其进行有机组合是非常重要的。同时,在复合菌剂应用到实际生产过程中,为了保证菌剂发挥作用,需要菌剂在长时间的保藏下还能保持较高的活菌量。为了营造一个适宜微生物生存的环境,提高复合菌剂对不良环境的抵抗能力,降低微生物的流失速度,一般采用微生物固定方法,将微生物固定并封存在特殊的载体材料当中,并提高其稳定性与反应启动的速度。微生物的固定方法,主要分为6类,分别是:交联法、包埋法、吸附法、系统截留法、共价结合(偶联) 法和非载体固定法,它们的主要区别在于载体和机理不同。其中,吸附法操作简单,活性损失低,因而被广泛使用。影响吸附法有效性与经济性的关键在于载体的选择,吸附法所使用的载体来源广泛,性质各异,成本不一。在众多载体中挑出价廉、易得、固化效果好的载体,对于复合菌剂的保存、运输,以及后续的推广具有重要的意义。
[0004]
因此,如何筛选出高效的木质纤维素降解菌,进行有机组合并挑选适宜的菌剂载体是本领域技术人员亟需解决的问题。
技术实现要素:
[0005]
鉴于此,本发明提供了一种纤维素降解复合菌剂及应用。通过筛选木质纤维素酶活力良好的高效菌株,构建高效纤维素降解复合菌剂。以蔬菜废弃物、耕地土壤和羊的粪便为原料,进行纤维素降解菌的筛选,最终获得5株高效纤维素降解菌并进行保藏,同时筛选出最适宜的菌剂载体。
[0006]
保藏信息为:保藏中心:中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号;谷氨酸杆菌(glutamicibactersp.)mi8,保藏编号为cgmcc no.20641、谷氨酸杆菌(glutamicibactersp.)ms6,保藏编号为cgmcc no.20642、纤维微细菌(cellulosimicrobiumsp.)ms8,保藏编号为cgmcc no.20643、类芽孢杆菌(paenibacillus sp.)ms10,保藏编号为cgmcc no.20644、芽孢杆菌(bacillus sp.)ms13,保藏编号为 cgmcc no.20645,保藏时间均为2020年09月14日。
[0007]
为了实现上述目的,本发明采用如下技术方案:
[0008]
一种纤维素降解复合菌剂,包括谷氨酸杆菌(glutamicibacter sp.)mi8,保藏编号为cgmcc no.20641、谷氨酸杆菌(glutamicibacter sp.)ms6,保藏编号为cgmcc no.20642、纤维微细菌(cellulosimicrobium sp.)ms8,保藏编号为cgmcc no.20643、类芽孢杆菌(paenibacillus sp.)ms10,保藏编号为 cgmcc no.20644、芽孢杆菌(bacillussp.)ms13,保藏编号为cgmcc no. 20645。
[0009]
优选的:谷氨酸杆菌mi8、谷氨酸杆菌ms6、纤维微细菌ms8、类芽孢杆菌ms10和芽孢杆菌ms13质量比为(0.9~1.1):(2.8~3.0):(0.9~1.1):(0.9~1.1): (0.9~1.1)。
[0010]
优选的:谷氨酸杆菌mi8、谷氨酸杆菌ms6、纤维微细菌ms8、类芽孢杆菌ms10和芽孢杆菌ms13菌落数均为(1.0~1.5)
×
108cfu/g。
[0011]
优选的:还包括菌剂载体,菌剂载体为草炭土。
[0012]
优选的:纤维素降解复合菌剂和菌剂载体的质量比为(0.9~1.1): (4.8~5.2)。
[0013]
本发明还提供了一种纤维素降解复合菌剂的应用,促进木质纤维素的降解,加速腐解过程,缩短降解周期。
[0014]
本发明还提供了一种纤维素降解复合菌剂的应用,在农业生产中,提高作物产量、改善土壤质量。
[0015]
经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种纤维素降解复合菌剂及应用,取得的技术效果为复合菌剂促进木质纤维素的降解,加速腐解过程,缩短降解周期,改善土壤质量,显著提升农作物产量。
附图说明
[0016]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
[0017]
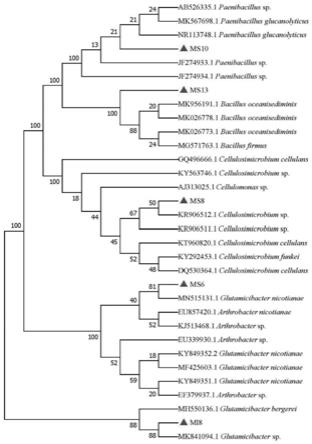
图1附图为本发明提供的部分菌株在纤维素刚果红培养基上形成的透明圈示意图。
[0018]
图2附图为本发明提供的部分菌株滤纸崩解情况示意图。
[0019]
图3附图为本发明提供的菌株基于16srdna序列构建的系统发育树示意图。
[0020]
图4附图为本发明提供的28℃保藏条件下不同载体材料中的活菌数量变化示意图。
具体实施方式
[0021]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0022]
实施例中,筛选菌株的原料来源:
[0023]
以蔬菜废弃物、耕地土壤和羊的粪便3种物质作为原料进行纤维素降解菌的筛选。所用蔬菜废弃物为腐烂的叶菜类蔬菜废弃物,耕地土壤为北京市怀柔区怀北镇长期种植蔬
菜的0~20cm表层土壤,羊的粪便为内蒙古草原长期放牧的乌珠穆沁羊的粪便。
[0024]
实施例中各培养基成分:
[0025]
羧甲基纤维素钠培养基:cmc-na 10g/l,蛋白胨2g/l,nacl 0.5g/l, k2hpo
4 1g/l,mgso4·
6h2o 0.5g/l,酵母膏0.5g/l,琼脂12g/l,ph 7.0。
[0026]
纤维素刚果红培养基:cmc-na 2g/l,(nh4)2so
4 2g/l,nacl 0.5g/l, k2hpo
4 1g/l,mgso4·
6h2o 0.5g/l,刚果红0.4g/l,琼脂12g/l,ph 7.0。
[0027]
滤纸条崩解培养基:(nh4)2so
4 1.0g/l,mgso4·
6h2o0.5g/l,k2hpo41.0 g/l,酵母膏0.1g/l,滤纸条(1cm
×
6cm)3条/三角瓶,ph7.0。
[0028]
麦秆降解培养基:蛋白胨2g/l,mgso4·
6h2o 0.5g/l,kh2po
4 1.0g/l, nacl 0.5g/l,酵母膏0.5g/l,cacl
2 0.2g/l,ph7.0。
[0029]
lb培养基:胰蛋白胨10g/l,酵母膏5g/l,nacl 10g/l,ph 7.4。
[0030]
实施例中涉及的部分仪器:
[0031]
高压蒸汽灭菌锅(mls-3750)、数显型酸度剂(sartorius pb-10)、电子分析天平(pl203)、台式离心机(tgl-16c)、超净工作台(sw-cj-1fd)、生化培养箱 (3px-150)、数显气浴恒温振荡器(shz-82a)、紫外可见光分光光度计 (uv-4802)、微型植物试样粉碎机(gt100)、恒温金属浴(jyc-100)、鼓风干燥箱(101-3ab)、生物显微镜(xsz-hs3)、超低有机物型超纯水机(xyfi-5-h)、超低温冰箱(mdf-382e(n))。
[0032]
未提及的实验材料、试剂盒等均为市售渠道采购,对其品牌来源不做要求,未提及的方法为实验常规方法,在此不再一一赘述。
[0033]
本发明实施例公开了一种纤维素降解复合菌剂及应用。
[0034]
实施例1
[0035]
纤维素降解菌的富集培养
[0036]
将采集的样品用无菌水逐级稀释10倍至10-4
、10-5
和10-6
倍后,分别取 0.1ml涂布于羧甲基纤维素钠培养基上,每个浓度涂2个平板,28℃生化培养箱中倒置培养,定期观察。
[0037]
纤维素降解菌的初筛(纯化)
[0038]
挑取生长良好的菌株,通过划线法分离纯化。观察菌落外观,结合显微镜涂片染色检查菌苔纯度,若发现有杂菌混杂,就再一次进行分离纯化,直到获得纯的菌株。真菌、细菌和放线菌分别用马铃薯葡萄糖琼脂培养基(pda)、 lb培养基及高氏一号培养基培养,并用30%甘油在-80℃条件下进行超低温保存。
[0039]
实施例2
[0040]
纤维素降解菌的复筛
[0041]
纤维素刚果红透明圈实验:具有纤维素分解功能的菌株能分泌纤维素酶,降解培养基中的纤维素,生成低聚糖、纤维二糖、葡萄糖等小分子。水解后的糖类同刚果红染料可以形成红色沉淀,随着菌落的生长,逐渐出现清晰的水解透明圈。透明圈的大小可以用来判断菌株的cmc相对酶活力,根据透明圈大小能初步筛选出降解纤维素能力较强的菌株。将纯化后的菌株分别接种于羧甲基纤维素钠培养基上,待菌落长出后,用灭菌枪头将其点接到纤维素刚果红培养基上,每个培养基接种同一菌株三次,28℃恒温培养2d后,测量透明圈直径(d)与菌落直径(d)大小,计算出刚果红透明圈与菌落的直径之比 (d/d),用于初步衡量菌株的纤维素降解能力。
[0042]
以蔬菜废弃物、耕地土壤和羊的粪便3种物质作为原料进行纤维素降解菌的筛选,通过富集培养、划线分离、刚果红透明圈实验筛选得到26株能在刚果红培养基上形成清晰透明圈的菌株(部分菌株在纤维素刚果红培养基上形成的透明圈的情况参见图1)。其中5株菌株(mv1-mv5)来自蔬菜废弃物, 8株菌株(mi1-mi8)来自羊的粪便,13株菌株(ms1-ms13)来自耕地土壤。通过测量菌落大小(d)及形成的透明圈大小(d),结合菌落的生长形态,筛选出纤维素降解能力较强的10株菌株进行后续实验,纤维素刚果红透明圈实验结果如表1。
[0043]
表1 26株菌株纤维素刚果红培养基上形成的透明圈情况
[0044][0045][0046]
实施例3
[0047]
滤纸条崩解实验
[0048]
为了进一步判断菌株对纤维素的降解能力,通过滤纸条崩解实验来判断不同菌株所分泌的各种纤维素酶的综合酶活力水平。
[0049]
选择刚果红透明圈实验中纤维素降解能力较好的10株菌株进行滤纸条崩解实验。用无菌水将所获得的菌株制成菌悬液,分别接种2ml于装有100ml 滤纸条崩解培养基的250ml三角瓶中,摇床培养(28℃,130r/min),定期观察滤纸条崩解情况,每个处理3次重复,并设置空白对照。连续观察3天并记录滤纸条降解情况,3天后将降解后的滤纸条残片从锥形瓶中取出,烘干至恒重后称重,与降解前的滤纸条质量进行比较并计算滤纸降解率。
[0050]
结果表明,绝大多数菌株对滤纸条有一定的崩解能力(部分菌株滤纸崩解实验照片参见图2)。3d后,利用烘干法测定滤纸条的失重率,其中菌株ms13降解能力最强,滤纸条崩解率可达94.25%,滤纸条崩解实验结果结果见表2。
[0051]
表2菌株滤纸条崩解情况
[0052][0053]
实施例4
[0054]
液态发酵降解麦秆实验
[0055]
为了能够进一步了解筛选得到的纤维素降解菌株对天然的木质纤维素物质的降解效果,选择了富含蛋白、非结构性糖以及木质纤维素的麦秆作为实验材料,将筛选得到的10株菌株进行液态发酵降解麦秆实验,以麦秆失重率来衡量菌株对天然木质纤维素物质的降解能力。
[0056]
将麦杆粉碎,过40目筛,50℃烘至恒重。在每个三角瓶中加入100ml 麦秆降解培养
基,然后分别加入1g麦秆,121℃灭菌20min,各接种2ml 菌悬液,28℃,130r/min培养。7d后,将培养物离心10min(5000
×
g),弃上清,用盐酸和硝酸的混合液冲洗消除菌体,离心10min(5000
×
g),用蒸馏水冲洗,离心(5000
×
g)10min,105℃烘至恒重,计算失重率。
[0057]
结果表明,各菌株对麦秆均表现出一定的降解作用。其中,菌株ms6对麦秆降解率最高,为68.02%。液态发酵降解麦秆实验结果如表3所示。
[0058]
表3菌株液态降解麦秆情况
[0059][0060]
实施例5
[0061]
菌株鉴定
[0062]
细菌、放线菌采用形态、生理生化及16srdna序列比对进行;真菌采用形态及核糖体dna内转录间隔区(its)序列比对进行鉴定。采用细菌基因组提取试剂盒提取细菌和放线菌总dna,采用真菌基因组提取试剂盒提取真菌总 dna。以提取的细菌和放线菌总dna为模板,以通用引物:
[0063]
8f:5'-gagagtttgatcctggctcag-3',seq id no.1;
[0064]
1492r:5'-cggctaccttgttacgac-3',seq id no.2;
[0065]
作引物扩增菌株的16srdna序列。pcr反应体系:10
×
pcr buffer 5μl, mgcl
2 3μl,dntp 4μl,模板1μl,引物8f和1492r(10μmol/l)各1μl, rtaqdna聚合酶(5u/μl)0.5μl,加ddh2o至50μl。pcr反应条件:95℃变性5min,94℃变性1min,54℃退火1min,72℃延伸2min,30个循环;72℃延伸7min。
[0066]
以提取的真菌总dna为模板,通用引物:
[0067]
its15.8sf:5'-tccgtaggtgaacctgc-3',seq id no.3;
[0068]
its45.8sr:5'-tcctccgcttattgatatgc-3',seq id no.4。
[0069]
扩增菌株的its序列。pcr反应体系:10
×
pcr buffer 5μl,mgcl23μl, dntp4μl,模板1μl,引物its1和its4(10μmol/l)各1μl,rtaqdna聚合酶(5u/μl)0.25μl,加ddh2o至50μl。pcr反应条件:94℃预变性5min,94℃变性1min,53℃退火1min,72℃延伸50s,30个循环;72℃延伸10min。用凝胶提取回收试剂盒纯化回收pcr产物,送北京睿博兴科生物公司测序。将所测16srdna和its区序列与ncbi中已知的序列进行blast比对,用 mega7.0构建菌株系统发育树进行序列比对和系统发育分析,采用 neighbor-joining算法构建系统发育树,确定菌株的亲缘关系。
[0070]
结果表明,mv1~mv5为黄杆菌属(flavobacterium),mi1~mi7、ms1~ms3 为链霉菌属(streptomyces),mi8为谷氨酸杆菌属(glutamicibacter),ms4为白蚁菌属(isoptericola),ms5、ms7、ms10-ms12为类芽孢杆菌属(paenibacillus), ms6为谷氨酸杆菌属(glutamicibacter),ms8为纤维微细菌属 (cellulosimicrobium),ms9为纤维单胞菌属(celloulonmonas),ms13为芽孢杆菌属(bacillus)。
[0071]
实施例6
[0072]
不同菌株的拮抗实验
[0073]
将灭菌圆形滤纸片(d=6mm)在各菌悬液中完全浸湿,静置2h。分别取各菌悬液0.5ml,用涂布器均匀涂布于羧甲基纤维素钠培养基上。将滤纸片取出均匀分布、平铺于涂布单一菌悬液的羧甲基纤维素钠培养基平板上。28℃培养2d后分别检查滤纸片上各菌株和涂布于培养基上单一菌株之间的拮抗活性。
[0074]
对筛选到的10株纤维素降解菌株进行了拮抗试验,结果表明(参见表4),除mv1与ms6有拮抗现象外,其余菌株相互间均互不拮抗。
[0075]
表4 10株纤维素降解菌拮抗实验结果
[0076]
[0077]
注:+表示有拮抗反应,-表示无拮抗反应。
[0078]
实施例7
[0079]
由表3、表4数据,挑选具有较高纤维素降解能力且互不拮抗的5个菌株(mi8、ms6、ms8、ms10、ms13并保藏)制备一种纤维素降解复合菌剂,其质量比为1:3:1:1:1。
[0080]
实施例8
[0081]
与实施例7的区别在于质量比为0.9:2.8:1.1:1.1:1.0。
[0082]
实施例9
[0083]
与实施例7的区别在于质量比为1.1:3.0:0.9:0.9:1.1。
[0084]
实施例10
[0085]
与实施例7的区别在于质量比为0.9:3.0:1.0:1.1:0.9。
[0086]
实施例7~10中,复合菌剂载体选择草炭土,纤维素降解复合菌剂和菌剂载体的质量比为(0.9~1.1):(4.8~5.2);谷氨酸杆菌mi8、谷氨酸杆菌ms6、纤维微细菌ms8、类芽孢杆菌ms10和芽孢杆菌ms13菌落数均约为 (1.0~1.5)
×
108cfu/g。
[0087]
利用mega7.0对筛选出来的5株纤维素降解菌进行序列比对和系统发育分析,采用neighbor-joining算法构建系统发育树,确定菌株的亲缘关系(菌株基于16srdna序列构建的系统发育树参见图3),并对其进行保藏。
[0088]
对比实验1
[0089]
复合菌剂载体对比实验
[0090]
选取5种载体,包括:无机载体(活性炭、硅藻土)和有机载体(麦麸、草炭土、小麦秸秆粉)。将载体材料磨碎后过40目筛,121℃,20分钟灭菌, 50℃烘干备用。在接种之前,先记录菌液初始活菌数量,再进行载体接种,具体步骤是:在无菌条件下,将载体与菌液按照10g载体材料对应50ml菌液的比例充分混合,置于28℃的生化培养箱中保存,采用平板涂布法计数活菌数量。接着按照2h、6h、12h、24h、2d、4d、10d、20d的时间间隔,取0.1g样本加入蒸馏水定容至1ml,振荡5分钟,4000转离心10分钟,倾去上清液,于沉淀中加入1ml蒸馏水,振荡后梯度稀释,利用平板涂布法测定各接种菌剂后载体中的活菌数,并进行记录。
[0091]
结果表明(参见图4),28℃保藏条件下,在菌液接种2h后,硅藻土和草炭土中的有效活菌数有所增加,活性炭、麦麸、小麦秸秆粉中的有效活菌数均呈现减少的趋势。总体来看,在菌液接种到5种载体中以后,有效活菌数均出现损失。保藏20d时5种固化菌剂的活菌数量分别为:活性炭8.00
×
10
6 cfu/g、硅藻土7.00
×
107cfu/g、麦麸6.00
×
105cfu/g、草炭土1.52
×
108cfu/g、小麦秸秆粉1.00
×
105cfu/g。草炭土作为固化载体,固化的活菌量最高,说明草炭土能够在较长时间内保持较高的微生物活性,是一种良好的载体材料。
[0092]
对比试验2
[0093]
各菌株协同增效实验
[0094]
为挑选出各菌株最佳组合比例,设置5个组。
[0095]
1组,同实施例7,5个菌株(mi8、ms6、ms8、ms10、ms13)质量比为 1:3:1:1:1。
[0096]
2组,与实施例7的区别在于,将ms13替换为实验室现有芽孢杆菌。
[0097]
3组,与实施例7的区别在于,将ms6替换为实验室现有谷氨酸杆菌。
[0098]
4组,与实施例7的区别在于,将5个菌株(mi8、ms6、ms8、ms10、 ms13)质量比为随机调整为3:1:1:2:1。
[0099]
5组,与实施例7的区别在于,将5个菌株(mi8、ms6、ms8、ms10、 ms13)质量比为随机调整为1:1:1:1:1。
[0100]
按照各组实验的比例制成复合菌剂的菌悬液,分别接种2ml于装有100 ml滤纸条崩解培养基的250ml三角瓶中,摇床培养(28℃,130r/min),定期观察滤纸条崩解情况,每个处理2次重复。连续观察3天并记录滤纸条降解情况,3天后将降解后的滤纸条残片从锥形瓶中取出,烘干至恒重后称重,与降解前的滤纸条质量进行比较并计算滤纸降解率,实验结果见表5。
[0101]
结果表明,根据实施例7进行实验滤纸条崩解效果最好,滤纸降解率可达96.90%,将其中一个菌株替换为同一属其他菌株,或随机改变各菌株比例,滤纸降解率均没有实施例7高,可能是因为替换菌株后菌株之间存在拮抗作用,或是改变比例后协同增效效果没有达到最优。
[0102]
表5各菌株协同增效实验结果
[0103][0104]
对比试验3
[0105]
蔬菜废弃物就地还田实验
[0106]
为检验复合菌剂实际应用效果,采用了田间试验的方法,设置了3个处理f1~f3,对辣椒秸秆进行就地还田。
[0107]
f1:微生物菌剂(同实施例7)+辣椒秸秆就地还田;
[0108]
f2:微生物菌剂(市售)+辣椒秸秆就地还田;
[0109]
f3:不添加微生物菌剂+辣椒秸秆就地还田。
[0110]
试验在山东省济宁市金乡县鸡黍镇开展,共持续3个月,通过监测试验过程土壤理化性质的变化,分析接种复合菌剂对蔬菜废弃物腐解过程的影响。根据实验安排开展实验,实验结果参见表6。
[0111]
表6蔬菜废弃物就地还田实验结果
[0112][0113]
结果表明,在辣椒秸秆就地还田过程中添加自制菌剂可以有效促进秸秆腐解,提高土壤养分,增加作物产量,f1(自制菌剂)各项土壤指标均优于 f2(市售微生物菌剂),具有良好的市场竞争力。
[0114]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0115]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1