PRR34-AS1作为新型分子标志物及其定量检测方法和应用与流程
本发明涉及肿瘤分子生物学领域,具体涉及定量检测白血病患者尤其是急性髓细胞性白血病(aml)患者细胞中prr34-as1作为分子标记物的方法及其用途。
背景技术:
急性髓细胞性白血病(aml)是起源于髓系祖细胞的一类造血系统恶性疾病,其发病涉及细胞分化、增殖、凋亡等多方面的异常改变,非随机性染色体异常、癌基因和抑癌基因突变等在aml发生发展过程中起着重要作用。近二十年的研究结果表明在白血病发生过程中表观遗传学(epigenetics)改变是继染色体异常、基因组改变如杂合性缺失以及基因突变等之外发挥重要作用的又一病理机制。表观遗传学是指在不改变dna序列的前提下,通过某些机制引起可遗传的基因表达或细胞表型的变化,主要包括dna甲基化、组蛋白修饰和非编码rna等。近年来的研究表明,非编码rna与aml的发生、发展密切相关,可以作为有效的分子标志物应用于aml的辅助诊断、预后判断和疾病监测,并且可以为治疗提供更多的靶向分子。临床上期待发现更多特异而敏感的非编码rna,并将其运用于aml的临床诊疗。
我们通过数据库分析prr34-as1在aml表达上调,提示prr34-as1可能在肿瘤的发生发展中起重要作用,当前尚无报道揭示prr34-a1在aml中的表达情况,以及是否可作为aml的标志物,也无在aml中prr34-as1表达的检测方法,我们发现prr34-as1启动子区域含有一个较大的cpg岛,目前尚无该基因启动子甲基化及其检测方法的报道。
技术实现要素:
针对上述现有技术,本发明的目的是提出一种新的急性髓系白血病患者的生物标志物及其检测方法,其是基于定量pcr检测人prr34-as1表达水平及启动子甲基化水平的方法,以此作为急性髓系白血病患者的生物标志物,为临床上急性髓系白血病患者的早期发现、治疗疗效及预后判断提供支持。
为了实现发明目的,本发明是通过以下技术方案实现的:
本发明的目的是提供一种prr34-as1作为新型生物标记物在制备白血病辅助诊断、治疗疗效或者预后判断试剂或药物的应用。
优选地,其中prr34-as1包含seqidno.1所示的核苷酸序列。
优选地,所述的急性髓系白血病辅助诊断、治疗疗效或者预后判断试剂为实时定量pcr检测试剂。
优选地,所述实时定量pcr检测试剂是一种检测人prr34-as1表达的特异性引物包括如seqidno.2所示的正向引物和如seqidno.3所示的反向引物。
优选地,所述检测试剂是检测prr34基因启动子区域cpg岛甲基化水平的特异性引物,所述特异性引物包括一对与发生甲基化的硫化dna模板匹配的特异性引物上游引物mf和下游引物mr和一对与未发生甲基化的硫化dna模板匹配的特异性引物上游引物uf和下游引物ur,所述针对甲基化序列的引物如seqidno.4-5所示,所述针对未甲基化序列的引物如seqidno.6-7所示。
本发明提供一种用于急性髓系白血病辅助诊断、治疗疗效或者预后判断的试剂盒,所述试剂盒包括如前所述的引物。
本发明提供所述的引物、所述的试剂盒在制备白血病辅助诊断、治疗效率或者预后判断用的试剂中的应用。
进一步,本发明提供定量pcr检测prr34-as1表达水平的试剂在制备急性髓系白血病辅助诊断、治疗疗效或者预后判断试剂或药物的应用,其中检测prr34-as1表达水平通过如下步骤实现:
(1)提取人组织或细胞样本总rna并对提取的rna样本进行质量检测;
(2)将步骤(1)总rna逆转录成cdna;
(3)将步骤(2)的cdna分别使用seqidno.2和seqidno.3所示的引物对进行扩增,以abl序列特异性引物进行定量pcr作为每个标本dna的质量控制,分析所述样本中prr34-as1的表达水平,得到相关数据。
优选地,当prr34-as1显著低表达时,意味着该患者接受诱导分化治疗的预后良好,具有较长的生存期。
本发明提供定量pcr检测prr34-as1基因启动子甲基化水平的试剂在制备急性髓系白血病辅助诊断、治疗疗效或者预后判断试剂或药物的应用,其中检测prr34-as1基因启动子甲基化水平通过如下步骤实现:
(1)提取人组织或体液样本基因组dna并对提取的dna样本进行质量检测;
(2)亚硫酸氢钠修饰基因组dna并纯化回收、定量;
(3)以回收的修饰dna为模板,分别使用seqidno.4-5和seqidno.6-7所示的甲基化和未甲基化特异性引物分别进行定量pcr;
(4)以alu序列特异性引物进行荧光定量pcr作为每个标本dna的质量控制;
(5)甲基化和未甲基化水平计算。
优选地,当prr34-as1基因启动子甲基化水平显著高于对照组时,意味着该患者接受诱导分化治疗的预后良好,具有较长的生存期。
本发明有益效果:本发明涉及用于检测白血病的新的基因标志物及其用途,还涉及使用该基因标志物对白血病进行检测的方法。与现有技术相比,本发明用于检测白血病的方法是基于基因标志物prr34-as1表达及甲基化的水平,与其他临床指标相结合,为白血病的诊断、治疗与预后提供更准确的判断。本发明提供的标志物及其引物组是发明人付出创造性劳动进行优化和筛选获得的,该标志物能够准确诊断或预测aml,该引物能够高灵敏高特异性的扩增靶基因。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
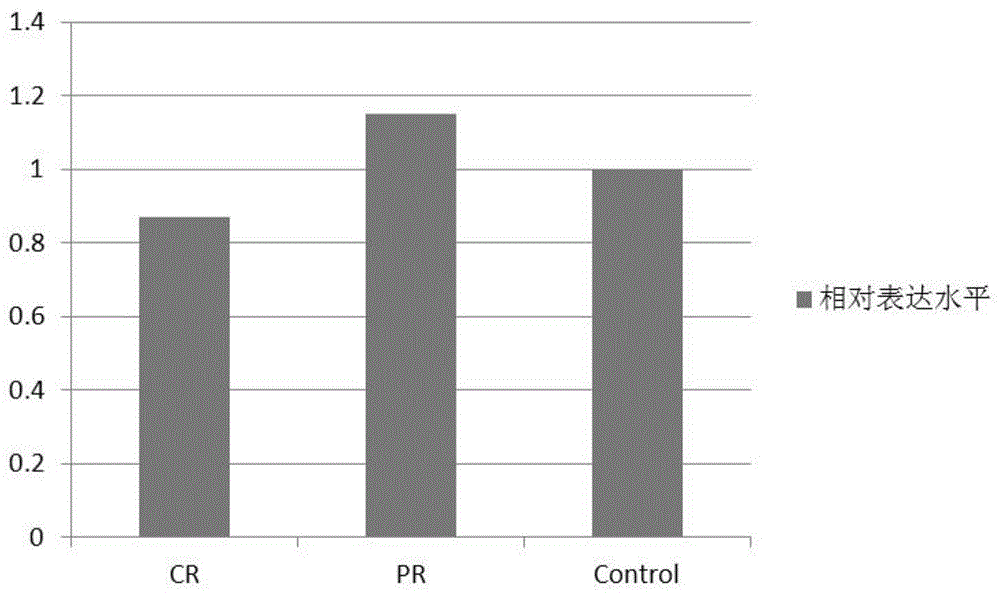
图1为amlcr和pr组的prr34-as1相对表达水平。
图2为amlcr和pr组的prr34-as1基因启动子甲基化相对水平。
图3为总生存率曲线分析。
具体实施方式
下面利用展示实例的方式来具体说明本发明的实施例,应该理解,这些实施例仅用于说明目的,而不用于限制本发明范围。对本发明公开的内容可以同时从材料、方法和反应条件进行改进,所有这些改进,均应落入本发明的精神和范围之内。
实施例1:建立基于定量pcr检测prr34-as1表达水平的方法
(1)总rna提取:
①骨髓单个核细胞分离:将获取的骨髓标本先后加5ml淋巴细胞分离液和红细胞裂解液,上下颠倒混匀,1000×rpm离心5min,弃上清;
②在上述沉淀中加1mltrizol,充分吹打混匀至水样;
③加200μl三氯甲烷,漩涡充分振荡30sec,室温静置5min,12000×rpm离心10min;
④上清加入干净1.5mlep管,同时加入600μl异丙醇,盖紧盖子,上下颠倒混匀50次,室温静置10min后,12000×rpm离心10min,小心弃去上清,ep管底白色沉淀即为rna;
⑤加入1ml70%乙醇,轻弹或颠倒混匀漂洗沉淀,12000×rpm离心5min,小心弃上清;
⑥再加入1ml100%乙醇,轻弹或颠倒混匀漂洗沉淀,12000×rpm离心10min,小心弃上清,并于洁净纸上扣干;
⑦将沉淀rna置于37℃金属浴干燥至沉淀可轻弹起,而后加入适量(10-20μl)depc,于冰上溶解rna;
⑧混匀后取2μlrna,应用nanodrop分光光度计检测所提取样本rna的浓度、纯度,
并调整至均一浓度。
(2)cdna逆转录:
①取0.2mlep管,分别依次加入4μl六随机引物、14μldepc水和4μgrna,置于普通pcr仪(37℃,5min);
②将8μl5×buffer、3μldepc水、4μldntp和1μlribolockrnaseinhibitor(thermoscientifictm)加入到上步ep管中,置于普通pcr仪(25℃5min);
③将2μlrevertaidreversetranscriptase(thermoscientifictm)继续加入上步产物中,继续反应(60℃60min),反应结束后将产物cdna保存于-20℃备用。
(3)实时定量pcr检测:
以abl1作为内参,prr34-as1及abl1反应体系为:2×aceqqpcrsybrgreenmastermix(vazyme)10.0μl,表达上游和下游引物各0.8μl,50×roxreferencedye0.4μl,ddh2o6.0μl,2.0μlcdna模板,总反应体积为20μl。检测引物序列见表1。
表1特异性检测引物
prr34-as1反应条件:预变性(95℃、5min),变性(95℃、10sec),退火(61℃、32sec),延伸(72℃、30sec),收集荧光(75℃,30sec),循环数为40循环;
(4)结果定量分析:
prr34-as1基因表达水平通过2-δδct进行计算,具体的计算公式如下:nprr34-as1=2δctprr34-as1(control-sample)÷2δctabl(control-sample)(2-δδct)每个平行实验重复3次。
实施例2:设计并合成特异性扩增prr34-as1基因启动子区域cpg岛的引物
针对prr34-as1基因启动子区域cpg岛信息,设计针对甲基化和未甲基化序列的两套引物,利用这2对引物可以特异性的分别扩增prr34-as1启动子区域cpg岛甲基化和未甲基化序列,进行后续的甲基化定量分析。具体设计步骤如下:
在ucsc(http://genome.ucsc.edu/)上找到并导出prr34-as1启动子cpg岛序列
路径:ucschomepage→tools→genesorter→genome(human)→search(prr34-as1)→go→选择prr34-as1→genomicsequence→选择启动子上游2000bp及下游60bp的5’utr→导出已得序列;
利用methylprimer1.0软件设计出所需msp引物;
实施路径:导入所得启动子序列→designprimers→findcpgislands→next→next→selectmsporbspandclicknext(designmspprimers)→得到甲基化及未甲基化引物序列,经过筛选和优化最终确定的甲基化引物如下:
具体序列信息如seqidno.4-7所示,引物在上海华大基因公司合成。
实施例3:建立基于定量pcr检测prr34-as1基因启动子gpg岛甲基化状态的方法
本发明的检测方法是基于甲基化特异性pcr原理,通过分别含有甲基化和非甲基化特异性引物的定量pcr扩增即可将甲基化与非甲基化dna序列区分开来。该方法包括如下步骤:
(1)dna模板制备
取1份aml和正常对照的肝素抗凝骨髓标本5-10ml,应用ficoll液分离单个核细胞,应用基因组dna提取试剂盒(购自gentra公司)提取单个核细胞中的基因组dna,具体步骤如下:
向细胞中加入1mltrizol(裂解液),充分混匀至水样;
加入200ul三氯甲烷(氯仿),盖紧盖子,在旋涡振荡器上充分震荡混匀(30-60s),静置10min;
12000r/min,离心10min,使其分为上中下三层;
吸取中间白膜层(含dna)至新的ep管内,加入100%无水乙醇300ul,上下颠倒混匀,静置10min后12000r/min,离心10min,弃去上清;
加入1ml柠檬酸三钠,上下颠倒混匀,静置15min,12000r/min离心10min,弃上清;
加入75%乙醇1ml,上下颠倒混匀,静置5min,12000r/min离心10min,弃上清;
再次加入100%无水乙醇1ml,轻轻上下颠倒混匀,静置1min,12000r/min离心10min后弃尽上清;
将下层剩余物于37℃金属浴中充分干燥,加入适量dna溶解液(te)于65℃金属浴5min,4℃孵育过夜;
孵育完成后进行琼脂糖凝胶电泳检测dna完整度,并用紫外分光光度计定量,260/280在1.7-2.1之间,dna样本浓度为250ng/μl,置于4℃保存备用。
(2)亚硫酸盐修饰
1.试剂使用chemicon公司cpgenomedna修饰试剂盒(canada);
2.取与dna相应管数的bisulfitemix,每管bisulfitemix中加800ulrnase-free水溶解。涡旋至bisulfitemix完全溶解(5min左右)。(注意:不要将bisulfitemix放到冰上;必要时可以放至60℃孵育后再涡旋溶解);
3.在200ul的pcr管中准备重亚硫酸盐反应液。总体积为140ul的反应液成分如下:dna液xul(总质量为1-500ng),rnase-free水(40-x)ul,溶解后的bisulfitemix85ul,dna保护缓冲液15ul。
4.盖上pcr管,完全混匀反应液,室温存放(dnaprotectbuffer在加入bisulfitemix后由绿色变为蓝色,表明转化反应充分且ph正确)。
5.放至pcr仪上反应。耗时约5小时。反应条件设置:变性95℃5min→孵育60℃25min→变性95℃5min→孵育60℃85min→变性95℃5min→孵育60℃175min→20℃保温过夜。
纯化回收转化产物(接上面第5步):
6.瞬时离心pcr管的转化液,转移至1.5ml的离心管中(若有沉淀,也将其转移);
7.每管加入现配的560ul缓冲液bl(含carrierrna),涡旋混匀后瞬离;
8.准备对应数量的epitect离心柱和收集管,将步骤7中的液体转移至离心柱中;
9.最大转速离心1分钟。弃收集管中液体后再将离心柱放入收集管中;
10.每个离心柱中加入500ul的缓冲液bw,最大转速离心1分钟。弃收集管中液体后再将离心柱放入收集管中;
11.每个离心柱中加入500ul的缓冲液bd,室温静置15分钟。(注意:若缓冲液bd中有沉淀,要避免将沉淀转移进去。加完缓冲液bd后要及时盖上盖子);
12.最大转速离心1分钟。弃收集管中液体后再将离心柱放入收集管中;
13.每个离心柱中加入500ul的缓冲液bw,最大转速离心1分钟。弃收集管中液体后再将离心柱放入收集管中;
14.重复步骤13一次;
15.将离心柱放至新的2ml收集管上,最大转速离心1分钟;
16.将离心柱开盖,放在新的1.5ml离心管上(自备),56℃孵育5分钟。(注:蒸发残余液体);
17.将离心柱放至新的1.5ml离心管上(自备),加入20ul缓冲液eb(小心滴在中央膜上),15000g(12000rpm)1分钟。(注:再用20ul缓冲液eb重复步骤17以提高dna产量)
注:-80℃长期可保存经重亚硫酸盐处理后的dna,或4℃短暂保存。
rq-msp扩增
用rq-msp方法检测prr34-as1和内参基因alu的启动子区甲基化,每次pcr反应均携带阴性质控(水)和阳性质控(目的基因质粒);仪器使用荧光定量pcr仪7500(abi公司,美国);rq-msp试剂使用sybrpremixextaqi(takara公司,日本)。具体步骤如下:
体系配制:
①prr34-as1甲基化pcr(m-msp)反应体系为:浓度均为10μm的m-msp正向引物和反向引物各0.8μl、10μltbgreentmpremixextaqtmⅱ、0.4μlroxreferencedyeⅱ(takara),2μldna模板和6μl灭菌水。
②prr34-as1未甲基化pcr(u-msp)反应体系为:浓度均为10μm的u-msp正向引物和反向引物各0.8μl、10μltbgreentmpremixextaqtmⅱ、0.4μlroxreferencedyeⅱ(takara),2μldna模板和6μl灭菌水。
③alu甲基化反应体系为:浓度均为10μm的alu正向引物和反向引物各0.5μl、2.5μl10×buffer、2.0μlmgcl2(25mmol/l),0.5μldntp(10mmol/l),1.2μl20×evagreen,0.5μl50×rox,1.0μltaqdna酶,2.0μldna模板和14.3μl灭菌水。
2.上机(反应条件分别设置如下):
①prr34-as1甲基化pcr(m-msp)反应条件:预变性95℃5min→40个循环(变性95℃10s;退火61℃32s;延伸72℃30s;荧光收集75℃32s)→95℃15s→60℃1min。
②prr34-as1未甲基化pcr(u-msp)反应条件:预变性95℃5min→40个循环(变性95℃10s;退火59℃30s;延伸72℃30s;荧光收集75℃32s)→95℃15s→60℃1min。
③alu反应条件:预变性95℃5min→20个循环(变性95℃30s;退火61℃32s;延伸72℃30s;荧光收集80℃30s)→95℃15s→60℃1min。
3.结果计算:
nm-prr34-as1=2δctm-prr34-as1(control-sample)÷2δctalu(control-sample)(2-δδct)
(4)结果分析
观察pcr扩增得到的熔解曲线,观察熔解曲线发现,每支pcr管中均得到单一熔解温度,即扩增产物的特异性良好。
实施例4:接受诱导治疗的完全缓解及非完全缓解的急性髓系白血病患者中prr34-as1表达以及启动子甲基化差异
取68例初诊aml样本提取rna作为分析样本,将其接受诱导治疗的患者分为完全缓解组及未完全缓解组,每一例样本均采用实施例1相同的处理方法进行处理,分别计算每例样本中prr34-as1表达水平。结果如图1所示,相较于完全缓解组和对照组,未完全缓解组aml患者样本prr34-as1表达水平明显增高。
仍取上述68例初诊aml样本提取其基因组dna作为分析样本,将其接受诱导治疗的患者分为完全缓解组及未完全缓解组,每一例样本均采用实施例3相同的处理方法进行处理,分别计算每例样本中prr34-as1基因启动子gpg岛甲基化状态。结果如图2所示,相较于完全缓解组和对照组,未完全缓解组aml患者样本prr34-as1基因启动子gpg岛甲基化水平明显降低。这也与对表达水平的分析情况相一致。
实施例5prr34-as1表达水平及其基因启动子甲基化水平在aml患者接受诱导分化治疗预后的预测中的应用价值
为了进一步验证prr34-as1表达水平是否可以作为预测接受诱导治疗的患者的预后标志物,我们选择了另外一组aml初诊患者,共40例,在未知诱导治疗结果的情况下,按照实施例1的处理方法进行处理,分别计算每例样本中prr34-as1表达水平。然后按照表达水平相对于对照组的升高情况进行分组,分为高表达组和低表达组,结果发现,prr34-as1表达水平相对于对照组明显升高的aml患者组在接受诱导治疗后,其病情未完全缓解,而表达水平相对于对照组未明显升高的患者组在接受诱导治疗后,其病情完全缓解。同时对这些患者进行2年随访,根据患者的生存情况制作了生存曲线,如图3a所示,prr34-as1表达水平相对于对照组明显升高的aml患者组在接受诱导治疗后的总生存率明显低于prr34-as1表达水平低的aml患者。
为了进一步验证prr34-as1基因启动子甲基化水平是否可以作为预测接受诱导治疗的患者的预后标志物,我们选择了另外一组aml初诊患者,共40例,在未知诱导治疗结果的情况下,按照实施例3的处理方法进行处理,分别计算每例样本中prr34-as1基因启动子甲基化水平。然后按照相对于对照组的升高情况进行分组,结果发现,prr34-as1基因启动子甲基化水平明显降低的aml患者组在接受诱导治疗后,其病情未完全缓解,而甲基化水平明显升高的患者组在接受诱导治疗后,其病情完全缓解。同时对这些患者进行2年随访,根据患者的生存情况制作了生存曲线,如图3b所示,prr34-as1启动子甲基化水平相对于对照组明显降低的aml患者组在接受诱导治疗后的总生存率明显低于prr34-as1启动子甲基化水平高的aml患者。
因此,本发明建立的基于定量pcr检测prr34-as1表达及启动子甲基化水平的方法,可用于aml的辅助诊断、预后判断和疾病监测,具有良好的应用前景。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用。它完全可以被适用于各种适合本发明的领域。对于熟悉本领域的人员而言,可容易地实现另外的修改。因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!