由芳基炔酸酯合成3位二氟甲基取代香豆素衍生物的方法与流程
[0001]
本发明属于有机合成领域,涉及一种由芳基炔酸酯关环合成3位二氟甲基取代香豆素衍生物的方法。
背景技术:
[0002]
将氟原子或者含氟基团引入有机小分子中,能够显著性地改善分子的亲脂性,脂溶性,代谢稳定性,细胞通透性等性质。因此,对含氟有机化合物的研究越来越多,尤其发现含氟有机化合物在医药,材料,农业等领域中发挥着重要的作用。二氟甲基是含氟官能团中一类重要的基团,它可以作为-nh,-oh或-sh 的电子等排体,将二氟甲基同样引入到药物分子中不仅可以改变药物的理化性质还可以改变药物的药理活性。
[0003]
前人报道了许多基于二氟甲基自由基的二氟甲基化反应。采用的二氟甲基自由基前体有二氟甲基亚磺酸锌,二氟甲基亚磺酸钠,二氟甲基亚磺酰氯,二氟甲基苯并噻唑砜,二氟甲基膦盐等。但用这些二氟甲基化试剂要么需要多步合成,要么在二氟甲基化反应过程中需要用到昂贵的金属催化剂。2017年maruoka 等人用[双(二氟乙酰氧基)碘]苯作为二氟甲基化试剂实现了对芳香杂环的直接二氟甲基化反应。但是用 [双(二氟乙酰氧基)碘]苯作为二氟甲基化试剂对芳基炔酸酯的二氟甲基化未见报道。
[0004]
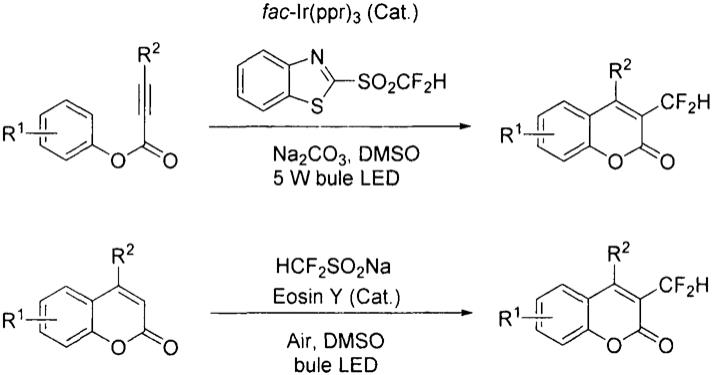
目前合成3位二氟甲基取代香豆素的方法包括:1)苯炔酸酯和二氟甲基苯并噻唑砜在fac-ir(ppy)3的催化下,在5w蓝光led灯的照射下关环得到。但是该方法用到了昂贵金属光催化剂,同时合成二氟甲基苯并噻唑砜需要多步反应。2)通过二氟甲基亚磺酸钠,在曙红y的催化下,在5w蓝光led灯的照射下与香豆素反应来制备。但是该方法使用的二氟甲基亚磺酸钠要通过二氟甲基苯并噻唑砜作为原料来合成。
[0005][0006]
本专利利用[双(二氟乙酰氧基)碘]苯作为二氟甲基化试剂,在可见光催化下,产生二氟甲基自由基,随后芳香丙炔酸酯发生自由基加成,氧化,和重排反应,得到3位二氟甲基取代的香豆素衍生物。[双(二氟乙酰氧基)碘]苯可以通过乙酸碘苯与二氟乙酸经过1步反应方便地制备。此外本专利使用的方法不需要光催化剂,操作简便。
技术实现要素:
[0007]
本发明的目的是由芳香丙炔酸酯关环合成3位二氟甲基取代的香豆素衍生物。
[0008]
一种在光催化下由芳基炔酸酯关环合成二氟甲基取代香豆素衍生物的方法,其特征在于以[双(二氟乙酰氧基)碘]苯为二氟甲基源。具体步骤:在无水无氧条件下加入芳基炔酸酯、[双(二氟乙酰氧基)碘] 苯和n,n二甲基乙酰胺,在蓝色18w led灯光照下室温反应。反应结束后,经萃取,洗涤,干燥,柱层析分离得到二氟甲基取代的香豆素衍生物。
[0009]
所述的二氟甲基化方法,其反应通式如下所示,其中r1选自氰基、苯基、甲氧基、卤素、叔丁基; r2选自环丙基、苯基、取代苯基;
[0010][0011]
表1用本发明合成二氟甲基香豆素衍生物的结构如下表所示:
[0012]
[0013][0014]
本发明与现有技术相比,具有的优点有:
[0015]
1、本发明所用的反应不需要光催化剂和氧化剂,条件操作简单、相对温和。
[0016]
2、[双(二氟乙酰氧基)碘]苯具有稳定性并且容易制备
[0017]
3、[双(二氟乙酰氧基)碘]苯既是反应中二氟甲基的来源,也是氧化剂,在氧化自由基到碳正离子,进而重排成香豆素的结构过程中起重要作用。
[0018]
具体的实施方式:
[0019]
本发明提供的由芳香丙炔酸酯合成3位二氟甲基香豆素衍生物的方法及,其反应式如下所示:
[0020][0021]
操作步骤如下:
[0022]
首先对10ml schlenk管进行无水无氧处理,通过烘枪高温除去反应管壁、管口以及管内中残留的水分,通过双排管进行氮气和反应管中空气置换,营造一个无水无氧环境,待schlenk管在氮气氛围中冷却后,将芳香丙炔酸酯及其衍生物(0.30mmol)、[双(二氟乙酰氧基)碘]苯(0.60mmol)依次加入反应管,用长针头注射器在双排管氮气的保护下取1.00ml无水dmac加入反应管中,搅拌下溶解两反应物,在蓝色18w led灯光照下室温反应。经tlc确认反应完全后,加入大量水洗涤,用乙酸乙酯萃取四次,饱和氯化钠溶液洗涤两次,取有机相用无水硫酸钠干燥,将溶剂通过旋蒸除去,残留物经硅胶柱层析纯化得到产物(流动相体系为石油醚∶乙酸乙酯)。
[0023]
下面通过实例具体说明:
[0024]
实施例1
[0025][0026]
首先对10ml schlenk管进行无水无氧处理,通过烘枪高温除去反应管壁、管口以及管内中残留的水分,通过双排管进行氮气和反应管中空气置换,营造一个无水无氧环境,待schlenk管在氮气氛围中冷却后,将3,5-二甲氧基苯基3-苯基丙酸酯(0.30mmol)、[双(二氟乙酰氧基)碘]苯(0.60mmol)依次加入反应管,用长针头注射器在双排管氮气的保护下取1.00ml无水dmac打入反应管中,搅拌下溶解两反应物,在蓝色18w led灯光照下室温反应。经tlc确认反应完全后,加入大量水洗涤,用乙酸乙酯萃取四次,饱和氯化钠溶液洗涤两次,取有机相用无水硫酸钠干燥,将溶剂通过旋蒸除去,残留物经硅胶柱层析纯化得到产物,白色固体,收率84%。1h nmr(400mhz,cdcl3)δ7.55(t,j=3.2hz,3h),7.33-7.31(m,2h), 6.74(d,j=2.4hz,1h),6.52(t,j=53.2hz,1h),6.02(d,j=2.8hz,1h),3.96(s,3h),3.62(s,3h).
13
c nmr (100mhz,cdcl3)δ157.71,156.48,156.19,148.33,138.70,132.14,129.77,128.75,128.40,120.14,118.43(t,j =22.0hz,1c),111.88(t,j=238.5hz,1c),104.45(d,j=2.0hz,1c),100.94,56.56(d,j=6.0hz,1c),55.72 (d,j=4.0hz,1c).
19
f nmr(376mhz,cdcl3)δ-114.69(s,2f).hrms esi(m/z):calcd for c
18
h
14
f2o4[m+ na]
+
:355.0752,found:355.0755.
[0027]
实施例2
[0028][0029]
首先对10ml schlenk管进行无水无氧处理,通过烘枪高温除去反应管壁、管口以及管内中残留的水分,通过双排管进行氮气和反应管中空气置换,营造一个无水无氧环境,待schlenk管在氮气氛围中冷却后,将3-(4-氯苯基)丙酸酯(0.30mmol)、[双(二氟乙酰氧基)碘]苯(0.60mmol)依次加入反应管,用长针头注射器在双排管氮气的保护下取1.00ml无水dmac打入反应管中,搅拌下溶解两反应物,在蓝色18w led灯光照下室温反应。经tlc确认反应完全后,加入大量水洗涤,用乙酸乙酯萃取四次,饱和氯化钠溶液洗涤两次,取有机相用无水硫酸钠干燥,将溶剂通过旋蒸除去,残留物经硅胶柱层析纯化得到产物,淡黄色油,收率74%。1h nmr(400mhz,cdcl3)δ7.64(t,j=1.2,1h),7.54(d,j=8.3hz,2h),7.41 (d,j=8.4hz,1h),7.29(d,j=8.4hz,2h),7.25(t,j=7.3hz,1h),7.09(d,j=7.2hz,1h),6.68(t,j=53.3hz, 1h).
13
c nmr(100mhz,cdcl3)δ158.18,155.24,153.68,136.08,133.79,130.29,129.90,129.13,128.38, 124.94,119.44,118.26(t,j=22.0hz,1c),117.23,111.53(t,j=237.0hz,1c).
19
f nmr(376mhz,cdcl3)δ
ꢀ-
113.76(s,2f).hrms esi(m/z):calcd for c
16
h9clf2o2[m+na]
+
:329.0151,found:329.0154.
[0030]
实施例3
[0031][0032]
首先对10ml schlenk管进行无水无氧处理,通过烘枪高温除去反应管壁、管口以及管内中残留的水分,通过双排管进行氮气和反应管中空气置换,营造一个无水无氧环境,待schlenk管在氮气氛围中冷却后,将3-氟苯基3-苯基丙酸酯(0.30mmol)、[双(二氟乙酰氧基)碘]苯(0.60mmol)依次加入反应管,用长针头注射器在双排管氮气的保护下取1.00ml无水dmac打入反应管中,搅拌下溶解两反应物,在蓝色18w led灯光照下室温反应。经tlc确认反应完全后,加入大量水洗涤,用乙酸乙酯萃取四次,饱和氯化钠溶液洗涤两次,取有机相用无水硫酸钠干燥,将溶剂通过旋蒸除去,残留物经硅胶柱层析纯化得到产物,白色固体,收率64%。1h nmr(400mhz,cdcl3)δ7.58-7.57(m,3h),7.34-7.31(m,2h),7.14-7.10(m, 2h),6.95(td,j=8.0hz,2.4hz,1h),6.49(t,j=53.2hz,1h).
13
c nmr(100mhz,cdcl3)δ166.79,164.24, 157.56,156.05,155.03(d,j=13.0hz,1c),131.59,130.72(d,j=10.0hz,1c),130.02,128.98,128.38,116.39, 113.01(d,j=23.0hz,1c),111.75(t,j=237.0hz,1c),104.59(d,j=26.0hz,1c).
19
f nmr(376mhz, cdcl3)δ-102.34(s,1f),-114.78(s,2f).hrms esi(m/z):calcd for c
16
h9f3o2[m+na]
+
:313.0447,found: 313.0450.
[0033]
实施例4
[0034][0035]
首先对10ml schlenk管进行无水无氧处理,通过烘枪高温除去反应管壁、管口以及管内中残留的水分,通过双排管进行氮气和反应管中空气置换,营造一个无水无氧环境,待schlenk管在氮气氛围中冷却后,将3-环丙基丙酸酯苯基(0.30mmol)、[双(二氟乙酰氧基)碘]苯(0.60mmol)依次加入反应管,用长针头注射器在双排管氮气的保护下取1.00ml无水dmac打入反应管中,搅拌下溶解两反应物,在蓝色 18w led灯光照下室温反应。经tlc确认反应完全后,加入大量水洗涤,用乙酸乙酯萃取四次,饱和氯化钠溶液洗涤两次,取有机相用无水硫酸钠干燥,将溶剂通过旋蒸除去,残留物经硅胶柱层析纯化得到产物,白色固体,收率23%。1h nmr(400mhz,cdcl3)δ8.17(d,j=8.0hz,1h),7.59(td,j=8.4hz,1.2hz, 1h),7.37-7.33(m,2h),7.18(t,j=53.6hz,1h),2.06-1.99(m,1h),1.35-1.32(m,2h),0.91(q,j=6.0hz,2h). 13
c nmr(100mhz,cdcl3)δ158.66,157.22(d,j=3.0hz,1c),153.44,133.14,127.27,124.61,120.26(t,j= 22.3hz,1c),120.18,117.27,111.78(t,j=239.0hz,1c),10.83,8.06,0.14.
19
f nmr(376mhz,cdcl3)δ
ꢀ-
116.78(s,2f).hrms esi(m/z):calcd for c
13
h
10
f2o2[m+na]
+
:259.0541,found:259.0544。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1