一种3-亚苄基-2,3-二氢喹诺酮化合物的制备方法
1.本发明属于有机合成领域,尤其涉及一种3-亚苄基-2,3-二氢喹诺酮化合物的制备方法。
背景技术:
2.2,3-二氢喹诺酮化合物是一种重要的含羰基六元氮杂环,广泛存在于各种具有重要生物活性分子骨架中,如具有潜在止痛活性的化合物a(j.med.chem.1965,8,566-571)和抗癌分子b(j.med.chem.1998,41,1155-1162)等。
[0003][0004]
基于2,3-二氢喹诺酮骨架的重要性,至今已有大量文献报道其合成方法(chem.2019,5,1059-1011)。然而,通过羰基化反应合成2,3-二氢喹诺酮类化合物的报道较少,目前应用并不广泛,具有较大的应用前景。
[0005]
基于此,我们发展了一种以n-吡啶磺酰基-邻碘苯胺和联烯为起始原料,过渡金属钯催化的羰基化反应高效地合成3-亚苄基-2,3-二氢喹诺酮化合物的方法。
技术实现要素:
[0006]
本发明提供了一种3-亚苄基-2,3-二氢喹诺酮化合物的制备方法,该制备方法步骤简单,可以兼容多种官能团,反应适用性好,此方法还可以扩大至克级,为工业上大规模生产应用提供了可能。
[0007]
一种3-亚苄基-2,3-二氢喹诺酮化合物的制备方法,包括如下步骤:将二(乙酰丙酮)钯、1,3-双(二苯基膦)丙烷、三乙胺、1,3,5-均三甲酸苯酚酯,n-吡啶磺酰基-邻碘苯胺和联烯加入到有机溶剂中,于80~100℃进行反应24~48小时,反应完全后,后处理得到所述的3-亚苄基-2,3-二氢喹诺酮化合物;
[0008]
所述的n-吡啶磺酰基-邻碘苯胺的结构如式(ii)所示:
[0009][0010]
所述的联烯的结构如式(iii)所示:
[0011][0012]
所述的3-亚苄基-2,3-二氢喹诺酮化合物的结构如式(ⅰ)所示:
[0013][0014]
式(ⅰ)~(iii)中,r为取代或者未取代的芳基;
[0015]
所述芳基上的取代基选自甲基、叔丁基、甲氧基、卤素中的一个或者多个;取代位置可以为邻位、对位或者间位。
[0016]
进一步的,所述的芳基优选为苯基或者萘基。
[0017]
所述的二(乙酰丙酮)钯、1,3-双(二苯基膦)丙烷和1,3,5-均三甲酸苯酚酯的摩尔比为0.1:0.1:1;
[0018]
反应式如下:
[0019][0020]
反应中可能首先经历了钯插入n-吡啶磺酰基-邻碘苯胺的碳氮键形成芳基钯中间体,1,3,5-均三甲酸苯酚酯放出的一氧化碳插入芳基钯中间体生成酰基钯中间体。随后,联烯与酰基钯中间体配位、插入得到烷基钯中间体。最后,发生还原消除得到3-亚苄基-2,3-二氢喹诺酮化合物。
[0021]
本发明中,可选用的后处理过程包括:过滤,硅胶拌样,最后经过柱层析纯化得到相应的3-亚苄基-2,3-二氢喹诺酮化合物,采用柱层析纯化为本领域常用的技术手段。
[0022]
作为优选,r为取代或者未取代的苯基,所述苯基上的取代基选自甲基、叔丁基、甲氧基、f、cl、br中的一个或者多个,反应的产率较高。
[0023]
作为优选,所述的反应的时间为24~48小时,反应时间较短难以保证反应的完全。
[0024]
本发明中,作为优选,所述的有机溶剂为甲苯,此时,各种原料都能以较高的转化率转化成产物。
[0025]
所述的有机溶剂的用量能将原料较好的溶解即可,1mmol的n-吡啶磺酰基-邻碘苯胺使用的有机溶剂的量约为5ml。
[0026]
作为优选,所述的催化剂为二(乙酰丙酮)钯,在众多钯催化剂中反应效率较高。
[0027]
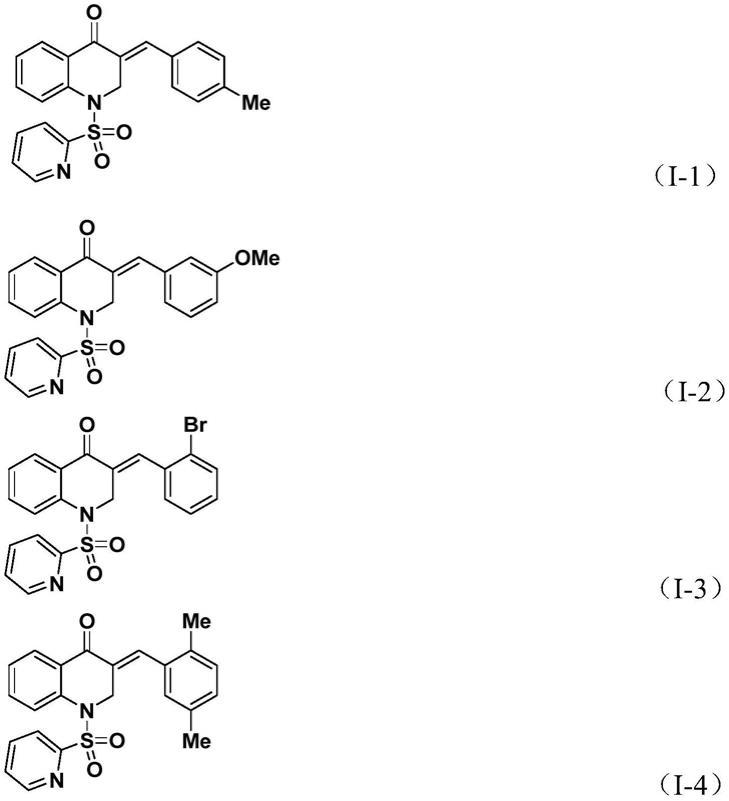
作为进一步的优选,所述的3-亚苄基-2,3-二氢喹诺酮化合物为式(i-1)-式(i-5)所示化合物中的一种:
[0028][0029][0030]
上述制备方法中,所述的二(乙酰丙酮)钯和1,3-双(二苯基膦)丙烷一般采用市售产品,都能从市场上方便地得到;所述的n-吡啶磺酰基-邻碘苯胺可由相应的邻碘苯胺和吡啶磺酰氯快速合成得到;所述的联烯可由相应的烯烃快速合成得到。
[0031]
同现有技术相比,本发明的有益效果体现在:该制备方法易于操作,后处理简便;反应起始原料廉价易得,底物可设计性强,底物官能团容忍范围广,反应效率高,可快速合成3-亚苄基-2,3-二氢喹诺酮化合物,实用性较强。
具体实施方式
[0032]
下面结合具体实施例对本发明做进一步的描述。
[0033]
按照表1的原料配比在35ml的schlenk管中加入二(乙酰丙酮)钯、1,3-双(二苯基膦)丙烷、三乙胺(1mmol)、1,3,5-均三甲酸苯酚酯、n-吡啶磺酰基-邻碘苯胺(ii)、联烯
(iii)和有机溶剂2.5ml,混合搅拌均匀,按照表2的反应条件反应24小时,过滤,硅胶拌样,经过柱层析纯化得到相应的3-亚苄基-2,3-二氢喹诺酮化合物(ⅰ),反应过程如下式所示:
[0034][0035]
表1实施例1~15的原料加入量
[0036][0037]
表2
[0038][0039]
表1和表2中,t为反应温度,t为反应时间,ph为苯基,me为甲基,ome为甲氧基,t-bu为叔丁基,toluene为甲苯。
[0040]
实施例1~5制备得到化合物的结构确认数据:
[0041]
由实施例1制备得到的3-亚苄基-2,3-二氢喹诺酮化合物(i-1)的核磁共振(1h nmr、
13
c nmr)和高分辨(hrms)检测数据为:
[0042][0043]1h nmr(400mhz,cdcl3)δ8.36
–
8.35(m,1h),7.95(dd,j=7.8,1.5hz,1h),7.75(dd,j=8.2,0.5hz,1h),7.63
–
7.55(m,2h),7.48(d,j=7.8hz,1h),7.44(s,1h),7.36
–
7.32(m,2h),7.26
–
7.23(m,2h),7.18(d,j=8.1hz,2h),5.09(d,j=1.4hz,2h),2.39(s,3h).
[0044]
13
c nmr(100mhz,cdcl3)δ183.0,156.1,150.1,141.6,140.3,137.9,137.8,137.7,134.0,131.3,130.2,129.7,129.5,128.8,128.2,126.9,126.2,122.7,48.3,21.5.
[0045]
hrms(esi-tof)calcd.for c
22
h
19
n2o3s
+
[m+h]
+
:391.1111;found:391.1115.
[0046]
由实施例2制备得到的3-亚苄基-2,3-二氢喹诺酮化合物(i-2)的核磁共振(1h nmr、
13
c nmr)和高分辨(hrms)检测数据为:
[0047][0048]1h nmr(400mhz,cdcl3)δ8.39(dd,j=4.6,0.6hz,1h),7.96(dd,j=7.8,1.4hz,1h),7.76(d,j=7.8hz,1h),7.65(td,j=7.8,1.7hz,1h),7.60
–
7.56(m,1h),7.53(d,j=7.8hz,1h),7.47(s,1h),7.36(ddd,j=13.6,9.2,4.3hz,3h),6.96
–
6.93(m,1h),6.88(d,j=7.7hz,2h),5.10(d,j=1.4hz,2h),3.84(s,3h).
[0049]
13
c nmr(100mhz,cdcl3)δ183.0,159.8,156.1,150.1,141.7,138.0,137.6,135.4,134.2,130.6,130.0,128.7,128.3,127.0,126.9,126.1,122.8,122.3,115.4,115.3,55.4,48.3.
[0050]
hrms(esi-tof)calcd.for c
22
h
19
n2o4s
+
[m+h]
+
:407.1060;found:407.1064.
[0051]
由实施例3制备得到3-亚苄基-2,3-二氢喹诺酮化合物(i-3)的核磁共振(1h nmr、
13
c nmr)和高分辨(hrms)检测数据为:
[0052][0053]1h nmr(400mhz,cdcl3)δ8.44(dd,j=4.6,0.7hz,1h),7.97(dd,j=7.8,1.5hz,1h),7.78(d,j=8.2hz,1h),7.72(td,j=7.8,1.7hz,1h),7.68(s,1h),7.64(dd,j=8.0,0.8hz,1h),7.61
–
7.55(m,2h),7.41
–
7.36(m,2h),7.34
–
7.31(m,2h),7.28
–
7.23(m,1h),5.01(d,j=1.6hz,2h).
[0054]
13
c nmr(100mhz,cdcl3)δ182.5,155.8,150.1,141.6,138.2,136.6,134.3,133.4,131.5,130.9,130.2,128.6,128.4,127.7,127.3,127.0,126.0,125.7,122.6,48.4.
[0055]
hrms(esi-tof)calcd.for c
21
h
16
brn2o3s
+
[m+h]
+
:455.0060;found:455.0052.
[0056]
由实施例4制备得到的3-亚苄基-2,3-二氢喹诺酮化合物(i-4)的核磁共振(1h nmr、
13
c nmr)和高分辨(hrms)检测数据为:
[0057][0058]1h nmr(400mhz,cdcl3)δ8.42(dd,j=4.6,0.7hz,1h),7.99(dd,j=7.8,1.4hz,1h),7.79
–
7.77(m,1h),7.72
–
7.67(m,2h),7.61
–
7.55(m,2h),7.38(ddd,j=7.7,4.8,1.1hz,1h),7.34(td,j=7.8,1.0hz,1h),7.11(s,2h),6.98(s,1h),5.02(d,j=1.6hz,2h),2.34(s,3h),2.15(s,3h).
[0059]
13
c nmr(100mhz,cdcl3)δ183.1,156.4,150.0,149.9,141.8,137.9,137.0,136.9,135.6,134.8,134.1,133.0,130.5,129.2,128.8,128.4,127.0,126.8,125.8,122.7,48.5,21.1,19.5.
[0060]
hrms(esi-tof)calcd.for c
23
h
21
n2o3s
+
[m+h]
+
:405.1267;found:405.1273.
[0061]
由实施例5制备得到的3-亚苄基-2,3-二氢喹诺酮化合物(i-5)的核磁共振(1h nmr、
13
c nmr)和高分辨(hrms)检测数据为:
[0062][0063]1h nmr(400mhz,cdcl3)δ8.39(d,j=4.0hz,1h),8.01(dd,j=7.8,1.4hz,1h),7.90
–
7.85(m,3h),7.80
–
7.77(m,2h),7.65(s,1h),7.63
–
7.59(m,2h),7.58
–
7.53(m,2h),7.48(d,j=7.8hz,1h),7.39
–
7.34(m,3h),5.20(d,j=1.3hz,2h).
[0064]
13
c nmr(100mhz,cdcl3)δ183.0,156.2,150.1,141.7,137.9,137.7,134.2,133.6,133.1,131.7,130.5,130.4,128.8,128.7,128.6,128.3,127.9,127.6,127.0,126.9,126.7,126.2,122.8,48.4.
[0065]
hrms(esi-tof)calcd.for c
25
h
18
n2o3sna
+
[m+na]
+
:449.0930;found:449.0931.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1