一种2-氨基2,3二甲基丁酰胺的制备方法与流程
[0001]
本发明涉及2-氨基2,3二甲基丁酰胺制备技术领域,尤其涉及一种2-氨基2,3二甲基丁酰胺的制备方法。
背景技术:
[0002]
2-氨基-2,3-二甲基丁酰胺,外观为白色片状晶体,熔点为84℃,能溶于水和大多数有机溶剂。是咪唑啉酮类超高效除草剂如咪唑乙烟酸、咪唑喹啉酸和甲氧咪草烟等的通用中间体,市场需求广阔。但是至制备2-氨基-2,3-二甲基丁酰胺的过程中,其中所含的腈水合酶在中性偏酸的条件下,稳定性较好,而其碱性环境会对该酶的酶活造成严重的抑制,影响2-氨基-2,3-二甲基丁酰胺的被吸收反应效果。因此,我们提出了一种2-氨基2,3二甲基丁酰胺的制备方法用于解决上述问题。
技术实现要素:
[0003]
本发明的目的是为了解决现有技术中存在的缺点,而提出的一种2-氨基2,3二甲基丁酰胺的制备方法。
[0004]
一种2-氨基2,3二甲基丁酰胺的制备方法,包括以下步骤:
[0005]
s1、菌株的筛选:对大肠杆菌重组腈水合酶酶库进行筛选,获得来源于pseudonocardia thermophila jcm3095的大肠杆菌重组菌;
[0006]
s2、新菌株的获取:以pet-28a为载体,通过镍柱对大肠杆菌重组菌进行纯化,纯化时加入0.2mm金属离子和0.8ml有机溶剂,以获得新菌株;
[0007]
s3、发酵条件优化:令新菌株在30-40℃下生长至od600为0.8-1.0时,向其中添加诱导剂,令其在发酵培养基内进行发酵24-48h以获得腈水合酶,在培养过程中,间隔补加1%(w/v)鲜骨蛋白胨;
[0008]
s4、反应体系的构建:以2-氨基-2,3-二甲基丁腈为底物,腈水合酶作为催化剂,在hfe-7100/水(10%,v/v)两相体系下,于ph6.0-10.0、20-40℃环境下进行催化水合反应,制得2-氨基-2,3-二甲基丁酰胺。
[0009]
优选的,所述菌株的筛选过程采用的是铁离子显色反应,其中,铁离子显色反应的标准为颜色呈深紫色且带有金属光泽。
[0010]
优选的,所述金属离子为ni
2+
、k
+
和ca
2+
中的任意一种,有机溶剂为异辛烷、醋酸甲酯和乙二醇单甲醚的其中一种。
[0011]
优选的,所述载体与大肠杆菌重组菌的结合过程如下:先利用ecori和hindiii酶切割位点,然后进行蛋白诱导表达,将切割下的质粒与基因用dna连接酶连接成重组质粒,最后与大肠杆菌重组菌的感受态细胞混合。
[0012]
优选的,所述诱导剂为0.1mm iptg,诱导温度为20℃。
[0013]
优选的,所述发酵培养基组分为1.6%(w/v)山梨醇、2%(w/v)鲜骨蛋白胨、1%(w/v)oxoid酵母提取物和0.25%(w/v)na2hpo4。
[0014]
优选的,所述新菌株为大肠杆菌重组菌中的e.coli bl21(de3)/pet-28a(+)nhase。
[0015]
优选的,所述s3中补加鲜骨蛋白胨的起始时间为第4个小时,且补加的时间间隔为4h。
[0016]
优选的,所述2-氨基-2,3-二甲基丁腈的初始浓度为0.03-0.3m,且在s4中,2-氨基-2,3-二甲基丁腈和腈水合酶的配比为(1.1-1.3):1。
[0017]
本发明的有益效果是:
[0018]
1、本发明在制备过程中,向其中添加金属离子,其可以维持多相体系的渗透平衡,且在添加的过程中,发现在加入了ni
2+
后,经发酵后,腈水合酶的活性提幅都高于其他金属离子。
[0019]
2、本发明在制备过程中,向其中添加有机溶剂,其可以改善腈水合酶的稳定性,且在添加的过程中,发现在加入量异辛烷后,经发酵后,其对腈水合酶活性的促进作用都优于其他有机溶剂的效果。
[0020]
综上所述,本发明在制备过程中,加入金属离子和有机溶剂,能够对腈水合酶的活力存在一定的影响,既能进一步提高其在中性偏酸的条件下的稳定性,又能改善碱性环境下对酶的抑制作用。
具体实施方式
[0021]
下面结合具体实施例对本发明作进一步解说。
[0022]
一种2-氨基2,3二甲基丁酰胺的制备方法,包括以下步骤:
[0023]
s1、菌株的筛选:对大肠杆菌重组腈水合酶酶库进行筛选,通过铁离子显色反应,获得来源于pseudonocardia thermophila jcm3095的大肠杆菌重组菌;
[0024]
s2、新菌株的获取:以pet-28a为载体,通过镍柱对大肠杆菌重组菌进行纯化,纯化时加入0.2mm金属离子和0.8ml有机溶剂,以获得新菌株,其中金属离子为ni
2+
、k
+
和ca
2+
中的任意一种,有机溶剂为异辛烷、醋酸甲酯和乙二醇单甲醚的其中一种,在将载体与大肠杆菌重组菌结合时,先利用ecori和hindiii酶切割位点,然后进行蛋白诱导表达,将切割下的质粒与基因用dna连接酶连接成重组质粒,最后与大肠杆菌重组菌的感受态细胞混合;
[0025]
s3、发酵条件优化:令新菌株在37℃下生长至od600为0.8时,向其中添加诱导剂0.1mm iptg,在20℃环境下进行诱导,令其在发酵培养基内进行发酵24h以获得腈水合酶,在培养过程中,从第4个小时开始,每隔4h向其中补加1%(w/v)鲜骨蛋白胨;
[0026]
s4、反应体系的构建:以2-氨基-2,3-二甲基丁腈为底物,腈水合酶作为催化剂,并令其二者以1.3:1的配比在hfe-7100/水(10%,v/v)两相体系下,于ph6.0、35℃环境下进行催化水合反应,制得2-氨基-2,3-二甲基丁酰胺。
[0027]
其中,发酵培养基组分为1.6%(w/v)山梨醇、2%(w/v)鲜骨蛋白胨、1%(w/v)oxoid酵母提取物和0.25%(w/v)na2hpo4;2-氨基-2,3-二甲基丁腈的初始浓度为0.3m。
[0028]
实施例一:
[0029]
一种2-氨基2,3二甲基丁酰胺的制备方法,包括以下步骤:
[0030]
s1、菌株的筛选:对大肠杆菌重组腈水合酶酶库进行筛选,通过铁离子显色反应,获得来源于pseudonocardia thermophila jcm3095的大肠杆菌重组菌;
[0031]
s2、新菌株的获取:以pet-28a为载体,通过镍柱对大肠杆菌重组菌进行纯化,纯化时加入0.2mm金属离子和0.8ml有机溶剂,以获得新菌株;
[0032]
s3、发酵条件优化:令新菌株在37℃下生长至od600为0.8时,向其中添加诱导剂0.1mm iptg,在20℃环境下进行诱导,令其在发酵培养基内进行发酵24h以获得腈水合酶,在培养过程中,从第4个小时开始,每隔4h向其中补加1%(w/v)鲜骨蛋白胨;
[0033]
s4、反应体系的构建:以2-氨基-2,3-二甲基丁腈为底物,腈水合酶作为催化剂,并令其二者以1.3:1的配比在hfe-7100/水(10%,v/v)两相体系下,于ph6.0、35℃环境下进行催化水合反应,制得2-氨基-2,3-二甲基丁酰胺。
[0034]
实施例二:
[0035]
一种2-氨基2,3二甲基丁酰胺的制备方法,包括以下步骤:
[0036]
s1、菌株的筛选:对大肠杆菌重组腈水合酶酶库进行筛选,通过铁离子显色反应,获得来源于pseudonocardia thermophila jcm3095的大肠杆菌重组菌;
[0037]
s2、新菌株的获取:以pet-28a为载体,通过镍柱对大肠杆菌重组菌进行纯化,纯化时加入0.2mm金属离子和0.8ml有机溶剂,以获得新菌株;
[0038]
s3、发酵条件优化:令新菌株在37℃下生长至od600为0.8时,向其中添加诱导剂0.1mm iptg,在20℃环境下进行诱导,令其在发酵培养基内进行发酵24h以获得腈水合酶,在培养过程中,从第4个小时开始,每隔4h向其中补加1%(w/v)鲜骨蛋白胨;
[0039]
s4、反应体系的构建:以2-氨基-2,3-二甲基丁腈为底物,腈水合酶作为催化剂,并令其二者以1.3:1的配比在hfe-7100/水(10%,v/v)两相体系下,于ph8.0、35℃环境下进行催化水合反应,制得2-氨基-2,3-二甲基丁酰胺。
[0040]
对比例一-对比例三:
[0041]
一种2-氨基2,3二甲基丁酰胺的制备方法,包括以下步骤:
[0042]
s1、菌株的筛选:对大肠杆菌重组腈水合酶酶库进行筛选,通过铁离子显色反应,获得来源于pseudonocardia thermophila jcm3095的大肠杆菌重组菌;
[0043]
s2、新菌株的获取:以pet-28a为载体,通过镍柱对大肠杆菌重组菌进行纯化,纯化时加入0.2mm金属离子,以获得新菌株;
[0044]
s3、发酵条件优化:令新菌株在37℃下生长至od600为0.8时,向其中添加诱导剂0.1mm iptg,在20℃环境下进行诱导,令其在发酵培养基内进行发酵24h以获得腈水合酶,在培养过程中,从第4个小时开始,每隔4h向其中补加1%(w/v)鲜骨蛋白胨;
[0045]
s4、反应体系的构建:以2-氨基-2,3-二甲基丁腈为底物,腈水合酶作为催化剂,并令其二者以1.3:1的配比在hfe-7100/水(10%,v/v)两相体系下,于35℃且为酸性的环境下进行催化水合反应,制得2-氨基-2,3-二甲基丁酰胺。
[0046]
对比例四-对比例六:
[0047]
一种2-氨基2,3二甲基丁酰胺的制备方法,包括以下步骤:
[0048]
s1、菌株的筛选:对大肠杆菌重组腈水合酶酶库进行筛选,通过铁离子显色反应,获得来源于pseudonocardia thermophila jcm3095的大肠杆菌重组菌;
[0049]
s2、新菌株的获取:以pet-28a为载体,通过镍柱对大肠杆菌重组菌进行纯化,纯化时加入0.2mm金属离子,以获得新菌株;
[0050]
s3、发酵条件优化:令新菌株在37℃下生长至od600为0.8时,向其中添加诱导剂
0.1mm iptg,在20℃环境下进行诱导,令其在发酵培养基内进行发酵24h以获得腈水合酶,在培养过程中,从第4个小时开始,每隔4h向其中补加1%(w/v)鲜骨蛋白胨;
[0051]
s4、反应体系的构建:以2-氨基-2,3-二甲基丁腈为底物,腈水合酶作为催化剂,并令其二者以1.3:1的配比在hfe-7100/水(10%,v/v)两相体系下,于35℃且为碱性的环境下进行催化水合反应,制得2-氨基-2,3-二甲基丁酰胺。
[0052]
于对比例一-对比例六中,分别加入三种金属离子(ni
2+
、k
+
和ca
2+
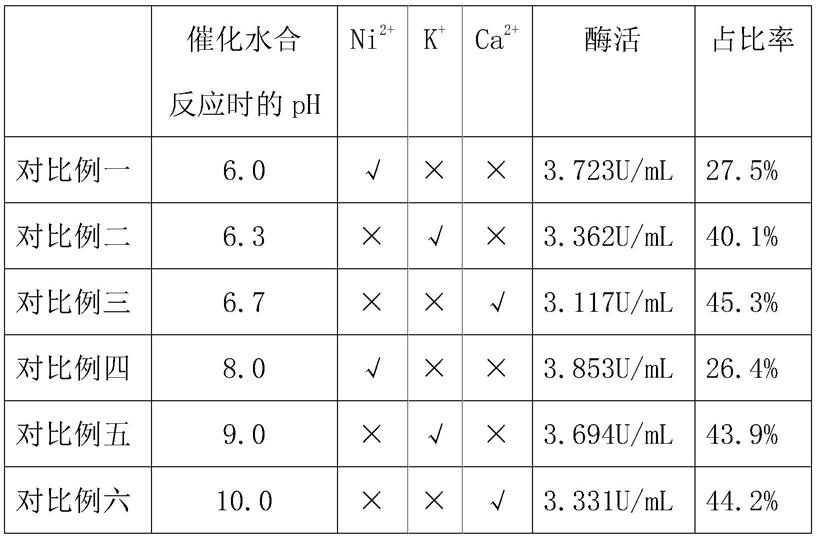
),检测发酵后腈水合酶的酶活,另外,再取湿菌体(小球诺卡氏菌)3.0g悬浮于180ml ph 7.8的磷酸盐缓冲液中,在30℃、转速180rpm的条件下预热5min,加入2-氨基-2,3-二甲基丁酰胺,使其终浓度达到0.2m,反应40min,取样气相测定上述反应40min后的反应溶液每100ml中2-氨基-2,3-二甲基丁酰胺的浓度(即2-氨基-2,3-二甲基丁酰胺此时的占比率,占比率高则说明2-氨基-2,3-二甲基丁酰胺仍有大量未被吸收反应,吸收反应率低,反之则说明2-氨基-2,3-二甲基丁酰胺吸收反应率高),具体数据如下表所示(表中“√”表示加入,
“×”
表示未加入):
[0053][0054]
注:占比率为100ml的反应后溶液中2-氨基-2,3-二甲基丁酰胺所占的百分比。
[0055]
由上表数据可知,向菌株中添加金属离子(ni
2+
、k
+
或ca
2+
),都可以维持多相体系的渗透平衡,且在添加的过程中,可以发现在加入了ni
2+
后,发酵后腈水合酶的活性的增幅都高于其他金属离子,另外,在同样的条件下,加入了ni
2+
改性后的2-氨基-2,3-二甲基丁酰胺在反应容液中的占比率相对较低,也就是说,该情况下的2-氨基-2,3-二甲基丁酰胺更易被吸收反应。
[0056]
对比例七-对比例九:
[0057]
一种2-氨基2,3二甲基丁酰胺的制备方法,包括以下步骤:
[0058]
s1、菌株的筛选:对大肠杆菌重组腈水合酶酶库进行筛选,通过铁离子显色反应,获得来源于pseudonocardia thermophila jcm3095的大肠杆菌重组菌;
[0059]
s2、新菌株的获取:以pet-28a为载体,通过镍柱对大肠杆菌重组菌进行纯化,纯化时加入0.8ml有机溶剂,以获得新菌株;
[0060]
s3、发酵条件优化:令新菌株在37℃下生长至od600为0.8时,向其中添加诱导剂0.1mm iptg,在20℃环境下进行诱导,令其在发酵培养基内进行发酵24h以获得腈水合酶,在培养过程中,从第4个小时开始,每隔4h向其中补加1%(w/v)鲜骨蛋白胨;
[0061]
s4、反应体系的构建:以2-氨基-2,3-二甲基丁腈为底物,腈水合酶作为催化剂,并令其二者以1.3:1的配比在hfe-7100/水(10%,v/v)两相体系下,于35℃且为酸性的环境下进行催化水合反应,制得2-氨基-2,3-二甲基丁酰胺。
[0062]
对比例十-对比例十二:
[0063]
一种2-氨基2,3二甲基丁酰胺的制备方法,包括以下步骤:
[0064]
s1、菌株的筛选:对大肠杆菌重组腈水合酶酶库进行筛选,通过铁离子显色反应,获得来源于pseudonocardia thermophila jcm3095的大肠杆菌重组菌;
[0065]
s2、新菌株的获取:以pet-28a为载体,通过镍柱对大肠杆菌重组菌进行纯化,纯化时加入0.8ml有机溶剂,以获得新菌株;
[0066]
s3、发酵条件优化:令新菌株在37℃下生长至od600为0.8时,向其中添加诱导剂0.1mm iptg,在20℃环境下进行诱导,令其在发酵培养基内进行发酵24h以获得腈水合酶,在培养过程中,从第4个小时开始,每隔4h向其中补加1%(w/v)鲜骨蛋白胨;
[0067]
s4、反应体系的构建:以2-氨基-2,3-二甲基丁腈为底物,腈水合酶作为催化剂,并令其二者以1.3:1的配比在hfe-7100/水(10%,v/v)两相体系下,于35℃且为碱性的环境下进行催化水合反应,制得2-氨基-2,3-二甲基丁酰胺。
[0068]
对比例七-对比例十二中,分别加入三种有机溶剂(异辛烷、醋酸甲酯或乙二醇单甲醚),检测发酵后腈水合酶的酶活,另外,再取湿菌体(小球诺卡氏菌)3.0g悬浮于180ml ph 7.8的磷酸盐缓冲液中,在30℃、转速180rpm的条件下预热5min,加入2-氨基-2,3-二甲基丁酰胺,使其终浓度达到0.2m,反应40min,取样气相测定上述反应40min后的反应溶液每100ml中2-氨基-2,3-二甲基丁酰胺的浓度(即2-氨基-2,3-二甲基丁酰胺此时的占比率,占比率高则说明2-氨基-2,3-二甲基丁酰胺仍有大量未被吸收反应,吸收反应率低,反之则说明2-氨基-2,3-二甲基丁酰胺吸收反应率高),具体数据如下表所示(表中“√”表示加入,
“×”
表示未加入):
[0069][0070][0071]
注:占比率为100ml的反应后溶液中2-氨基-2,3-二甲基丁酰胺所占的百分比。
[0072]
由上表数据可知,向菌株中添加有机溶剂(异辛烷、醋酸甲酯或乙二醇单甲醚),可以改善腈水合酶的稳定性,且在添加的过程中,发现在加入异辛烷后,经发酵后,其对腈水合酶活性的促进作用都优于其他有机溶剂的效果,另外,在同样的条件下,加入了异辛烷改性后的2-氨基-2,3-二甲基丁酰胺在反应溶液中的占比率相对较低,也就是说,该情况下的2-氨基-2,3-二甲基丁酰胺更易被吸收反应。
[0073]
参照例一:
[0074]
一种2-氨基2,3二甲基丁酰胺的制备方法,包括以下步骤:
[0075]
s1、菌株的筛选:对大肠杆菌重组腈水合酶酶库进行筛选,通过铁离子显色反应,获得来源于pseudonocardia thermophila jcm3095的大肠杆菌重组菌;
[0076]
s2、新菌株的获取:以pet-28a为载体,通过镍柱对大肠杆菌重组菌进行纯化,以获得新菌株;
[0077]
s3、发酵条件优化:令新菌株在37℃下生长至od600为0.8时,向其中添加诱导剂0.1mm iptg,在20℃环境下进行诱导,令其在发酵培养基内进行发酵24h以获得腈水合酶,在培养过程中,从第4个小时开始,每隔4h向其中补加1%(w/v)鲜骨蛋白胨;
[0078]
s4、反应体系的构建:以2-氨基-2,3-二甲基丁腈为底物,腈水合酶作为催化剂,并令其二者以1.3:1的配比在hfe-7100/水(10%,v/v)两相体系下,于ph6.0、35℃环境下进行
催化水合反应,制得2-氨基-2,3-二甲基丁酰胺。
[0079]
参照例二:
[0080]
s1、菌株的筛选:对大肠杆菌重组腈水合酶酶库进行筛选,通过铁离子显色反应,获得来源于pseudonocardia thermophila jcm3095的大肠杆菌重组菌;
[0081]
s2、新菌株的获取:以pet-28a为载体,通过镍柱对大肠杆菌重组菌进行纯化,以获得新菌株;
[0082]
s3、发酵条件优化:令新菌株在37℃下生长至od600为0.8时,向其中添加诱导剂0.1mm iptg,在20℃环境下进行诱导,令其在发酵培养基内进行发酵24h以获得腈水合酶,在培养过程中,从第4个小时开始,每隔4h向其中补加1%(w/v)鲜骨蛋白胨;
[0083]
s4、反应体系的构建:以2-氨基-2,3-二甲基丁腈为底物,腈水合酶作为催化剂,并令其二者以1.3:1的配比在hfe-7100/水(10%,v/v)两相体系下,于ph8.0、35℃环境下进行催化水合反应,制得2-氨基-2,3-二甲基丁酰胺。
[0084]
将对比例一和七与实施例一以及参照例一对比成组,并将对比例四和十与实施例二及参照例二对比成组,对其中的腈水合酶进行酶活检测,另外,再取湿菌体(小球诺卡氏菌)3.0g悬浮于180ml ph 7.8的磷酸盐缓冲液中,在30℃、转速180rpm的条件下预热5min,加入2-氨基-2,3-二甲基丁酰胺,使其终浓度达到0.2m,反应40min,取样气相测定上述反应40min后的反应溶液每100ml中2-氨基-2,3-二甲基丁酰胺的浓度(即2-氨基-2,3-二甲基丁酰胺此时的占比率,占比率高则说明2-氨基-2,3-二甲基丁酰胺仍有大量未被吸收反应,吸收反应率低,反之则说明2-氨基-2,3-二甲基丁酰胺吸收反应率高),具体数据如下表所示(表中“√”表示加入,
“×”
表示未加入):
[0085][0086]
注:占比率为100ml的反应后溶液中2-氨基-2,3-二甲基丁酰胺所占的百分比。
[0087]
由上表可知,在菌株中加入金属离子或有机溶剂后,对经发酵后所产生的腈水合酶的活性都具有一定的促进作用,且同时加入金属离子和有机溶剂后,能够进一步的提高腈水合酶的活性,另外,在同样的条件下,仅加入金属离子或有机溶剂改性后的2-氨基-2,3-二甲基丁酰胺在反应溶液中的占比率达20%-30%,而同时加入金属离子和有机溶剂改性后的2-氨基-2,3-二甲基丁酰胺在反应溶液中的占比率低于20%,能够大幅度提高2-氨基-2,3-二甲基丁酰胺的占比率,也就是说,该情况下的2-氨基-2,3-二甲基丁酰胺更易被吸收反应。
[0088]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1