GmDGAT2A在提高大豆油含量并增加亚油酸含量中的应用的制作方法
gmdgat2a在提高大豆油含量并增加亚油酸含量中的应用
技术领域
[0001]
本发明属于生物技术领域,具体涉及gmdgat2a在提高大豆油含量并增加亚油酸含量中的应用。
背景技术:
[0002]
大豆是重要的油料植物,在人们的饮食、畜类生产以及工业和医疗行业都有重要地位。随着世界人口的不断增加以及人们生活水平的提高,对大豆,尤其是大豆油以及有益脂肪酸的需求不断增大。大豆油中,油酸和亚油酸是含量最大的两种脂肪酸。其中,亚油酸具有降低血脂、软化血管的作用,可预防或减少心血管病的发病率,特别是对高血压、高血脂、心绞痛、冠心病、动脉粥样硬化、老年性肥胖症等的防治极为有利,能起到防止人体血清胆固醇在血管壁的沉积,有“血管清道夫”的美誉,具有防治动脉粥样硬化及心血管疾病的保健效果,且是人体不能合成的脂肪酸,只能通过从饮食中获得,是人体必需的脂肪酸。
[0003]
然而世界范围内可利用的耕地面积在逐年减少,大豆的种植面积也在减少。培育高油且高亚油酸的大豆品种是解决日益增加的需求量和不断减少的耕地面积的矛盾最有效的方式。其中转基因等基因工程手段较传统育种能更精确地实现已知功能基因的定向转移,并且可以通过选择不同的启动子来调控所转移的基因的表达,基因的转移效率也非常高,这为难度较大的大豆品质改良提供了最为直接和高效的方法。因此,通过转基因等基因工程技术选育高油、高亚油酸的大豆新品种,为大豆遗传育种开辟了广阔的应用前景。
[0004]
gmdgat2a基因(phytozome网站https://phytozome.jgi.doe.gov/pz/portal.html上基因号为glyma09g32790)编码gmdgat2a蛋白(二酰甘油酰基转移酶),该蛋白参与tag的生物合成,在植物、动物、藻类中具有高度的同源性。目前,植物中对于dgat1基因的研究较多,研究发现干扰油菜dgat1的表达以及拟南芥dgat1的突变体中,种子的油含量都会明显降低,且dgat1的催化底物很广泛。关于dgat2的研究相对较少。在蓖麻中人们发现过表达蓖麻的dgat2(rcdgat2)可以提高种子中的羟基脂肪酸;油菜的dgat2则更倾向于催化亚麻酸等长链多不饱和脂肪酸的生成。但人们对于大豆中gmdgat2a基因功能了解还十分有限。
技术实现要素:
[0005]
针对现有技术的不足,本发明的目的是提供gmdgat2a在提高大豆油含量并增加亚油酸含量中的应用。
[0006]
本发明解决其技术问题采用的技术方案是:
[0007]
本发明首先保护gmdgat2a蛋白的应用:为s1)或s2):
[0008]
s1)调控植物组织中脂肪酸的合成;
[0009]
s2)培育高油、高亚油酸的转基因植物;
[0010]
上述应用中,所述gmdgat2a蛋白可为a1)或a2)或a3):
[0011]
a1)氨基酸序列是seq id no:3所示的蛋白质;
[0012]
a2)在seq id no.:3所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质;
[0013]
a3)将seq id no:3所示的氨基酸序列经过一个或几个氨基酸残基的取代和/目的或缺失和/或添加得到的与调控植物组织中脂肪酸合成相关的蛋白质。
[0014]
其中,seq id no:3由337个氨基酸残基组成。
[0015]
本发明还保护编码所述gmdgat2a蛋白的核酸分子的应用,为s1)或s2):
[0016]
s1)调控植物组织脂肪酸的合成;
[0017]
s2)培育高油、高亚油酸的转基因植物。
[0018]
上述应用中,所述核酸分子可为如下b1)或b2)所示的dna分子:
[0019]
b1)编码区是seq id no:2所示的dna分子;
[0020]
b2)在严格条件下与b1)限定的核苷酸序列杂交,且编码所述gmdgat2a蛋白的dna分子。
[0021]
其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
[0022]
其中,seq id no:2由1014个核苷酸组成。
[0023]
本发明还保护含有编码权利要求1所述的gmdgat2a蛋白的核酸分子的重组载体、表达盒、转基因细胞系或重组菌的应用,选自s1)或s2):
[0024]
s1)调控植物组织中脂肪酸的合成;
[0025]
s2)培育高油、高亚油酸的转基因植物;
[0026]
上述应用中,所述核酸分子为如下b1)或b2)所示的dna分子:
[0027]
b1)编码区是seq id no:2所示的dna分子;
[0028]
b2)在严格条件下与b1)限定的核苷酸序列杂交,且编码所述gmdgat2a蛋白的dna分子。
[0029]
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码所述gmdgat2a蛋白的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的所述gmdgat2a蛋白的核苷酸序列75%或者更高同一性的核苷酸,只要编码所述gmdgat2a蛋白,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
[0030]
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码seq id no:3所示的氨基酸序列组成的gmdgat2a蛋白的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
[0031]
上述任一所述的应用中,所述调控植物组织中脂肪酸的合成可为提高植物中油含量和亚油酸含量或降低植物中油含量和亚油酸含量。
[0032]
所述植物组织为种子。
[0033]
上述任一所述的应用中,所述植物可为如下c1)或c2):c1)双子叶植物;c2)单子叶植物;优选的,所述双子叶植物为十字花科植物或豆科植物。
[0034]
更优选的,所述十字花科植物为拟南芥;优选的,所述拟南芥为野生型拟南芥columbia-0亚型。
[0035]
更优选的,所述豆科植物为大豆。
[0036]
本发明还保护一种培育高油、高亚油酸的转基因植物的方法,包括如下步骤:提高出发植物中gmdgat2a蛋白的表达量和/或活性,得到转基因植物;与出发植物相比,转基因植物的中子油含量和亚油酸含量提高。
[0037]
上述方法中,所述“提高出发植物中gmdgat2a蛋白的表达量和/或活性”可通过改变启动子的方法,达到提高出发植物中上述任一所述gmdgat2a蛋白的表达量和/或活性的效果。
[0038]
本发明提供了一种大豆中分离的种子特异性启动子promoter ole1,用其来启动gmdgat2a在转基因材料的种子中特异性表达,提高gmdgat2a载重自重的表达量和活性。其核苷酸序列如seq id no:1所述。
[0039]
上述方法中,所述提高出发植物中gmdgat2a蛋白的表达量和/或活性通过向出发植物中导入编码所述gmdgat2a蛋白的核酸分子实现。
[0040]
上述方法中,所述向出发植物中导入编码所述gmdgat2a蛋白的核酸分子可通过向出发植物中导入重组载体实现;所述重组载体为向表达载体插入编码所述gmdgat2a蛋白的核酸分子,得到的重组质粒。
[0041]
所述重组载体具体可为重组质粒pro ole1:gmdgat2a-pba002。所述重组质粒pro ole1:gmdgat2a-pba002具体可为将pba002载体的限制性内切酶ncoi和xbai识别序列之间的35s启动子替换为seq id no:1所示的dna分子,得到的重组质粒pro ole1-pba002。然后用xbai和xhoi识别序列之间的小片段,替换为seq id no:2所示的dna分子,得到的重组质粒pro ole1:gmdgat2a-pba002。
[0042]
所述转基因植物具体可为实施例提及的oe1和oe2。此时出发植物为大豆,具体为栽培型大豆p03。
[0043]
本发明还保护一种植物育种方法,通过提高植物中所述gmdgat2a表达量,从而提高植物油含量、增加亚油酸组分的含量。
[0044]
有益效果
[0045]
实验证明,在栽培型大豆p03种子中过表达gmdgat2a基因可以提高大豆的油含量,并增加油分中亚油酸的含量;同时,利用文中所述油体蛋白启动子启动gmdgat2a在种子中过表达,不影响转基因大豆植株的株高、分支数、单株荚数等农艺性状。本发明符合农业可持续发展的要求,对于选育高油、高亚油酸的大豆新品种,提高植物产量和品质以及改善生态环境等方面具有重要的应用价值和市场前景。
附图说明
[0046]
图1为大豆油体蛋白基因及所用种子特异性启动子的功能验证,其中,图1a为大豆油体蛋白基因在大豆中各组织表达量分析;图1b为大豆转基因所用豆子特异性启动子的功能验证;
[0047]
图2为大豆转基因所用的载体图谱;
[0048]
图3为转基因大豆材料的鉴定结果,其中,图3a为转基因大豆材料的电泳图,图3b为大豆gmdgat2a在转基因大豆材料中的表达量分析;
[0049]
图4为转基因大豆种子油含量的测定结果;
[0050]
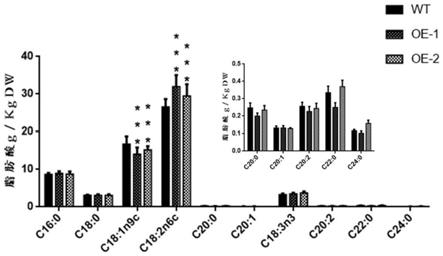
图5为转基因大豆种子油组分变化分析;
具体实施方式:
[0051]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0052]
拟南芥野生型col-0生态型(arabidopsis thaliana ecotype columbia-0)种子购自拟南芥生物研究中心(abrc,https://www.arabidopsis.org/)。在下文中,拟南芥野生型col-0生态型种子简称野生型拟南芥种子,拟南芥野生型col-0生态型简称野生型拟南芥。
[0053]
栽培型大豆p03种子来自吉林农科院。在下文中,大豆栽培型p03种子简称栽培型大豆种子,栽培型大豆p03简称栽培型大豆。
[0054]
根癌农杆菌gv3101记载于如下文献中:r.berres,l.otten,b.tinland et
[0055]
al.transformation of vitis tissue by different strains of agrobacterium
[0056]
tumefaciens containing the t_6b gene.plant cell reports,1992(11):192-195.
[0057]
大肠杆菌dh5α(de3)感受态为takara-宝日医生物技术有限公司的产品。
[0058]
下述实施例中涉及的gmdgat2a基因来源于大豆(glycine max(linn.)merr.),其在大豆基因组中的氨基酸序列如seq id no:3所示,cds序列如seq id no:2所示。种子特异性启动子基因序列来源于大豆,dna序列如seq id no:1所示。
[0059]
实施例1、大豆种子特异性启动子的获得和鉴定
[0060]
一、大豆油体蛋白基因表达水平鉴定
[0061]
1.提取大豆根、茎、幼叶、老叶、花、未成熟种子、成熟种子、幼荚和老荚等组织rna
[0062]
取适量上述大豆组织样品,研磨充分,期间不断加入液氮,直至样品成粉状;转移样品至装有适量rnaiso plus的1.5ml tube中,室温静置5分钟,12000g 4℃离心5分钟,转移上清至新的1.5ml tube中,加入1/5rnaiso plus体积量的氯仿,振荡混匀,室温静置5分钟,12000g 4℃离心15分钟,转移上清至新的1.5ml tube中,加入0.5-1倍rnaiso plus体积量的异丙醇,室温静置10分钟,12000g 4℃离心10分钟,用与rnaiso plus等体积的75%乙醇清洗沉淀,7500g 4℃离心5分钟,弃上清保留沉淀,干燥(不可加热干燥),溶解于适量的depc处理水(参照takara rnaiso plus说明书中的rna提取操作流程图)。待rna沉淀完全溶解后,经过电泳和紫外分光光度计(a260/a280)检测样品的rna浓度和质量,于-80℃保存。
[0063]
2.反转录
[0064]
取上述提取的rna样品各2μg,进行反转。
[0065]
1.)cdna的合成
[0066]
在反应pcr管中加入以下混合液:
[0067][0068]
65℃,5min后于冰上急冷,加入以下反转录混合液:
[0069][0070]
30℃,10min反应后于42℃,30min;再经95℃失活处理后冰上放置,以用于下一步pcr扩增。
[0071]
3.半定量pcr扩增引物设计及半定量rt-pcr:
[0072]
根据该油体蛋白基因的cds序列设计如下引物:
[0073]
forward:5'-tactccactcaggtcgtcaa-3'(seq id no:4);
[0074]
reverse:5'-tgtagatccacgccagcacc-3'(seq id no:5);
[0075]
将反转录得到的产物进行半定量pcr反应,以在大豆中高度保守、并组成型表达的cons6基因为内参照,pcr反应体系(25μl体系):ddh2o,9.5μl;mix,12.5μl;rtaq酶,0.5μl;模板dna,0.5μl;sense primer,1μl;anti-sense primer,1μl。pcr反应条件为预变性94℃3min;94℃30s,退火温度30s,72℃30s,共28个循环;最后72℃延伸10min。利用相关软件进行表达量分析,油体蛋白基因的扩增产物经琼脂糖凝胶电泳根据溴化乙锭(eb)染色信号分析扩增片段大小,拍摄凝胶的照片。
[0076]
结果见图1.a,半定量结果显示该油体蛋白基因只在未成熟种子中表达量很高。
[0077]
二、油体蛋白基因启动子的获得和功能鉴定
[0078]
1.油体蛋白基因启动子的克隆
[0079]
利用sds法提取大豆(品种为glycine max wm82.a2.v1)总dna,设计引物扩增目的启动子序列,加入salⅰ和bamhⅰ酶切位点,扩增引物为:
[0080]
forward:5
’-
gtcgacttctattcaggaggtggttg-3’(seq id no:6);
[0081]
reverse:5
’-
ggatccgagttttgagtgaagagtgag-3’(seq id no:7);
[0082]
扩增序列大小为1601bp。将克隆产物与t载体(购自promega公司)连接,挑单菌落摇菌并提取质粒测序,验证启动子序列正确。将测序验证正确的质粒和pbi101载体(购自biovector science lab)用salⅰ和bamhⅰ限制性内切酶双酶切,将酶切回收的目的片段和载体片段在4℃过夜连接,连接产物转入大肠杆菌感受态细胞,37℃恢复1h后涂板过夜培
养。挑取单菌落提质粒测序,验证目的启动子序列正确。得到更换启动子的改造后的pba002载体:promoter ole-pba002。
[0083]
将提取质粒电击转化农杆菌gv3101感受态,测序获得阳性菌株,-80℃保存。
[0084]
2.蘸花法转化拟南芥
[0085]
(1)农杆菌侵染拟南芥
[0086]
a.转化介质的配置
[0087]
转化介质组分:1/2ms培养液,0.01μg/ml bap,5%蔗糖,0.02%silwet l-77,用koh调ph至5.7。
[0088]
b.挑取活化的含目的基因质粒的单克隆阳性农杆菌gv3101菌株至含5ml含kan(50mg/l)和利福平(50mg/l)的新鲜yep液体培养基,28℃,210g/min,24h.
[0089]
c.取上述菌液1ml接至100ml含kan(50mg/l)和利福平(50mg/l)的新鲜yep液体培养基,28℃,210g/min,7h,使od值达到0.8左右。
[0090]
d.取上述菌液50ml于ep管中,室温,5000g/min,离心5min,其去上清,用转化介质重悬沉淀至od值达到0.8左右。
[0091]
e.将待转化的拟南芥植株平放,将花蕾部分插入含转化介质的50ml ep管中,浸染10s。用吸水纸轻轻吸干侵染液。暗培养16-24h后,恢复正常培养。
[0092]
(2)阳性植株的筛选
[0093]
将收获的转基因植株种子种在含25mg/l kanamycin的ms培养基上,选取生长十天左右的具有抗性的转化苗,移入土壤中继续生长。提取野生型及转基因植株的基因组dna,pcr鉴定转基因植株是否为转基因阳性植株,分别收获每棵植株的种子,将其再种在含50μg/ml kanamycin的ms培养基上,选取kanamycin抗性筛选具有3:1的分离比的抗性转化苗,移植到土壤中生长,分别收获每棵植株的种子,将其再种在含50μg/ml kanamycin的ms培养基上,具有100%kanamycin的转化苗即为转基因阳性纯合体植株。
[0094]
(3)gus基因组织表达活性的检测
[0095]
对构建的种子特异性启动子表达载体转化的拟南芥阳性纯合体进行各发育阶段的gus组织染色,选取10天幼苗、16天幼苗、25天幼苗、茎叶花幼果荚、开花后5天、开花后8天、开花后11天、开花后14天、开花后20天的种子和荚子,放入gus染色液,根据组织器官的不同,染色时间也不同,一般种子和荚染色时间较长。染色后各组织经乙醇脱色完毕后,经透明液透明(幼苗、根尖等组织透明5-l0 min左右;荚子、种子等组织需透明几小时乃至过夜),然后利用体视显微镜观察并拍照。
[0096]
染色液配方:1)x-gluc母液:x-gluc,用n-n-二甲基酰胺(dmf)配成20mm的贮存液,分装并保存于-20℃。2)x-gluc基液(50mm pbs,ph7.0):50mm nah2po4,50mm na2hpo4共同溶解;10mm na2edta,0.1%triton-100,1mm k3[fe(cn)6],0.5mm k4[fe(cn)6]。
[0097]
图1.b为gus染色结果,说明gus基因只在未成熟种子和种子萌发时期表达,而在其他组织中基本不表达,说明了所获得的油体蛋白基因启动子是种子特异性启动子。
[0098]
实施例2、gmdgat2a种子特异性过表达转基因大豆的获得
[0099]
一、重组质粒promoter ole:gmdgat2a-pba002的获得
[0100]
1.设计引物扩增目的启动子序列,利用实施例1中所述大豆总dna进行油体蛋白启动子扩增。加入ncoi和xbaⅰ酶切位点,扩增引物为:
[0101]
forward:5
’-
ccatggttctattcaggaggtggttg-3’(seq id no:8);
[0102]
reverse:5
’-
tctagagagttttgagtgaagagtgag-3’(seq id no:9);
[0103]
扩增序列大小为1601bp。pcr产物纯化后,利用ncoi和xbaⅰ酶对pcr产物和pba002质粒进行酶切,37℃3h,并回收目的片段。利用t4连接酶(购自takara)将酶切后的pcr产物片段连进质粒的酶切位点,连接条件4℃,过夜。转化连接产物到大肠杆菌感受态细胞,37℃恢复1h后涂板过夜培养。挑取单菌落提质粒测序,验证目的启动子序列正确,并保存目的质粒promoter ole-pba002。
[0104]
2.设计引物扩增目的基因gmdgat2a,利用实施例1中所述大豆cdna进行大豆gmdgat2a目的基因扩增。加入xbaⅰ和spei酶切位点,扩增引物为:
[0105]
forward:5
’-
tctagaatgcagcgcacggcggcggcgac-3’(seq id no:10);
[0106]
reverse:5
’-
actagttcaaacaattctcaactcaaggtttg-3’(seq id no:11);
[0107]
扩增序列大小为1014bp。利用xbaⅰ和spei酶同时酶切pcr产物和上述promoter ole-pba002质粒。利用t4连接酶连接酶切产物,并将连接产物转化到大肠杆菌感受态细胞,37℃恢复1h后涂板过夜培养。挑取单菌落提质粒测序,验证目的启动子序列正确,并保存目的质粒promoter ole:gmdgat2a-pba002。重组载体如图2所示。
[0108]
3.将提取质粒promoter ole:gmdgat2a-pba002电击转化农杆菌gv3101感受态,测序获得阳性菌株,-80℃保存备用。
[0109]
二、gmdgat2a种子特异性过表达转基因大豆的获得
[0110]
1、子叶节侵染法转化大豆
[0111]
a)、大豆转化所用培养基:
[0112]
gm培养基:b5培养基3.21g/l,蔗糖30g/l,mes 0.59g/l,phytagel 3.5g/l,koh调ph值至5.8,121℃高压灭菌20分钟;
[0113]
if培养基:b5培养基0.321g/l,蔗糖30g/l,mes 3.9g/l,koh调ph至5.4,121℃高压灭菌20分钟后,加入ga3 0.25mg/l,6-ba 1.67mg/l,as 40mg/l;
[0114]
ccm培养基:b5培养基0.321g/l,蔗糖30g/l,mes 3.9g/l,琼脂糖10g/l,koh调ph至5.4,121℃高压灭菌20分钟后加入ga3 0.59mg/l,6-ba 1.67mg/l,as 40mg/l,dtt 154.2mg/l,l-cys 400mg/l,nathio 158mg/l;
[0115]
siw培养基:b5培养基3.21g/l,蔗糖30g/l,mes0.59 g/l,koh调ph至5.8,121℃高压灭菌20分钟后加入6-ba 1.67mg/l,cef 100mg/l,carb 500mg/l;
[0116]
sem培养基:b5培养基3.21g/l,蔗糖30g/l,mes0.59 g/l,phytagel 3.5g/l,koh调ph至5.8,121℃高压灭菌20分钟后加入6-ba 1.67mg/l,cef 100mg/l,carb 500mg/l;
[0117]
sim培养基:
[0118]
1)大筛阶段:b5培养基3.21g/l,蔗糖30g/l,mes0.59 g/l,phytagel 3.5g/l,koh调ph至5.8,121℃高压灭菌20分钟后加入6-ba 1.67mg/l,cef 100mg/l,carb 500mg/l,glufo 6mg/l;
[0119]
2)次筛阶段:msb 4.44g/l,蔗糖30g/l,mes 0.59g/l,琼脂粉10g/l,koh调ph至5.8,121℃高压灭菌20分钟加入zr 1mg/l,iaa 0.1mg/l,asn 50mg/l,l-pyro 100mg/l,ga
3 0.5mg/l,cef 100mg/l,carb 500mg/l,glufo 3mg/l;
[0120]
3)继代阶段:msb4.44g/l,蔗糖30g/l,mes0.59g/l,琼脂粉10g/l,koh调ph至5.8,
121℃高压灭菌20分钟加入zr 1mg/l,iaa 0.1mg/l,asn 50mg/l,l-pyro 100mg/l,ga3 0.5mg/l,cef 100mg/l,carb 500mg/l,glufo 1.5mg/l;
[0121]
rm培养基:msb培养基2.22g/l,蔗糖30g/l,mes 0.59g/l,琼脂粉10g/l,koh调ph至5.8,121℃高压灭菌20分钟;
[0122]
b)、大豆转化
[0123]
(1)无菌苗的获得
[0124]
选取表面光滑无裂口异色,大小均一饱满的大豆种子,将种子放入50ml离心管中,加入适量的0.1%的氯化汞消毒液,颠倒离心管数次,使种子充分与消毒液接触,清洗7-8分钟之后,倒出消毒液。之后,加入适量的灭菌水清洗三次,每次7-8分钟。将消毒后的种子接种于gm培养基上,25℃,每天16h光照培养。
[0125]
(2)子叶节外植体的准备
[0126]
取生长5-6天的无菌大豆苗,去除种皮,切除下胚轴,留下3-5mm;沿着下胚轴,纵向切割分离两片子叶,刮掉顶芽及初生芽后,在子叶节膨大处用手术刀切十余下,刀口深度约为0.5mm,刀口不可过深,否则会伤及生长点,也不可过浅,否则农杆菌无法侵染进入生长点。
[0127]
(3)外植体的侵染及共培养
[0128]
挑取农杆菌于yep培养基中28℃,200rpm过夜培养,得到od
600
值到1.0-1.2左右的菌液,4000rpm离心10min收集菌体之后,用if培养基重悬菌体,得到od
600
值约0.5-0.6左右的重悬菌液作为侵染液。之后,将准备好的子叶节外植体置于侵染液中,在28℃,150rpm下侵染45min。倒掉侵染液,将外植体近轴面朝下平铺于铺有一层无菌滤纸的ccm培养基上,在25℃下,黑暗中共培养5天。
[0129]
(4)芽诱导培养
[0130]
在共培养5天后将外植体转入无菌培养罐中,用加入适量100mg/l cef和500mg/l carb的siw培养基在25℃,150rpm下清洗45min,倒掉清洗液后,再用干净的siw培养基在超净台中清洗两次,直到清洗液澄清后,将外植体放入铺有无菌滤纸的大培养皿中,吸去多余的液体。
[0131]
待种子干燥之后,将子叶近轴面朝下,下胚轴斜插入sem培养基中,在25℃,每天16h光照下培养两周。
[0132]
(5)芽筛选阶段
[0133]
大筛阶段:等子叶节在sem培养基中培养两周后,选出生有不定芽的子叶节转移到含有6mg/l筛选剂-草胺膦的sim培养基中,25℃,每天16h光照下培养两周;
[0134]
次筛阶段:两周后将大筛培养基中的外植体移到含有3mg/l草胺膦的sim培养基中,移入之前用手术刀刮掉下胚轴茎部的坏死组织,以确保组织对培养基养分的吸收,25℃,每天16h光照下培养两周;
[0135]
继代阶段:大筛次筛之后,将存活的子叶节转入含1.5mg/l草胺膦的sim培养基中,每两周转接一次到新的培养基中,转接时依旧切去下胚轴茎部的老化组织。
[0136]
(6)生根及移栽
[0137]
数次继代之后,待再生苗长至2-3cm高时,从培养皿中移入培养罐中,待苗生长到5cm以上后,将伸长的抗性芽延基部切下,转入rm培养基中,24℃,每天16h光照条件下,诱导
生根。
[0138]
两周后,将生根的完整小植株炼苗3天,洗净干净根部的培养基,移栽到蛭石:营养土1:5的花盆中,在培养箱中,25℃,16h光照条件下培养至成熟,结荚。
[0139]
2、材料鉴定并繁代
[0140]
a)、dna水平上鉴定转基因大豆
[0141]
大豆转基因植株pcr检测的目的基因是载体上459bp编码筛选剂抗性蛋白的bar片段,根据bar基因片段设计引物:
[0142]
forward:5
′-
gtaccggcaggctgaagtcc-3
′
(seq id no:12);
[0143]
reverse:5
′-
cggtctgcaccatcgtcaac-3
′
(seq id no:13)。
[0144]
利用前期提取的大豆基因组dna为模板,野生型p03为对照进行pcr反应。扩增所用的酶为taqdna聚合酶。
[0145]
挑选阳性苗进行繁代种植。对后代幼苗同样进行抗性基因的pcr鉴定,直至没有抗性分离,即为纯合的转基因材料。如图3a所示。
[0146]
b)、rna水平上鉴定转基因大豆
[0147]
野生型大豆(p03)和纯合的转基因大豆材料的幼嫩种子(30daf)和叶片被收集并按实施例1中所述方法进行提取rna和反转录实验,利用所得的cdna进行rt-pcr实验,检测转基因材料的叶片和种子中gmdgat2a表达量的变化;所用引物为:
[0148]
forward:5
′-
ttgtggctcggaaccattca-3
′
(seq id no:14);
[0149]
reverse:5
′-
tgagcacgaaaagcaaaccg-3
′
(seq id no:15)。
[0150]
如图3b所示,对比分析gmdgat2a在野生型大豆和转基因大豆的叶片和种子中的表达量发现:利用油体蛋白启动子启动gmdgat2a在大豆种子里表达,特异性的提高了gmdgat2a在种子里的表达量,而叶子中gmdgat2a的表达量没有提高。
[0151]
实施例3、gmdgat2a种子特异性过表达转基因大豆种子油含量统计分析
[0152]
一、gmdgat2a种子特异性过表达转基因大豆种子油含量统计分析
[0153]
1、成熟种子油脂提取
[0154]
(1)分别挑取大小相近的p03(wt)以及过表达(oe1和oe2)的饱满大豆种子,用植物样品粉碎机进行粉碎;粉碎后的样品使用国家标准筛筛取细度在0.3mm(50目)~1mm的研磨样品约15mg,记录重量,置于15ml尖底离心管中,进行脂提取。
[0155]
(2)向步骤(1)称取的每管样品中加入2ml含0.01%bht的异丙醇,85℃水浴约30min;加入3ml的正己烷,颠倒数次使其完全混匀,室温静置5min;上述混合液中加入2.5ml的15%的na2so4,颠倒数次使其完全混匀,室温静置5min,混合液分为三层;将最上一层吸入到20ml玻璃瓶中;剩下的混合液中加入4ml正己烷/异丙醇7:2(v/v),颠倒使用数次直至完全混匀,室温静置10min;收集最上一层至前一个玻璃瓶中;将玻璃瓶中油脂提取液用氮气吹干,油脂留在离心管底部,呈黄色;向吹干后的油脂中加入2ml甲醇(含5%h2so4和0.01%bht),在加入30μl 5.4mm的17:0tag作为内标,95℃水浴加热2h;水浴后静置冷却再向玻璃瓶中加入1ml的水和1ml的正己烷,颠倒数次使其完全混匀后静置5min,室温4500rpm离心5min,取上层有机相转移到气相测量瓶中,用于气相测定。
[0156]
2、甲酯化和气相色谱法检测分析
[0157]
将上述的样品及标准品用气相色谱(gc)测定。所使用的色谱柱类型为sptm-2560,
100m
×
0.25mm,0.2um film,进样体积为1μl,柱口温度为260℃。
[0158]
分析大豆种子油脂测定的结果可见:在大豆种子中过表达gmdgat2a明显提高了油含量(如图4)。
[0159]
分析油脂组分可见,在大豆种子中过表达gmdgat2a明显提高了油份中亚油酸(c18:2)的含量(如图5)
[0160]
二、gmdgat2a种子特异性过表达转基因大豆大田农艺性状统计
[0161]
上述所述大豆材料t4和t5代在吉林农科院的试验田种植并进行相关农艺性状统计,见表1。从统计结果可见:在大豆种子中过表达gmdgat2a,并没有改变植株的株高、分支数、结节数、单株荚数等农艺性状,对植株的生长没有影响。
[0162]
表1为转基因大豆材料田间农艺性状统计结果
[0163]
株系含油量(%)蛋白(%)株高(cm)结节数分支数单株荚数wt20.15
±
0.34341.55
±
0.4985.4
±
8.1518.8
±
1.641.3
±
0.5594
±
13.55oe-1(2018)22
±
0.7140.55
±
0.7886.4
±
6.0218.4
±
1.950.8
±
1.7987.4
±
38.08oe-1(2019)22.25
±
0.7740.05
±
3.6083.2
±
4.8717
±
1.871.8
±
0.4594.2
±
25.40oe-2(2018)21.7
±
0.4240
±
0.4282
±
3.8117.6
±
0.891.8
±
2.49104.6
±
39.78oe-2(2019)21.07
±
0.1143.4
±
0.3686.8
±
5.9318.8
±
1.101.4
±
0.5596
±
22.81
[0164]
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求为保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1