一种能同时区分成像脂滴和内质网的单分子荧光探针及其应用的制作方法
[0001]
本发明涉及一种能同时双色成像的荧光探针及其应用,尤其涉及一种利用可在正常(n*)和互变异构体(t*)状态之间产生激发态分子内质子转移(esipt)反应的能同时区分、双色成像脂滴和内质网的单分子双靶标荧光探针及其在动态监测脂滴和内质网并揭示其两者关系中的应用。
背景技术:
[0002]
细胞内的细胞器由于空间区域化和功能特异化而具有精细的分工,它们彼此之间相互配合并紧密接触,形成了细胞器互作网络,以完成生物体内各种生理活动。因此,研究不同细胞器的分布与相互作用具有十分重要的价值,特别是密切相关的细胞器,比如脂滴(lds)和内质网(er)。脂滴是一种广泛存在于大多数细胞中的高度动态的细胞器,由一个含有甘油三酯和胆固醇酯的中性内核和含有蛋白质的磷脂单分子层组成。作为高度动态的细胞器,脂滴在维持脂质代谢和体内稳态中起着关键的作用,同时与细胞内其他细胞器相互作用,特别是内质网。最近,脂滴蛋白质组学研究表明,用于催化生成脂滴的中性脂质的合成酶主要位于内质网中。此外,不同类型细胞的电子显微图像也表明脂滴与内质网紧密接触。因此,内质网现在普遍被认为是脂滴形成的发源地。但是,所有上述观察都是基于固定或死亡的生物样本,可能会导致信息失真。因此,为了准确地阐明脂滴与内质网之间的关系,脂滴和内质网的同时可视化具有非常重要的意义。
[0003]
由于非侵入性、原位和高分辨率的独特优势,荧光技术已广泛应用于生物学研究。并且,多色标记可以用于同时观察细胞内不同组分,利用分别靶向脂滴和内质网的两种商业探针的组合,理论上可实现脂滴和内质网的可视化。但是要求这两类荧光探针的发射光谱易于区分,以避免荧光串色带来的信号干扰,另外也要求探针对各自靶标的高度专一性,以避免两个不同靶标之间的相互干扰。到目前为止,可用的商业化脂滴探针只有nile red和bodipy 493/503,因此极大地减少了可与内质网探针组合用于多色标记的可能性。并且nile red和bodipy 493/503对脂滴的选择性都较低,它们不但会染色脂滴,而且着色细胞内其他膜结构。因此当与商业内质网探针共染时,会带来严重的信号干扰。此外,同时引入两个探针还会带来其他一系列问题,比如不同步的光响应、复杂的染色过程以及增大的细胞毒性。
[0004]
近年来已经开发出可以同时靶向脂滴和内质网的单个荧光探针。但是,这些探针只能发出单一颜色的荧光,同时观察两种细胞器造成了很大的干扰。在实际应用中,仍需要添加另一种可实现多色成像的商业脂滴或内质网靶向的探针,不能真正实现商业应用。基于此,开发可同时靶向脂滴和内质网且发出不同颜色的单分子双靶标荧光探针以实现同时区分并双色成像脂滴和内质网是现阶段科研研究的目标。基于激发态分子内质子转移(esipt)原理的反应型荧光探针,因其具有高选择性、高灵敏度及大的斯托克斯位移等优点而被广泛关注。经检索,有关利用可在正常(n*)和互变异构体(t*)状态之间产生激发态分
子内质子转移(esipt)反应的能同时区分、双色成像脂滴和内质网的单分子双靶标荧光探针及其应用还未见报道。
技术实现要素:
[0005]
针对现有技术的不足,本发明要解决的问题是提供一种能同时区分、双色成像脂滴和内质网的单分子双靶标荧光探针及其在动态监测脂滴和内质网并揭示其两者关系中的应用。
[0006]
本发明所述的能同时区分、双色成像脂滴和内质网的单分子双靶标荧光探针,其特征在于:该荧光探针的化学命名为:2-(4-(二苯基氨基)苯基)-3-羟基-4h-色烯-4-酮,简称ppc。其化学结构式如式(i)所示;
[0007][0008]
本发明所述荧光探针ppc是基于可在正常(n*)和互变异构体(t*)状态之间产生esipt反应的3-羟基黄酮(3hf)衍生物设计而成,这类分子的荧光强度及发射波长可随溶剂的极性变化而变化。所以其对水含量极其敏感,进入细胞后可同时结合脂滴和内质网,并产生不同的颜色荧光。脂滴拥有独特的两亲性结构,而细胞内其他的膜细胞器比如内质网,线粒体和溶酶体,它们的磷脂双分子层都或多或少地含有水相成分。利用本发明所述单分子双靶标荧光探针能以不同的荧光颜色感知脂滴和内质网含水量的微小差别,实现以荧光探针来同时区分脂滴和内质网,实验结果显示本发明的荧光探针ppc在脂滴中呈现橙黄色荧光,在内质网中显示绿色荧光。
[0009]
本发明所述荧光探针ppc即式(i)所述结构化合物大体的制备方法是:
[0010]
首先将2'-羟基苯乙酮和4-(n,n-二苯基氨基)苯甲醛加入烧瓶中,再加入适量naoh,于室温下反应得到化合物1,化合物1在h2o2的作用下得到产物。进一步通过二氯甲烷萃取得到黄色粉末产物,即ppc。其制备反应式如下:
[0011][0012]
本发明所述单分子双靶标荧光探针ppc在同时双色成像细胞或组织中的脂滴和内质网中的应用。
[0013]
其中:所述细胞是培养的活宫颈癌细胞(hela)、宫颈鳞癌细胞(siha)或间充质干
细胞(msc)。所述组织为wistar大鼠活的心脏组织、肝组织、脾组织或骨骼肌组织;所述荧光探针ppc的激发光是405nm,能使成熟的脂滴显示出橙黄色荧光,使内质网显示出绿色荧光。
[0014]
上述荧光探针ppc在揭示不同组织中脂滴和内质网的形态、大小以及分布中的应用中,实验结果证实,在不同类型的组织中,脂滴和内质网的形态,分布和大小是多样的。心脏和肝脏组织作为脂滴的主要储存地点,其脂滴明显多于其他组织。肝脏中的脂滴尺寸明显大于其他组织中的。内质网在骨骼肌组织中具有固定的形态:围绕肌纤维呈现出规则的网络结构,且与脂滴紧密靠近。
[0015]
本发明所述的单分子双靶标荧光探针ppc在原位或动态同时可视化监测脂滴和内质网关系中的应用。
[0016]
实验结果证实,新生的脂滴出现在内质网区域,并发出与内质网非常相似的绿色荧光,而成熟的脂滴则显示出橙黄色荧光。上述实验结果可以为脂滴起源于内质网的假说提供直接可靠的证据。
[0017]
本发明所述的单分子双靶标荧光探针ppc在对水含量变化的敏感性测试中的应用。
[0018]
上述的应用中:所述荧光探针随着水分在体积量0%至10%范围增加,t*态的荧光强度几乎保持不变,但是n*态的荧光强度显著增强,同时荧光颜色也从橙黄色变为黄绿色;对应的cie1931坐标值显示坐标从橙黄色区域中的(0.44,0.41)变为绿色区域中的(0.34,0.56),提示探针ppc对水含量的变化极其敏感,且能通过荧光颜色的变化响应于水含量的微小改变。
[0019]
本发明公开了一种能同时区分、双色成像脂滴和内质网并揭示两者关系的单分子双靶标荧光探针ppc,该荧光探针是基于esipt机制设计合成的。它具有亲脂性,可同时靶向细胞内脂滴和内质网。并且对水含量的微小变化极为敏感,能够在水含量从0%变到10%时产生明显的荧光颜色变化,因此能够以两种不同的颜色着色脂滴和内质网。在脂滴中呈现橙黄色荧光,在内质网中显示绿色荧光。此外,ppc也可以被用来揭示不同组织中脂滴和内质网的形态、大小以及分布。研究表明脂滴在不同组织中虽然大小不一,但是形状相似,均为圆形,且与内质网在空间上紧密接触。与现有其他探针相比,本发明所述的探针能够用两种荧光颜色同时成像脂滴和内质网,并能原位或动态监测两者之间的关系。并且,本发明的探针具有显色强、光稳定性强、定位准确等特点,有望在区分脂滴和内质网及验证两者的关系中得到深入应用。
[0020]
值得注意的是,本发明通过免疫荧光成像,首次发现新生的脂滴与内质网具有相似的荧光颜色和原位光谱,因此推断脂滴极有可能是源于内质网区域。这一发现为脂滴产生于内质网的假说提供了新的直接证据,也将加速对脂滴生物学的深入理解。
附图说明
[0021]
图1:探针ppc在含不同体积水(0%,2%,4%,6%,8%,10%)的1,4-二氧六环-水混合溶剂中365nm激发下的紫外灯裸眼照片(a图)、荧光发射光谱(b图)和对应的cie1931坐标(c图)。激发波长:405nm。当水含量从0%变到10%时,荧光颜色发生明显的变化,对应的cie1931坐标值从橙黄色区域中的(0.44,0.41)变为绿色区域中的(0.34,0.56),说明ppc对水含量的微小变化极为敏感。
[0022]
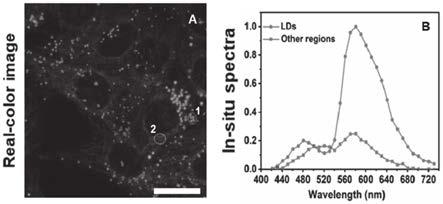
图2:用1μm的探针ppc染色hela细胞,在405nm激发下获得的实彩荧光图像(a图)以及在该图中标记的圈1和圈2处采集的原位光谱(b图)。显示探针ppc能够以两种颜色同时着色脂滴和内质网,使成熟的脂滴显示出橙黄色荧光,使内质网显示出绿色荧光。可以用作同时双色区分成像脂滴和内质网的有用工具。
[0023]
图3:用1μm的探针ppc染色不同类型细胞(a:siha细胞和b:msc细胞)2min后,在405nm激发下获得的实彩荧光图像。ppc在siha细胞和msc中都能够以不同颜色同时着色脂滴和内质网。上述结果证实探针ppc的染色行为不受细胞类型的影响。
[0024]
图4:用1μm探针ppc和商业探针bodipy 493/503、er red共同染色hela细胞得到的荧光成像图片。(绿色通道channel 1:450-550nm;红色通道channel 2:600-700nm。)其中:a图、b图和c图中dic图片(ⅰ)是明场激光扫描的微分干涉显微照片,merge图(ⅳ)为channel 1(ⅱ)、channel 2(ⅲ)两图的合并图(共定位图);其中b图和c图是商业探针参与共染的照片。ppc、bodipy 493/503和er red的激发波长分别为405nm、473nm和543nm。结果显示ppc的染色区域和bodipy 493/503以及er red的染色区域都具有很高的重叠度,表明探针ppc染色的部位确实是脂滴和内质网。
[0025]
图5:用1μm的探针ppc染色用油酸预处理2h的hela细胞的dic图片(a图)以及矩形框的放大图像(b图)、实彩荧光图像(c图)、叠加图像(d图)和在选定位置处采集的原位荧光光谱(e图)。b图中箭头1指示原始的脂滴,圆圈指示内质网区域,箭头2指示新生的脂滴。探针ppc激发波长:405nm。结果显示细胞用油酸处理后,除了橙黄色的脂滴外,在内质网区域还有许多绿点。这些呈现球状的绿点很有可能是新生的脂滴。
[0026]
图6:油酸处理的hela细胞被1μm的探针ppc和抗tip47抗血清共同染色后的实彩荧光图像(a图、b图)、共定位图像(c图)以及原位荧光光谱图(d图)。ppc和抗tip47抗血清分别用405nm和561nm激发。结果显示除了原始脂滴可与tip47蛋白重合外,内质网区域中的新生绿点也可与tip47蛋白质重合,则意味着新生绿点应该是脂滴。
[0027]
图7:用5μm的探针ppc和10μm的syto 61染色心脏组织(ⅰ)、肝组织(ⅱ)、脾组织(ⅲ)和骨骼肌组织(ⅳ)获得的共聚焦图像(a图)和相应的在选定位置处采集的原位光谱(b图)。ppc和syto 61分别用405nm和633nm激发。结果显示探针ppc能同时着色多种不同组织中的脂滴和内质网,在脂滴中呈现橙黄色荧光,在内质网中显示绿色荧光。
[0028]
图8:探针ppc染色hela细胞后不清洗,然后在405nm激发下用共聚焦显微镜的lambda成像模式直接观察细胞,对脂滴进行原位和动态监测照片。其中a图ⅰ~ⅳ是0s至200s的观察结果;b图ⅰ~ⅳ是a图中选定框相应的放大图。结果显示探针ppc能够对成熟的脂滴和内质网进行清晰的标记,荧光颜色分别为橙黄色和绿色。从放大后的图像中可以看到,随着时间的推移,一个绿点(脂滴)开始从内质网区域出现(箭头标记处),并逐渐长大。
具体实施方式
[0029]
下面结合具体附图和实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,应该说明的是,下述说明仅仅是为了解释本发明,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
[0030]
下述实施例中,所使用的材料、试剂等,如无特殊说明,均从商业途径得到。
[0031]
实施例1:探针ppc的合成
[0032]
将由2'-羟基苯乙酮(1ml,8.3mmol)和4-(n,n-二苯基氨基)苯甲醛(8.3mmol)组成的混合物加入烧瓶中,用乙醇(15ml)作溶剂。然后将溶解在2ml水中的naoh(66.4mmol)加入该烧瓶,室温下搅拌24小时。之后再次向该混合物中加入naoh(16.6mmol)、2ml水和3ml 30%h2o2,室温下搅拌15分钟,然后加热至50℃反应5小时。冷却至室温后,将反应体系中和至中性,然后用二氯甲烷萃取并用水洗涤三次。残余物经重结晶后得到黄色粉末产物,即为2-(4-(二苯基氨基)苯基)-3-羟基-4h-色烯-4-酮,简称ppc。产率为85%。
[0033]1h nmr(400mhz,dmso-d6):δ(ppm)9.44(s,1h),8.16-8.06(m,3h),7.82-7.76(m,1h),7.71(dd,j=8.4,1.2hz,1h),7.49-7.43(m,1h),7.42-7.34(m,4h),7.19-7.11(m,6h),7.08-7.01(m,2h).
13
c nmr(100mhz,dmso-d6):δ(ppm)172.97,154.90,149.12,146.86,146.05,138.75,133.94,130.26,129.47,125.95,125.58,125.20,124.93,124.68,124.43,121.87,121.18,118.71.hr-ms calculated for c
27
h
20
no
3+
m/z 406.1438([m+h]
+
),found 406.1451.
[0034]
实施例2:探针ppc对水含量变化的敏感性测试
[0035]
用含不同体积水(0%,2%,4%,6%,8%,10%)的1,4-二氧六环-水混合溶剂配制2μm的ppc溶液,再用365nm激发下的紫外灯照射获得裸眼照片(图1a图);用配备有450w xe灯的hitach f-2700荧光分光光度计在405nm激发下获得ppc的荧光发射光谱(图1b图),并得到对应的cie1931坐标(图1c图)。
[0036]
由图1结果可知:从裸眼照片中可以看到,ppc在含不同体积水(0%,2%,4%,6%,8%,10%)的1,4-二氧六环-水混合溶剂中产生了不同颜色的荧光。随着水分的增加,t*态的荧光强度几乎保持不变,但是n*态的荧光强度显着增强,同时荧光颜色也从橙黄色变为黄绿色。对应的cie1931坐标值显示随着水分从0%增加到10%,坐标从橙黄色区域中的(0.44,0.41)变为绿色区域中的(0.34,0.56)。上述结果充分说明发生了esipt反应的ppc对水含量的变化极其敏感,且能通过荧光颜色的变化响应于水含量的微小改变。
[0037]
实施例3:制备测试用活细胞样本
[0038]
hela细胞和siha细胞在含有10%胎牛血清(fbs)和1%青霉素和链霉素的高糖培养基(h-dmem)中培养。间充质干细胞(msc)在含有10%fbs和1%青霉素和链霉素的h-dmem中培养。于37℃,5%co2的饱和湿度的孵箱中,每2-3天传代1次。
[0039]
待细胞生长到对数期,接片培养:
①
将盖玻片于无水乙醇中浸泡30min,酒精灯烘干后放入一次性35mm培养皿中,备用;
②
将100ml细胞瓶中长满的细胞用pbs洗三遍,用1ml 0.25%胰酶消化3-5分钟,小心地倒出胰酶,加入新鲜培养液吹打均匀并细胞计数,以培养液的添加量控制细胞密度,使细胞终浓度为每毫升1
×
105,然后接种至内上述含盖玻片的培养皿中,放入5%co2培养箱中37℃培养,使细胞爬片生长。待细胞长满盖玻片后,即获得爬片生长的hela细胞、siha细胞、间充质干细胞(msc)活细胞样本,用于实验。
[0040]
实施例4:测试探针ppc对活siha细胞、hela细胞和msc细胞的染色结果
[0041]
首先配制1mm探针ppc的dmso溶液作为母液。待细胞爬片长满盖玻片后,用1μm的ppc染色细胞,在co2培养箱中孵育2min。染色后洗去多余的探针,将细胞生长面朝下盖在载玻片上,在激光共聚焦荧光显微镜下(用405nm的激光照射细胞)观察染色结果,包括细胞着色位置,荧光分布及亮度变化等。
[0042]
结果见图2和图3。
[0043]
由实验结果可知:探针ppc在hela细胞中能够以两种不同颜色同时着色脂滴(橙黄色荧光)和内质网(绿色荧光),根据在脂滴和类内质网区域采集的原位光谱,脂滴的荧光颜色应该主要是来自t*状态的长波长荧光,内质网的荧光颜色应该是来自n*和t*状态的叠加荧光。同样的,ppc在siha细胞和msc中也能够以两种不同的颜色同时着色脂滴(橙黄色荧光)和内质网(绿色荧光)。说明ppc的染色行为不受细胞类型的影响,可以用作同时双色区分成像脂滴和内质网的有用工具。
[0044]
实施例5:通过共定位实验验证并确定探针ppc能同时染色脂滴和内质网
[0045]
将活hela细胞先用1μm的探针ppc在培养液中孵育2min,pbs冲洗两次后,再将bodipy 493/503加入培养液中孵育10min,用荧光共聚焦显微镜对细胞进行成像。
[0046]
将活hela细胞先用1μm的探针ppc在培养液中孵育2min,pbs冲洗两次后,再将er red加入培养液中孵育10min,用荧光共聚焦显微镜对细胞进行成像。
[0047]
结果见图4。(绿色通道channel 1(收光范围:450-550nm)代表bodipy 493/503的荧光;红色通道channel 2(收光范围:600-700nm)代表ppc的荧光。)其中:a图、b图和c图中dic图片(ⅰ)是明场激光扫描的微分干涉显微照片,merge图(ⅳ)为channel 1(ⅱ)、channel 2(ⅲ)两图的合并图(共定位图);其中b图和c图是商业探针参与共染的照片。
[0048]
由实验结果可知:在bodipy 493/503染色的图像中,明亮的点状实体代表脂滴,而较弱的片状区域是背景噪音。从叠加图像可以看到ppc的染色区域和bodipy的染色区域可以很好地重合,共定位系数约为0.94,表明ppc染色的点确实是脂滴。同样的,ppc着色的类内质网区域与er red染色网状区域(用闭合曲线表示)具有很高的重叠度,共定位系数约为0.87,表明由ppc染色的类内质网区域应该是内质网。上述结果证明了探针ppc能够同时着色细胞内脂滴和内质网,并能够以两种不同的颜色标记出来。
[0049]
实施例6:利用实彩成像揭示新生脂滴源于内质网
[0050]
先用油酸处理活性hela细胞2h,使其产生大量新的脂滴。活hela细胞再用1μm的探针ppc在培养液中孵育2min,pbs冲洗两次后,用荧光共聚焦显微镜对细胞进行实彩成像。通过尼康显微镜的光谱成像模块获得探针ppc的实彩图片。在光谱成像中,显微镜可以每8nm采取一张荧光照片,并根据每个通道的波长赋予对应图片以实际颜色,最后将每个通道的实际颜色叠加得到最终可反映荧光真实颜色的实彩图片。它们的原位光谱可通过对这一系列照片的每个像素点进行分析得到,实彩成像所用的激发波长为405nm,收光范围为410-740nm。
[0051]
结果见图5。
[0052]
实验结果显示:细胞用油酸处理后,除了橙黄色的脂滴(箭头1所示)外,在内质网区域还有许多绿点(箭头2所示)。脂滴在形成过程中,需要把水排除出去。因此新生的脂滴的含水量应该是高于成熟脂滴的含水量。基于此,用ppc染色后的细胞中,新生的脂滴应该是呈现同内质网上相似的绿色,而成熟的脂滴应该呈现橙黄色。新产生的绿点也呈现球状,且它们在相差显微图像中(dic)也显示出略高的折射率,说明这些绿点很有可能是新生的脂滴。此外,原位光谱也显示出新生脂滴的t*和n*态的强度比值接近于内质网(圆圈表示)而不是原始脂滴(箭头1表示)。以上结果可为脂滴源于内质网的假说提供了一个参考依据。
[0053]
实施例7:免疫荧光法证实新生脂滴源于内质网
[0054]
首先在玻璃盖玻片上接种hela细胞,孵育24小时后用40μm的油酸预处理4小时,使脂滴增多。然后用4%的多聚甲醛固定细胞30分钟,再用皂苷通透细胞,并用10%的山羊血清进行封闭。之后依次加入一抗(抗人tip47兔多克隆抗血清,缩写为抗tip47抗血清)和二抗(alexa fluor 594-缀合的山羊抗兔igg)。最后,活性hela细胞再用1μm的探针ppc在培养液中孵育2min,pbs冲洗两次后,用荧光共聚焦显微镜采集实彩荧光图像。
[0055]
结果见图6。
[0056]
实验结果显示:在用ppc和抗tip47抗血清共同染色的细胞中,除了原始脂滴可与tip47蛋白重合外,内质网区域中的新生绿点也可与tip47蛋白质重合,则意味着新生绿点应该是脂滴。用ppc染色的细胞中存在两种不同颜色荧光点,即橙黄色和绿色点,且从放大图像中可看到他们都被标记tip47蛋白的红色荧光紧密环绕。同时,从原位光谱来看,新生脂滴(箭头2表示)的t*和n*态的强度比值也接近内质网(用圆圈表示)而不是原始脂滴(用箭头1表示)。因此,免疫荧光方法进一步证明绿色的点应该是脂滴,并且其应该是源自内质网。
[0057]
实施例8:探针ppc同时双色区分成像多种组织的脂滴和内质网
[0058]
用5μm的探针ppc同时染色wistar大鼠的心脏组织、肝组织、脾组织和骨骼肌组织,通过405nm激发利用荧光共聚焦显微镜采集实彩图像。再用10μm的syto 61也同时染色wistar大鼠的心脏组织、肝组织、脾组织和骨骼肌组织,在633nm激发下采集663-735nm蓝色通道的伪彩叠加图,以及在脂滴和内质网区域中采集原位光谱。
[0059]
结果见图7。
[0060]
实验结果显示:心脏和肝脏组织作为脂滴的主要储存地点,其中的脂滴明显多于其他组织。而且肝脏中的脂滴尺寸明显大于其他组织中的。而除了骨骼肌组织外,内质网在其他组织中没有固定的形态。内质网在骨骼组织中围绕肌纤维呈现出规则的网络结构,且与脂滴紧密靠近。同时,相应组织中ppc的原位光谱与在活细胞中的结果类似。表明ppc能同时着色多种不同组织中的脂滴和内质网,并在脂滴中呈现橙黄色荧光,在内质网中显示绿色荧光。
[0061]
实施例9:原位或动态同时可视化监测脂滴和内质网的关系
[0062]
将活性hela细胞先用1μm的探针ppc在培养液中孵育2min对细胞进行染色,不清洗。然后用激光扫描共聚焦显微镜的lambda成像模式直接观察细胞。lambda模式下的荧光成像可以在扫描成像中直接获得真实的彩色发射,避免子通道成像中的光谱串扰,并提供更清晰和明确的标记信息。此外,基于lambda模式的荧光成像可以区分另一个具有不同发射颜色的染色区域,这对于同时成像具有相似和相近发射光谱的不同细胞器特别实用,利于区别。
[0063]
结果见图8。
[0064]
实验结果显示:ppc能对成熟的脂滴和内质网进行清晰的标记。放大后的图像可以看到,在开始的内质网区域(箭头的位置)没有绿点。随着时间的推移,一个绿点开始从内质网区域出现,并在200秒内逐渐长大。以上结果可为脂滴源于内质网的假设提供直接可靠的证明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1