燕麦糖基转移酶AsUGT73E5及其在甾体皂苷合成中的应用
燕麦糖基转移酶asugt73e5及其在甾体皂苷合成中的应用
技术领域
1.本发明涉及皂苷代谢途径,具体涉及燕麦糖基转移酶asugt73e5及其在甾体皂苷合成中的应用。
背景技术:
2.重楼是百合科重楼属植物的泛称,可作为云南白药、宫血宁和热毒清等中成药的主要原料,具有极高的药用和经济价值。甾体皂苷是重楼植物的主要化学成分,目前已分离鉴定出 160余种,主要包括重楼皂苷(polyphyllin)ⅰ、ⅱ、ⅲ、
ⅴ
(薯蓣皂苷类)和ⅵ、ⅶ(偏诺皂苷类),药理活性广泛。抗肿瘤是重楼皂苷的主要作用,重楼皂苷ⅰ通过抑制人胃癌hgc-27 细胞中pdk1/akt/mtor信号通路并下调细胞周期蛋白b1,诱导自噬和细胞周期停滞(heet al.2019)。重楼皂苷ⅵ在非小细胞肺癌中通过ros触发的mtor信号通路诱导细胞凋亡和自噬(teng et al.2019)。重楼皂苷ⅶ能够促进线粒体产生ros并激活mapk和pten/p53 途径,共同诱导hepg2人肝癌细胞凋亡(zhang et al.2016)。重楼皂苷ⅶ在抗菌消炎方面也颇有成效,能显著抑制枝状枝孢菌、念珠菌和痤疮丙酸杆菌的生长,可作为合成药物的有效替代品(deng et al.2008;qin et al.2012)。薯蓣皂苷元(diosgenin)能增强高脂血症小鼠的脂蛋白脂肪酶、肝脂酶、超氧化物歧化酶、谷胱甘肽过氧化酶与一氧化氮合酶的活性,改善脂质分布,起到降血脂的效果(gong et al.2010)。重楼皂苷ⅲ具有优异的驱虫活性,可以杀死寄生在金鱼鳃部的指环虫(ec
50
=18.06mg l-1
),且对金鱼低毒(wang et al.2010)。在新冠肺炎研究中发现,皂苷类分子具有潜在的抗新冠病毒活性。通过对接筛选,推测重楼皂苷ⅰ可与2019-ncov主要蛋白酶(m protease)结合,阻止病毒复制(yan et al.2020)。
3.现阶段对于重楼皂苷的研究主要集中在医药和临床,导致对其代谢途径,尤其是下游生物合成过程的了解还十分欠缺。2,3-氧化鲨烯(2,3-oxidosqualene)是甾醇和三萜合成的共同前体,在2,3-氧化鲨烯环化酶(2,3-oxidosqualene cyclases,oscs)的催化下生成甾醇类或三萜类骨架。多数五环三萜合酶能够催化2,3-氧化鲨烯形成“chair-chair-chair”构象的达玛烷型阳离子,随后经过进一步重排产生α-amyrin、β-amyrin和羽扇豆醇(lupeol)等五环三萜(xue et al.2018)。环阿屯醇合酶(cycloartenol synthase)催化2,3-氧化鲨烯形成“chair-boat-chair”构象的前固醇阳离子,继而转化成环阿屯醇,并经一系列反应合成胆固醇。植物中胆固醇的含量虽然普遍较低,但却是植物甾醇(phytosterol)的重要组成部分,亦是甾体皂苷的直接前体(c
á
rdenas et al.2015)。甾体皂苷元合成需要胆固醇侧链的羟化,主要由细胞色素p450酶 (cytochrome p450 monooxygenase,cyp)参与修饰。例如,在七叶一枝花(paris polyphylla) 中发现cyp90bs通过基因复制进化出固醇多羟化酶活性,ppcyp90g4能催化胆固醇c16和 c22位羟化伴随e环闭合。16,22(s)-二羟基胆固醇在ppcyp94d108等酶作用下c26位进一步羟化形成薯蓣皂苷元(christ et al.2019),而偏诺皂苷元(pennogenin)c17位p450酶仍待解析。最后,薯蓣皂苷元或偏诺皂苷元在糖基转移酶(udp-glucosyltransferase,ugt)的作用下发生糖基化,形成具有多种生物活性的重楼皂苷。目前,有关甾体皂苷元糖基化修饰的研究鲜有报道。
4.重楼皂苷基本来源于植物提取,然而由于过度开发导致了重楼资源的枯竭。利用合成生物学构建异源生物合成途径,逐渐成为获取天然活性成分的有效方式。然而重楼属植物基因组庞大,皂苷种类众多,难以通过基因共表达网络对重楼皂苷代谢途径进行解析。燕麦(avenasativa l.)是禾本科植物中唯一富含皂苷的植物(vincken et al.2007),可以合成两类不同的皂苷。一类是在根和根尖中合成的三萜皂苷—燕麦苷(avencins),另一类是甾体皂苷—燕麦皂苷(avenacosides),在叶片和谷粒中积累。燕麦是一年生草本植物,生长周期短,长日照条件下3~4个月可以完成一个生长周期,可作为研究甾体皂苷合成途径的理想模式材料。随着三萜皂苷avencins代谢基因簇的发现,经过多年研究已较完整的解析了燕麦三萜皂苷的合成途径(louveau et al.2018;orme et al.2019)。
技术实现要素:
5.为解析重楼皂苷代谢途径,实现重楼皂苷的人工合成,我们以燕麦为模式材料,获得了两个燕麦糖基转移酶,分别命名为asugt73e5和asugt73e1。为验证糖基转移酶功能,我们设计了糖基转移酶基因asugt73e5、asugt73e1编码区的pcr引物asugt73e5-orf-f/r、 asugt73e1-orf-f/r。以反转录后的燕麦幼苗cdna为模板进行pcr扩增,获得了 asugt73e5和asugt73e1基因。asugt73e5基因的开放阅读框含有1548个碱基,其核苷酸序列如seq id no:2所示,编码的氨基酸序列如seq id no:1所示。asugt73e1基因的开放阅读框含有1473个碱基,其核苷酸序列如seq id no:4所示,编码的氨基酸序列如seqid no:3所示。
6.然后,我们进行了蛋白表达和纯化。利用同源重组将基因asugt73e5、asugt73e1的开放阅读框(orf)克隆至原核表达载体pgex-6p-1中,转化表达感受态rosetta(de3)。在amp 抗性的lb液体培养基中培养至od600=0.6,加入iptg低温诱导过夜。菌体超声破碎后,通过glutathione beads纯化上清中的蛋白,收集各组分进行sds-page分析(图2)。与未经诱导的对照样品相比,重组蛋白在80kda附近均出现了明显条带。asugt73e5和asugt73e1 蛋白分别包含515和490个氨基酸,与gst标签融合后的分子量分别为82.21kda和79.79 kda。
7.接下来我们分别采用薯蓣皂苷元、偏诺皂苷元和纽阿替皂苷元对糖基转移酶asugt73e5 和asugt73e1进行了功能验证,结果如下:
8.将asugt73e5蛋白与薯蓣皂苷元、udp-glc反应的产物进行hplc检测(图3),与空载的反应相比,asugt73e5的产物在22.3min出现了新峰(product 1),与延龄草苷(trillin) 标准品出峰时间相同。回收样品,加入asugt73e1蛋白和udp-rha继续反应,在20.7min 出现了新产物峰(product 2),时间与重楼皂苷v标准品相符。tof正离子扫描模式检测见图4,product 1和product 2的分子量大小分别为577.38(m+h+)和723.43(m+h+),与延龄草苷(576.3)和重楼皂苷v(722.4)的分子量一致,表明薯蓣皂苷元经过asugt73e5和 asugt73e1的连续催化后生成了重楼皂苷v。
9.将asugt73e5蛋白与偏诺皂苷元、udp-glc反应的产物进行hplc检测后(图5),与空载的反应相比,asugt73e5的产物在18.8min出现了新峰(product 3)。回收样品,加入 asugt73e1蛋白和udp-rha继续反应,在17.1min出现了新产物峰(product 4),时间与重楼皂苷ⅵ标准品相符。tof正离子扫描模式检测见图6,product 3和product 4的分子量大小分别为593.37(m+h+)和739.43(m+h+),与偏诺皂苷元-3-o-葡糖苷(592.3)和重楼皂苷ⅵ(738.4)的分子量一致,表明偏诺皂苷元经过asugt73e5和asugt73e1的连续催化后生成了
重楼皂苷ⅵ。
10.将asugt73e5蛋白与纽阿替皂苷元、udp-glc反应的产物进行hplc检测后(图8),与空载的反应相比,asugt73e5的产物在16.7min出现了新峰(product 5)。回收样品,加入asugt73e1蛋白和udp-rha继续反应,在15.6min出现了第二个产物峰(product 6)。 tof正离子扫描模式检测见图9,product 5和product 6的分子量大小分别为593.37(m+h
+
) 和739.43(m+h
+
),表明纽阿替皂苷元经过asugt73e5和asugt73e1的连续催化后生成了相应的糖基化产物。
11.基于上述研究,本发明提供一种糖基转移酶,是如下a1或a2所述的蛋白质:
12.a1.氨基酸序列如seq id no:1所示的蛋白质;
13.a2.将seq id no:1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/ 或添加而形成的具有糖基转移酶活性的蛋白质。
14.编码所述糖基转移酶的基因也属于本发明的保护范围。
15.在本发明的一些实施例中,所述基因的核苷酸序列如seq id no:2所示。
16.含有所述基因的表达盒、载体或重组菌也属于本发明的保护范围。
17.在一些实施例中,所述载体是克隆载体,包含所述糖基转移酶的编码基因以及质粒复制所需的元件,例如,插入了所述编码基因的pclone007 blunt simple vector。在另一些实施例中,所述载体是表达载体,包含所述糖基转移酶的编码基因和能够使蛋白成功表达的元件,例如,插入了所述编码基因的pgex-6p-1载体。
18.在一些实施例中,所述重组菌是含有克隆载体的重组菌,例如e.coli dh5α,通过培养重组菌使所述糖基转移酶的编码基因得到复制。在另一些实施例中,所述重组菌是含有表达载体的重组菌,在适当的条件下培养该重组菌,例如,加入适量的iptg,16℃诱导所述糖基转移酶的表达。
19.本发明还提供所述糖基转移酶的制备方法,包括如下步骤:构建所述糖基转移酶的编码基因的表达载体,将表达载体导入表达宿主菌中,获得重组菌,培养重组菌并诱导蛋白表达,收集菌体,提取和纯化蛋白。
20.所述糖基转移酶在糖基转移反应中的用途也属于本发明的保护范围。
21.所述糖基转移酶在甾体皂苷合成中的用途也属于本发明的保护范围。所述甾体皂苷合成包括体外合成和体内合成,例如,在微生物(例如酵母)或植物体内合成甾体皂苷。
22.在本发明的一些实施例中,所述甾体皂苷合成中采用薯蓣皂苷元、偏诺皂苷元或纽阿替皂苷元,在所述糖基转移酶的作用下引入葡萄糖基,从而产生相应的甾体皂苷。所述甾体皂苷合成中使用的皂苷元包括但不限于薯蓣皂苷元、偏诺皂苷元和纽阿替皂苷元。所述甾体皂苷包括但不限于延龄草苷或偏诺皂苷元-3-o-葡糖苷。
23.本发明还提供一种合成重楼皂苷v的方法,包括如下步骤:利用本发明所述的糖基转移酶与薯蓣皂苷元、udp-glc反应生成延龄草苷;然后以延龄草苷为底物,加入氨基酸序列如 seq id no:3所示的糖基转移酶和udp-rha继续反应,生成重楼皂苷v。
24.本发明还提供一种合成重楼皂苷ⅵ的方法,包括如下步骤:利用本发明所述的糖基转移酶与偏诺皂苷元、udp-glc反应生成偏诺皂苷元-3-o-葡糖苷;然后以偏诺皂苷元-3-o-葡糖苷为底物,加入氨基酸序列如seq id no:3所示的糖基转移酶和udp-rha继续反应,生成重楼皂苷ⅵ。
25.本发明提供的糖基转移酶将有助于我们探究植物甾体皂苷的合成途径,同时也为大量获得重楼皂苷或其他皂苷提供了基因资源。
附图说明
26.图1.asugt73e5、asugt73e1基因扩增产物电泳图。m为dl 2000;1为asugt73e5 基因条带;2为asugt73e1基因条带。
27.图2.asugt73e5、asugt73e1蛋白原核表达sds-page电泳图。m:page-ruler蛋白分子标记;1:未诱导;2:iptg诱导后全细胞蛋白;3:iptg诱导后细胞上清;4:iptg诱导后细胞沉淀;5:上清gst柱纯化;6:纯化蛋白超滤浓缩。
28.图3.asugt73e5、asugt73e1与薯蓣皂苷元反应的糖基化产物的色谱图。横坐标为保留时间(min),纵坐标为电信号(mau)。pgex-空载:含有pgex-6p-1空载体的细胞经蛋白诱导表达后提取和纯化的蛋白,作为空白对照;pgex-asugt73e5:含有pgex-asugt73e5 载体的细胞经蛋白诱导表达后提取和纯化的asugt73e5蛋白;含有pgex-asugt73e1载体的细胞经蛋白诱导表达后提取和纯化的asugt73e1蛋白。
29.图4.asugt73e5、asugt73e1与薯蓣皂苷元反应的糖基化产物的质谱分析。横坐标为质荷比,纵坐标为离子强度。
30.图5.asugt73e5、asugt73e1与偏诺皂苷元反应的糖基化产物的色谱图。横坐标为保留时间(min),纵坐标为电信号(mau)。pgex-空载:含有pgex-6p-1空载体的细胞经蛋白诱导表达后提取和纯化的蛋白,作为空白对照;pgex-asugt73e5:含有pgex-asugt73e5 载体的细胞经蛋白诱导表达后提取和纯化的asugt73e5蛋白;含有pgex-asugt73e1载体的细胞经蛋白诱导表达后提取和纯化的asugt73e1蛋白。
31.图6.asugt73e5、asugt73e1与偏诺皂苷元反应的糖基化产物的质谱分析。横坐标为质荷比,纵坐标为离子强度。
32.图7.asugt73e5和asugt73e1催化甾体皂苷元糖基化的过程。
33.图8.asugt73e5、asugt73e1与纽阿替皂苷元反应的糖基化产物的色谱图。横坐标为保留时间(min),纵坐标为电信号(mau)。pgex-空载:含有pgex-6p-1空载体的细胞经蛋白诱导表达后提取和纯化的蛋白,作为空白对照;pgex-asugt73e5:含有 pgex-asugt73e5载体的细胞经蛋白诱导表达后提取和纯化的asugt73e5蛋白;含有 pgex-asugt73e1载体的细胞经蛋白诱导表达后提取和纯化的asugt73e1蛋白。
34.图9.asugt73e5、asugt73e1与纽阿替皂苷元反应的糖基化产物的质谱分析。横坐标为质荷比,纵坐标为离子强度。
具体实施方式
35.下面结合实施例进一步描述本发明,需要理解的是,下述实施例仅作为对本发明的解释和说明,不以任何方式限制本发明的范围。
36.实验材料:
37.以下实验使用的植物材料为二倍体燕麦(avena strigosa,s75),已知品种,记载在非专利文献papadopoulou et al.1999中。上述生物材料本实验室亦有保存,申请人声明可自申请日起二十年内向公众发放用于验证实验。
38.大肠杆菌(escherichia coli)dh5α和rosetta(de3)购于上海唯地生物技术有限公司。克隆载体pclone007 blunt simple vector购于北京擎科新业生物技术有限公司。原核表达载体 pgex-6p-1为实验室保存,该载体亦可商购获得。
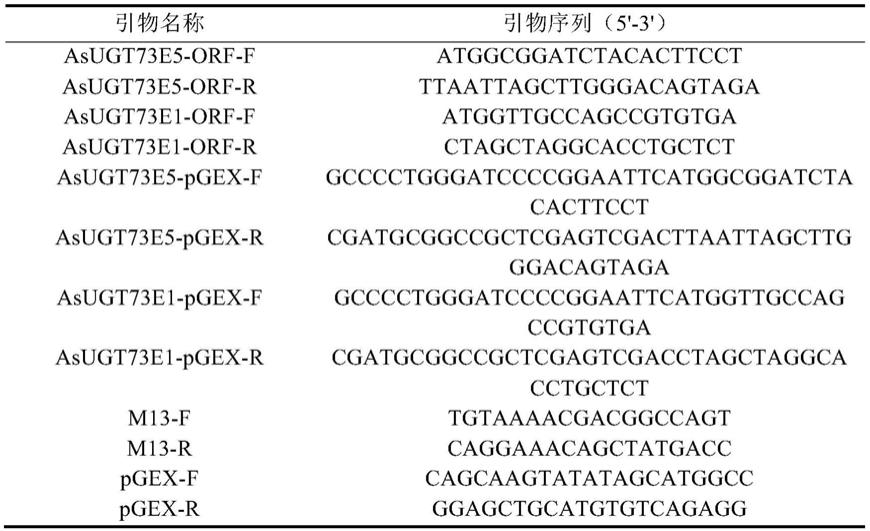
39.pcr引物:
[0040][0041]
主要试剂:
[0042]
薯蓣皂苷元:cas号:512-04-9,分子式:c
27h42
o3,英文名称diosgenin,购买自成都普瑞法科技开发有限公司,货号bp0504。
[0043]
偏诺皂苷元:cas号:507-89-1,分子式:c
27h42
o4,英文名称pennogenin。实验中使用的偏诺皂苷元通过重楼皂苷vi酶解分离纯化获得,酶解分离纯化方法参考li,w.,wang,z., gu,j.,chen,l.,hou,w.,jin,y.p.,&wang,y.p.(2015).bioconversion of ginsenoside rd toginsenoside m1 by snailase hydrolysis and its enhancement effect on insulin secretion in vitro.diepharmazie,70:340
–
346.中记载的方法。偏诺皂苷元亦可商购获得。
[0044]
纽阿替皂苷元:cas号:6811-35-4,分子式:c
27h42
o4,英文名称nuatigenin。实验中使用的纽阿替皂苷元通过燕麦皂苷(avenacosides)提取物酶解分离纯化获得,燕麦皂苷 (avenacosides)的提取方法参考yang,j.l.,wang,p.,wu,w.b.,zhao,y.t.,idehen,e.,& sang,s.m.(2016).steroidal saponins in oat bran.journal of agricultural&food chemistry, 64(7):1549-1556.,酶解分离纯化方法参考li,w.,wang,z.,gu,j.,chen,l.,hou,w.,jin,y.p., &wang,y.p.(2015).bioconversion of ginsenoside rd to ginsenoside m1 by snailase hydrolysisand its enhancement effect on insulin secretion in vitro.die pharmazie,70:340
–
346.。
[0045]
udp-glucose(udp-glc):cas号:28053-08-9,分子式:c
15h22
n2na2o
17
p2,购买自北京酷来博科技有限公司,货号cu11611-500mg。
[0046]
udp-rhamnose(udp-rha):cas号:1526988-33-9,分子式:c
15h22
n2na2o
16
p2,英文名
称udp 5'-diphospho-a-l-rhamnose,购买自苏州汉酶生物技术有限公司。
[0047]
延龄草苷:cas号:14144-06-0,分子式:c
33h52
o8,购买自成都普瑞法科技开发有限公司,货号bp1124。
[0048]
重楼皂苷v:cas号:19057-67-1,分子式:c
39h62o12
,购买自成都普瑞法科技开发有限公司,货号bp1151。
[0049]
重楼皂苷ⅵ:cas号:55916-51-3,分子式:c
39h62o13
,购买自成都普瑞法科技开发有限公司,货号bp1131。
[0050]
色谱甲醇:购买自美国默克,货号1.06007.4008。
[0051]
若未特别说明,以下实施例中使用的试剂均为本领域常规试剂,可商购获得或按照本领域常规方法配制而得;使用的实验方法和条件均为本领域常规的实验方法和条件,可参考相关实验手册、公知文献或厂商说明书。除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域普通技术人员通常理解的含义相同的含义。
[0052]
实施例1.糖基转移酶基因asugt73e5和asugt73e1的发现、克隆与表达
[0053]
1.基因发现
[0054]
我们以燕麦为模式材料,发现两个糖基转移酶基因,将其命名为asugt73e5和 asugt73e1。asugt73e5基因的开放阅读框(orf)含有1548个碱基,其核苷酸序列如seqid no:2所示,编码氨基酸序列如seq id no:1所示的糖基转移酶。asugt73e1基因的开放阅读框(orf)含有1473个碱基,其核苷酸序列如seq id no:4所示,编码氨基酸序列如seq id no:3所示的糖基转移酶。通过转录组与目标代谢物关联分析(pearson correlation),我们发现在燕麦10种组织中这两个糖基转移酶的表达与胆固醇合成高度协同,因此很可能参与了甾体皂苷的合成。为了验证这两个糖基转移酶在甾体皂苷合成中的功能,我们进行了基因克隆与表达。
[0055]
2.基因克隆
[0056]
2.1燕麦幼苗总rna的提取
[0057]
rna的提取采用天根生物公司的rnaprep pure plant kit(货号:dp441),按照试剂盒使用说明书进行操作,步骤如下:
[0058]
(1)50-100mg燕麦叶片在液氮中迅速研磨成粉末,加入450μl rl(使用前加入β-巯基乙醇),涡旋剧烈震荡混匀;
[0059]
(2)将溶液转移至过滤柱cs上,12,000rpm离心2-5min,吸取收集管中的上清至 rnase-free的离心管中;
[0060]
(3)加入0.5倍上清体积的无水乙醇混匀,得到的溶液和沉淀一起转入吸附柱cr3中, 12,000rpm离心30-60sec,倒掉废液,吸附柱cr3放回收集管中;
[0061]
(4)吸附柱cr3中加入350μl去蛋白液rw1,12,000rpm离心30-60sec,倒掉废液,吸附柱cr3放回收集管中;
[0062]
(5)dnase i工作液的配制:取10μl dnase i储存液放入新的rnase-free离心管中,加入70μl rdd缓冲液,轻柔混匀;
[0063]
(6)向吸附柱cr3中央加入80μl的dnase i工作液,室温放置15min;
[0064]
(7)向吸附柱cr3中加入350μl去蛋白液rw1,12,000rpm离心30-60sec,倒掉废液,吸附柱cr3放回收集管中;
[0065]
(8)向吸附柱cr3中加入500μl漂洗液rw(使用前加入乙醇),室温静置2min,12,000 rpm离心30-60sec,倒掉收集管中的废液,将吸附柱cr3放回收集管中,重复一次;
[0066]
(9)12,000rpm离心2min,倒掉废液,吸附柱cr3置于室温放置数分钟,彻底晾干残余的漂洗液;
[0067]
(10)将吸附柱cr3放入一个新的rnase-free离心管中,向吸附膜的中间部位悬空滴加 30-100μl rnase-free ddh2o,室温放置2min,12,000rpm离心2min,得到rna溶液。
[0068]
2.2 cdna的合成
[0069]
应用superscriptⅲrreverse transcriptase试剂盒(invitrogen,货号:18080085)并按试剂盒说明书进行操作:
[0070]
(1)rna模板变性
[0071][0072]
65℃加热5min,迅速置于冰上骤冷,并在冰上静置2min。
[0073]
(2)第一链cdna合成
[0074][0075]
短暂离心混匀。55℃反应60min,70℃加热15min终止反应,产物-20℃保存。
[0076]
2.3目的基因扩增
[0077]
设计糖基转移酶基因asugt73e5、asugt73e1编码区引物asugt73e5-orf-f/r、 asugt73e1-orf-f/r。以5倍稀释后的燕麦幼苗cdna作为模板进行pcr扩增,分别使用引物asugt73e5-orf-f/r、asugt73e1-orf-f/r和2
×
phanta max master mix高保真酶 (vazyme,货号:p515-02)对目的基因进行pcr扩增,反应体系如下:
[0078][0079]
反应条件:95℃预变性3min;95℃变性30sec,按引物tm值(asugt73e5-orf-f/r: 60℃,asugt73e1-orf-f/r:60℃)退火30sec,72℃延伸1min,共33个循环;72℃彻底延伸7min。反应结束后,对pcr产物进行1%琼脂糖凝胶电泳检测。
[0080]
结果如图1所示,1为asugt73e5,2为asugt73e1,基因条带大小均为1500bp左右。
[0081]
2.4 dna凝胶回收
[0082]
使用gel extraction kit(omega,货号:d2500-02)试剂盒回收目的基因片段,按照试剂盒使用说明书进行操作,具体如下:
[0083]
(1)在紫外切胶仪中切下含有目的条带的琼脂糖凝胶,取等体积的结合缓冲液/bindingbuffer,混合物在55℃孵育7min至凝胶完全融化。
[0084]
(2)吸取700μl混合液,转移到套有2ml收集管的dna吸附柱内,静置1min,10,000 g离心1min,弃滤液。
[0085]
(3)吸附柱置回收集管内,加入700μl无水乙醇稀释的spw wash buffer,10,000g离心1min,弃滤液。重复一次。
[0086]
(4)弃去滤液,空吸附柱置回离心管内,12,000g离心2min。
[0087]
(5)空吸附柱置于灭菌的1.5ml离心管中,打开管盖静置1min,在吸附膜中央加入 30μl无菌水(60℃预热),室温静置1min。12,000g离心1min,洗脱dna。
[0088]
2.5克隆载体连接
[0089]
将目的基因克隆至pclone007 blunt simple vector(北京擎科生物,货号:tsv-007bs),反应体系如下表:
[0090][0091]
室温反应5min即可。
[0092]
2.6大肠杆菌转化
[0093]
(1)取100μl冰浴融化的感受态细胞dh5α(上海唯地生物),加入目的dna,轻轻混匀后冰浴放置30min;
[0094]
(2)42℃水浴热激60s,将离心管迅速转移到冰浴中2min;
[0095]
(3)向离心管中加入200μl无抗性的无菌lb培养液,混匀后于37℃摇床中180rpm 培养1h,使细菌复苏;
[0096]
(4)吸取上一步转化的感受态细胞加到含有氨苄青霉素(amp,筛选浓度100mg/l) 抗性的lb琼脂培养基上,将细胞均匀涂开,吹干培养基表面液体,平板倒置于37℃过夜培养;
[0097]
(5)挑取若干单菌落,加入含有amp抗性(100mg/l)的500μl lb液体培养基中, 37℃ 180rpm培养4h,菌液pcr鉴定,鉴定引物为m13-f/r,阳性克隆送睿博兴科生物技术有限公司进行测序,获得序列正确的克隆载体pclone007-asugt73e5和 pclone007-asugt73e1。
[0098]
2.7质粒提取
[0099]
测序正确的样品保菌后,使用e.z.n.a.plasmid mini kitⅰ试剂盒(omega,货号:d6942-02) 按照使用说明书提取质粒,操作步骤如下:
[0100]
(1)取5ml 37℃过夜培养的菌液(12-16h),10,000g离心1min,弃去上清;
[0101]
(2)向离心管中加入250μl solutionⅰ(已加入rnase a),吹打混匀;
[0102]
(3)加入250μl solutionⅱ,上下颠倒4-6次混匀,静置2min使菌体充分裂解(总时间少于5min);
[0103]
(4)加入350μl solutionⅲ,立即上下颠倒6-8次,让溶液彻底混匀,此时出现大量白色絮状沉淀。13,000g离心10min;
[0104]
(5)将吸附柱置于收集管内,吸取离心后的上清加入吸附柱中,10,000g离心1min,弃滤液;
[0105]
(6)吸附柱中加入700μl的dna wash buffer,10,000g离心1min,弃滤液。重复一次;
[0106]
(7)空吸附柱放回收集管中,13,000g离心2min,吸附柱转移至新的1.5ml离心管中,管盖打开干燥吸附柱1min,挥干吸附柱中残留的漂洗液;
[0107]
(8)吸附柱的膜中央加入50μl预热至55℃的无菌水,静置2min,13,000g离心1min。弃去吸附柱,质粒保存于-20℃待用。
[0108]
3.蛋白表达
[0109]
3.1原核表达载体构建
[0110]
以包含目的基因asugt73e5和asugt73e1开放阅读框的pclone007载体 (pclone007-asugt73e5和pclone007-asugt73e1)为模板,设计重组引物 asugt73e5-pgexf/r、asugt73e1-pgexf/r进行pcr扩增,反应体系和反应条件同上述 2.3,获得用于构建表达载体的基因片段。
[0111]
采用pgex-6p-1作为原核表达载体。pgex-6p-1载体用ecorⅰ(thermo,货号:fd0274) 和salⅰ(thermo,货号:fd0644)快速内切酶线性化,体系如下:
[0112][0113]
37℃反应1h后终止。
[0114]
将pcr扩增产物和线性化的pgex-6p-1载体通过琼脂糖凝胶电泳检测后回收。使用 clonexpressⅱone step cloning kit试剂盒(vazyme,货号:c112-02)按照说明书对回收的基因片段和线性化pgex-6p-1进行同源重组,将基因asugt73e5、asugt73e1的orf分别克隆至原核表达载体pgex-6p-1中,反应体系如下:
[0115][0116]
37℃反应30min,降至4℃或置于冰上冷却,得到的反应产物转化大肠杆菌dh5α,转化方法同上述2.6。过夜培养后,挑取单菌落,加入含有amp抗性(100mg/l)的500μl lb 液体培养基中,37℃ 180rpm培养4h,菌液pcr鉴定,鉴定引物为pgex-f/r,阳性克隆送睿博兴科
生物技术有限公司进行测序。测序结果正确的样品保菌后提取质粒 pgex-asugt73e5/pgex-asugt73e1,质粒提取方法同上述2.7。用提取的质粒转化大肠杆菌rossetta(de3)表达感受态(上海唯地生物),同时设置pgex-6p-1空载体转化作为对照,转化方法同上述2.6。
[0117]
3.2蛋白诱导表达
[0118]
按1:100的体积比将含有pgex-asugt73e5/pgex-asugt73e1/pgex-6p-1空载体的 rossetta(de3)菌液分别接种于1l含有amp抗性(100mg/l)的lb液体培养基中,37℃摇床200rpm培养至od
600
=0.6,加入0.2mm iptg,16℃摇床160rpm过夜诱导。4℃,4,000 rpm离心收集菌体,加入10ml预冷的pbs溶液(浓度0.01m,ph 7.4,配方:nacl 8.0g, kcl 0.2g,na2hpo
4 1.44g,kh2po
4 0.24g,加蒸馏水至1l)重悬,冰上超声破碎至溶液呈半透明状。4℃,12,000rpm离心15min,收集上清和沉淀,sds-page电泳检测。
[0119]
3.3蛋白纯化
[0120]
配制平衡/洗杂液(平衡液和洗杂液的配方一样)和洗脱液,并在使用前加入1mm dtt。平衡/洗杂液(1l):140mm nacl,2.7mm kcl,10mm na2hpo4,1.8mm kh2po4,ph 7.4。洗脱液(1l):50mm tris-hcl,10mm还原型谷胱甘肽,ph 8.0。
[0121]
(1)将glutathione beads(常州天地人和生物,货号:sa008010)装入合适的层析柱,用5倍柱体积的平衡液进行平衡,使填料处于与目的蛋白相同的缓冲体系下,起到保护蛋白的作用;
[0122]
(2)将样品加到平衡好的glutathione beads中,保证目的蛋白与glutathione beads充分接触,提高目的蛋白的回收率,收集流出液;
[0123]
(3)用10倍柱体积的洗杂液进行清洗,去除非特异性吸附的杂蛋白,收集洗杂液;
[0124]
(4)使用5倍柱体积的洗脱液,收集洗脱液,即目的蛋白组分;
[0125]
(5)依次使用3倍柱体积的平衡液和5倍柱体积的去离子水平衡填料;
[0126]
(6)将纯化后的蛋白液加入millipore 15ml超滤管(10kd),4℃,4,000rpm离心浓缩样品至500μl,加入15ml pbs磷酸缓冲液(浓度0.01m,配方:nacl 8.0g,kcl 0.2g, na2hpo
4 1.44g,kh2po
4 0.24g,调节ph 7.4,加蒸馏水至1l),继续浓缩至500μl。重复一次;
[0127]
(7)吸取纯化的蛋白,稀释后加入甘油至终浓度10%,-80℃保存。
[0128]
sds-page检测纯化蛋白。结果如图2所示,1为未经诱导的全细胞蛋白;2为iptg诱导后的全细胞蛋白;3为iptg诱导后的细胞上清;4为iptg诱导后的细胞沉淀;5为上清 gst柱纯化的蛋白;6为超滤浓缩后的纯化蛋白。与未经诱导的对照样品相比,重组蛋白在 80kda附近均出现了明显条带。asugt73e5和asugt73e1蛋白分别包含515和490个氨基酸,与gst标签融合后的分子量分别为82.21kda和79.79kda。
[0129]
实施例2.糖基转移酶asugt73e5和asugt73e1的功能鉴定
[0130]
1.酶活性检测
[0131]
(1)asugt73e5催化的糖基化反应
[0132]
准确称取1mm甾体皂苷元(薯蓣皂苷元/偏诺皂苷元/纽阿替皂苷元),1mmudp-glucose(udp-glc),50μl纯化后的糖基转移酶asugt73e5,溶于pbs磷酸缓冲液(浓度0.01m,配方:nacl 8.0g,kcl 0.2g,na2hpo
4 1.44g,kh2po
4 0.24g,调节ph 8.0,加蒸馏水至1l),使终体积达到300μl。37℃反应2h后,加入等体积甲醇终止酶活,产物减压旋干后,溶于500μl色谱甲醇待测。
[0133]
(2)asugt73e1催化的糖基化反应
[0134]
重复(1)中的糖基化反应,将产物浓缩干燥后全部用作底物,加入1mm udp-rhamnose (udp-rha),50μl纯化后的糖基转移酶asugt73e1,溶于pbs磷酸缓冲液(ph 8.0),使终体积达到300μl。37℃反应2h后,加入等体积甲醇终止酶活,产物减压旋干后,溶于500 μl色谱甲醇待测。
[0135]
2.hplc及lc-q-tof鉴定酶产物
[0136]
(1)液相色谱
[0137]
本实验使用thermo ultimate 3000液相色谱仪,thermo hypersil gold c
18
液相色谱柱 (250mm
×
4.6mm,5μm)进行hplc检测。流动相为水(a)和乙腈(b)。洗脱梯度:0~6 min,20%~30%b;6~15min,30%~60%b;15~21min,60%~100%b;21~30min,100%b; 30~35min,100%~20%b。流速1ml/min,柱温30℃,进样量10μl,检测波长:210nm。
[0138]
(2)质谱检测
[0139]
本实验使用ab sciex tripletof 6600超高分辨质谱仪进行检测。正离子数据采集模式,条件为:毛细管电压3.6kv,锥孔电压35kv,离子源温度105℃,脱溶剂气温度340℃,反向锥孔气流55l/h,脱溶剂气650l/h,萃取锥孔4v。质荷比数据扫描范围:50-1500m/z。
[0140]
结果与分析
[0141]
将asugt73e5蛋白与薯蓣皂苷元、udp-glc反应的产物用真空浓缩仪干燥,加入500μl 色谱甲醇溶解,0.22μm滤膜过滤后进行hplc检测。如图3所示,与空载的反应相比, asugt73e5的产物在22.3min出现了新峰(product 1),与延龄草苷(trillin)标准品出峰时间相同。回收样品,加入asugt73e1蛋白和udp-rha继续反应,在20.7min出现了新产物峰(product 2),时间与重楼皂苷v标准品相符。tof正离子扫描模式检测见图4,product 1 和product 2的分子量大小分别为577.38(m+h
+
)和723.43(m+h
+
),与延龄草苷(576.3) 和重楼皂苷v(722.4)的分子量一致,表明薯蓣皂苷元经过asugt73e5和asugt73e1的连续催化后生成了重楼皂苷v。
[0142]
将asugt73e5蛋白与偏诺皂苷元、udp-glc反应的产物进行hplc检测后(图5),与空载的反应相比,asugt73e5的产物在18.8min出现了新峰(product 3)。回收样品,加入 asugt73e1蛋白和udp-rha继续反应,在17.1min出现了新产物峰(product 4),时间与重楼皂苷ⅵ标准品相符。tof正离子扫描模式检测见图6,product 3和product 4的分子量大小分别为593.37(m+h
+
)和739.43(m+h
+
),与偏诺皂苷元-3-o-葡糖苷(592.3)和重楼皂苷ⅵ(738.4)的分子量一致,表明偏诺皂苷元经过asugt73e5和asugt73e1的连续催化后生成了重楼皂苷ⅵ。asugt73e5和asugt73e1蛋白催化甾体皂苷元糖基化的过程见图7。
[0143]
将asugt73e5蛋白与纽阿替皂苷元、udp-glc反应的产物用真空浓缩仪干燥,加入500 μl色谱甲醇溶解,0.22μm滤膜过滤后进行hplc检测。如图8所示,与空载的反应相比,asugt73e5的产物在16.7min出现了新峰(product 5)。回收样品,加入asugt73e1蛋白和udp-rha继续反应,在15.6min出现了第二个产物峰(product 6)。tof正离子扫描模式检测见图9,product 5和product 6的分子量大小分别为593.37(m+h
+
)和739.43(m+h
+
),表明纽阿替皂苷元经过asugt73e5和asugt73e1的连续催化后生成了相应的糖基化产物。
[0144]
参考文献:
[0145]cá
rdenas,p.d.,sonawane,p.d.,heinig,u.,bocobza,s.e.,burdman,s.,&
297.
[0156]
wang,g.x.,han,j.,zhao,l.w.,jiang,d.x.,liu,y.t.,&liu,x.l.(2010).anthelmintic activity of steroidal saponins from paris polyphylla.phytomedicine,17(14),1102-1105.
[0157]
xue,z.y.,tan,z.w.,huang,a.c.,zhou,y.,sun,j.c.,wang,x.n.,
…
&qi,x.q.(2018). identification of key amino acid residues determining product specificity of 2,3-oxidosqualene cyclase in oryza species.new phytologist,218(3):1076-1088.
[0158]
yan,y.m.,shen,x.,cao,y.k.,zhang,j.j.,wang,y.,&cheng,y.x.(2020).discovery of anti-2019-ncov agents from 38 chinese patent drugs toward respiratory diseases via docking screening.preprints,2020020254(doi:10.20944/preprints202002.0254.v2).
[0159]
zhang,c.,jia,x.j.,bao,j.l.,chen,s.h.,wang,k.,zhang,y.l.,
…
&he,c.w.(2016). polyphyllin vii induces apoptosis in hepg2 cells through ros-mediated mitochondrialdysfunction and mapk pathways.bmc complementary and alternative medicine,16(58)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1