一种二苯并七元杂环类化合物及其制备方法与应用与流程
sn(r8)(r9)-或-ge(r
10
)(r
11
);其中,r3~r
11
各自独立地选自氢、氘、卤素、氰基、硝基、取代或未取代的(c3-c30)环烷基、取代或未取代的(3元-30元)杂环烷基、取代或未经取代的(c6-c30)芳基、取代或未经取代的(3元-30元)杂芳基;
[0009]
l为连接键,且l为经取代或未经取代的(c6-c30)亚芳基、经取代或未经取代的(3元-15元)亚杂芳基;
[0010]
ar1和ar2为相同取代基或不同取代基;且ar1和ar2至少选自以下基团中的一种:取代或未取代的(c1-c30)环烷基、取代或未取代的(3元-30元)杂环烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(3元-30元)杂芳基、取代或非取代的(c6-c30)芳基氨基、取代或非取代的(3元-30元)杂芳基氨基;
[0011]
r1和r2为相同取代基或不同取代基;且r1和r2至少选自以下基团中的一种:氢、氘、卤素、氰基、羧基、硝基、羟基、磺酸基、磷酸基、硼烷基、经取代或未经取代的(c1-c30)烷基、经取代或未经取代的(c2-c30)烯基、经取代或未经取代的(c2-c30)炔基、取代或未取代的(c3-c30)环烷基、取代或未取代的(3元-30元)杂环烷基、取代或未经取代的(c6-c30)芳基、取代或未经取代的(3元-30元)杂芳基、取代或未经取代的(c1-c30)烷氧基、取代或未经取代的(c6-c30)芳基氨基、取代或未经取代的(c6-c30)芳氧基。
[0012]
优选的,所述x为-o-、-s-或-si(r6)(r7)-。
[0013]
优选的,ar1和ar2各自独立地选自取代或未取代的(c3-c15)环烷基、取代或未取代的(3元-15元)杂环烷基、取代或未取代的(c6-c20)芳基、取代或未取代的(3元-20元)杂芳基。
[0014]
优选的,r1、r2各自独立地选自氢、氘、卤素、氰基、经取代或未经取代的(c1-c10)烷基、取代或未取代的(c3-c20)环烷基、取代或未取代的(3元-15元)杂环烷基、取代或未经取代的(c6-c20)芳基、取代或未经取代的(3元-20元)杂芳基。
[0015]
进一步优选的,所述l、ar1、ar2及r1~r
11
上的杂原子为n、o或s。
[0016]
需要说明的是,上述技术方案中,术语“经取代或未经取代的”意指被选自以下的一个、两个或更多个取代基取代:
[0017]
氘、卤素基团、腈基、羟基、羰基、酯基、甲硅烷基、硼基、经取代或未经取代的烷基、经取代或未经取代的环烷基、经取代或未经取代的烷氧基、经取代或未经取代的烯基、经取代或未经取代的烷基胺基、经取代或未经取代的杂环基胺基、经取代或未经取代的芳基胺基、经取代或未经取代的芳基、经取代或未经取代的杂环基;
[0018]
或者被以上所示的取代基中的两个或更多个取代基相连接的取代基取代,或者不具有取代基。例如,“两个或更多个取代基相连接的取代基”可以包括联苯基。换言之,联苯基可以为芳基,或者可以解释为两个苯基相连接的取代基。
[0019]
示范性的,所述二苯并七元杂环类化合物选自以下结构式中任意一种:
[0020]
[0021]
[0022]
[0023][0024]
以上仅列举了一些具体的结构式,但本发明请求保护的系列二苯并七元杂环类化合物不局限上述分子结构,凡是本发明公开的基团及其取代位置的简单变换就可以得到其他具体的分子结构,在此不再一一赘述,且其均应落入本发明申请的保护范围。
[0025]
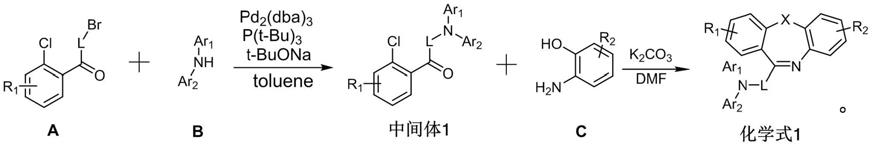
本发明还提供上述二苯并七元杂环类化合物的制备方法,包括以下步骤:
[0026]
(1)在氮气保护下,将原料a和原料b溶于甲苯溶液中,加入钯催化剂、膦配体及叔丁醇钠,搅拌均匀,升温并回流,制备得到中间体1;
[0027]
(2)在氮气保护下,将原料c溶于dmf溶液中,随后加入中间体1和碳酸钾,搅拌均匀,制备得到如化学式1所示的二苯并七元杂环类化合物;
[0028]
具体的,所述二苯并七元杂环类化合物的制备反应式如下:
[0029][0030]
优选的,所述原料a和原料b的质量添加配比为1:1,添加所述钯催化剂、膦配体及叔丁醇钠的质量比为1:5:200。
[0031]
优选的,添加所述原料c、中间体1及碳酸钾的质量比为5:5:6。
[0032]
更为优选的,本发明公开的一种二苯并七元杂环类化合物的制备方法,具体步骤如下所述:
[0033]
步骤1:在氮气保护下,将原料a(1.0eq)和原料b(1.0eq)溶于甲苯溶液中,加入三(二亚苄基丙酮)二钯(0.01eq),三叔丁基膦(0.05eq)及叔丁醇钠(2.0eq),搅拌均匀,升温至90℃~110℃,并回流反应4.5h~5h;反应结束后,稍降温度至75℃,使用硅藻土进行过滤,除去盐以及催化剂,滤液冷却至室温后,水洗三遍,保留有机相,接着用乙酸乙酯萃取水相;合并有机相后,使用无水硫酸镁进行干燥,并使用旋转式蒸发器去除溶剂;使用二氯甲烷将固体有机物完全溶解,然后缓慢滴加到石油醚溶液中,搅拌均匀,有沉淀析出,抽滤得固体,依次用无水乙醇、石油醚淋洗,烘干,制备得到中间体1;
[0034]
步骤2:在氮气保护下,将原料c(1.0eq)溶于dmf溶液中,随后加入中间体1(1.0eq)和碳酸钾(k2co3)(1.2eq),将该混合物升温至90℃~110℃,并搅拌反应19h~20h。反应结束后,除去溶剂,得到固体有机物;利用二氯甲烷和石油醚(v二氯甲烷:v石油醚=10:4)的混合溶液,通过柱色谱法纯化剩余物质获得如化学式1所示的二苯并七元杂环类化合物。
[0035]
本发明公开提供的二苯并七元杂环类化合物的合成路线较短,工艺简单,原料易得,成本低,适于工业化生产与应用。
[0036]
以及本发明还请求保护上述二苯并七元杂环类化合物在有机电致发光器件中的应用。
[0037]
具体地,所述二苯并七元杂环类化合物用于制备有机电致发光器件,包括:第一电极、第二电极和设置于所述第一电极与第二电极之间的一个或多个有机物层;
[0038]
进一步的,所述有机物层是指有机电致发光器件第一电极和第二电极之间的全部层,且所述有机物层中的至少一层为发光层。
[0039]
示范性的,当所述有机物层包括空穴传输层时,所述空穴传输层中含有本发明所述的二苯并七元杂环类化合物,也即本发明公开制备的二苯并七元杂环类化合物可作为空穴传输层材料应用于有机电致发光器件中。
[0040]
与现有技术相比,本发明公开了一种二苯并七元杂环类化合物及其制备方法与应用,具有如下有益效果:
[0041]
1)本发明通过选择与特定的杂环配体配位,调节取代基的位置或取代基的活性。并因配合物上的胺单元具有较低的离子化电位,而使其具有较好的给电子性,较高的空穴迁移率。
[0042]
2)本发明通过降低分子的对称性来增加分子的构象异构体,同时在化学式1中的r1、r2位置上连有取代基,使化合物具有刚性平面结构,增加了分子量,则分子间不易结晶、不易聚集,使材料具有较高的光热稳定性。
[0043]
3)通过将本发明公开制备的二苯并七元杂环类化合物作为空穴传输材料应用于制备有机电致发光器件,使得器件的发光效率得到提高,寿命得到延迟,驱动电压得到降低,其是一种性能优异的有机电致发光化合物,适于市面推广与应用。
具体实施方式
[0044]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普
通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0045]
本发明实施例公开了一种二苯并七元杂环类化合物,该材料可用于制备有机电致发光期间,既能够提高器件的发光效率,又能延长器件的使用寿命,适于推广与应用。
[0046]
实施例1:合成化合物-005
[0047]
1、在氮气保护下,将原料a-005(30.00mmol)和原料b-005(30.00mmol)溶于200.00ml甲苯溶液中,加入三(二亚苄基丙酮)二钯(0.3mmol),三叔丁基膦(1.5mmol)及叔丁醇钠(60.00mmol),搅拌均匀,升温至90℃,并回流反应5h;反应结束后,稍降温度至75℃,使用硅藻土进行过滤,除去盐以及催化剂,滤液冷却至室温后,水洗三遍,保留有机相,接着用乙酸乙酯萃取水相;合并有机相后,使用无水硫酸镁(30.00g)进行干燥,并且使用旋转式蒸发器去除溶剂;使用二氯甲烷将固体有机物完全溶解,然后缓慢滴加到石油醚溶液中,搅拌均匀,有沉淀析出,抽滤得固体,依次用无水乙醇、石油醚淋洗,烘干(80℃,4h),制备得到中间体1(16.10g,产率:87.61%);
[0048][0049]
2、在氮气保护下,将原料c-005(26.14mmol)溶于180.00mldmf溶液中,随后加入中间体1(26.14mmol)和碳酸钾(k2co3)(31.37mmol),将该混合物升温至100℃,并搅拌反应20h;反应结束后,除去溶剂,得到固体有机物;利用二氯甲烷和石油醚(v
二氯甲烷
:v
石油醚
=10:4)的混合溶液,通过柱色谱法纯化剩余物质获得化合物005(13.28g,产率:76.18%,mw:666.81)。
[0050][0051]
对所得化合物-005进行检测分析,结果如下:
[0052]
1)hplc纯度>99%。
[0053]
2)质谱测试:
[0054]
理论值为666.82;测试值为666.81。
[0055]
3)元素分析:
[0056]
计算值为:c,88.26;h,5.14;n,4.20;o,2.40;
[0057]
测试值为:c,88.25;h,5.15;n,4.21;o,2.39。
[0058]
实施例2:合成化合物-059
[0059]
1、在氮气保护下,将原料a-059(30.00mmol)和原料b-059(30.00mmol)溶于250.00ml甲苯溶液中,加入三(二亚苄基丙酮)二钯(0.3mmol),三叔丁基膦(1.5mmol)及叔丁醇钠(60.00mmol),搅拌均匀,升温至90℃,并回流反应5h;反应结束后,稍降温度至75℃,使用硅藻土进行过滤,除去盐以及催化剂,滤液冷却至室温后,水洗三遍,保留有机相,接着用乙酸乙酯萃取水相;合并有机相后,使用无水硫酸镁(35.00g)进行干燥,并且使用旋转式蒸发器去除溶剂;使用二氯甲烷将固体有机物完全溶解,然后缓慢滴加到石油醚溶液中,搅拌均匀,有沉淀析出,抽滤得固体,依次用无水乙醇、石油醚淋洗,烘干(80℃,4h),制备得到中间体1(20.87g,产率:87.56%);
[0060][0061]
2、在氮气保护下,将原料c-059(25.17mmol)溶于250.00mldmf溶液中,随后加入中间体1(25.17mmol)和碳酸钾(k2co3)(30.20mmol),将该混合物升温至100℃,并搅拌反应20h;反应结束后,除去溶剂,得到固体有机物;利用二氯甲烷和石油醚(v
二氯甲烷
:v
石油醚
=10:4)的混合溶液,通过柱色谱法纯化剩余物质获得化学式1(17.36g,产率:76.22%,mw:905.21)。
[0062][0063]
对所得化合物-59进行检测分析,结果如下:
[0064]
1)hplc纯度>99%。
[0065]
2)质谱测试:理论值为905.24;测试值为905.21。
[0066]
3)元素分析:
[0067]
计算值为:c,84.92;h,6.68;n,3.09;o,1.77;s,3.54;
[0068]
测试值为:c,84.93;h,6.67;n,3.08;o,1.76;s,3.56。
[0069]
实施例3:合成化合物-069
[0070]
1、在氮气保护下,将原料a-069(30.00mmol)和原料b-069(30.00mmol)溶于
200.00ml甲苯溶液中,加入三(二亚苄基丙酮)二钯(0.3mmol),三叔丁基膦(1.5mmol)及叔丁醇钠(60.00mmol),搅拌均匀,升温至90℃,并回流反应5h;反应结束后,稍降温度至75℃,使用硅藻土进行过滤,除去盐以及催化剂,滤液冷却至室温后,水洗三遍,保留有机相,接着用乙酸乙酯萃取水相;合并有机相后,使用无水硫酸镁(30.00g)进行干燥,并且使用旋转式蒸发器去除溶剂;使用二氯甲烷将固体有机物完全溶解,然后缓慢滴加到石油醚溶液中,搅拌均匀,有沉淀析出,抽滤得固体,依次用无水乙醇、石油醚淋洗,烘干(80℃,4h),制备得到中间体1(15.62g产率:87.66%);
[0071][0072]
2、在氮气保护下,将原料c-069(25.25mmol)溶于180.00mldmf溶液中,随后加入中间体1(25.25mmol)和碳酸钾(k2co3)(30.30mmol),将该混合物升温至100℃,并搅拌反应20h;反应结束后,除去溶剂,得到固体有机物;利用二氯甲烷和石油醚(v
二氯甲烷
:v
石油醚
=10:4)的混合溶液,通过柱色谱法纯化剩余物质获得化学式1(12.79g,产率:76.15%,mw:664.85)。
[0073][0074]
对所得化合物-069进行检测分析,结果如下:
[0075]
1)hplc纯度>99%。
[0076]
2)质谱测试:
[0077]
理论值为664.87;测试值为664.85。
[0078]
3)元素分析:
[0079]
计算值为:c,83.10;h,5.46;n,4.21;o,2.41;s,4.82;
[0080]
测试值为:c,83.11;h,5.45;n,4.22;o,2.40;s,4.82。
[0081]
实施例4:合成化合物-087
[0082]
1、在氮气保护下,将原料a-087(30.00mmol)和原料b-087(30.00mmol)溶于200.00ml甲苯溶液中,加入三(二亚苄基丙酮)二钯(0.3mmol),三叔丁基膦(1.5mmol)及叔
丁醇钠(60.00mmol),搅拌均匀,升温至90℃,并回流反应5h;反应结束后,稍降温度至75℃,使用硅藻土进行过滤,除去盐以及催化剂,滤液冷却至室温后,水洗三遍,保留有机相,接着用乙酸乙酯萃取水相;合并有机相后,使用无水硫酸镁(30.00g)进行干燥,并且使用旋转式蒸发器去除溶剂;使用二氯甲烷将固体有机物完全溶解,然后缓慢滴加到石油醚溶液中,搅拌均匀,有沉淀析出,抽滤得固体,依次用无水乙醇、石油醚淋洗,烘干(80℃,4h),制备得到中间体1(16.30g,产率:87.59%);
[0083][0084]
2、在氮气保护下,将原料c-087(25.80mmol)溶于220.00mldmf溶液中,随后加入中间体1(25.80mmol)和碳酸钾(k2co3)(30.30mmol),将该混合物升温至100℃,并搅拌反应20h;反应结束后,除去溶剂,得到固体有机物;利用二氯甲烷和石油醚(v
二氯甲烷
:v
石油醚
=10:4)的混合溶液,通过柱色谱法纯化剩余物质获得化学式1(15.12g,产率:76.19%,mw:769.04)。
[0085][0086]
对所得化合物-087进行检测分析,结果如下:
[0087]
1)hplc纯度>99%。
[0088]
2)质谱测试:
[0089]
理论值为769.06;测试值为769.04。
[0090]
3)元素分析:
[0091]
计算值为:c,85.90;h,6.29;n,3.64;s,4.17;
[0092]
测试值为:c,85.91;h,6.28;n,3.65;s,4.16。
[0093]
因结构通式为
技术实现要素:
中的化学式1,其他化合物的合成路线和原理均与上述所列举的实施例相同,所以在此不再穷举。其中,本发明实施例5~10按照上述制备方法可得到如下表1所示的二苯并七元杂环类化合物:
[0094]
表1:
[0095][0096]
[0097][0098]
并采用tma4000热机械分析仪对上述实施例合成的化合物测试其玻璃化转变温度(tg),如表2所示:
[0099]
表2
[0100]
化合物玻璃化转变温度(tg)化合物玻璃化转变温度(tg)5168.369168.820170.578170.938169.287172.642171.493171.759172.199169.7
[0101]
从表2公开的化合物玻璃化转变温度可以看出,由本发明公开制备的化合物具有相对较高的热转变温度,以说明材料具有较高的热稳定性。
[0102]
此外,为了进一步说明本发明公开制备的二苯并七元杂环类化合物在电致发光器件中的应用效果,发明人还进行了下述测试实验,具体如下:
[0103]
器件实施例1:
[0104]
所制备oled器件的结构为:ito(氧化铟锡)-ag-ito(氧化铟锡)阳极/hil/htl/eml/etl/eil/阴极/光取出层。
[0105]
a、ito阳极:将涂层厚度为的ito(氧化铟锡)-ag-ito(氧化铟锡)玻璃基板在蒸馏水中清洗2次,超声波洗涤30min,再用蒸馏水反复清洗2次,超声波洗涤10min,洗涤结束后,用甲醇、丙酮、异丙醇依次超声波洗涤(每次洗涤5min),干燥,然后转移至等离子体清洗机内洗涤5min,再送至蒸镀机中,以该基板为阳极,在其上依次蒸镀其它功能层。
[0106]
b、hil(空穴注入层):蒸镀2-tnata(即n1-(2-萘基)-n4,n4-二(4-(2-萘基(苯基)氨基)苯基)-n1-苯基苯-1,4-二胺)10nm,形成空穴注入层。
[0107]
c、htl(空穴传输层):蒸镀上述实施例1制备的化合物-00515nm,形成空穴传输层。
[0108]
d、eml(发光层):主体材料emh-1和掺杂材料emd-1,以重量比97∶3混合蒸镀40nm,形成发光层。其中主体材料emh-1和掺杂材料emd-1的结构式如下;
[0109]
f、etl(电子传输层):蒸镀et-1和liq40nm,形成电子传输层。其中et-1和liq的重量比为60:40,其中et-1的结构式如下;
[0110]
g、eil(电子注入层):蒸镀yb1.0nm,形成电子注入层。
[0111]
h、阴极:蒸镀镁和银18nm,其重量比为1:9,得到oled器件。
[0112]
i、光取出层:在阴极上真空蒸镀厚度为70nm的idx001,作为光取出层。
[0113][0114]
器件实施例2~10:按照器件实施例1的方法,分别选用化合物-020、038、042、059、069、078、087、093、099替代化合物-005,进行空穴传输层的蒸镀,并制备得到相应的有机电致发光器件,分别记为器件实施例2-10。
[0115]
器件对比例1:
[0116]
该对比例提供了一种有机电致发光器件,该有机电致发光器件的制备方法与器件实施例1的唯一区别在于,该有机电致发光器件是选用化合物tcta替代上述器件实施例1中的空穴传输材料(化合物-005)进行蒸镀,制备得到相应的有机电致发光器件,记为器件对比例1。其中,tcta的化学结构式为:
[0117][0118]
在6000(nits)亮度下对上述器件实施例1~15以及器件对比例1~2得到的有机电致发光器件的驱动电压、发光效率以及寿命进行表征,测试结果如下表3:
[0119]
表3
[0120][0121][0122]
由上述表3的结果能确认使用本发明提供的二苯并七元杂环类化合物作为空穴材料的有机电致发光器件表现出高的发光效率及长的使用寿命,特别是:本发明的二苯并七元杂环类化合物适用在空穴层时候,与对比化合物1和tcta比能明显提高效率和寿命。
[0123]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 4‑乙烯基苯并环丁烯的合成方法与制造工艺
- 羟基苯并三唑衍生物和/或羟基吲唑衍生物作为塑料材料的阻燃剂的用途以及阻燃塑料材料模塑料的制造方法与工艺
- 扩展的非线性并苯衍生物和它们作为有机半导体的用途的制造方法与工艺
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 靛红杂合喹唑啉类化合物合成的靛红衍生物及其在制备抗肿瘤药物中的应用的制造方法与工艺