一种吲哚布芬关键中间体2-(4-硝基苯基)丁酸的合成方法与流程
1.本发明属于化合物合成领域,具体涉及一种吲哚布芬关键中间体2-(4-硝基苯基)丁酸的合成方法。
背景技术:
2.吲哚布芬(indobufen)化学名为2-[4-(1-氧代2-异吲哚啉基)苯基]丁酸,是由美国辉瑞公司研发的一种外消旋体混合物,它能选择的作用于循环的血小板,阻断血栓形成,抑制血小板因子释放而发挥抗血小板聚集作用,这种抑制是可逆的,不改变血浆参数,无损血小板功能,并使变异常的血小板功能恢复正常。与同类药物相比,吲哚布芬抑制血小板因子,抗血小板聚集效果是水杨酸的2~5倍,较之有轻微持续时间更短的出血时间。
[0003]
高学民等在《抗凝药吲哚布芬的合成》(中国医药工业杂志,1989,20(11))、郑庚修等在《吲哚布芬的制备工艺》(中国医药工业杂志,1991,22(7))、发明专利cn 106631974 b中公开的吲哚布芬或吲哚布芬中间体的合成路线均以2-(4-硝基苯基)丁酸为起始物料,目前关于2-(4-硝基苯基)丁酸的合成报道非常少,例如郑庚修等在《吲哚布芬的制备工艺》(中国医药工业杂志,1991,22(7))中公开的吲哚布芬制备路线中显示,2-(4-氨基苯基)丁酸可以通过苯乙腈和溴己烷反应,然后经过硝化得到。但受环评影响,涉及硝化反应的生产受严格控制,为了降低风险,十分必要开发一种吲哚布芬关键中间体2-(4-硝基苯基)丁酸新的制备方法。
技术实现要素:
[0004]
为解决现有技术存在的缺陷,本发明提供了一种吲哚布芬关键中间体2-(4-硝基苯基)丁酸新的合成方法。
[0005]
本发明采用如下技术方案:
[0006]
一种吲哚布芬关键中间体2-(4-硝基苯基)丁酸的合成方法包括如下步骤:
[0007]
(1)在有机溶剂中,在碱性物质的作用下,式ⅰ所示的化合物与溴乙烷反应得到式ⅱ所示的化合物;
[0008][0009]
(2)式ⅱ所示的化合物在酸性条件下水解得到式ⅲ所示的目标产物;
[0010][0011]
进一步,步骤(1)中,所述的碱性物质为碳酸钠、氢氧化钠、氢氧化钾、氢化钠或氨基钠。
[0012]
进一步,步骤(1)中,所述的式ⅰ所示的化合物与溴乙烷、碱性物质的比例关系为1:0.5~2:0.5~2;再进一步,式ⅰ所示的化合物与氢化钠摩尔比优选为1:1.2,式ⅰ所示的化合物与除氢化钠之外的碱性物质的摩尔比优选为1:3。
[0013]
进一步,步骤(1)中,所述的反应温度在室温下进行,反应时间为8~20h,优选为12h。
[0014]
进一步,步骤(1)中,所述反应在有机溶剂中进行,所述的有机溶剂为四氢呋喃、二氧六环、n,n-二甲基甲酰胺。
[0015]
进一步,步骤(2)中,所述的酸为硫酸、盐酸、三氟甲磺酸、醋酸,优选为50%浓硫酸。
[0016]
进一步,步骤(2)中,所述的α-(对硝基苯基)丁腈与酸的摩尔比为1:1~6,优选为1:5。
[0017]
进一步,步骤(2)中,所述的反应时间为5~30h,优选为24h,反应温度为80~120℃,优选为100℃。
[0018]
与现有技术相比,本发明的有益效果在于:
[0019]
本发明所述的方法步骤简单,操作方便,反应无硝化过程,安全性高,污染小,产物的收率高。
具体实施方式
[0020]
以下实施例作为对本发明的进一步说明,不应将其视为对本发明的限制。
[0021]
实施例中所述的sm1原料可购买,亦可根据文献制备得到:sm1的制备
[0022]
在50ml三颈瓶中将7ml硝酸和10ml硫酸混和,冷却至10℃,滴加苯乙腈4ml(4.06g,34.66mmol)。加毕,室温搅拌1小时,倒入50ml冰水中。过滤,用乙醇重结晶,干燥,得对硝基苯乙腈4.85g,产率:86.30%,mp:110~112℃(文献mp:112~114℃,中国医药工业杂志,1993,24(6):276)。
[0023]
实施例1
[0024][0025]
在反应瓶中加入sm1(1.62g,10.00mmol)和氢氧化钠(1.20g,30.00mmol),溶于dmf中,搅拌下滴入溴乙烷(1.63g,15.00mmol),室温反应12h。反应完毕后将反应液倒入水中,用乙酸乙酯萃取,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,柱层析纯化,洗脱剂正己烷:乙酸乙酯=10:1,得到淡黄色油状液体a00 1.50g,收率79%。1h nmr(60mhz,cdcl3)δ8.47
–
8.03(m,2h),7.78
–
7.35(m,2h),3.89(t,j=7.0hz,1h),2.34
–
1.73(m,2h),1.31
–
0.93(m,3h).hrms(esi):found 189.0765[m+h]-[0026]
实施例2
[0027][0028]
在反应瓶中加入sm1(1.62g,10.00mmol)溶于dmf中,冷却至0℃,冰浴下加入nah(0.28g,12.00mmol),搅拌半小时后滴入溴乙烷(1.63g,15.00mmol),撤去冰浴,室温反应12h。反应完毕后将反应液倒入水中,用乙酸乙酯萃取,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,柱层析纯化,洗脱剂正己烷:乙酸乙酯=10:1得到淡黄色油状液体a00 1.56g,收率85%。
[0029]1h nmr(60mhz,cdcl3)δ8.47
–
8.03(m,2h),7.78
–
7.35(m,2h),3.89(t,j=7.0hz,1h),2.34
–
1.73(m,2h),1.31
–
0.93(m,3h).hrms(esi):found 189.0765[m-h]-[0030]
实施例3
[0031]
将实施例1中的氢氧化钠替换为三乙胺(4.09ml,30.00mmol),其余条件参数不变,不发生反应,无法得到目标产物a00。
[0032]
实施例4
[0033]
将实施例1中的氢氧化钠替换为叔丁醇钾(3.36g,30.00mmol),其余条件参数不变,不发生反应,无法得到目前产物a00。
[0034]
实施例5
[0035]
将实施例1中的氢氧化钠替换为甲醇钠(1.62g,30.00mmol),其余条件参数不变,不发生反应,无法得到目前产物a00。
[0036]
实施例6
[0037]
将实施例1中的氢氧化钠替换为碳酸钾(4.14g,30.00mmol),其余条件参数不变,不发生反应,无法得到目前产物a00。
[0038]
实施例7
[0039]
将实施例1中的氢氧化钠替换为碳酸铯(9.78g,30.00mmol),其余条件参数不变,不发生反应,无法得到目前产物a00。
[0040]
实施例8
[0041][0042]
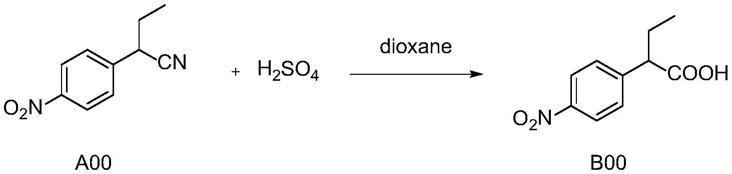
在反应瓶中加入a00(0.20g,1.05mmol),溶于5ml二氧六环中,搅拌下滴入50%浓硫酸(1.03ml,5.25mmol),100℃反应24h。反应完毕后,反应液旋干,加水,naoh调ph至10~12,二氯甲烷萃取,弃去有机相,水相用hcl调ph至3~6,二氯甲烷萃取,有机相饱和食盐水洗,无水硫酸钠干燥,旋干得到淡黄色固体b00 1.50g,收率71%。
[0043]1h nmr(60mhz,cdcl3)δ8.19(d,j=8.6hz,2h),7.49(d,j=8.6hz,2h),3.61(t,j=7.4hz,1h),1.96(dp,j=13.8,6.8hz,2h),0.93(t,j=7.2hz,3h).
[0044]
hrms(esi):found 208.0615[m-h]-[0045]
对比例:
[0046]
文献《吲哚布芬的制备工艺》中提供的文献makosza m et al:organic syntheses,ed by masamune s l976,vol 5pp 91~93.john wiley.new york由苯乙腈制备文献中的化合物3,收率为72%;
[0047]
由化合物3制备2-(硝基苯基)丁酸的步骤为:将浓硝酸和浓硫酸各45ml置反应瓶中混合,冰浴冷却,搅拌下于0~5℃滴加3l8g(0.124mol),加完后继续搅拌1.5h,倒入冰水中,分出油层。将油状物加入h2so4与h2o(1:1)100ml中,在搅拌下回流4h,冷却、倒入冷水100ml中滤出固体。以苯一石油醚重结晶,得5 11.5g二步连乘收率44.2%,mp 121~122℃。即由苯乙腈制备2-(硝基苯基)丁酸的收率为31.82%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1