一种反式糖苷水解酶及其在糖苷结构改造及修饰中的应用的制作方法
[0001]
本发明涉及一种反式糖苷水解酶,还涉及其在糖苷结构改造及修饰中的应用。本发明属于生物化学技术领域。
背景技术:
[0002]
随着科学技术的进步,越来越多的天然产物不断的被发现和利用,但一方面往往具有巨大效果的天然物的含量在天然物种的含量偏低,而且几种相似天然化合物还有着相同的结构,因此可以通过化学修饰进行相互之间的转化,从而提升天然化合物分布不均的情况,另一方面部分天然产物其活性不够强、作用特异性低、药代动力学性质不理想、毒副作用大等缺点、不能直接药用,也需要进一步的结构改造和修饰,以提高生物活性和利用率并降低毒副作用。一般可通过化学法、生物转化法、组合化学等方法实现。而生物转化法通过利用生物酶对其进行结构修饰,具备很大的优势,如反应条件温和,无需保护基团保护,选择性高,能够进行一些化学法无法进行的反应,不污染环境等,目前生物转化修饰结构有羟基化、环氧化、甲基化、异构化、酯化、氧化还原、重排和水解等等。
[0003]
皂苷是比较常见的天然化合物的存在形式,有着比较复杂的结构,具有广泛的生物活性。其中像人参、三七、绞股蓝等等,就含有大量的皂苷成分,皂苷由皂苷配基与糖、糖醛酸或其他有机酸组成。组成皂苷的糖常见的有d-葡萄糖、l
-ꢀ
鼠李糖、d-半乳糖、l-阿拉伯糖、l-木糖。常见的糖醛酸有葡萄糖醛酸、半乳糖醛酸,这些糖或糖醛酸往往先结合成低聚糖糖链,然后与皂苷配基分子中c3
─
oh 相缩合,或由两个糖链分别与皂苷配基分子中两个不同位置上的oh相缩合,皂苷配基分子中的
─
cooh也可能与糖连接,形成酯苷键。往往由于其结合的糖种类和数量等不同,造成其性质和活性的差异,这就给通过化学修饰改造结构提供了较大的空间。其中人参皂苷rh2和薯蓣皂素就是典型的案例。
[0004]
人参作为传统中药,已经有四千年的使用历史了。上世纪90年代初,日本学者发现人参中的一种活性物质一人参皂苷rg3具有选择性地抑制肿瘤细胞浸润和转移的作用。人参中共有40多种皂苷,但rg3在新鲜的或自然干燥的人参药材中并不存在,在红参中的含量仅为十万分之三。人参皂苷不仅具有防癌和抗癌的作用,还有提高免疫、保肝、抗疲劳、保护脑神经细胞及抗血栓等药理作用。同时随着对人参研究的深入,日本学者首次从红参中发现了人参皂苷rh2,这种皂苷是一种次生苷,是鲜人参加工制成红参时,由于某些结构相似的皂苷受热降解后生成的,其在红参中的含量约在十万分之一左右。人参皂苷rh2在十年前就被发现有抗癌活性,但是由于含量低、提取效率低、成本过高,并没有被过度的开发和利用。近年来临床试验结果陆续被报导出来,人参皂苷rh2对于抗癌的疗效极为惊人,被视为当今最具潜力的天然抗癌物质,研究证明人参皂苷rh2对癌细胞有抑制及抗转移的效果,而且效果非常明显。人参皂苷rh2不但具有抑制所有癌细胞的生长、诱导分化癌细胞和抗转移的功能,同时对人体无毒性。人参皂苷 rh2使癌细胞核枯萎、死亡的作用,不同于任何放化疗方法及药物。人参皂苷rh2对人体尚有非常优秀的提升各种免疫机能的作用,对人体健康细胞毫无毒副作用,只专攻击癌细胞。具有极大的开发利用价值。
[0005]
三七与人参同为五加科人参属植物,有研究表明,三七茎叶也是人参皂苷rh2和人参皂苷rg3的重要来源。同时三七中含有大量的人参二醇组皂苷,这是制备人参苷rh2和人参皂苷rg3的提供良好的原料基础。
[0006]
薯蓣皂素是黄姜或川地龙中重要的活性物质,具有雌激素和降低胆固醇的作用,具有抗菌、消炎、止咳等作用,由于其结构与甾体激素的结构极为相似,可作为合成甾体激素药物的主要中间体,是半合成甾族化合物的重要原料。以川地龙或黄姜生药为原料,经水解、提取而得。将薯蓣皂素进行开环、氧化、水解和消除反应,可制得孕甾双烯酮醇。再经肟化、重排和水解,可制得去氢表雄酮。中国化学家黄鸣龙等以薯蓣皂苷元为原料,用七步反应成功地合成了可的松。这些中间体在药物生产中有重要价值。由于薯蓣皂素在原药材中的含量较低,通常是以糖苷的形式存在,其中含量最高的为薯蓣皂苷,但由于薯蓣皂苷自身结构问题,在提取过程中与植物细胞壁黏贴紧密,因此提取效率低。工业上一般采用先发酵(酸解后)形成薯蓣皂素后再提取纯化获得,但这种方法存在着污水量大,有机物含量高,酸性强,色素浓,极难治理,对周围环境造成巨大污染,因此找到一个合适的方法对于其开发利用有着重要意义。
技术实现要素:
[0007]
本发明的目的之一是提供一种糖水解酶,该酶能够将皂苷间糖单元之间的反式糖苷键进行水解,从而改变皂苷的性质,从而解决皂苷间糖单位之间的结构修饰问题。
[0008]
为了达到上述目的,本发明采用了以下技术手段:
[0009]
本发明的一种反式糖苷水解酶,是一种水解反式糖苷键的水解酶类,其氨基酸序列如seq id no.2所示。
[0010]
进一步的,本发明还提出了编码所述的反式糖苷水解酶的核苷酸序列。其中,优选的,所述的核苷酸序列如seq id no.1所示。
[0011]
含有所述的核苷酸序列的表达载体以及含有所述的表达载体的宿主细胞也在本发明的保护范围之内。
[0012]
更进一步的,本发明还提出了一种制备所述的反式糖苷水解酶的方法,包括以下步骤:
[0013]
(1)反式糖苷水解酶基因的获取
[0014]
活化clostridium stercorarium dsm8532菌种,收集细胞,按照用柱式质粒 dna小量抽提试剂盒说明说提取dna,将提取好的dna做为pcr的模板;以上下游引物进行pcr扩增,获得编码权利要求1所述的反式糖苷水解酶的核苷酸序列,上下游引物分别为:
[0015]
上游引物:agctgaagaacgcggaatga
[0016]
下游引物:agcattcgatgccgagctta
[0017]
(2)重组质粒的构建及转化
[0018]
将步骤(1)获得的编码权利要求1所述的反式糖苷水解酶的核苷酸序列通过xhoi和bamhi酶切位点和载体pet-24c(+)连接,得到含有编码权利要求1 所述的反式糖苷水解酶的核苷酸序列的重组表达载体,命名为pet-24c(+)-gh;
[0019]
(3)重组酶的表达
[0020]
挑起单菌落重组大肠杆菌pet-24c(+)-gh至含抗生素的lb培养基中, 37℃,
220rpm,培养过夜,然后按照5%的接种量,接种到新鲜培养液中,培养至od600为0.7时,加入诱导剂iptg,使iptg在培养基的终浓度为 0.2mmol/l,31℃,220rpm,诱导10个小时,收集菌体10000rpm/20min;
[0021]
(4)纯化
[0022]
将离心得到的菌体,加入6倍体积的0.1m的pbs缓冲液,放置冰水中,超声破碎机破损,所得浑浊液离心,所得上清即为粗酶液;于上清粗酶液中加入絮凝剂,待有沉淀生成后离心去滤渣,用30kda的超滤膜超滤,以除去小分子蛋白和盐,以及会对后续反应带来影响的微量元素并提高酶活性,浓缩至破碎液体积的30%,得到纯化后的反式糖苷水解酶,其中,优选的,所述的絮凝剂为阳离子型聚丙烯酰胺絮凝剂。
[0023]
再进一步的,本发明还提出了所述的反式糖苷水解酶在糖苷结构改造及修饰中的应用,其特征在于,所述的反式糖苷水解酶通过水解糖单元之间的反式糖苷键实现对糖苷结构的改造及修饰。
[0024]
本发明的目的之二是提供一种人参皂苷rh2的酶催化制备方法。
[0025]
本发明的目的在于通过对人参皂苷和三七皂苷的化学修饰,建立一种研究天然物分离提纯的新方法,对于某些活性好,但是来源少或者含量极低的活性成分,可通过转化的方法提高含量后,在进行分离提纯,降低成本。
[0026]
本发明主要着重对于天然物的结构改造,人参皂苷rg3与人参皂苷rh2在结构上就是皂苷元上连接的葡萄糖数量的不同,三七中含有大量的原人参二醇组皂苷,他们之间的区别在于其连接的糖的类型、数量和连接方式不同,因此出现了不同类型的人参皂苷,像人参皂苷rb1,人参皂苷rc,人参皂苷rd,人参皂苷 rb3等,在对其大量研究和实验中,发现酸水解可以使他们转化为人参皂苷rg3、 rd和少量rh2,但酸水解存在不稳定和不确定性,往往时间过长或者酸度过强,都会水解过度,生产大量的皂苷元,因此本发明采用先酸水解,在酶解得方案,提高转化的效率。人参皂苷rg3连接的是两个葡萄糖是通过α-1,2糖苷键连接的,而人参皂苷rh2连接是一个葡萄糖,在第二部酶解中,我们利用构建的特异性水解酶,由于能够识别α糖苷键,将双糖拆分,水解掉一个葡萄糖,而不会水解掉双糖单位,从而完成了人参皂苷rg3向人参皂苷rh2的转化,大大的提高了人参皂苷rh2的含量,更加容易获得其单体成分,为其开发利用提供了基础。
[0027][0028]
在原料选取上,本发明发明人分析了人参和三七的根和茎叶总皂苷的成分,尤其分析了人参皂苷rg3和人参皂苷rh2具有相同的母核-原人参二醇组皂苷的含量,其中结果如
下表1所示:
[0029]
表1
[0030][0031]
这其中可以看出原人参二醇组皂苷含量最高的就是三七茎叶总皂苷,从收率和成本上考虑,选取该原料最为划算。
[0032]
本发明依据植物提取的常规工艺进行研究开发,采用三七茎叶总皂苷为起始原料,进行制备人参皂苷rh2。具体流程如下:
[0033]
三七总皂苷
→
酸解物
→
酶解物
→
硅胶柱
→
单体成分
[0034]
具体实施分为三步:
[0035]
(1)酸解(通过酸水解转化修饰皂苷成需要的人参皂苷rh2和其前体物人参皂苷rg3和rd)
[0036]
取三七茎叶总皂苷加入8-12倍体积的4-6%v/v的乙酸回流酸解8-12h,冷却析晶过滤,干燥获得酸解物;
[0037]
其中人参皂苷rh2含量为10-20%之间,人参皂苷rg3含量30-50%之间,人参皂苷rd10%以下(含量的不稳定主要在于原料含量差异,还有酸解本身具有不稳定性,无选择性造成的)。收率在20%左右,酸解时间越长,收率越低,目标产物含量也降低。
[0038]
(2)酶解及纯化
[0039]
酸解物加8-12倍体积的含有0.5-3%w/v的权利要求1所述的反式糖苷水解酶的pbs缓冲溶液,50-65℃水解18-24h,调酸析出,干燥得酶解物;
[0040]
其中,人参皂苷rg3和rd消失,完全转化为人参皂苷rh2,收率95%,人参皂苷rh2含量为50%-80%,取决于第一步转化情况;
[0041]
(3)纯化
[0042]
用硅胶柱分离,洗脱剂采用三氯甲烷和甲醇混合溶剂比例洗脱,tlc跟踪监测(薄层色谱硅胶板,展开剂为正丁醇:乙酸乙酯:水=4:1:5上层,用10%硫酸乙醇溶液显色),洗脱完成后,收集目标物负压浓缩,低温浓缩后冷冻干燥,重结晶可得纯品人参皂苷rh2,含量≥98%,构型为r型。
[0043]
其中,优选的,步骤(3)中硅胶与酶解物比例为100:1的分离比,洗脱剂中,三氯甲烷和甲醇的体积比为4:1。
[0044]
本发明的目的之三是提供一种薯蓣皂素的酶催化制备方法。
[0045]
本发明在基于传统制备薯蓣的工艺上,结合自身对酸水解和酶催化水解皂苷糖单元的技术,总结出解决天然皂苷化合物之间的化学修饰(或者说糖修饰)的一般性方法。
[0046]
薯蓣皂苷与薯蓣皂素在结构上的区别,在于其皂苷元连接有一个葡萄糖和两个鼠李糖单元,且连接方式为葡萄糖通过β-1,4糖苷键与皂苷元相连接,两个鼠李糖分别通过α-1,4糖苷键和α-1,2与葡糖糖相连接。下式为其结构:
[0047][0048]
从结构中,我们可以看出鼠李糖与葡萄糖连接是在空间上相对的连接方式即通过α糖苷键连接的,这和人参皂苷rg3两个葡萄糖之间的糖苷键的连接方式是一样的,因此针对这种情况,使用皂苷糖苷水解酶,就可脱掉两个鼠李糖单位,转化生产葡萄糖基薯蓣皂素。其结构如下:
[0049][0050]
在此基础上,本发明提出了一种蓣皂素的酶催化制备方法,包括以下步骤:
[0051]
(1)葡萄糖基薯蓣皂苷的制备
[0052]
薯蓣皂苷采用含有15-25%v/v的乙醇的0.05m,ph7.0的pbs使之溶解,加入0.1-0.5倍体积的20u/ml的本发明所述的反式糖苷水解酶,30-40℃反应3-5小时,tlc点板监测,完全转化,液相检测,转化完全后挥去乙醇,过滤可得产物,即为葡萄糖基薯蓣皂苷;
[0053]
(2)薯蓣皂素的制备
[0054]
葡萄糖基薯蓣皂苷采用含有15-25%v/v的乙醇的0.05m,ph7.0的pbs使之溶解,加入底物1%w/w的β葡萄糖水解酶10u/ml,55-65℃反应1-.5-2.5h,液相检测,转化完全后挥去乙醇,过滤可得产物,即为薯蓣皂素,重结晶后得纯品,含量>98%。
[0055]
相较于现有技术,本发明的有益效果是:
[0056]
本发明提出了一种糖水解酶,该酶能够特异性识别皂苷双糖塘单元之间反式的糖苷键,这就给皂苷之间的结构修饰提供多种可能,能够为天然物的结构改造提供技术手段,尤其在皂苷类接有葡萄糖单元的物质修饰中有着巨大优势,也为研究其他天然物的提纯和分离提供新的思路,并且能够产生一定的实际经济意义。此外,通过利用本发明所述的反式糖苷水解酶对三七皂苷和薯蓣皂苷通过酸解和酶催化进行结构修饰改造,本发明还建立了制备人参皂苷rh2和薯蓣皂素的方法,为人参皂苷rh2和薯蓣皂素的生产提供了新的技术手段。
附图说明
[0057]
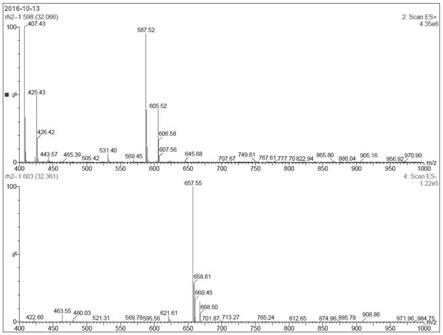
图1为实施例2制备得到的人参皂苷rh2样品质谱图;
[0058]
图2为薯蓣皂素标准品质谱图;
[0059]
图3为实施例3制备得到的薯蓣皂素样品质谱图。
具体实施方式
[0060]
以下通过具体实施例对本发明进行详细描述,以使本领域技术人员能够容易地根据本说明书的公开内容实施本发明。以下所描述的实施例仅是本发明的一部分实施例,而不是全部。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
[0061]
实施例1反式糖苷水解酶的表达和纯化
[0062]
一、重组大肠杆菌的构建
[0063]
1.反式糖苷水解酶基因的获取
[0064]
活化clostridium stercorarium dsm8532菌种(the hemicellulose-degradingenzyme system of the thermophilic bacterium clostridium stercorarium:comparativecharacterisation and addition of new hemicellulolytic glycoside hydrolases, doi:10.1186/s13068-018-1228-3),收集细胞,按照用柱式质粒dna小量抽提试剂盒(购于上海生工)说明说提取dna,将提取好的dna作为pcr的模板。
[0065]
构建质粒所用的酶切位点如下:xhoi和bamhi;
[0066]
上下游引物分别为:上游引物 agctgaagaacgcggaatga
[0067]
下游引物 agcattcgatgccgagctta
[0068]
(所有引物由上海生工合成)
[0069]
基因的pcr条件:按照如下条件30~35个循环,98℃变性10s,65℃退火5s,72℃延伸10s。
[0070]
2.重组质粒的构建及转化
[0071]
通过琼脂糖凝胶电泳尽可能将目的dna片段与其他片段分开,切下含有目的dna片段的琼脂糖凝胶块,胶回收目的基因。用xhoi和bamhi双酶切含有两个酶切位点的目的基因和载体pet-24c(+)(购于上海生工),用t4连接酶将目的基因和表达载体pet-24c(+)在16℃下连接过夜,取连接产物10μl与100μl感受态细胞bl21plyss轻柔混匀,冰上放置30min,42℃热击90sec,冰上放置3
-ꢀ
5min,加入4倍体积的培养基,37℃,180rpm,活化45min,将100μl菌液涂于含有100mg/l卡那霉素的lb培养板上12-16小时。提取质粒,将鉴定正确的含有目的基因的重组表达载体,命名为pet-24c(+)-gh,其中所含有的反式糖苷水解酶基因的核苷酸序列如seq id no.1所示。
[0072]
二、重组酶的表达及纯化
[0073]
1.反式糖苷水解酶的表达
[0074]
挑起单菌落重组大肠杆菌pet-24c(+)-gh至含抗生素的lb培养基中, 37℃,220rpm,培养过夜,然后按照5%的接种量,接种到新鲜培养液中,培养至od600约为0.7时,加入诱导剂iptg,使iptg在培养基的终浓度为 0.2mmol/l,31℃,220rpm,诱导10个小时,收集菌体10000rpm/20min。
[0075]
三、纯化
[0076]
将离心得到的菌体,加入6倍体积的0.1m的pbs缓冲液,放置冰水中,超声破碎机破
损(60%功率30秒,破碎3秒,停3秒),所得浑浊液离心,所得上清即为粗酶液。于上清粗酶液中加入阳离子型聚丙烯酰胺絮凝剂,待有沉淀生成后离心去滤渣,用30kda的超滤膜超滤,以除去小分子蛋白和盐,以及会对后续反应带来影响的微量元素并提高酶活性,浓缩至破碎液体积的30%,得到纯化后的反式糖苷水解酶,其氨基酸序列如seq id no.2所示。
[0077]
实施例2人参皂苷rh2的酶催化制备
[0078]
取100g三七茎叶总皂苷(uv80%)加入1000ml 5%v/v的乙酸溶液,100℃回流10h,后自然冷却,待产物完全析出后过滤,水洗后,烘干得产物21g,检测人参皂苷rh2含量为19.2%,人参皂苷rg332%,人参皂苷rd2%。
[0079]
将酸水解产物21g用210ml的ph8.0的pbs缓冲溶液溶解后,置于60摄氏度水浴锅中预热后,加入200mg的实施例1制备得到的反式糖苷水解酶后,均匀搅拌200r/min,20h后停止加热和搅拌,冷却后调ph至6.0,过滤水洗烘干得产物19.8g,检测人参皂苷rh2含量50.5%。
[0080]
酶解产物19.8g用直径12cm,高度40cm的硅胶柱,加入2kg的硅胶填充后,用少量甲醇溶解样品后加入氯仿兑成氯仿甲醇4:1(v:v)的上样液,洗脱剂采用三氯甲烷和甲醇(v/v=4:1)混合溶剂比例洗脱,tlc跟踪监测(薄层色谱硅胶板,展开剂为正丁醇:乙酸乙酯:水体积比=4:1:5上层,用10%硫酸乙醇溶液显色),洗脱完成后,收集目标物负压浓缩,低温浓缩后冷冻干燥得产物10.2g,人参皂苷rh2含量92.2%,将这10.2g的产物进行重结晶一次可得产物7.2g结晶物,人参皂苷rh2含量95.2%,母液干燥得3.0g,人参皂苷rh
2 84.6%。大量生产可套用。
[0081]
人参皂苷rh2质谱图如图1所示。
[0082]
实施例3薯蓣皂素的酶催化制备
[0083]
取100g薯蓣皂苷(98%)加入1000ml含有20%v/v的乙醇的0.05m,ph 7.0 的pbs,使之溶解,加入100ml 20u/ml的实施例1制备得到的反式糖苷水解酶粗酶液,35℃反应4小时,液相检测,水解率>99%,转化完全后挥去乙醇,过滤可得产物65g,即为葡萄糖基薯蓣皂苷。
[0084]
将水解产物65g加入650ml含有20%v/v的乙醇的0.05m,ph 8.0的pbs,使之溶解,加入6.5mg 10u/mlβ葡萄糖水解酶,60℃反应2h,即可反应完全,液相检测,水解率>98%,转化完全后挥去乙醇,过滤可得产物薯蓣皂素43g,重结晶得40g纯品。
[0085]
薯蓣皂素标准品的质谱图如图2所示,制备得到的薯蓣皂素样品的质谱图如图3所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1