一种卤代氧杂烯丙基胺类化合物及其制备方法和应用与流程
1.本发明属于有机合成技术领域,具体涉及一种卤代氧杂烯丙基胺类化合物及其制备方法和应用。
背景技术:
2.含多个杂原子的胺类化合物普遍存在于天然产物、药物和其他具有生物活性的小分子中。其中,含多杂原子的烯丙基胺类化合物是合成药物的关键中间体,近年来吸引了化学家们的广泛关注,例如:(a)oxprenolol盐酸盐(ba 39089)是一种口服有效的β-肾上腺素受体(β-ar)拮抗剂,ki为7.10nm;(b)propranolol是一种非选择性的β-adrenergic receptor(βar)拮抗剂,对β1ar和β2ar具有高亲和力,ki值分别为1.8nm和0.8nm。propranolol抑制[3h]-dha与大鼠脑膜制剂的结合,ic
50
为12nm。propranolol用于高血压,嗜铬细胞瘤,心肌梗塞,心律不齐,心绞痛和肥大心肌病的相关研究。
[0003]
其结构式分别如下:
[0004][0005]
因此探究高效合成含多杂原子的烯丙基胺类化合物的方法是十分有必要的。近年来,科学家们开发了各种合成方法来构建烯丙基胺类化合物:(1)过渡金属催化的烯丙醇直接烯丙基胺化;(2)过渡金属催化的氢胺化;(3)过渡金属催化的胺的乙烯基化;(4)过渡金属催化的烯丙基c-h胺化。(g.hirata,h.satomura,h.kumagae,a.shimizu,g.onodera,and m.kimura,org.lett.,2017,19,6148-6151;j.b.sweeney,a.k.ball,p.a.lawrence,m.c.sinclair,l.j.smith,angew.chem.int.ed.,2018,57,10202
–
10206.n.nishina,y.yamamoto,angew.chem.,int.ed.,2006,45,3314
–
3317;r.blieck,j.bahri,m.taillefer,f.monnier,org.lett.,2016,18,1482.y.xie,j.hu,y.wang,c.xia,and h.huang,j.am.chem.soc.,2012,134,20613-20616.t.ramirez,a.;b.zhao,y.shi,chem.soc.rev.,2012,41,931-942.q.cheng,j.chen,s.lin,and t.ritter,j.am.chem.soc.,2020,142,17287-17293.)。
[0006]
虽然烯丙基胺类化合物的合成策略已经非常成熟,但是对于含多个杂原子的烯丙基胺类化合物尤其是卤代氧杂烯丙基胺类化合物的合成方法却非常少,目前已报道的反应中,多是采用吸电子的联烯与相应的卤源反应得到环化的卤代烯丙基胺产物(t.xu,x.mu,h.peng,and g.liu,angew.chem.int.ed.,2011,50,8176
–
8179;s.ma and h.xie,tetrahedron.,2005,61,251
–
258;s.ma and h.xie,org.lett.,2000,24,3801-3803.)。或是通过对甲苯磺酰胺作为联烯的导向基团实现联烯的卤胺化反应,得到线性或支链型的卤代烯丙基胺类化合物(h.li,x.li,z.zhao,t.ma,c.sun and b.yang,chem.commun.,2016,52,10167-10170;h.-h.li,x.-x.li,z.-g.zhao,c.-b.lin,t.ma,c.-y.sun,b.-w.yang,
tetrahedron letters.,2016,57,4640
–
4644;h.-h.li,x.-x.li,z.-g.zhao,x.y.and c.-y.sun,x.-l.fu,org.biomol.chem.,2017,15,4005.)。但是,上述反应,都不能应用于卤代氧杂烯丙基胺的合成,使得反应的底物适用性受限,不具有广阔的应用前景。基于氧杂烯丙基胺在药物合成中的重要性,以及卤原子在合成中广泛的应用,探索发现新颖高效的合成卤代氧杂烯丙基胺的合成方法具有非常重要的意义。
技术实现要素:
[0007]
为了克服现有技术存在的不足,需要发展铜催化联烯醚的卤胺化反应,为构建卤代氧杂烯丙基胺类衍生物提供一种便捷高效的新合成策略;本发明的目的是提供一种卤代氧杂烯丙基胺类化合物的合成及其制备方法和应用。
[0008]
本发明的首要目的在于提供一种卤代氧杂烯丙基胺类化合物的制备方法和应用。
[0009]
本发明的另一目的在于提供通过上述方法制备得到卤代氧杂烯丙基胺类化合物。
[0010]
本发明目的通过以下技术方案实现。
[0011]
本发明提供的卤代氧杂烯丙基胺类化合物,其结构式如下所示:
[0012][0013]
其中,r1选自苯基、4-甲基苯基、2-甲基苯基、4-氟苯基、3-甲基苯基、3,5-二氯苯基、萘环中的一种;
[0014]
r2选自氢、甲基、乙基、烯丙基、苄基中的一种;
[0015]
r3选自苯基、2-甲氧基苯基、2-甲基苯基、3-甲基苯基、4-甲基苯基、2-溴苯基、4-溴苯基、4-氯苯基、2,4-二氯苯基、萘环中的一种;
[0016]
x选自cl、br中的一种。
[0017]
本发明提供的卤代氧杂烯丙基胺类化合物的制备方法,包括如下步骤:
[0018]
在反应器中加入卤化铜cux,然后加入溶于有机溶剂中,在氧气氛围下搅拌反应,得到反应液,将所述反应液经分离纯化后,得到所述的卤代氧杂烯丙基胺类化合物。
[0019]
其中,r1选自苯基、4-甲基苯基、2-甲基苯基、4-氟苯基、3-甲基苯基、3,5-二氯苯基、萘环中的一种;
[0020]
r2选自氢、甲基、乙基、烯丙基、苄基中的一种;
[0021]
r3选自苯基、2-甲氧基苯基、2-甲基苯基、3-甲基苯基、4-甲基苯基、2-溴苯基、4-溴苯基、4-氯苯基、2,4-二氯苯基、萘环中的一种;
[0022]
x选自cl、br中的一种。
[0023]
上述的一种卤代氧杂烯丙基胺类化合物的制备方法,其反应式如下所示:
[0024]
[0025]
进一步地,所述卤化铜的加入量与反应底物的摩尔比为(0.60~1.0):1。
[0026]
进一步地,所述有机溶剂为1,4-二氧六环,1,2-二氯乙烷,四氢呋喃,甲苯中的一种;所述的有机溶剂的用量以的物质的量计为3~8ml/mmol;所述搅拌反应的时间为5~10h,所述搅拌反应的温度为35~45℃;所述的氧气氛围为氧气球。
[0027]
进一步地,所述为1.0~2.0equiv,为1.0equiv。
[0028]
进一步地,所述分离纯化包括:将反应液冷却至室温,用乙酸乙酯萃取,合并有机相,使用无水硫酸钠干燥,过滤,减压蒸馏除溶剂得粗产物,经薄层层析提纯得到所述的卤代氧杂烯丙基胺类化合物。
[0029]
进一步地,所述薄层层析提纯为以石油醚和乙酸乙酯的混合溶剂为展开剂的薄层层析,所述石油醚与乙酸乙酯的体积比为(50~500):1。
[0030]
本发明的卤代氧杂烯丙基胺类化合物在合成多取代烯丙基胺类化合物中的应用。
[0031]
进一步地,所述的卤代氧杂烯丙基胺类化合物在合成中的应用,所述多取代烯丙基胺类化合物为苯基取代的氧杂烯丙基胺;所述化合物通过格式反应制得。
[0032]
本发明的反应原理是以联烯醚、芳香胺为原料,在卤化铜的作用下,通过铜胺中间体对联烯醚的活化启动反应,得到烯基铜中间体,接着游离的胺亲核进攻,最后经还原消除一步合成卤代氧杂烯丙基胺类化合物。
[0033]
与现有技术相比,本发明具有如下优点和有益效果:
[0034]
(1)本发明提供的合成方法以简单易得的联烯醚、芳香胺作为反应原料合成一系列卤代氧杂烯丙基胺类化合物,该方法具有原料简单易得,操作方便、条件温和,步骤经济性高,底物适用性广,官能团的容忍性好等特点;
[0035]
(2)本发明的合成方法新颖高效,并通过放大量实验初步证明了其在工业上的潜在应用价值,因而有望进一步应用于实际工业生产;
[0036]
(3)本发明提供的合成方法在得到一系列卤代氧杂烯丙基胺类化合物后,可以高效的进行转化,通过格式反应将一系列格式试剂与卤代氧杂烯丙基胺进行有效组合。
附图说明
[0037]
图1和图2分别是实施例1所得目标产物的氢谱图和碳谱图;
[0038]
图3和图4分别是实施例2所得目标产物的氢谱图和碳谱图;
[0039]
图5和图6分别是实施例3所得目标产物的氢谱图和碳谱图;
[0040]
图7和图8分别是实施例4所得目标产物的氢谱图和碳谱图;
[0041]
图9和图10分别是实施例5所得目标产物的氢谱图和碳谱图;
[0042]
图11和图12分别是实施例6所得目标产物的氢谱图和碳谱图;
[0043]
图13和图14分别是实施例7所得目标产物的氢谱图和碳谱图;
[0044]
图15和图16分别是实施例8所得目标产物的氢谱图和碳谱图;
[0045]
图17和图18分别是实施例9所得目标产物的氢谱图和碳谱图;
[0046]
图19和图20分别是实施例10所得目标产物的氢谱图和碳谱图;
[0047]
图21和图22分别是实施例11所得目标产物的氢谱图和碳谱图;
[0048]
图23和图24分别是实施例12所得目标产物的氢谱图和碳谱图;
[0049]
图25和图26分别是应用例1所得目标产物的氢谱图和碳谱图。
具体实施方式
[0050]
以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
[0051]
以下实施例中所使用的联烯醚结构式为其通过如下方法制备得到:将酚(1.0当量)加到丙酮溶液中,室温搅拌下加入碳酸钾(2.1当量),搅拌15分钟后,将炔丙基溴(1.5当量)一滴滴缓慢加入,反应体系加热回流3小时。
[0052]
反应结束加入饱和氯化铵溶液淬灭反应,萃取有机相,浓缩过柱分离得到炔丙基醚。将得到的炔丙基醚溶于四氢呋喃和叔丁醇1:3的混合溶剂中,再加入叔丁醇钾(1.5当量),将反应体系在室温下搅拌反应12小时后,加入饱和氯化铵溶液,用乙酸乙酯萃取有机相,干燥浓缩有机相,过柱分离即得到联烯醚类底物。
[0053]
以下实施例中所使用的胺结构式为实施例1
[0054]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最后加入0.2毫摩尔n-甲基苯胺和0.3毫摩尔苯基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率70%。
[0055]
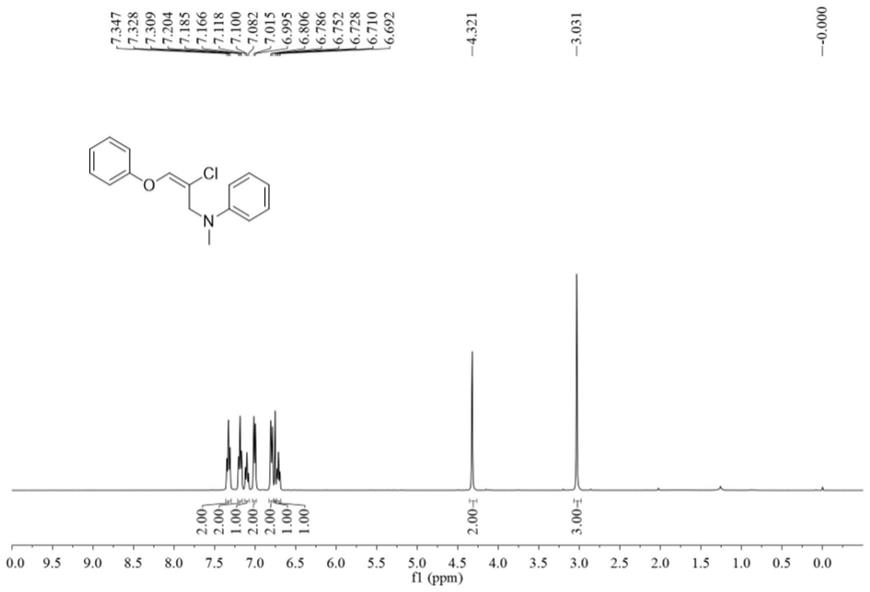
本实施例所得产物的氢谱图和碳谱图分别如图1和图2所示;结构表征数据如下所示:
[0056]1h nmr(400mhz,cdcl3)δppm 7.33(t,j=7.6hz,2h),7.18(t,j=7.6hz,2h),7.10(t,j=7.2hz,1h),7.00(d,j=8.0hz,2h),6.80(d,j=8.0hz,2h),6.75(s,1h),6.71(t,j=7.2hz,1h),4.32(s,2h),3.03(s,3h);
[0057]
13
c nmr(100mhz,cdcl3)δppm 156.6,148.7,140.4,129.8,129.0,123.5,119.9,116.9,116.3,112.7,77.3,77.0,76.7,51.5,39.0;
[0058]
ir(kbr)3055,2919,1596,1492,1353,1228,1046,747,512cm-1
;
[0059]
hrms(esi)calcd for chemical formula:c
16
h
17
clno
+
[m+h]
+
:274.0993,found:274.0986.
[0060]
经以上数据推断得到如下结构:
[0061][0062]
实施例2
[0063]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最后加入0.2毫摩尔2-甲基-n-甲基苯胺和0.3毫摩尔苯基联烯醚,套一个氧气球,在40摄氏度
下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率82%。
[0064]
本实施例所得产物的氢谱图和碳谱图分别如图3和图4所示;结构表征数据如下所示:
[0065]1h nmr(400mhz,cdcl3)δppm 7.31(t,j=7.6hz,2h),7.15(d,j=7.2hz,1h),7.12-7.04(m,3h),6.99-6.86(m,3h),6.74(s,1h),3.91(s,2h),2.73(s,3h),2.39(s,3h);
[0066]
13
c nmr(100mhz,cdcl3)δppm 156.7,141.0,133.4,131.0,129.7,126.2,123.4,123.3,120.6,116.2,54.3,41.1,18.2;
[0067]
ir(kbr)ν
max 3057,2937,1588,1477,1223,1055,744cm-1
;
[0068]
hrms(esi)calcd for chemical formula:c
17
h
19
clno
+
[m+h]
+
:288.1150,found:288.1149.
[0069]
经以上数据推断得到如下结构:
[0070][0071]
实施例3
[0072]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最后加入0.2毫摩尔2-溴-n-甲基苯胺和0.3毫摩尔苯基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率68%。
[0073]
本实施例所得产物的氢谱图和碳谱图分别如图5和图6所示;结构表征数据如下所示:
[0074]1h nmr(500mhz,cdcl3)δppm 7.51(d,j=7.5hz,1h),7.30(t,j=8.0hz,2h),7.23-7.13(m,2h),7.08(t,j=7.5hz,1h),6.91(d,j=8.0hz,2h),6.86(t,j=7.0hz,1h),6.76(s,1h),4.17(s,2h),2.86(s,3h);
[0075]
13
c nmr(125mhz,cdcl3)δppm 156.6,149.9,141.2,133.8,129.7,127.8,124.4,123.3,122.8,119.7,119.q,116.1,53.7,40.6;
[0076]
ir(kbr)ν
max 3317,2928,1685,1578,1469,1330,1217,1035,747,492cm-1
;
[0077]
hrms(esi)calcd for chemical formula:c
16
h
15
brclnnao
+
[m+na]
+
:373.9918,found:373.9923.
[0078]
经以上数据推断得到如下结构:
[0079][0080]
实施例4
[0081]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最
后加入0.2毫摩尔4-甲基-n-甲基苯胺和0.3毫摩尔苯基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率68%。
[0082]
本实施例所得产物的氢谱图和碳谱图分别如图7和图8所示;结构表征数据如下所示:
[0083]1h nmr(500mhz,cdcl3)δppm 7.34(t,j=8.0hz,2h),7.11(t,j=7.5hz,1h),7.00(dd,j=8.5,2.5hz,4h),6.82-6.65(m,3h),4.29(s,2h),3.00(s,3h),2.23(s,3h).
[0084]
13
c nmr(125mhz,cdcl3)δppm 156.7,140.4,129.8,129.6,123.5,116.3,113.2,51.9,39.2,20.2.ir(kbr)ν
max 2919,1605,1499,1348,1226,1044,757,507cm-1
;
[0085]
hrms(esi)calcd for chemical formula:c
17
h
19
clno
+
[m+h]
+
:288.1150,found:288.1159.
[0086]
经以上数据推断得到如下结构:
[0087][0088]
实施例5
[0089]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最后加入0.2毫摩尔4-氯-n-甲基苯胺和0.3毫摩尔苯基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率72%。
[0090]
本实施例所得产物的氢谱图和碳谱图分别如图9和图10所示;结构表征数据如下所示:
[0091]1h nmr(400mhz,cdcl3)δppm 7.35(t,j=7.6hz,2h),7.12(t,j=6.4hz,3h),7.00(d,j=8.0hz,2h),6.76(s,1h),6.69(d,j=8.4hz,2h),4.30(s,2h),3.02(s,3h);
[0092]
13
c nmr(100mhz,cdcl3)δppm 156.6,147.3,140.6,129.9,128.8,123.7,121.7,119.3,116.3,113.8,51.6,39.4;
[0093]
ir(kbr)ν
max 3313,2926,1683,1588,1488,1343,1222,1119,1046,967,758,490cm-1
;
[0094]
hrms(esi)calcd for chemical formula:c
16
h
16
cl2no
+
[m+h]
+
:288.1150,found:288.1150。
[0095]
经以上数据推断得到如下结构:
[0096][0097]
实施例6
[0098]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最
后加入0.2毫摩尔2-甲基-n-甲基苯胺和0.3毫摩尔2,4-二氯苯基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率84%。
[0099]
本实施例所得产物的氢谱图和碳谱图分别如图11和图12所示;结构表征数据如下所示:
[0100]1h nmr(500mhz,cdcl3)δppm 7.15-7.01(m,4h),6.98-6.89(m,1h),6.77(d,j=1.5hz,2h),6.61(s,1h),3.88(s,2h),2.73(s,3h),2.35(s,3h);
[0101]
13
c nmr(125mhz,cdcl3)δppm 157.2,150.5,139.3,135.6,133.5,131.0,126.2,123.6,122.6,120.7,115.0,54.2,41.5,18.1;
[0102]
ir(kbr)ν
max 2939,1580,1429,1240,1059,924,839,745cm-1
;
[0103]
hrms(esi)calcd for chemical formula:c
17
h
17
cl3no
+
[m+h]
+
:356.0370,found:356.0378.
[0104]
经以上数据推断得到如下结构:
[0105][0106]
实施例7
[0107]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最后加入0.2毫摩尔3-甲基-n-甲基苯胺和0.3毫摩尔苯基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率70%。
[0108]
本实施例所得产物的氢谱图和碳谱图分别如图13和图14所示;结构表征数据如下所示:
[0109]1h nmr(500mhz,cdcl3)δppm 7.37-7.29(m,2h),7.13-7.04(m,2h),7.01(dd,j=8.5,1.0hz,2h),6.75(s,1h),6.61(s,2h),6.53(d,j=7.5hz,1h),4.31(s,2h),3.03(s,3h),2.19(s,3h);
[0110]
13
c nmr(125mhz,cdcl3)δppm 156.7,148.7,140.3,138.7,129.8,128.9,123.5,120.1,118.0,116.2,113.5,110.0,51.6,39.3,21.8;
[0111]
ir(kbr)ν
max 3522,2925,1585,1474,1222,1038,861,754,484cm-1
;
[0112]
hrms(esi)calcd for chemical formula:c
17
h
19
clno
+
[m+h]
+
:288.1150,found:288.1159.
[0113]
经以上数据推断得到如下结构:
[0114]
[0115]
实施例8
[0116]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最后加入0.2毫摩尔n-甲基-1-萘胺和0.3毫摩尔苯基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率62%。
[0117]
本实施例所得产物的氢谱图和碳谱图分别如图15和图16所示;结构表征数据如下所示:
[0118]1h nmr(400mhz,cdcl3)δppm 8.45(d,j=8.0hz,1h),7.80(d,j=8.0hz,1h),7.48(dt,j=28.8,8.0hz,3h),7.38-7.27(m,3h),7.17(d,j=7.2hz,1h),7.08(t,j=7.6hz,1h),6.92(d,j=8.0hz,2h),6.81(s,1h),4.11(s,2h),2.92(s,3h);
[0119]
13
c nmr(100mhz,cdcl3)δppm 156.6,149.2,141.2,134.8,129.7,129.4,128.2,125.8,125.5,124.1,123.7,123.4,119.8,116.2,55.4,41.4;
[0120]
ir(kbr)ν
max 2933,1650,1581,1469,1210,1029,867,754,571,491cm-1
;
[0121]
hrms(esi)calcd for chemical formula:c
20
h
19
clno
+
[m+h]
+
:324.1150,found:324.1153.
[0122]
经以上数据推断得到如下结构:
[0123][0124]
实施例9
[0125]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最后加入0.2毫摩尔2,4-二氯苯胺和0.3毫摩尔苯基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率45%。
[0126]
本实施例所得产物的氢谱图和碳谱图分别如图17和图18所示;结构表征数据如下所示:
[0127]1h nmr(400mhz,cdcl3)δppm 7.36(t,j=7.6hz,2h),7.26(s,1h),7.13(t,j=7.6hz,1h),7.05-6.95(m,3h),6.79(s,1h),6.67(d,j=8.8hz,1h),4.22(s,2h);
[0128]
13
c nmr(100mhz,cdcl3)δppm 156.5,141.6,140.9,129.9,128.8,127.6,123.8,122.1,120.1,118.7,116.3,112.7,42.6;
[0129]
ir(kbr)ν
max 3459,2924,1601,1485,1219,1051,955,845,752,487cm-1
;
[0130]
hrms(esi)calcd for chemical formula:c
15
h
12
cl3nnao
+
[m+na]
+
:349.9877,found:349.9870.
[0131]
经以上数据推断得到如下结构:
[0132][0133]
实施例10
[0134]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最后加入0.2毫摩尔2-甲基-n-甲基苯胺和0.3毫摩尔2-甲基苯基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率86%。
[0135]
本实施例所得产物的氢谱图和碳谱图分别如图19和图20所示;结构表征数据如下所示:
[0136]1h nmr(500mhz,cdcl3)δppm 7.22-7.06(m,j=12.9,4.7hz,5h),7.03-6.91(m,2h),6.80(d,j=8.0hz,1h),6.72(s,1h),3.92(s,2h),2.74(s,3h),2.39(s,3h),2.26(s,3h);
[0137]
13
c nmr(125mhz,cdcl3)δppm 155.0,151.0,141.4,133.4,131.1,127.2,127.0,126.2,123.3,120.5,119.2,114.6,54.4,41.1,18.2,16.0;
[0138]
ir(kbr)ν
max 2939,1668,1586,1484,1320,1232,1049,847,748,553cm-1
;
[0139]
hrms(esi)calcd for chemical formula:c
18
h
21
clno
+
[m+h]
+
:302.1306,found:302.1311.
[0140]
经以上数据推断得到如下结构:
[0141][0142]
实施例11
[0143]
在试管中,先依次加入0.12毫摩尔氯化铜,溶于1.0毫升1,4-二氧六环溶剂中,最后加入0.2毫摩尔2-甲基-n-甲基苯胺和0.3毫摩尔2-萘基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率75%。
[0144]
本实施例所得产物的氢谱图和碳谱图分别如图21和图22所示;结构表征数据如下所示:
[0145]1h nmr(500mhz,cdcl3)δppm 7.79(dd,j=8.0,4.0hz,2h),7.73(d,j=8.0hz,1h),7.47(t,j=7.5hz,1h),7.40(t,j=7.5hz,1h),7.20-7.04(m,5h),6.95(t,j=7.5hz,1h),6.86(s,1h),3.96(s,2h),2.76(s,3h),2.40(s,3h);
[0146]
13
c nmr(125mhz,cdcl3)δppm 154.5,140.8,134.1,133.5,131.1,130.1,129.9,127.7,127.1,126.8,126.3,124.8,123.5,120.7,118.0,110.6,54.4,41.3,18.2;
[0147]
ir(kbr)ν
max 3055,2936,1605,1482,1358,1235,1048,951,846,747,472cm-1
;
[0148]
hrms(esi)calcd for chemical formula:c
20
h
18
clnnao
+
[m+h]
+
:346.0969,found:
346.0973.
[0149]
经以上数据推断得到如下结构:
[0150][0151]
实施例12
[0152]
在试管中,先依次加入0.12毫摩尔溴化铜,溶于1.0毫升1,4-二氧六环溶剂中,最后加入0.2毫摩尔2-甲基-n-甲基苯胺和0.3毫摩尔苯基联烯醚,套一个氧气球,在40摄氏度下转速700rpm下搅拌反应6小时,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率62%。
[0153]
本实施例所得产物的氢谱图和碳谱图分别如图23和图24所示;结构表征数据如下所示:
[0154]1h nmr(500mhz,cdcl3)δppm 7.32(t,j=7.5hz,2h),7.17(d,j=7.5hz,1h),7.10-7.08(m,3h),6.99-6.93(m,3h),6.84(s,1h),3.98(s,2h),2.73(s,3h),2.41(s,3h);
[0155]
13
c nmr(125mhz,cdcl3)δppm 156.5,143.0,133.6,131.1,129.7,126.3,123.5,120.7,116.3,55.0,41.3,18.3;
[0156]
ir(kbr)ν
max 2930,1591,1483,1319,1224,1034,846,751,579,494;ir(kbr,cm-1
):ν
max
=2930,1591,1483,1319,1224,1034,846,751,579,494cm-1
;
[0157]
hrms(esi)calcd for chemical formula:c
17
h
19
brno
+
[m+h]
+
:332.0645,found:332.0651.
[0158]
经以上数据推断得到如下结构:
[0159][0160]
应用例1
[0161]
在史莱克管中,先依次加入0.02毫摩尔二氯二三苯基膦钯,溶于2.0毫升无水四氢呋喃溶液中,最后加入实施例2制备的0.2毫摩尔氯代氧杂烯丙基胺和0.6毫摩尔苯基溴化镁,置换氮气3-5次,在35摄氏度下转速700rpm下搅拌反应过夜,停止搅拌。加入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸钠干燥,过滤,减压浓缩,再通过薄层层析分离纯化,得到目标产物,所用的薄层层析展开剂为体积比为500:1的石油醚:乙酸乙酯混合溶剂,产率63%。
[0162]
本应用例所得产物的氢谱图和碳谱图分别如图25和图26所示;结构表征数据如下所示:
[0163]1h nmr(400mhz,cdcl3)δppm 7.40-7.36(m,2h),7.35-7.30(m,2h),7.29-7.24(m,2h),7.24-7.20(m,1h),7.14(d,j=7.2hz,1h),7.08(t,j=7.8hz,3h),7.03(d,j=7.8hz,2h),6.93(t,j=6.9hz,1h),6.83(s,1h),4.18(s,2h),2.61(s,3h),2.09(s,3h);
[0164]
13
c nmr(100mhz,cdcl3)δppm 157.4,152.0,141.5,138.2,133.6,130.8,129.7,
128.1,126.7,126.7,126.2,123.1,123.0,122.2,120.8,116.5,51.2,42.0,17.9;
[0165]
ir(kbr)ν
max 3049,2935,2849,1589,1483,1324,1226,1124,1015,850,750,494cm-1
;
[0166]
hrms(esi)calcd for chemical formula:c
23
h
24
no
+
[m+h]
+
:330.1852,found:330.1849.
[0167]
经以上数据推断得到如下结构:
[0168][0169]
以上实施例和应用例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1