一种生产右旋龙脑的重组酵母工程菌的制作方法
1.本发明涉及基因工程及发酵工程领域,具体涉及一种合成冰片的基因工程菌及其构建方法与应用
背景技术:
2.冰片,又称龙脑,双环单萜类化合物,根据旋光性分为右旋龙脑和左旋龙脑(图1),右旋龙脑又称天然冰片,左旋龙脑又称艾片,右旋龙脑目前主要来源于龙脑樟和梅片树,左旋龙脑存在于艾纳香,在薰衣草、乳香、松树、冷杉和香茅油、乳香中也含有龙脑。
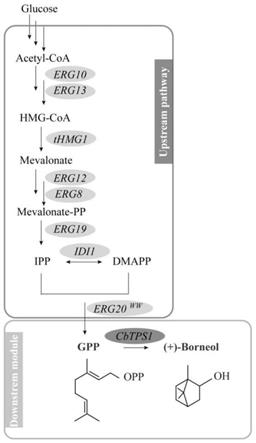
3.龙脑是珍贵的传统中药材和高级香料,广泛用于医药、食品、日化、农药等领域,目前制药企业和药厂的大多数成药原料和配方倾向于使用价廉易得的合成冰片,但是合成冰片除龙脑以外还含有大量有毒的异龙脑,在冰片植物来源上,研究者采用植物提取法,具有产量低、周期长且冰片优质资源不易栽培等缺点。利用发酵法生产龙脑和其它单萜类化合物及其衍生物是可行的思路。研究发现,单萜类化合物的生物合成均来源于共同的前体(gpp)—在植物体内,甲羟戊酸(mevalonate,mva)途径和4-磷酸-2-甲基赤藓糖(2-c-methyl-d-erythritol-4-phosphate,mep)途径产生成异戊烯基焦磷酸(isopentenyl diphosphate,ipp)及其同分异构体二甲基烯丙基焦磷酸(dimethylallyldiphosphate,dmapp),在牻牛儿基焦磷酸单萜合酶的催化下,ipp和dmapp缩合生成焦磷酸香叶酯(geranyl pyrophosphate,gpp),最终在单萜合酶的作用下形成种类繁多的单萜类化合物(o'brien t e,bertolani s j,zhang y,et al.predicting productive binding modes for substrates and carbocation intermediates in terpene synthases-bornyl diphosphate synthase as a representative case[j].acs catal,2018,8:3322.)。张超等(cn110669713a)公开了一种高产单萜类成分的酵母工程菌,并在酿酒酵母中重构柠檬烯合酶的生物合成途径,能够异源合成d-柠檬烯,d-柠檬烯的产量27.3mg/l;周萍萍等(cn111411101a)利用顺式芳樟醇合成酶t67omclis,构建芳樟醇生物合成途径,通过过度表达整个mva通路和引入一个具有降低fpp形成能力的erg20
f96w/n127w
变体,使得前体gpp的供应得到加强,最终菌株在摇瓶中产生53.14mg/l芳樟醇培养物。可见,单萜工程菌的构建使单萜产量得到提高,但是冰片相关的工程菌还没有报道。
技术实现要素:
[0004]
本发明的第一方面在于提供一种生产右旋龙脑的酵母工程菌(重组菌),所述重组菌为体内含有或表达冰片二磷酸合成酶cbtps1的酵母菌。本发明所述的冰片二磷酸合成酶cbtps1在申请人的在先专利(cn201911082325.8)中已有公开,其为来源于阴香树(cinnamomum burmanni),可用于合成或制备右旋龙脑的单萜合酶,该专利的全部内容被引入本技术并作为本技术的一部分。
[0005]
在一方面,所述酵母菌含有经过密码子优化的冰片二磷酸合成酶cbtps1基因。本发明根据酿酒酵母密码子偏好性进行改进,改进的方法是本领域的常规技术手段,例如,根
据本领域已知的相关基因的序列并参照酿酒酵母密码子偏好性进行人工合成(酿酒酵母密码子偏好性设计可参考http://www.kazusa.or.jp/codon/cgi-bin/showcodon.cgi?species=493所公开的信息进行),任何依据酿酒酵母密码子偏好而设计得到的上述基因,均可以用于本发明。
[0006]
优选的,本发明经过密码子优化的cbtps1编码核酸如seq id no:1所示。
[0007]
在本发明的第二方面,本发明还包括对关键酶cbtps1进行蛋白修饰。将cbtps1的n端氨基酸截短,形成3个截短的蛋白(下文称t10-cbtps1,t32-cbtps1,t37-cbtps1),发现截短体蛋白的右旋龙脑产量得到了明显的提高。本发明所述t10-cbtps1、t32-cbtps1、t37-cbtps1的编码核酸如seq id no:2、seq id no:3和seq id no:4所示。
[0008]
在本发明的第三方面发现,在截短的基础上,在截短体蛋白的起始密码子atg前面增加kozak序列,得到了3个新的截短体(下文称t10-cbtps1k,t32-cbtps1k,t37-cbtps1k),可以进一步提升右旋龙脑产量。
[0009]
在某些实施例中,本发明所述体内含有或表达冰片二磷酸合成酶为将所述冰片二磷酸合成酶的编码核酸导入所述酵母菌;和/或,所述将冰片二磷酸合成酶的编码核酸导入所述酵母菌为将含有所述冰片二磷酸合成酶的的编码核酸表达盒导入所述酵母菌;和/或,所述含有冰片二磷酸合成酶的编码核酸表达盒通过表达所述冰片二磷酸合成酶的编码核酸表达盒的载体导入所述酵母菌;优选通过质粒形式导入所述酵母菌。
[0010]
在某些实施例中,本发明通过底盘菌的优化,以提高前体物质gpp的供给(以下简称m/d)。例如,本发明所述的酵母菌包含来自于酵母甲羟戊酸途径中相关的内源性基因,如乙酰乙酰辅酶a转移酶基因erg10(seq id no:5)、hmg-coa合酶基因erg13(seq id no:6)、hmg辅酶a还原酶基因thmg1(seq id no:7)、甲羟戊酸激酶基因erg12(seq id no:8)、磷酸甲羟戊酸激酶基因erg8(seq id no:9)、甲羟戊酸焦磷酸脱羧酶基因erg19(seq id no:10)、法尼基焦磷酸合酶基因erg20、异戊烯焦磷酸异构酶基因idi1(seq id no:11)。在某些优选的实施例中,本发明使用的erg20为突变体erg20
f96w-n127w
(seq id no:12)。
[0011]
在某些实施例中,本发明所述酵母为酿酒酵母(saccharomyces cerevisiae);和/或所述酿酒酵母为cen.pk2-1d,基因型为matα,ura3-52,trp1-289,leu2-3112,his3δ1,mal2-8c,suc2。
[0012]
本发明的第四方面,提供了一种生产右旋龙脑的方法,所述方法包括:
[0013]
将生产右旋龙脑的重组酵母菌接种到培养基中,进行发酵,提取分离发酵后的菌液,得到目标产物右旋龙脑,其中,所述重组酵母菌能发酵生产gpp。
附图说明
[0014]
图1为酿酒酵母中gpp和右旋龙脑的生物合成途径示意图;
[0015]
图2为改造的底盘菌菌株中香叶醇产量图,其中a为菌株m/d的生长曲线;b为菌株m/d香叶醇产量;
[0016]
图3为右旋龙脑的gc-ms定性检测图,其中a为右旋龙脑的气象色谱检测结果;b为右旋龙脑的质谱鉴定结果。
[0017]
图4为冰片二磷酸合酶cbtps1不同n端截短方式对右旋龙脑产量的影响,其中a为对蛋白截短体表达菌株的产物进行gc-ms定性分析,b为不同菌株中右旋龙脑产量的比较。
具体实施方式
[0018]
实验材料
[0019]
表1载体和菌株信息
[0020][0021][0022]
表2引物信息
[0023]
[0024]
[0025][0026]
主要试剂:
[0027]
gene jet gel extraction kit(美国thermo scientific公司);e.z.n.atm plasmid mini kit i(美国omega bio-tek公司);peasy-uni seamless cloning and assembly kit(北京全式金生物技术有限公司);2
×
easytaq pcr supermix(+dye)(北京全式金生物技术有限公司);easypure genomic dna kit(北京全式金生物技术有限公司);phusion high-fidelity master mix(美国neb公司);bsai(美国neb公司);bamhi-hf(美国neb公司);t4 dna ligase美国neb公司;sd-ura酵母培养基(北京泛基诺科技有限公司);sd-leu-ura酵母培养基(北京泛基诺科技有限公司);frozen-ez yeast transformation ii kit
tm
(zymo research生物科技公司;
[0028]
ypd固体平板:1%酵母膏+2%蛋白胨+2%葡萄糖+1.5%琼脂;不加琼脂则成为相应液体培养基(ypd液体培养基);
[0029]
ypl诱导培养基:1%酵母膏+2%蛋白胨+2%半乳糖;
[0030]
sd-ura固体平板:sd-ura+2%葡萄糖+2%琼脂;不加琼脂则成为相应液体培养基(sd-ura液体培养基);
[0031]
sd-ura-leu固体平板:sd-ura-leu+2%葡萄糖+2%琼脂;不加琼脂则成为相应液体培养基(sd-ura-leu液体培养基)。
[0032]
实施例1重组酵母底盘菌的构建
[0033]
以增加右旋龙脑的前体物质gpp为指标,对酿酒酵母菌cen.pk2-1d进行改造,改造方法参考文献(jianga g z,yaoa m d,wanga y,et al.manipulation of ges and erg20 for geraniol overproduction in saccharomyces cerevisiae[j].metabolic engineering,2017,41:57-66.)(xiao-jing g,wen-hai x,ying w,et al.metabolic engineering of saccharomyces cerevisiae for 7-dehydrocholesterol overproduction[j].biotechnology for biofuels,2018,11(1):192.)。(本发明重组酵母底盘菌信息见表1)。
[0034]
1、酵母菌株的构建
[0035]
本研究中使用的初始菌株为cen.pk2-1d来自酿酒酵母(表1)。所有mva通路的内源性基因erg10、erg13、thmg1、erg12、erg8、erg19、idi1、erg20均来自cen.pk2-1d基因组dna。本研究中使用的erg20突变体erg20
f96w-n127w
被报道具有更高的单萜生产效率。采用m2s整合方法将基因表达盒整合到酵母染色体中(li s,ding w,zhang x,et al.development of a modularized two-step(m2s)chromosome integration technique for integration of multiple transcription units in saccharomyces cerevisiae[j].biotechnology for biofuels,2016,30(1):232-243.)。简单描述为通过添加bsai酶切位点扩增erg10和erg13,并将头对头启动子(pgal1-pgal10)连接到终止载体t1-(tpi1-pgi1)中,生成质粒t1-(erg10-erg13)。将两个终止子插入质粒中,分别在终止子设计同源臂l1和l2。同样,t2-(thmg1-thmg1)、t3-(thmg1-erg12)、t4-(erg8-erg19)和t5-(idi1-erg20
f96w-n127w
)分别具有特异的同源臂l2和l3、l3和l4、l4和l5、l5和l6。
[0036]
分别扩增每个带有同源臂的表达模块。本次将外源基因构建在酿酒酵母基因组15位点(yprcδ15),使用ura筛选标记。从cen.pk2-1d基因组dna中扩增得到上游同源臂yprcδ15-up;从pesc-ura载体中扩增包含启动子的ura3模块;从t1载体中扩增得到l1。将3个模块进行overlap pcr(重叠pcr)组装形成选择标记模块yprcδ15up-ura3-l1。从cen.pk2-1d基因组dna中扩增得到下游同源臂yprcδ15down,从t5载体中扩增得到l6,然后组合生成下游同源臂模块l6-yprcδ15。
[0037]
将所有模块均电转入cen.pk2-1d用于组装和整合。转化产物滴在缺陷型sd-ura固体平板中央,用涂布器涂布均匀,直至涂布的全部菌液吸收完全,置于30℃恒温箱中倒立培养2-3d。挑取单菌落测序验证,得到阳性菌株md(附图1)。
[0038]
2、发酵
[0039]
为了测定md菌株产gpp的能力,对菌株进行发酵检测。详细过程为:
[0040]
(1)挑取sd-ura固体平板上长出来的md的单菌落,置于10ml sd-ura液体培养基中,30℃200rpm 48h;
[0041]
(2)室温5000g 5min离心收集菌体,转接入10ml ypl诱导培养基,30℃200rpm诱导培养48h,得到发酵产物。
[0042]
3、发酵产物萃取
[0043]
目标成分为萜类化合物,脂溶性,易溶于乙酸乙酯,因此选取乙酸乙酯为溶剂萃取发酵产物,得到目标化合物。其中,所述萃取步骤如下:
[0044]
(1)发酵结束后,吸取5ml发酵液,加入等体积乙酸乙酯超声萃取1h,期间每个10分
钟上下颠倒混匀,并加入冰使超声温度维持在10℃,以免产物挥发;
[0045]
(2)13,000g离心10分钟,吸取上层有机相,加入适量的无水硫酸钠(120℃烘干30min),边加边摇,除去萃取液的水分;
[0046]
(3)转移至液相小瓶中,密封,用于gc-ms检测。
[0047]
4、发酵产物gc-ms检测
[0048]
gc-ms分析条件为:色谱柱为tr-5ms(30m
×
0.25mm),取1μl样品进样,无分流模式下,50℃保持2min,5℃
·
min-1
升至230℃,保持5min,10℃
·
min-1
升至300℃,保持2min;进样口温度280℃,传输线温度280℃,电子能量70ev,对样品进行50-300m/z范围扫描。以geraniol标准品作为对照,制作标准曲线,并对样品中geraniol含量进行测定。
[0049]
在md菌株中,检测到其geraniol的产量为12.52mg
·
l-1
。(附图2)。
[0050]
实施例2 cbtps1真核表达载体的构建
[0051]
将从阴香树中克隆得到的单萜合酶cbtps1(参见在先中国专利201911082325.8,其所有内容被引入本专利中)根据酿酒酵母密码子偏好性进行改进,改进的方法是本领域的常规技术手段。示例性的单萜合酶基因改进后的密码子序列如seq id no:1所示。将获得上述改进的单萜合酶基因,设计同源臂引物,通过同源重组的方式将其构建至真核表达载体pesc-leu的bamhi位点。具体操作如下:
[0052]
(1)设计带有bamhi位点同源臂的引物cbtps1-f’和cbtps1-r’将单萜合酶cbtps1从pet32a::cbtps1质粒(中国专利201911082325.8)中进行pcr扩增,回收并进行纯化获得纯化pcr产物。其中,所述引物序列见表2(下划线所示序列为载体同源区):
[0053]
(2)取pesc-leu载体(agilent technologies公司),用限制性内切酶bamhi进行酶切,回收线性化的载体骨架。
[0054]
(3)取步骤1)得到的纯化pcr产物,按北京全式金生物技术有限公司peasy-uni seamless cloning and assembly kit说明书操作,将其克隆至步骤2)的线性化的载体骨架,得到重组质粒pesc-leu::cbtps1。
[0055]
将重组质粒pesc-leu::cbtps1转化至大肠杆菌trans5α感受态细胞,涂布lb平板,并阳性克隆pcr鉴定(购自北京全式金生物技术有限公司),得到pesc-leu::cbtps1重组菌,用e.z.n.atm plasmid mini kit i(omega bio-tek公司)试剂盒提取pesc-leu::cbtps1重组质粒。
[0056]
实施例3右旋龙脑的发酵
[0057]
将构建好的pesc-leu::cbtps1重组质粒转入md菌株,进行发酵检测右旋龙脑的产量,具体操作如下:
[0058]
1.md酵母感受态制备
[0059]
采用zymo research frozen-ez yeast transformation ii试剂盒做酵母感受态细胞:
[0060]
(1)从sd-ura固体平板上挑取新活化的md酵母菌单菌落,接种于10ml sd-ura液体培养基中,30℃下振荡培养至od600=0.8-1.0左右;
[0061]
(2)室温,500g离心4min,去上清;
[0062]
(3)加入10ml frozen-ez solution 1悬浮菌体,室温,500g离心4min,去上清;
[0063]
(4)加入1ml frozen-ez solution 2悬浮菌体,得到by-mono酵母感受态细胞,分
装至灭菌的1.5ml ep管中,每管50μl;
[0064]
(5)缓慢降温至-70℃(4℃,1h;-20℃,1h;-40℃,1h;-70℃保存),禁止用液氮速冻感受态细胞。
[0065]
2.重组质粒pesc-leu::cbtps1转化至md酵母感受态细胞
[0066]
(1)取0.2-1μg重组质粒pesc-leu::cbtps1(少于5μl)与50μl by-mono酵母感受态细胞混合;
[0067]
(2)加入500μl frozen-ez solution 3,剧烈混匀;
[0068]
(3)30℃孵育1-2h,期间在此混匀2-3次;
[0069]
(4)取50-150μl孵育的菌液,涂布sd-ura-leu固体平板上,晾干后,置于30℃倒置培养48h,得到转入重组质粒pesc-leu::cbtps1的重组酵母,将其命名为md-1。发酵及右旋龙脑产物检测见实施例1。发酵而得的初始菌株中含有30μg
·
l-1
的右旋龙脑(附图3)。
[0070]
实施例4右旋龙脑高产模块的蛋白结构优化
[0071]
本发明中将获得的酵母密码子优化的cbtps1继续对其进行了进一步修饰。将蛋白cbtps1n端的叶绿体转运肽(c37)截掉,同时当起始密码子atg直接跟着ucu的时候,基因的表达会增高,在s10(tcc)和s32(tca)均是丝氨酸,与ucu编码的氨基酸一致,所以在s10及s32位也进行了截短实验,并将氨基酸突变为tct,由此获得三个截短蛋白t10-cbtps1、t32-cbtps1和t37-cbtps1,编码所述截短蛋白t10-cbtps1、t32-cbtps1和t37-cbtps1蛋白的核酸序列分别如seq id no:2、seq id no:3和seq id no:4。将截短蛋白导入md菌株得到新的菌株(表1)。另一方面,在截短蛋白基础上,将酵母特有的kozak序列(aaaaaa)构到了截短体atg的前面。具体操作如下:
[0072]
(1)设计截短引物,见表2,将单萜合酶cbtps1从pesu-leu::cbtps1质粒中进行pcr扩增,回收并进行纯化获得纯化pcr产物。其中,所述引物序列见表2(下划线所示序列为载体同源区):
[0073]
(2)取pesc-leu载体(agilent technologies公司),用限制性内切酶bamhi进行酶切,回收线性化的载体骨架。
[0074]
(3)取步骤1)得到的纯化pcr产物,按北京全式金生物技术有限公司peasy-uni seamless cloning and assembly kit说明书操作,将其克隆至步骤2)的线性化的载体骨架,得到重组质粒pesc-leu::cbtps1。
[0075]
将重组质粒pesc-leu::t10-cbtps1,pesc-leu::t32-cbtps1,pesc-leu::t37-cbtps1,pesc-leu::cbtps1k,pesc-leu::t10-cbtps1k,pesc-leu::t32-cbtps1k和pesc-leu::t37-cbtps1k转化至大肠杆菌trans5α感受态细胞,涂布lb平板,并阳性克隆pcr鉴定(购自北京全式金生物技术有限公司),得到重组菌,用e.z.n.atm plasmid mini kit i(omega bio-tek公司)试剂盒提取重组质粒。
[0076]
按实施例3的方法将重组质粒转入md菌株,得到新的菌株md-2,md-3,md-4,md-5,md-6,md-7,md-8,进行发酵萃取,产量如附图4所示。结果发现截短体融合蛋白的右旋龙脑产量均得到了明显的提高,其中,菌株md-3、md-5和md-7的产量分别为1.48mg
·
l-1
、2.16mg
·
l-1
和1.53mg
·
l-1
。此外,通过kozak序列优化的菌株md-4、md-5和md-8产量也得到了提升,分别为1.67mg
·
l-1
、2.89mg
·
l-1
和1.75mg
·
l-1
。
[0077]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和
范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1