利用木质纤维素衍生物生物合成高附加值化合物的方法与流程
本发明属于微生物技术领域,涉及一种利用木质纤维素衍生物生物合成高附加值化合物的方法;尤其涉及一种基于基因工程手段获得的生物催化剂的、利用木质纤维素衍生物为原料的生物合成高附加值化合物的方法。
背景技术:
天麻素(gastrodin),即4-羟甲基苯基β-d-吡喃葡萄糖苷(4-(hydroxymethyl)phenylbeta-d-glucopyranoside),经鉴定为天麻的主要活性成分,并被广泛的用于治疗各种疾病,比如头晕、头痛、抽搐以及眩晕等。另外,天麻素也具备其他生物活性作用,比如抗氧化、抗炎、抗焦虑、抗肥胖、抗癫痫以及具备记忆改进和神经保护的特性。
目前,天麻素的合成主要通过化学合成以及直接萃取天麻。化学合成通常面临专一性差、步骤多、副产物多以及反应过程产生过多污染物等问题;天麻植株萃取存在生长环境受限、萃取效率低、成本高等问题。近年来,利用可再生的葡萄糖,通过构建重组菌株,合成多种多样的天然产物愈来愈引起人们的关注。中国发明专利201910882020.9公开了异源代谢途径合成天麻素的方法。该方法利用重组大肠杆菌包括pcdfduet-arog*-ppsa-pgm-galu以及petduet-ubic-car-sfp-ugt73b6fs两种表达载体,通过构建新的对羟基苄醇合成通路,调控从葡萄糖到酪氨酸的代谢流,得到对羟基苄醇产量240mg/l,并引入高效udp葡萄糖基转移酶突变体,天麻素最高产量为265mg/l。
对苯二酚(hydroquinone,hq),是一种重要中间体,通常用于化工、医药以及聚合物工业的商业化制备。对苯二酚广泛的以糖基化的形式(熊果苷)存在于高等植物中,同时其也是白蚁的信息素。目前对苯二酚的工业化生产主要利用苯为起始原料,通常会用到强酸以及重金属等,引起严重的环境问题。同时苯作为石油基原料,并不是可再生资源。据文献(chemo-andregioselectivedihydroxylationofbenzenetohydroquinoneenabledbyengineeredcytochromep450monooxygenase,angewandtechemieinternationaledition,2019,58,764-768.)报道,以苯为起始原料,通过改造p450-mb3单加氧酶获得突变株a82f/a328f可以催化10mm苯的双羟基化合成9.2mm对苯二酚。
熊果苷(arbutin),是一种糖基化对苯二酚,存在于植物熊莓和小麦等中。其是一种皮肤美白剂,同时还具有抗菌、抗炎以及抗氧化等生物活性。作为一种温和、安全和有效的试剂,熊果苷已经被广泛的用于医疗和化妆品行业。熊果苷的获得通常采用植物萃取方法,但该方法不仅过程复杂并且产率较低。申晓林等通过代谢途径改造大肠杆菌积累对羟基苯甲酸,然后异源表达来源于candidaparapsilosiscbs604的4-羟基苯甲酸1-羟化酶(4-hydroxybenzoate1-hydroxylase,mnx1)以及来源于rauvolfiaserpentina的熊果苷合成酶(arbutinsynthase,as),以30g/l葡萄糖为原料,可以得到4.19g/l的熊果苷。中国发明专利201510107788.0公开了一种从蓝莓中富集纯化熊果苷的方法,该方法先采用高压脉冲电场提取设备对α-熊果苷进行提取,再利用膜设备和大孔吸附树脂进行α-熊果苷的初次纯化,然后用模拟移动床色谱分离技术的方法对α-熊果苷进行分离纯化,得到高纯度的α-熊果苷产品。中国发明专利201510991581.4公布了一种酶法转化淀粉类物质和对苯二酚合成熊果苷的方法,该方法以淀粉类物质和对苯二酚为原料,加入生物酶进行酶法转化反应;反应液经过除酶后,加入酵母菌发酵去除反应液中的葡萄糖,然后再除菌制得熊果苷。中国发明专利201510335885.5公布了一种生物发酵合成熊果苷的方法,该方法利用液化面粉、麸皮、碳酸钙、磷酸二氢钾和尿素作为发酵基质,在其中加入对苯二酚,利用米曲霉进行发酵制备而成。
红景天苷(salidroside),又名酪醇8-o-葡萄糖苷,是一种具备生物活性的酪氨酸衍生酚类天然产物,广泛地存在于药用植物红景天属。红景天除了在传统医学中具有抗疲劳和抗缺氧的作用外,红景天提取物和红景天苷也显示出抗心血管疾病和抗癌症功能。然而,市面上可买到的纯红景天苷目前主要通过一个从它的原生植物开始的漫长的净化过程,这是一个重要的阻碍红景天苷作为一种潜在治疗剂的瓶颈。中国发明专利201310463903.9公布了一种从红景天中提取红景天苷的方法。该方法首先将红景天药材粉碎,以水作为溶剂,超声波辅助提取,过滤得到滤液;随后经过大孔树脂柱收集,减压浓缩;然后用无水乙醇溶解,通过模拟移动床色谱分离,得到富含红景天苷的组分;最后,经过浓缩、结晶、离心、干燥得到红景天苷产品。中国发明专利201810753390.8公布了一种发酵法合成红景天苷的方法。该方法通过将带trc启动子的酮基脱羧酶基因skdc和带tac启动子的糖基转移酶基因sugt2,基因整合至sybe-002447染色体上,得到sdr1菌株。以葡萄糖为前体,对sdr1菌株进行发酵生产36h,得到0.7g/l红景天苷。
酪醇(tyrosol,对羟基苯乙醇),是一种酚类化合物,天然的存在于多种食物中,比如橄榄油和酒等。酪醇和其衍生物已经广泛的应用于医药领域(如生物活性化合物)、化学工业(如精细化合物)以及其他工业领域。例如,酪醇可以用来制备商用药物,比如倍他洛尔、美托洛尔以及选择性β受体阻滞剂用于治疗高血压、心绞痛、心力衰竭和青光眼。羟基酪醇(hydroxytyrosol,ht,3,4-二羟基苯乙醇),是一种天然的多酚抗氧化剂,主要存在于橄榄叶及其果实中,也存在于橄榄油工业副产品以及工业废水中。此外,羟基酪醇是一种备受关注的与人体健康息息相关的生物活性物质,具备抗菌,抗炎、抑制黑色素沉淀以及清除自由基等功能。目前羟基酪醇的批量生产还不成熟,主要有两种方式:1)通过酸解或酶解橄榄厂的废水、橄榄叶、原生橄榄油中的橄榄苦苷制备羟基酪醇;2)利用化学合成的方法制备羟基酪醇。通过植物萃取,虽然是废物利用,但中间会用到大量的有机试剂;化学合成法反应步骤长,副产物多,环境不友好,不适合绿色可持续合成的理念。中国发明专利201710195462.7公布了一种从橄榄叶中提取羟基酪醇的方法。该方法首先取橄榄叶,除杂洗净,烘干,粉碎;然后,高压微射流超微粉碎进行处理,得到膏状浆液;随后,微波提取;接着,提取液进大孔吸附树脂柱层析,以乙酸乙酯溶液进行洗脱;将洗脱液浓缩,干燥,得到羟基酪醇。中国发明专利201910882020.9公布了一种酶促反应合成羟基酪醇的方法,该方法以l-多巴为底物,在大肠杆菌重组菌同时表达l-苯丙氨酸脱氢酶、α-酮酸脱羧酶以及醇脱氢酶合成羟基酪醇。中国发明专利202010582557.6公布了一种高产羟基酪醇的大肠杆菌构建方法。该方法将质粒pacyc-hpabc、质粒pet-laad-aro10和质粒prsf-par共同转入大肠杆菌bl21(de3)感受态细胞中,得到重组大肠杆菌,以酪氨酸为底物催化合成羟基酪醇。酪氨酸和l-多巴较为昂贵,并且不属于可再生的资源范畴。
技术实现要素:
本发明的目的是为了克服现有技术的不足,提供一种利用木质纤维素衍生物生物合成高附加值化合物的方法。
本发明通过基因工程手段改造大肠杆菌,构建了3条新的酶促反应途径,利用木质纤维素衍生的芳香化合物对香豆酸(p-coumaricacid)以及阿魏酸(ferulicacid)高效合成包含天麻素、熊果苷、红景天苷等在内的多种高附加值的化合物,产物产量均达到克及以上。
本发明的目的是通过以下技术方案实现的:
本发明提供了一种利用木质纤维素衍生物生物合成高附加值化合物的方法,包括以下步骤:
a、对大肠杆菌进行改造,获得生物催化剂;
b、以木质纤维素衍生物为起始原料,通过生物催化剂合成高附加值化合物;
所述木质纤维素衍生物包括对香豆酸、阿魏酸中的至少一种;
所述高附加值化合物包括天麻素、熊果苷、红景天苷及其衍生物对苯二酚、酪醇、羟基酪醇以及高息香醇中的至少一种。
优选地,步骤a中,所述生物催化剂为e.coli(fcs-ech-slpar1-ugt73b6fs)、e.coli(fcs-ech-vdh-mnx1-as)、e.coli(fcs-ech-vdh-mnx1)、e.coli(blpad-styab-rostyc-slpar1-ugt85a1)、e.coli(blpad-styab-rostyc)、e.coli(blpad-styab-rostyc-slpar1)、e.coli(blpad-styab-rostyc-yqhd)、e.coli(blpad-styab-rostyc-yahk)以及e.coli(blpad-styab-rostyc-slpar1-hpabc)中的一种。
优选地,所述e.coli(fcs-ech-slpar1-ugt73b6fs)的获得方法为:通过在e.coli中过表达来源于pseudomonasputidakt2440的fcs、ech,来源于solanumlycopersicum的slpar1以及来源于植物rhodiola的突变酶ugt73b6fs实现。
优选地,所述e.coli(fcs-ech-vdh-mnx1-as)的获得方法为:通过在e.coli中过表达来源于p.putidakt2440的fcs、ech和vdh,来源于酵母candidaparapsilosiscdc317的mnx1和来源于rauvolfiaserpentina的熊果苷合成酶as实现;
所述e.coli(fcs-ech-vdh-mnx1)的获得方法为:通过在e.coli中过表达来源于p.putidakt2440的fcs、ech和vdh,来源于酵母candidaparapsilosiscdc317的mnx1实现。
优选地,所述e.coli(blpad-styab-rostyc-slpar1-ugt85a1)的获得方法为:通过在e.coli中过表达来源于bacilluslicheniformiscgmcc7172的脱羧酶blpad,来源于pseudomonassp.strainvlb120的styab,来源于rhodococcusopacus1cp的rostyc,来源于solanumlycopersicum的slpar1,以及实现来源于arabidopsisthaliana的糖苷转移酶ugt85a1;
所述e.coli(blpad-styab-rostyc)、e.coli(blpad-styab-rostyc-slpar1)、e.coli(blpad-styab-rostyc-yqhd)、e.coli(blpad-styab-rostyc-yahk)的获得方法为:通过在e.coli中过表达来源于bacilluslicheniformiscgmcc7172的脱羧酶blpad,来源于pseudomonassp.strainvlb120的styab,来源于rhodococcusopacus1cp的rostyc,来源于e.colibl21(de3)的yqhd或yahk或来源于solanumlycopersicum的slpar1实现;
所述e.coli(blpad-styab-rostyc-slpar1-hpabc)的获得方法为:通过在e.coli中过表达来源于bacilluslicheniformiscgmcc7172的脱羧酶blpad,来源于pseudomonassp.strainvlb120的styab,来源于rhodococcusopacus1cp的rostyc,来源于solanumlycopersicum的slpar1以及来源于e.colibl21(de3)的hpabc实现。
优选地,所述生物催化剂为e.coli(fcs-ech-slpar1-ugt73b6fs)时,步骤b中采用的木质纤维素衍生物为对香豆酸,合成的高附加值化合物为天麻素。
优选地,所述生物催化剂为e.coli(fcs-ech-vdh-mnx1-as)时,步骤b中采用的木质纤维素衍生物为对香豆酸,合成的高附加值化合物为熊果苷;
所述生物催化剂为e.coli(fcs-ech-vdh-mnx1)时,步骤b中采用的木质纤维素衍生物为对香豆酸,合成的高附加值化合物为对苯二酚。
优选地,所述生物催化剂为e.coli(blpad-styab-rostyc-slpar1-ugt85a1)时,步骤b中采用的木质纤维素衍生物为对香豆酸,合成的高附加值化合物为红景天苷;
所述生物催化剂为e.coli(blpad-styab-rostyc)、e.coli(blpad-styab-rostyc-slpar1)、e.coli(blpad-styab-rostyc-yqhd)、e.coli(blpad-styab-rostyc-yahk)时,步骤b中采用的木质纤维素衍生物为对香豆酸或阿魏酸,合成的高附加值化合物为酪醇或高息香醇;
所述生物催化剂为e.coli(blpad-styab-rostyc-slpar1-hpabc)时,步骤b中采用的木质纤维素衍生物为对香豆酸,合成的高附加值化合物为羟基酪醇。
本发明还提供了一种用于高附加值化合物生物合成的生物催化剂,所述生物催化剂为改造后的大肠杆菌,具体包括e.coli(fcs-ech-slpar1-ugt73b6fs)、e.coli(fcs-ech-vdh-mnx1-as)、e.coli(fcs-ech-vdh-mnx1)、e.coli(blpad-styab-rostyc-slpar1-ugt85a1)、e.coli(blpad-styab-rostyc)、e.coli(blpad-styab-rostyc-slpar1)、e.coli(blpad-styab-rostyc-yqhd)、e.coli(blpad-styab-rostyc-yahk)以及e.coli(blpad-styab-rostyc-slpar1-hpabc)中的一种。
优选地,所述高附加值化合物包括天麻素、熊果苷、红景天苷及其衍生物对苯二酚、酪醇、羟基酪醇以及高息香醇中的至少一种。
优选地,所述e.coli(fcs-ech-slpar1-ugt73b6fs)的获得方法为:通过在e.coli中过表达来源于pseudomonasputidakt2440的fcs、ech,来源于solanumlycopersicum的slpar1以及来源于植物rhodiola的突变酶ugt73b6fs实现。
优选地,所述e.coli(fcs-ech-vdh-mnx1-as)的获得方法为:通过在e.coli中过表达来源于p.putidakt2440的fcs、ech和vdh,来源于酵母candidaparapsilosiscdc317的mnx1和来源于rauvolfiaserpentina的熊果苷合成酶as实现;
所述e.coli(fcs-ech-vdh-mnx1)的获得方法为:通过在e.coli中过表达来源于p.putidakt2440的fcs、ech和vdh,来源于酵母candidaparapsilosiscdc317的mnx1实现。
优选地,所述e.coli(blpad-styab-rostyc-slpar1-ugt85a1)的获得方法为:通过在e.coli中过表达来源于bacilluslicheniformiscgmcc7172的脱羧酶blpad,来源于pseudomonassp.strainvlb120的styab,来源于rhodococcusopacus1cp的rostyc,来源于solanumlycopersicum的slpar1,以及实现来源于arabidopsisthaliana的糖苷转移酶ugt85a1;
所述e.coli(blpad-styab-rostyc)、e.coli(blpad-styab-rostyc-slpar1)、e.coli(blpad-styab-rostyc-yqhd)、e.coli(blpad-styab-rostyc-yahk)的获得方法为:通过在e.coli中过表达来源于bacilluslicheniformiscgmcc7172的脱羧酶blpad,来源于pseudomonassp.strainvlb120的styab,来源于rhodococcusopacus1cp的rostyc,来源于e.colibl21(de3)的yqhd或yahk或来源于solanumlycopersicum的slpar1实现;
所述e.coli(blpad-styab-rostyc-slpar1-hpabc)的获得方法为:通过在e.coli中过表达来源于bacilluslicheniformiscgmcc7172的脱羧酶blpad,来源于pseudomonassp.strainvlb120的styab,来源于rhodococcusopacus1cp的rostyc,来源于solanumlycopersicum的slpar1以及来源于e.colibl21(de3)的hpabc实现。
现有技术相比,本发明具有如下的有益效果:
(1)本发明通过基因工程手段,获得高效的生物催化剂,可以快速催化底物对香豆酸以及阿魏酸合成包含天麻素、熊果苷以及红景天苷在内的多种高附加值化合物。
(2)本发明利用构建的生物催化剂,通过生物转化实现了木质纤维素来源的芳香化合物(对香豆酸以及阿魏酸)的高效利用,相比较于发酵葡萄糖冗长的步骤,更具优势。
(3)通过本发明方法获得的目的化合物产量均在克及以上,转化率大都在90%以上,具有极大的应用潜力。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为合成天麻素的生物催化剂构建图;
图2为生物转化合成天麻素的结果;
图3为生物合成对苯二酚结果图:
图4为合成熊果苷的生物催化剂构建图;
图5为比较不同的生物催化剂合成熊果苷的结果图;
图6为生物转化合成熊果苷的结果图;
图7为合成酪醇的生物催化剂构建图;
图8为不同生物催化剂转化合成酪醇的结果图;
图9为生物合成酪醇以及高息香醇示意图;
图10为生物合成红景天苷结果图;
图11为生物合成羟基酪醇结果图:
图12为生物合成天麻素示意图;
图13为生物合成对熊果苷及其衍生物对苯二酚示意图;
图14为生物合成红景天苷和其衍生物酪醇、高息香醇以及羟基酪醇示意图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
以下实施例的方法包括:
步骤一,改造大肠杆菌获得高效的生物催化剂(e.coli(fcs-ech-slpar1-ugt73b6fs)),从对香豆酸出发成功地合成天麻素;
步骤二,改造大肠杆菌获得高效的生物催化剂(e.coli(fcs-ech-vdh-mnx1-as)以及e.coli(fcs-ech-vdh-mnx1)),以对香豆酸为起始原料,成功地合成了熊果苷以及其衍生物对苯二酚;
步骤三,改造大肠杆菌获得多个高效的生物催化剂(e.coli(blpad-styab-rostyc-slpar1-ugt85a1)、e.coli(blpad-styab-rostyc)、e.coli(blpad-styab-rostyc-slpar1)、e.coli(blpad-styab-rostyc-yqhd)、e.coli(blpad-styab-rostyc-yahk)以及e.coli(blpad-styab-rostyc-slpar1-hpabc))等,以对香豆酸以及阿魏酸为起始原料,成功地合成红景天苷、酪醇、羟基酪醇以及高息香醇;
步骤一中,所述生物催化剂(e.coli(fcs-ech-slpar1-ugt73b6fs))的构建通过在e.coli中过表达来源于pseudomonasputidakt2440的fcs、ech,来源于solanumlycopersicum的slpar1以及来源于植物rhodiola的突变酶ugt73b6fs实现。此过程中,首先构建e.coli(fcs-ech-slpar1)催化对香豆酸合成对羟基苯甲醇,随后引入ugt73b6fs构建新的催化剂催化对羟基苯甲醇合成天麻素;
步骤二中,所述生物催化剂(e.coli(fcs-ech-vdh-mnx1-as)以及e.coli(fcs-ech-vdh-mnx1))的构建通过在e.coli中过表达来源于p.putidakt2440的fcs、ech和vdh,来源于酵母candidaparapsilosiscdc317的mnx1和来源于rauvolfiaserpentina的熊果苷合成酶as实现。此过程中,首先构建e.coli(fcs-ech-vdh-mnx1)实现催化底物对香豆酸合成熊果苷前体物质对苯二酚,随后引入as构建多个生物催化剂高效合成熊果苷。
步骤三中,所述生物催化剂(e.coli(blpad-styab-rostyc-slpar1-ugt85a1)、e.coli(blpad-styab-rostyc)、e.coli(blpad-styab-rostyc-slpar1)、e.coli(blpad-styab-rostyc-yqhd)、e.coli(blpad-styab-rostyc-yahk)以及e.coli(blpad-styab-rostyc-slpar1-hpabc))等通过在e.coli中过表达来源于bacilluslicheniformiscgmcc7172脱羧酶blpad,来源于pseudomonassp.strainvlb120的styab,来源于rhodococcusopacus1cp的rostyc,来源于arabidopsisthaliana的糖苷转移酶ugt85a1,来源于e.colibl21(de3)的hpabc、yqhd和yahk以及来源于solanumlycopersicum的slpar1实现。在此过程中,首先构建多个生物催化剂e.coli(blpad-styab-rostyc)、e.coli(blpad-styab-rostyc-slpar1)、e.coli(blpad-styab-rostyc-yqhd)、e.coli(blpad-styab-rostyc-yahk)催化对香豆酸合成酪醇,选出最适催化剂,然后引入ugt85a1或hpabc进一步催化合成红景天苷和羟基酪醇。
实施例1
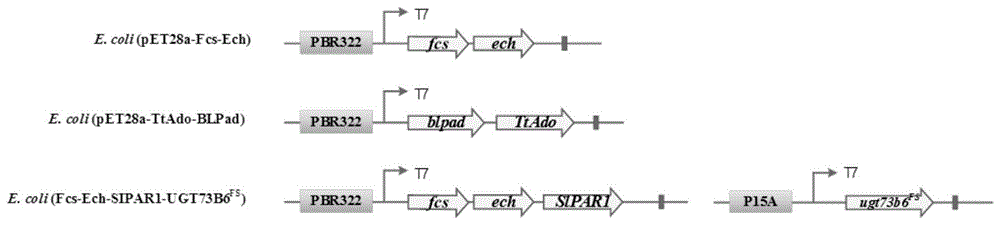
(1)构建生物催化剂用于合成天麻素(构建示意图如图1所示)
构建质粒pet28a-fcs-ech-slpar1和质粒pa7a-ugt73b6fs,将其转化进入bl21(de3)菌中,构建生物催化剂e.coli(fcs-ech-slpar1-ugt73b6fs)。具体方构建法如下:
从pseudomonasputidakt2440基因组上,pcr克隆得到fcs与ech,与slpar1共同构建于载体pet28a上得到质粒pet28a-fcs-ech-slpar1;将ugt73b6fs构到载体pa7a上得到质粒pa7a-ugt73b6fs;将质粒pet28a-fcs-ech-slpar1和质粒pa7a-ugt73b6fs通过热激或者电击的方法转化进入宿主bl21(de3)中,制得生物催化剂e.coli(fcs-ech-slpar1-ugt73b6fs)。
(2)生物转化合成天麻素(合成示意图如图12所示)
将制备的生物催化剂e.coli(fcs-ech-slpar1-ugt73b6fs)接种到2mllb中进行活化,37℃,10-12h后,按比例1:100将活化后的生物催化剂转接到100mllb中,待od600达到0.6-0.8时,加入诱导剂iptg至终浓度0.5mm,22℃下诱导10-12h后,4℃,4000g离心10min,收集菌体,重悬浮于m9y培养基中,添加底物2g/l对香豆酸,10g/l葡萄糖,37℃转化12h,可以获得1.45g/l天麻素,转化率为42.5%(图2)。
实施例2
(1)构建生物催化剂合成对苯二酚
构建质粒pet28a-fcs-ech-vdh以及质粒pa7a-mnx1,将其共同转入bl21(de3)中得到生物催化剂e.coli(fcs-ech-vdh-mnx1)。具体方法如下:从pseudomonasputidakt2440基因组上,pcr克隆得到fcs、ech以及vdh通过酶切连接进入载体pet28a上构建得到pet28a-fcs-ech-vdh,将mnx1通过酶切连接进入载体pa7a上构建得到pa7a-mnx1;将质粒pet28a-fcs-ech-vdh和质粒pa7a-mnx1通过热激或者电击的方法转化进入宿主bl21(de3)中,制得生物催化剂e.coli(fcs-ech-vdh-mnx1)。
(2)生物转化合成对苯二酚(合成示意图如图13所示)
将制备的生物催化剂e.coli(fcs-ech-vdh-mnx1)接种到2mllb中进行活化,37℃,10-12h后,按比例1:100将活化后的生物催化剂转接到100mllb中,待od600达到0.6-0.8时,加入诱导剂iptg至终浓度0.5mm,22℃下诱导10-12h后,4℃,4000g离心10min,收集菌体,重悬浮于m9y培养基中,添加底物3g/l对香豆酸,10g/l葡萄糖,37℃转化8h。结果如如3所示,可以获得1.95g/l对苯二酚,转化率为97%(图3)。
实施例3
(1)构建生物催化剂用于合成熊果苷(构建示意图如图4所示)对应的e.coli(fcs-ech-vdh-mnx1-as)催化剂,其中的sarbutin5效果最好。
构建质粒pet28a-fcs-ech,pet28a-fcs-ech-vdh,pa7a-vdh-mnx1-as,pa7a-mnx1-as,pacyc-as-mnx1,pa7a-as-mnx1,pa7a-as-7-mnx1(7表示t7启动子,相对于pa7a-as-mnx1而言,在mnx1基因前添加t7启动子)将其两两组合转化bl21(de3),得到5种生物催化剂sarbutin1,sarbutin2,sarbutin3,sarbutin4以及sarbutin5。具体方构建法如下:
从pseudomonasputidakt2440基因组上,pcr克隆得到fcs、ech以及vdh通过酶切连接进入载体pet28a构建得到pet28a-fcs-ech,pet28a-fcs-ech-vdh;将mnx1以及as通过酶切连接进入载体pa7a或pacyc构建得到pa7a-mnx1-as,pa7a-as-mnx1,pa7a-as-7-mnx1;pcr克隆得到的vdh、mnx1以及as通过酶切连接进入载体pa7a构建得到pa7a-vdh-mnx1-as。
5种生物催化剂sarbutin1为质粒pet28a-fcs-ech和pa7a-vdh-mnx1-as通过热激或者电击的方法转化进入宿主bl21(de3)中制得,sarbutin2为质粒pet28a-fcs-ech-vdh和pa7a-mnx1-as通过热激或者电击的方法转化进入宿主bl21(de3)中制得,sarbutin3为质粒pet28a-fcs-ech-vdh和pa7a-as-mnx1通过热激或者电击的方法转化进入宿主bl21(de3)中制得,sarbutin4为质粒pet28a-fcs-ech-vdh和pa7a-as-7-mnx1通过热激或者电击的方法转化进入宿主bl21(de3)中制得,sarbutin5为质粒pet28a-fcs-ech-vdh和pacyc-as-mnx1通过热激或者电击的方法转化进入宿主bl21(de3)中制得。
(2)生物转化合成熊果苷(合成示意图如图13所示)
将制备的5种生物催化剂接种到2mllb中进行活化,37℃,10-12h后,按比例1:100将活化后的生物催化剂转接到100mllb中,待od600达到0.6-0.8时,加入诱导剂iptg至终浓度0.5mm,22℃下诱导10-12h后,4℃,4000g离心10min,收集菌体,重悬浮于m9y培养基中,添加2g/l对香豆酸,10g/l葡萄糖,37℃转化12h。5种生物催化剂合成熊果苷的结果如图5所示,结果可见sarbutin5转化得到最高产量的熊果苷,为2.34g/l。其中,生物催化剂sarbutin5采用上述方法转化合成熊果苷随转化时间的变化结果如图6所示,24h后可以获得3.05g/l熊果苷,转化率为92%。
实施例4
(1)构建生物催化剂e.coli(blpad-styab-rostyc)、e.coli(blpad-styab-rostyc-slpar1)、e.coli(blpad-styab-rostyc-yqhd)、e.coli(blpad-styab-rostyc-yahk)、e.coli(blpad-styab-rostyc-slpar1)用于合成酪醇(构建示意图如图7所示)
构建质粒pet28a-styab-rostyc,pet28a-styab-rostyc-blpad,pet28a-styab-rostyc-slpar1,pet28a-styab-rostyc-yqhd,pet28a-styab-rostyc-yahk,pa7a-blpad,pa7a-blpad-slpar1,pa7a-blpad-yqhd,pa7a-blpad-yahk。将其两两组合转化bl21(de3),得到8种生物催化剂styrosol1,styrosol2,styrosol3,styrosol4,styrosol5,styrosol6,styrosol7以及styrosol8。
具体方构建法如下:pcr扩增bl21(de3)基因组上的yqhd和yahk,结合styab、rostyc,blpad以及slpar1,将styab、rostyc通过酶切连接进入载体pet28a构建得到pet28a-styab-rostyc;将styab、rostyc和blpad通过酶切连接进入载体pet28a构建得到pet28a-styab-rostyc-blpad;将styab、rostyc和yahk或yqhd或slpar1通过酶切连接进入载体pet28a构建得到pet28a-styab-rostyc-yqhd或pet28a-styab-rostyc-yahk或pet28a-styab-rostyc-slpar1;将blpad或其与yqhd或yahk或slpar1通过酶切连接进入载pa7a构建得到pa7a-blpad,pa7a-blpad-slpar1,pa7a-blpad-yqhd,pa7a-blpad-yahk。
上述生物催化剂styrosol1由质粒pet28a-styab-rostyc-blpad通过热激或者电击的方法转化进入宿主bl21(de3)中制得,styrosol2由质粒pet28a-styab-rostyc和pa7a-blpad通过热激或者电击的方法转化进入宿主bl21(de3)中制得,styrosol3由质粒pet28a-styab-rostyc-slpar1和pa7a-blpad通过热激或者电击的方法转化进入宿主bl21(de3)中制得,styrosol4由质粒pet28a-styab-rostyc-yqhd和pa7a-blpad通过热激或者电击的方法转化进入宿主bl21(de3)中制得,styrosol5由质粒pet28a-styab-rostyc-yahk和pa7a-blpad通过热激或者电击的方法转化进入宿主bl21(de3)中制得,styrosol6由质粒pet28a-styab-rostyc和pa7a-blpad-slpar1通过热激或者电击的方法转化进入宿主bl21(de3)中制得,styrosol7由质粒pet28a-styab-rostyc和pa7a-blpad-yqhd通过热激或者电击的方法转化进入宿主bl21(de3)中制得,styrosol8由质粒pet28a-styab-rostyc和pa7a-blpad-yahk通过热激或者电击的方法转化进入宿主bl21(de3)中制得。
(2)生物转化合成酪醇(合成示意图如图14所示)将制备的8种生物催化剂接种到2mllb中进行活化37℃,10-12h后,按比例1:100将活化后的生物催化剂转接到100mllb中,待od600达到0.6-0.8时,加入诱导剂iptg至终浓度0.5mm,22℃下诱导10-12h后,4℃,4000g离心10min,收集菌体,重悬浮于m9y培养基中,添加2.0g/l对香豆酸,10g/l葡萄糖,37℃转化12h。8种生物催化剂合成酪醇的结果如图8所示,结果可见styrosol3与styrosol7合成最多的酪醇,分别为1.63和1.64g/l。另外,利用生物催化剂styrosol7催化2.5g/l对香豆酸,结果如图9所示,24h后,可以获得2.04g/l酪醇,转化率为97.4%。
实施例5
生物转化合成高息香醇(合成示意图如图14所示)
将实施例4制备的生物催化剂styrosol7接种到2mllb中进行活37℃,10-12h后,按比例1:100将活化后的生物催化剂转接到100mllb中,待od600达到0.6-0.8时,加入诱导剂iptg至终浓度0.5mm,22℃下诱导10-12h后,4℃,4000g离心10min,收集菌体,重悬浮于m9y培养基中,添加1.5g/l阿魏酸,10g/l葡萄糖,37℃转化12h。合成高息香醇醇的结果如图9所示,转化结束后获得1.18g/l产物,转化率约为92%。
实施例6
(1)构建生物催化剂用于合成红景天苷
构建质粒pet28a-styab-rostyc-7-slpar1以及pa7a-blpad-ugt85a1,将其共同转化进入bl21(de3),得到生物催化剂e.coli(blpad-styab-rostyc-slpar1-ugt85a1)。具体方法如下:pcr扩增获得生物公司合成基因序列blpad、styab、rostyc、slpar1以及ugt85a1,将styab、rostyc、slpar1酶切连接进入载体pet28a得到pet28a-styab-rostyc-slpar1,blpad和ugt85a1酶切连接进入载体pa7a得到pa7a-blpad-ugt85a1。将质粒pet28a-styab-rostyc-slpar1以及pa7a-blpad-ugt85a1通过热激或者电击的方法转化进入宿主bl21(de3)中,制得生物催化剂e.coli(blpad-styab-rostyc-slpar1-ugt85a1)。
(2)生物转化合成红景天苷(合成示意图如图14所示)
将制备的生物催化剂e.coli(blpad-styab-rostyc-slpar1-ugt85a1)接种到2mllb中进行活37℃,10-12h后,按比例1:100将活化后的生物催化剂转接到100mllb中,待od600达到0.6-0.8时,加入诱导剂iptg至终浓度0.5mm,22℃下诱导10-12h后,4℃,4000g离心10min,收集菌体,重悬浮于m9y培养基中,添加2g/l对香豆酸,10g/l葡萄糖,37℃转化24h。12时,额外补加10g/l葡萄糖。结果如图10所示,最终合成红景天苷1.72g/l,转化率为48.3%。
实施例7
(1)构建生物催化剂用于合成羟基酪醇
构建质粒pet28a-styab-rostyc-slpar1以及pa7a-blpad-hpabc,将其共同转化进入bl21(de3),得到生物催化剂e.coli(blpad-styab-rostyc-slpar1-hpabc)。具体方法如下:pcr扩增获得bl21(de3)基因组上的hpabc以及生物公司合成基因序列blpad、styab、rostyc、slpar1,将styab、rostyc、slpar1酶切连接进入载体pet28a得到pet28a-styab-rostyc-slpar1,将hpabc和blpad酶切连接进入载体pa7a得到pa7a-blpad-hpabc。将质粒pet28a-styab-rostyc-slpar1以及pa7a-blpad-hpabc通过热激或者电击的方法转化进入宿主bl21(de3)中,制得生物催化剂e.coli(blpad-styab-rostyc-slpar1-hpabc)。
(2)生物合成羟基酪醇(合成示意图如图14所示)
将制备的生物催化剂e.coli(blpad-styab-rostyc-slpar1-hpabc)接种到2mllb中进行活37℃,10-12h后,按比例1:100将活化后的生物催化剂转接到100mllb中,待od600达到0.6-0.8时,加入诱导剂iptg至终浓度0.5mm,22℃下诱导10-12h后,4℃,4000g离心10min,收集菌体,重悬浮于m9y培养基中,添加2g/l对香豆酸,10g/l葡萄糖,37℃转化8h。结果如图11所示,最终合成羟基酪醇1.83g/l,转化率为97.5%。
本发明具体应用途径很多,以上所述仅是本发明的优选实施方式。应当指出,以上实施例仅用于说明本发明,而并不用于限制本发明的保护范围。对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进,这些改进也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!