一种稳定检测抗CD22单抗生物学活性的方法与流程
本发明属于生物药物活性检测领域,涉及一种稳定检测抗cd22单抗生物学活性的方法。
背景技术:
b细胞的异常活化和过度增殖是自身免疫病和b细胞肿瘤形成的重要机制,其结果为促使自身抗体形成、作为抗原提成细胞促进免疫反应的发生、分泌炎性细胞因子、免疫调节失调等,因此,靶向b细胞是治疗自身免疫病和b细胞肿瘤的方式和思路之一。
cd22,又名siglec-2,是一种i型跨膜糖蛋白,表达于igm+b细胞表面。胞外区含有7个免疫球蛋白样结构域,胞内区含有6个保守的酪氨酸,这些酪氨酸既可组合成itim基序,又可组合为内吞基序。尽管cd22交联可以诱发b细胞死亡,但cd22与bcr复合体相互作用,协助引发下游信号转导和促进细胞死亡的作用更加明显,如用特定抗原或抗体交联burkitt淋巴瘤b细胞表面的igm后,抗cd22抗体可以协助诱导burkitt淋巴瘤b细胞的凋亡。基于这一原理,抗cd22抗体可以用于自身免疫性疾病及b细胞肿瘤的治疗。已有文献表明,抗cd22单抗可以明显改善类风湿关节炎患者关节滑膜的炎性浸润,明显降低外周血b细胞数量,并使b细胞上的标志分子如cd19、cd20、cd21等的密度下降,此外,抗cd22单抗还能抑制系统性红斑狼疮患者活化的b细胞分泌炎性因子如il-6、tnfα等。
单抗的活性测定是对药物的有效成分和含量以及药物效价的测定,是确保抗体类药物有效性的重要质控指标。目前靶向cd22的单抗药物主要分为两大类,一类是抗cd22单抗,另一类为抗cd22的抗体偶联药物(利用cd22的内吞特点)。目前国内尚无已上市的抗cd22的单抗,处于临床开发阶段的抗cd22单抗有深圳赛乐敏公司的人鼠嵌合抗cd22单抗以及ucb/immunomedics公司的人源化抗cd22单抗,前者的适应症为类风湿性关节炎和系统性红斑狼疮,后者的适应症为非霍奇金淋巴瘤、系统性红斑狼疮和干燥综合征。抗cd22单抗活性检测的难点是确保抗cd22单抗与cd22结合后不被细胞内吞,目前的检测方法采用非特异性结合方式将抗cd22抗体固定在96孔微孔板中,由于非特异性结合方式可能对抗cd22单抗的抗原结合区域有不确定的影响,因此该方法结果不够稳定。
针对上述不足,本发明利用proteina与抗体fc段特异性结合的特点,将抗cd22单抗同向、均一地固定在proteina预包被的96孔板中,使fab段游离以便很好地发挥后续作用。经过对试验参数的优化,该方法能稳定、高效地检测抗cd22单抗的生物学活性,为抗cd22单抗活性的质量控制提供了有效的技术手段。
技术实现要素:
为了弥补现有技术的不足,本发明的目的在于建立一种稳定、高效检测抗cd22单抗生物学活性的方法,所述方法包括:
(1)将proteina加入到96孔微孔板,静置包被;
2)将抗cd22抗体梯度稀释后加入到步骤1)中的96孔微孔板,静置包被;
3)向b细胞悬液中加入抗igm抗体,然后加入到步骤2)中的96孔微孔板进行孵育;
4)向步骤3)中96孔微孔板内加入检测试剂,用酶标仪检测活细胞水平。
进一步,步骤1)中proteina的预包被浓度为0.1-10μg/ml。
进一步,浓度为1μg/ml。
进一步,步骤1)中静置方式为室温静置或2-8℃静置。
进一步,静置方式为室温静置。
进一步,室温静置时间为1h。
进一步,步骤2)中抗cd22抗体稀释比例为1:1.5-1:4,优选的,稀释比例为1:2。
进一步,步骤2)中抗cd22抗体包被时间为30-60min,优选的,包被时间为30min。
进一步,步骤3)中所述b细胞包括:ramos、ga-10细胞、raji细胞、daudi细胞、bjab细胞。
进一步,步骤3)中加入到96孔微孔板的b细胞的密度为4×103/孔-1×105/孔,优选的,细胞的密度为4×104/孔。
进一步,步骤3)中抗igm抗体终浓度为0.4-10μg/ml,优选的,终浓度为1μg/ml。
进一步,步骤3)中细胞孵育的时间为16-96h,优选的,孵育时间为48h。
进一步,步骤4)中检测试剂为celltiterblue、mts或celltiterglo,优选的,检测试剂为celltiterglo。
检测试剂celltiterblue原理为,活细胞能将一种氧化还原染料(刃天青,resazurin)转化成一种荧光终产物(试卤灵,resorufin),通过检测荧光信号确定活细胞水平;检测试剂mts的原理为,活细胞内脱氢酶将mts还原为甲臜,该产物在490nm具有光吸收,通过检测该波长下的光吸收,反应活细胞数量;检测试剂celltiterglo原理为,它可以作为显色剂直接对atp进行检测,更加精确地反映细胞代谢状态,而不仅仅是活细胞数量。
附图说明
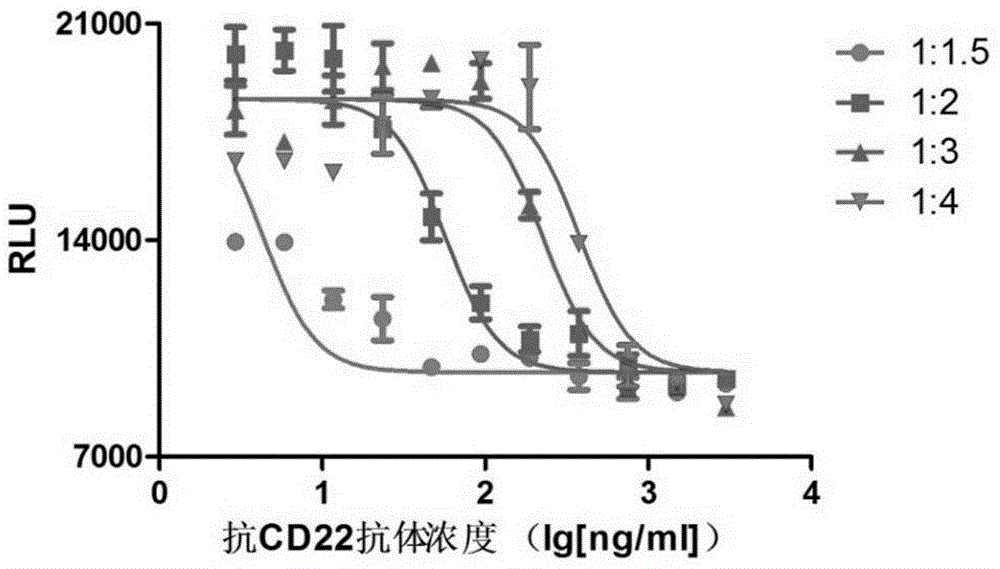
图1是ramos细胞在不同抗体稀释比例下的四参数曲线图;
图2是ramos细胞在不同细胞密度下的四参数曲线图;
图3是抗cd22抗体在不同包被时间下的四参数曲线图;
图4是ramos细胞在不同孵育时间下的四参数曲线图;
图5是ramos细胞在不同抗igm抗体浓度下的四参数曲线图;
图6是proteina在不同预包被浓度下的四参数曲线图;
图7是proteina在不同预包被时间下的四参数曲线图;
图8是直接包被法与本发明专利方法的四参数曲线结果及精密度和准确性比较图;其中,图a为直接包被法的四参数曲线结果图;图b为本发明专利方法的四参数曲线结果图;图c为直接包被法与本发明专利方法的变异度结果图;
图9是检测本发明专利方法对raji细胞和daudi细胞的适用性的四参数曲线图;
图10是检测本专利方法对依帕珠单抗(一种人源化抗cd22单抗)的适用性的四参数曲线图。
具体实施方式
下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
实施例1检测方法的优化
实验材料:ramos细胞、raji细胞、daudi细胞(人burkitt淋巴瘤细胞系)、抗cd22单抗(深圳赛乐敏公司,人鼠嵌合抗cd22单抗)、羊抗人igm(jacksonimmunoresearch,货号109-006-129)、proteina(thermofisher,货号21184)、96孔白板(corning,货号3917)、celltiterglo细胞活性检测试剂盒(promega,货号g7573)、na2co3(国药集团)、nahco3(国药集团)、rpmi1640培养基(gibco,货号22400-089)、fbs(胎牛血清,gibco,货号10099-141)、青霉素/链霉素(gibco,货号15140-122)、pbs(磷酸盐缓冲液,gibco,货号10010-023)、吐温20(tween20,(merck,货号655206)、spectramaxm5酶标仪(moleculardevice)
实验前准备:
(1)配制包被液:na2co31.59g,nahco32.93g,溶解后调整ph为9.6,定容为1000ml,2~8℃保存;
(2)配制rpmi1640完全培养基:取rpmi1640基础培养基,加入10%fbs,再加入青霉素/链霉素使两者终浓度分别为100units/ml和100μg/ml,配制好的完全培养基置于2~8℃保存。
1.1抗cd22抗体稀释比例的优化
用包被液将proteina稀释为1μg/ml,100μl/孔加入96孔白板,室温静置1h;用200μl/孔pbst洗涤proteina预包被的96孔白板,洗涤3次;封闭液(rpmi1640完全培养基)300μl/孔封闭板孔,室温静置1h;弃去板内液体,用rpmi1640完全培养基/t将抗cd22抗体稀释为3000ng/ml,分别按1:1.5、1:2、1:3、1:4进行倍比稀释,共11个浓度点,100μl/孔,室温包被30min;弃去板内液体,用300μl/孔pbs洗涤3次;用rpmi1640完全培养基将ramos细胞密度调整至4×105/ml,加入抗igm抗体至终浓度为4μg/ml,100μl/孔加入96孔白板中,37℃孵育72h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图1所示,图中各浓度点所示为x±sem。
结果:如图1所示,稀释比为1:2时各点在曲线上的分布最优,故将稀释比优化为1:2。
1.2ramos细胞密度的优化
用包被液将proteina稀释为1μg/ml,100μl/孔加入96孔白板,室温静置1h;用200μl/孔pbst洗涤proteina预包被的96孔白板,洗涤3次;封闭液(rpmi1640完全培养基)300μl/孔封闭板孔,室温静置1h;弃去板内液体,用rpmi1640完全培养基/t将抗cd22抗体稀释为3000ng/ml,并按1:2行倍比稀释,共10个浓度点,100μl/孔,室温包被30min;弃去板内液体,用300μl/孔pbs洗涤3次;用rpmi1640完全培养基将ramos细胞密度分别调整至4×104/ml、1×105/ml、4×105/ml、1×106/ml,加入抗igm抗体至终浓度为4μg/ml,100μl/孔加入96孔白板中,37℃孵育72h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图2所示,图中各浓度点所示为x±sem。
结果:如图2所示,细胞密度为4×104/孔的信噪比与1×105/孔的信噪比相当,故选用细胞密度为4×104/孔。
1.3抗cd22抗体包被时间的优化
用包被液将proteina稀释为1μg/ml,100μl/孔加入96孔白板,室温静置1h;用200μl/孔pbst洗涤proteina预包被的96孔白板,洗涤3次;封闭液(rpmi1640完全培养基)300μl/孔封闭板孔,室温静置1h;弃去板内液体,用rpmi1640完全培养基/t将抗cd22抗体稀释为3000ng/ml,并按1:2行倍比稀释,共10个浓度点,100μl/孔,室温包被30min或60min;弃去板内液体,用300μl/孔pbs洗涤3次;用rpmi1640完全培养基将ramos细胞密度调整至4×105/ml,加入抗igm抗体至终浓度为4μg/ml,100μl/孔加入96孔白板中,37℃孵育72h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图3所示,图中各浓度点所示为x±sem。
结果:如图3所示,包被时间为30min和60min曲线均较好且信噪比相当,为节省时间,故将抗cd22抗体包被时间优化为30min。
1.4ramos细胞孵育时间的优化
用包被液将proteina稀释为1μg/ml,100μl/孔加入96孔白板,室温静置1h;用200μl/孔pbst洗涤proteina预包被的96孔白板,洗涤3次;封闭液(rpmi1640完全培养基)300μl/孔封闭板孔,室温静置1h;弃去板内液体,用rpmi1640完全培养基/t将抗cd22抗体稀释为3000ng/ml,并按1:2行倍比稀释,共11个浓度点,100μl/孔,室温包被30min;弃去板内液体,用300μl/孔pbs洗涤3次;用rpmi1640完全培养基将ramos细胞密度调整至4×105/ml,加入抗igm抗体至终浓度为4μg/ml,100μl/孔加入96孔白板中,37℃分别孵育16h、24h、40h、48h、72h、96h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图4所示,图中各浓度点所示为x±sem。
结果:如图4所示,随着孵育时间延长,信噪比逐渐升高,到48h时,信噪比可达到2,孵育时间再延长,信噪比无明显增加,为了兼顾效率和信噪比,故将孵育时间优化为48h。
1.5抗igm抗体终浓度的优化
用包被液将proteina稀释为1μg/ml,100μl/孔加入96孔白板,室温静置1h;用200μl/孔pbst洗涤proteina预包被的96孔白板,洗涤3次;封闭液(rpmi1640完全培养基)300μl/孔封闭板孔,室温静置1h;弃去板内液体,用rpmi1640完全培养基/t将抗cd22抗体稀释为3000ng/ml,并按1:2进行倍比稀释,共11个浓度点,100μl/孔,室温包被30min;弃去板内液体,用300μl/孔pbs洗涤3次;用rpmi1640完全培养基将ramos细胞密度调整至4×105/ml,加入抗igm抗体至终浓度为分别为0.4μg/ml、1μg/ml、4μg/ml、10μg/ml,100μl/孔加入96孔白板中,37℃孵育72h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图5所示,图中各浓度点所示为x±sem。
结果:如图5所示,抗igm抗体终浓度为1μg/ml时信噪比明显高于其他浓度,故将抗igm抗体终浓度优化为1μg/ml。
1.6proteina预包被浓度的优化
方法:用包被液将proteina稀释为10、5、1、0.1μg/ml,100μl/孔加入96孔白板,室温静置1h;用200μl/孔pbst洗涤proteina预包被的96孔白板,洗涤3次;封闭液(rpmi1640完全培养基)300μl/孔封闭板孔,室温静置1h;弃去板内液体,用rpmi1640完全培养基/t(rpmi1640完全培养/0.05%tween20)将抗cd22抗体稀释为3000ng/ml,并按1:2进行倍比稀释,共11个浓度点,100μl/孔,室温包被30min;弃去板内液体,用300μl/孔pbs洗涤3次;用rpmi1640完全培养基将ramos细胞密度调整至4×105/ml,加入抗igm抗体至终浓度为1μg/ml,100μl/孔加入96孔白板中,37℃孵育48h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图6所示,图中各浓度点所示为x±sem。
结果:如图6所示,proteina预包被浓度为0.1μg/ml时,无明显四参数曲线,而protaina预包被浓度为10、5、1μg/ml时,均可呈现较好的曲线,出于节省试剂的考虑,故选用proteina预包被浓度为1μg/ml。
1.7proteina预包被时间的优化
用包被液将proteina稀释为1μg/ml,100μl/孔加入96孔白板,室温静置1h或2~8℃过夜(18h);用200μl/孔pbst洗涤proteina预包被的96孔白板,洗涤3次;封闭液(rpmi1640完全培养基)300μl/孔封闭板孔,室温静置1h;弃去板内液体,用rpmi1640完全培养基/t将抗cd22抗体稀释为3000ng/ml,并按1:2进行倍比稀释,共11个浓度点,100μl/孔,室温包被30min;弃去板内液体,用300μl/孔pbs洗涤3次;用rpmi1640完全培养基将ramos细胞密度调整至4×105/ml,加入抗igm抗体至终浓度为1μg/ml,100μl/孔加入96孔白板中,37℃孵育48h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图7所示,图中各浓度点所示为x±sem。
结果:如图7所示,室温预包被1h或2~8℃过夜预包被(18h)均可呈现较好的曲线,为节省时间,故选择proteina室温预包被1h。
根据以上参数优化的实验结果,整理得到的抗cd22抗体生物学活性方法的实验参数如表1所示:
表1抗cd22抗体生物学活性测定方法实验参数
实施例2检测方法验证
目前的检测方法(直接包被法)与本发明方法的四参数曲线结果及精密度和准确性比较。
直接包被法:抗cd22抗体通过pbs稀释直接包被在96孔板中,首浓度点84375ng/ml,1:1.5稀释,共11个浓度点,100μl/孔,2~8℃包被过夜;次日弃去板内液体,用250μl/孔pbs洗涤3次,200μl/孔rpmi1640完全培养基封闭1h;弃去板内液体,用rpmi1640完全培养基将ramos细胞密度调整至4×105/ml,加入抗igm抗体至终浓度为1μg/ml,100μl/孔加入96孔板中,37℃孵育72h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图8a所示,图中各浓度点所示为x±sem。
本方法:用包被液将proteina稀释为1μg/ml,100μl/孔加入96孔白板,室温静置1h;用200μl/孔pbst洗涤proteina预包被的96孔白板,洗涤3次;封闭液(rpmi1640完全培养基)300μl/孔封闭板孔,室温静置1h;弃去板内液体,用rpmi1640完全培养基/t将抗cd22抗体稀释为3000ng/ml,并按1:2进行倍比稀释,共11个浓度点,100μl/孔,室温包被30min;弃去板内液体,用300μl/孔pbs洗涤3次;用rpmi1640完全培养基将ramos细胞密度调整至4×105/ml,加入抗igm抗体至终浓度为1μg/ml,100μl/孔加入96孔白板中,37℃孵育48h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图8b所示,图中各浓度点所示为x±sem。
方法比较:按照上述直接包被法和本发明方法,对抗cd22抗体进行6次检测,每次检测中,平行样品中某样品作为参比品,其余作为样品,计算样品的相对生物学活性(回收率)并展示两种方法的变异度。结果如图8c所示,图中所示为x±sem。
结果:从图8可见,本发明方法的曲线拟合度(r2=0.772)明显优于直接包被法(r2=0.772),本发明方法的精密度(rsd=10%)明显优于直接包被法(rsd=29%)。
实施例3:检测本发明方法对raji细胞和daudi细胞的适用性
用包被液将proteina稀释为1μg/ml,100μl/孔加入96孔白板,室温静置1h;用200μl/孔pbst洗涤proteina预包被的96孔白板,洗涤3次;封闭液(rpmi1640完全培养基)300μl/孔封闭板孔,室温静置1h;弃去板内液体,用rpmi1640完全培养基/t将抗cd22抗体稀释为3000ng/ml,并按1:2行倍比稀释,共11个浓度点,100μl/孔,室温包被30min;弃去板内液体,用300μl/孔pbs洗涤3次;用rpmi1640完全培养基将ramos细胞密度调整至4×105/ml,加入抗igm抗体至终浓度为1μg/ml,100μl/孔加入96孔白板中,37℃孵育48h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图9所示,图中各浓度点所示为x±sem。
结果:如图9所示,burkitt淋巴瘤细胞系raji和daudi采用本发明方法,均可与ramos细胞一样,呈现较好的四参数曲线。说明本发明方法也适用于除ramos细胞外的其他b细胞如raji和daudi。
实施例4:检测本发明方法对依帕珠单抗(一种人源化抗cd22单抗)的适用性
用包被液将proteina稀释为1μg/ml,100μl/孔加入96孔白板,室温静置1h;用200μl/孔pbst洗涤proteina预包被的96孔白板,洗涤3次;封闭液(rpmi1640完全培养基)300μl/孔封闭板孔,室温静置1h;弃去板内液体,用rpmi1640完全培养基/t将抗cd22抗体稀释为3000ng/ml,并按1:2行倍比稀释,共12个浓度点,100μl/孔,室温包被30min;弃去板内液体,用300μl/孔pbs洗涤3次;用rpmi1640完全培养基将ramos细胞密度调整至4×105/ml,加入抗igm抗体至终浓度为1μg/ml,100μl/孔加入96孔白板中,37℃孵育48h;加入celltiterglo100μl/孔,酶标仪中读取化学发光值。结果如图10所示,图中各浓度点所示为x±sem。
结果:如图10所示,依帕珠单抗采用本方法,也可得到较好的四参数曲线,说明本方法除了适用于开发和验证中所使用的抗cd22抗体(一种人鼠嵌合抗cd22单抗),也可适用于其他抗cd22抗体如依帕珠单抗(人源化抗cd22单抗)。
- 还没有人留言评论。精彩留言会获得点赞!