基于微流控芯片的单分子计数生物大分子计量方法与流程
1.本发明涉及一种基于微流控芯片的单分子计数核酸计量方法,属于计量科学领域。
背景技术:
2.计量是利用技术和法制手段实现单位统一和量值准确可靠的测量活动,计量基准方法是具有最高计量学特性的测量方法,其操作可以被完全地描述和理解,可以用si单位完整地表述其不确定度。基准方法在量值源头复现和量值溯源传递中都发挥了重要的作用,研究建立计量基准方法,完善量值溯源传递体系对保证测量结果准确可靠,具有重要意义。
3.随着生物科学技术不断取得突破性进展,生命科学研究已逐渐从定性科学发展为精准定量的科学。核酸不仅是生命的基本遗传物质,同时在指导蛋白质生物合成的过程中也发挥着相当重要的作用,深刻影响着生命体的生长、发育、以及遗传等各个过程。因此核酸含量的定量测量技术已广泛应用于食品安全(如转基因作物的核酸定量)、临床诊断(如病毒负荷量和用药指导)、法证科学(如死亡时间推断)、以及分子生物学基础科学研究(如细胞因子mrna表达水平)等各个领域。尤其当前新冠病毒的“阴霾”笼罩全球,研究建立核酸计量基准方法,是维护大众生命健康的重要技术保障,也是生物计量研究的重点。
4.核酸定量测量方法有多种,它们根据是否需要标准物质可分为相对测量方法和绝对测量方法两类。常见的方法包括紫外分光光度法(uv)、电感耦合等离子体-发射光谱(icp-oes)、实时荧光定量pcr法(qrt-pcr)以及数字pcr等(傅博强,王晶,唐治玉,等.核酸定量测量技术研究进展[j],中国计量,2013(03):82-85;liang w,xu l,sui z,et al.quantification of plasmid dna reference materials for shiga toxin-producing escherichia coli based on uv,hr-icp-ms and digital pcr[j].chem cent j,2016,10(1):55;brennan rg,rabb sa,holden mj,et al.potential primary measurement tool for the quantification of dna[j].analytical chemistry,2009,81(9):3414-3420;kralik p,ricchi m.a basic guide to real time pcr in microbial diagnostics:definitions,parameters,and everything[j].front microbiol,2017,8:108;baker m.digital pcr hits its stride[j].nature methods,2012,9(6):541-544.)。
[0005]
紫外分光光度法(uv)通过260nm的紫外吸收值定量核酸的浓度,操作简单方便,是目前对核酸浓度初步定量的常规方法。但其灵敏度较低,且如果溶液中含有具有紫外吸收的其他化合物,如丙酮、苯系化合物、蛋白质等杂质,都会造成核酸定量结果的不准确(李春,刘建涛,高运华,等.紫外分光光度法测定核酸含量的影响因素分析[j].化学试剂,2020,42(01):53-57;sirajuddin m,ali s,badshah a.drug-dna interactions and their study by uv-visible,fluorescence spectroscopies and cyclic voltametry[j].journal of photochemistry and photobiology b,biology,2013,124:1-19)。
[0006]
高效电感耦合等离子体-发射光谱(hp-icp-oes)是基于核酸中的磷元素进行浓度测定,可通过磷的标准物质作为校准物,溯源至si单位,扩展不确定度很低。但hp-icp-oes方法应用的先决条件是样品应具有很高的纯度,能有效的排除其他物质中磷的干扰,且需要定量消解过程磷的回收率。这限制了该方法在dna定量中的应用(holden mj,rabb sa,tewari yb et al.traceable phosphorus measurements by icp-oes and hplc for the quantitation of dna[j].analytical chemistry,2007,79(4):1536-1541)。
[0007]
实时荧光定量pcr方法(qrt-pcr)是目前核酸拷贝数定量的主要技术,该技术在pcr反应体系中加入染料或探针,通过荧光信号实时监测整个扩增过程,并通过标准曲线对未知模板进行定量分析。qpcr技术存在以下问题:(1)dna提取时可能在样品中引入杂质,从而抑制pcr扩增检测效率;(2)校准物和样品间的pcr扩增效率可能存在差异,从而引入一定的不确定度。
[0008]
其中uv、icp-oes、hr-icp-ms和qrt-pcr都依赖于由特定的高纯度核酸标准物质绘制的标准曲线来确定未知样品的浓度,其量值不能直接溯源至si单位,因此都属于相对定量方法。与上述相对定量的方法相比,数字pcr(d-pcr)是一种超高灵敏度的绝对定量方法,无需标准物质,直接对核酸拷贝数浓度进行计数。它将低浓度的核酸样本平均分配到大量的独立反应单元中进行扩增反应,根据泊松分布和阳性信号比例来定量特定核酸片段的拷贝数,定量结果可直接溯源至si单位摩尔。目前该技术已成为核酸计量研究的重要手段,多次被用于核酸标准物质的定值研究以及核酸样本绝对定量的国际比对(huggett jf,foy ca,benes v,et al.the digital miqe guidelines:minimum information for publication of quantitative digital pcr experiments[j].clin chem,2013,59(6):892-902;deprez l,corbisier p,kortekaas a-m et al.validation of a digital pcr method for quantification of dna copy number concentrations by using a certified reference material[j].biomolecular detection and quantification,2016,9:29-39;sanders r,huggett jf,bushell ca et al.evaluation of digital pcr for absolute dna quantification[j].analytical chemistry,2011,83(17):6474-6484)。但因其基于pcr技术,易造成环境和检测试剂的pcr污染,使定量偏高或出现定性结果的“假阳性”。
[0009]
通过流式细胞仪可以检测细胞的数量(赵书涛,武晓东,王策,等.流式细胞仪的原理、应用及最新进展[j].现代生物医学进展,2011,11(22):4378-4381),检测的细胞相对于体积较大,易于检测,但如何通过流式方式检测更小的生物大分子如核酸分子,则是一道难题。因此亟需建立一种高灵敏度、无需扩增,且不依赖于标准物质可对核酸进行绝对定量的基准方法,进一步推动核酸量值溯源传递体系的发展。
技术实现要素:
[0010]
本发明的目的是克服现有生物大分子如核酸定量测量方法的不足,提供一种无需标准物质参照,直接测定核酸样本含量的高灵敏度绝对定量方法。该方法对单个核酸分子进行检测,无需pcr扩增,测量结果可直接溯源到si单位(摩尔),符合计量基准方法的定义。
[0011]
本发明提供的技术方案是:
[0012]
一种用于生物大分子如核酸、蛋白质单分子等的计数系统,所述系统用来实现液
流聚焦,主要由压力泵、微流控芯片、引流导管、核酸存储池和鞘液存储池、流量调节装置、荧光检测装置以及数据处理装置组成,其特征在于:所述微流控芯片含有样本流液流入口,鞘液流流入口,以及一个输出口,微流控芯片中内置的与样本流液流入口连通的样本流液微流通道和鞘液流流入口连通的相对位于样本流液微流通道两侧的鞘液流微流通道,在该样本流液微流通道的中部与两个相对样本流液微流通道交叉连通;流量调节装置用于调节样本流液和鞘液流的流速;所述引流导管包括连通核酸存储池与样本流液流入口的引流导管,以及连通鞘液微型存储池与鞘液流流入口的引流导管;所述荧光检测装置用于检测输出口中的样品和计数,数据处理装置则根据检测的参数计算得出生物大分子的检测结果数据。优选地,所述交叉处为十字交叉。
[0013]
所述荧光检测装置优选地采用光电倍增管对荧光显微镜获取的荧光信号进行光电转换,再通过电路采集卡进行数据采集,以实现原始的计数结果。
[0014]
所述数据处理装置包括计数模块和修正计数的数学计算处理模块,进一步包括数据显示装置。所述修正计数的数学计算处理模块包括下述数据修正模型:
[0015]
先根据公式(2)以得到最后的计数结果n
c
:
[0016]
nc=n
o
+n
dw
+n
dh-n
dye-n
noise
ꢀꢀ
(2)
[0017]
再通过流量计以确定检测的样本体积v,并得出核酸样本的浓度cc:
[0018][0019]
其中,n0指经dt优化后的计数结果,其通过下述公式(1)计算得到:
[0020][0021]
其中,n
r
指dt(dead time,即电子元件在识别相邻光子间存在的时间间隔)优化前的计数结果,τ为平均波峰宽度,t为总的计数时间;n
dw
和n
dh
分别表示通过峰宽和峰高鉴定的二聚体和冲突事件的计数值;n
noise
是通过设置缓冲液中只含有荧光染料的空白对照管,根据背景信号的强度设定阈值后检测空白对照管的计数。
[0022]
所述液流系统通过压力泵将样本液和鞘液从各自的微型存储池中引入微流控芯片,并在各自的微流通中移动至芯片中央的交叉处,其后两路液体混合形成鞘液位于两侧、样本流居中的一股液流,实现液流聚焦,即通过鞘液挤压样本流使后者液流宽度显著减小。
[0023]
本发明中的液流系统使标记后的生物大分子如核酸分子依次逐个经过检测区被激光激发,即保证在激光束与样本流正交重合的检测体积(probe volume,pv)内,同一时间除个别冲突事件外最多只有一个核酸分子通过(这与数字pcr每个反应单元中最多含有一个dna分子相似)。而现有的采用毛细管电泳(ce)的方法实现“样本流聚焦”开展核酸单分子检测,即以石英毛细管为流道,通过两端的电压驱动核酸样本流在溶液中心处移动的方法。但在电泳过程中,电渗流的细小变化将严重影响ce分离的重现性(迁移时间和峰面积重现性较差),造成检测的重复性不好。
[0024]
同时,本发明提供一种基于微流控芯片的生物大分子单分子计数的计量方法,该方法用所述的液流系统进行生物大分子的单分子计数,包括以下具体步骤:
[0025]
(1)样本制备
[0026]
将缓冲液经滤膜过滤后作为核酸样本的稀释液和微流控系统的鞘液;将高浓度核
酸样本稀释到10
5-106拷贝/微升,记录稀释倍数d1;
[0027]
将荧光染料加入核酸溶液中,对核酸分子进行充分标记,使每个核酸分子都结合上荧光染料;
[0028]
将标记后的核酸样本继续稀释至10
2-104拷贝/微升,记录稀释倍数d2,并以此作为待测核酸溶液;
[0029]
(2)上样
[0030]
在液流系统中导入核酸样本并调节样本流和鞘液流的速度,通过荧光显微镜实时观察液流流动状态,使两路溶液经过液流系统的微流控芯片“十字交叉”后相交汇聚成一股稳定的的液流,保证在鞘液流挤压下样本流宽度为<10μm;
[0031]
(3)计数模块对荧光信号的检测与计数
[0032]
为了检测核酸分子被激发后生成的荧光信号,采用荧光检测装置进行检测并计数。先检测阴性对照,待液流系统稳定后,打开荧光检测装置开始测量,先检测阴性对照,根据计数模块中其荧光信号的强度来设定计数的阈值,将稀释d1 x d2倍的荧光标记的核酸样本置于荧光成像装置上进行荧光信号的识别和采集,调节计数模块中的信号采样率和阳性信号的最小波峰宽度,对待测溶液进行检测,记录原始计数结果n
r
;
[0033]
(4)原始计数结果的修正
[0034]
修正计数的数学计算处理模块中通过数学模型,对原始计数结果进行三方面的修正最后得到准确的核酸拷贝数浓度:
[0035]
1)计算光电子件响应间隔时间的影响:根据公式(1)排除dt造成的计数影响:
[0036][0037]
其中,dt指电子元件在识别相邻光子间存在一定时间间隔(dead time),n0指经dt优化后的计数结果,n
r
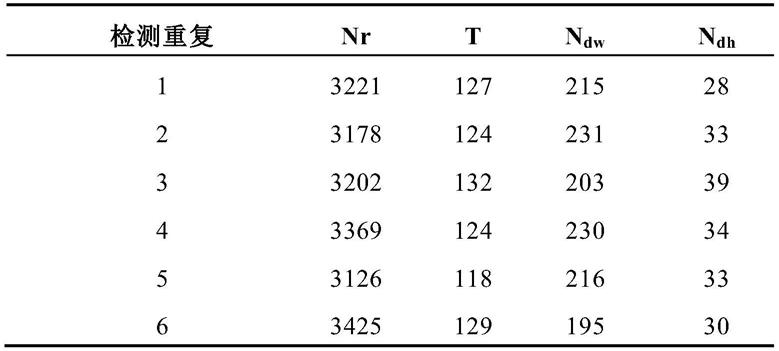
指dt优化前的计数结果,τ为平均波峰宽度,t为总的计数时间;
[0038]
2)计算二聚体和偶发冲突事件的数量:用n
dw
和n
dh
分别表示通过峰宽和峰高鉴定的二聚体和冲突事件的计数值;
[0039]
3)计算非特异信号的影响:设置缓冲液中只含有荧光染料的空白对照管,根据背景信号的强度设定阈值后检测空白对照管仍有少量计数n
noise
,则在对核酸样本计数时需要进行“背景扣除”;
[0040]
因此核酸分子总拷贝数的计算:整合公式(1)后,根据公式(2)得到最后的计数结果n
c
:
[0041]
nc=n
o
+n
dw
+n
dh-n
dye-n
noise
ꢀꢀ
(2)
[0042]
通过流量计确定检测的样本体积v,则核酸样本的浓度cc:
[0043][0044]
本发明方法不需要pcr扩增,直接通过“计数”的方法对核酸分子定量。建立该方法需要解决两个核心问题:1.单个核酸分子不经扩增结合的荧光染料很有限,必须尽可能增强激发效率,显著提升检测的灵敏度才能识别单分子的荧光信号;2.核酸分子非常小,保证在激光激发的检测区内同一时间只通过一个分子,是拷贝数定量的关键。
[0045]
所述的方法,优选地,步骤(1)中,将缓冲液经0.22μm滤膜过滤后作为核酸样本的
稀释液和微流控系统的鞘液;步骤(2)中,上样前先通入疏水剂15min以上,然后用超纯水冲洗管路,再在液流系统中导入核酸样本;步骤(3)中,对待测溶液进行检测,每次测量1μl样本,记录原始计数结果n
r
。
[0046]
步骤(4)中,计算二聚体和偶发冲突事件的数量:若两个dna分子形成二聚体通过,则信号峰的高度(最大荧光信号强度)是单分子峰高的近2倍;若双分子间距很小几乎同时到达检测区时,则双峰连在一起,总峰宽(通过检测区的时间)是单分子峰的近两倍。因此比较峰的面积、高度和宽度,就可以鉴别出二聚体和冲突事件的信号,从而确定两者各自的数量,用n
dw
和n
dh
分别表示通过峰宽和峰高鉴定的二聚体和冲突事件的计数值。
[0047]
本发明基于微流控芯片对生物大分子的单分子计数的核心技术问题是尽量缩小样本流的宽度,使单个核酸分子依次经过检测区被逐个识别。本发明采用微流控芯片实现“液流聚焦”,即通过鞘液流挤压样本流的方式显著减小了经过检测区时样本流的宽度。同时,基于微流控系统构建核酸定量测量体系,研究摸索出适用的样本流流速和宽度,以及激光聚焦于样本流的检测体积等关键实验条件,以及研究出计算方法以获得更准确的结果。因此,本发明实现了基于微流控芯片对生物大分子如核酸分子的单分子计数的核酸计量基准方法,整合液流系统、荧光检测装置、计数模块和修正原始计数的数学模型,实现对生物大分子如核酸样本的拷贝数浓度的测定,测量结果直接溯源至si单位。
[0048]
本发明具有以下有益效果:
[0049]
以检测核酸为例,目前用于微量核酸绝对定量的方法主要是数字pcr,本发明的基于微流控芯片的单分子计数核酸计量基准方法与目前已广泛应用于核酸绝对定量的“数字pcr”方法虽然有相似之处:1.均属于超高灵敏度的核酸单分子检测方法,以荧光标记的核酸单分子作为检测对象;2.核酸分子生成的荧光信号都需要特定的荧光检测装置进行识别;3.通过鉴别荧光信号的强度采用“计数”的方式统计样本中核酸分子数;4.获得样本的最终的拷贝数浓度,都需要一定的数学模型对原始计数结果进行修正。另一方面,两者之间也存在显著的差异,包括:1.核酸单分子的分离方式不同:“数字pcr”是将低浓度的核酸样本平均分配到大量的独立反应单元,保证绝大多数反应单元只有一个或无核酸分子;本发明方法是通过采用微米级的液流管道,通过流动的方式,将低浓度样本中的核酸单分子彼此分离;2.荧光信号的强度显著不同:“数字pcr”在独立反应单元中进行pcr反应,将核酸分子进行百万倍的扩增后进行信号检测,因此每个单元荧光信号较强;而本发明方法不经过pcr扩增直接识别核酸单分子生成的较弱的荧光信号,并且后续对原始计数结果进行修正模型不同。
[0050]
因此,与现有技术相比本发明方法有下面几方面优点:无需pcr扩增,因此更节省检测时间,且避免了可能因pcr污染造成定量结果偏高,或定性出现“假阳性”的情况;无需pcr扩增,避免由pcr过程引入不确定因素,减小实验测量偏差;试剂耗材成本较低,只需要常规的荧光染料。而数字pcr定量时必须使用对应厂家的试剂耗材,检测成本较高;尤其是检测结果准确可靠,测量结果直接溯源至si单位。
附图说明
[0051]
图1液流系统的示意图。
[0052]
图2“核酸单分子计数”平台工作原理的示意图。
[0053]
图3微流控芯片的结构以及不同压力下样本流聚焦的情况。
[0054]
图4计数模块识别λ-dna单分子荧光信号,其中a是计数模块分析实时界面;b是区分核酸单分子阳性和阴性荧光信号的方法。
[0055]
图5单个(a)和两个(b)核酸分子通过检测区的荧光成像结果。
具体实施方式
[0056]
下面通过具体实施方式的详细描述来进一步阐明本发明,但并不是对本发明的限制,仅仅作示例说明。
[0057]
实施例一
[0058]
本发明用于核酸单分子计数的系统,主要由压力泵、微流控芯片4、引流导管3、核酸存储池2和鞘液微型存储池1、流量调节装置、荧光检测装置以及数据处理装置组成,所述微流控芯片含有圆柱形液流入口和输出口8,液流入口分样本流入口6和鞘液流入口7,以及内置的“十字交叉”型微流通道其包括样本液微流通道9,两侧分布的鞘液微流通道10,它们在十字交叉处5汇合(其中,微流通道从液流入口到交叉处尺寸逐步断缩小,到交叉处的宽度和高度在10-25微米之间),其中,样本流入口6连通样本液微流通道9,鞘液流入口7连通鞘液微流通道10,在十字交叉处5,鞘液流从两侧与样本流汇合。核酸存储池2和鞘液微型存储池1分别能通过引流导管与微流控芯片上的样本流入口6和鞘液流入口7连通,如此构成液流系统,如图1所示(箭头为液流方向)。流量调节装置用于调节样本流液和鞘液流的流速;所述荧光检测装置用于检测输出口中的样品,数据处理装置则根据检测的参数计算得出生物大分子的检测结果数据。其中数据处理装置包括计数模块和修正计数的数学计算处理模块。上述的系统组成的流式核酸单分子计数平台,其工作流程示意图如图2所示。在一个具体实施方式中,所述荧光检测装置采用光电倍增管对荧光显微镜获取的荧光信号进行光电转换,再通过电路采集卡进行数据采集。最后采集的数据由计数模块识别特定的荧光信号,并定量记录核酸样本产生的荧光粒子数量,完成计数。
[0059]
数据处理装置包括计数模块和修正计数的数学计算处理模块。
[0060]
计数模块可以基于labview系统开发的自动计数程序来实现,以实时的将采集信号拟合成高斯分布的曲线,自动统计单位体积内核酸样本产生的荧光粒子数。开发的软件时可以调节设定不同的信号采集条件,如采样率、信号阈值、波峰宽度等,并实时显示荧光信号的相对强度、面积等参数。当核酸分子产生的荧光信号高于设定的阈值时,就会对其计数,从而实现对核酸样本拷贝数浓度的定量测量。同时自动存储荧光强度的原始数据,方便数据的后续处理。
[0061]
修正计数的数学计算处理模块包括通过数学模型,对原始计数结果进行三方面的修正得到准确的核酸拷贝数浓度:
[0062]
1)计算光电子件响应间隔时间的影响:电子元件在识别相邻光子间存在一定时间间隔(dead time,dt),即当dna分子产生高密度光量子时,在该段间隔时间产生的信号不会被元件采集,从而造成计数偏低。n0指经dt优化后的计数结果,n
r
指dt优化前的计数结果,τ为平均波峰宽度,t为总的计数时间。根据公式(1)排除dt造成的计数影响:
[0063]
[0064]
2)计算二聚体和偶发冲突事件的数量:实际检测时样本中少量dna分子会形成二聚体、或发生冲突事件,即两个分子相距很近被当成一个分子计数,造成定量结果偏低。图4中的a和b分别表示检测到一个和两个分核酸分子(冲突事件)通过检测区时ccd的荧光成像结果。可通过分析原始荧光数据,比较对应荧光信号的峰高和峰宽,来鉴别二聚体和冲突事件的数量。若两个dna分子形成二聚体通过,则信号峰的高度(最大荧光信号强度)是单分子峰高的近2倍;若双分子间距很小几乎同时到达检测区时,则双峰连在一起,总峰宽(通过检测区的时间)是单分子峰的近两倍。因此比较峰的面积、高度和宽度,就可以鉴别出二聚体和冲突事件的信号,从而确定两者各自的数量。其中用n
dw
和n
dh
分别表示通过峰宽和峰高鉴定的二聚体和冲突事件的计数值;
[0065]
3)计算非特异信号的影响:设置缓冲液中只含有荧光染料的空白对照管,根据背景信号的强度设定阈值后检测空白对照管仍有少量计数(n
noise
),则在对核酸样本计数时需要进行“背景扣除”;
[0066]
因此核酸分子总拷贝数的计算:整合公式(1)后,根据公式(2)得到最后的计数结果n
c
:
[0067]
nc=n0+n
dw
+n
dh-n
dye-n
noise
ꢀꢀ
(2)
[0068]
通过流量计确定检测的样本体积v,则核酸样本的浓度cc:
[0069][0070]
其中,本发明系统实现液流聚焦方式:通过压力泵将核酸样本和鞘液从各自的微型存储池中引入微流控芯片,并在各自的流道中移动至芯片中央的“十字交叉”处,并调节两股液流的流速,使经过“十字交叉”处后,两路液体混合形成鞘液位于两侧、样本流居中的一股液流,实现“液流聚焦”,即通过鞘液挤压样本流使后者液流宽度显著减小。微流控芯片的结构以及不同压力下样本流聚焦的情况示意图请参见图2。
[0071]
实施例二
[0072]
本发明基于实施例一的用于核酸单分子计数的系统对核酸单分子的计量方法,该方法包括以下具体步骤:
[0073]
(1)样本制备
[0074]
经0.22μm滤膜过滤后的缓冲液作为核酸样本的稀释液和微流控系统的鞘液,将高浓度核酸样本稀释到10
5-106拷贝/微升,记录稀释倍数d1;
[0075]
将适量荧光染料加入该核酸溶液中,对溶液中的核酸分子进行充分标记,使每个核酸分子都结合上荧光染料;
[0076]
将标记后的核酸样本继续稀释至10
2-104拷贝/微升,记录稀释倍数d2,并以此作为待测核酸溶液;
[0077]
(2)上样
[0078]
上样前先通入疏水剂,然后用超纯水冲洗管路。导入核酸样本并调节样本流和鞘液流的速度,通过荧光检测装置(荧光显微镜)实时观察液流流动状态,使两路溶液经过液流系统的微流控芯片“十字交叉”后相交汇聚成一股稳定的的液流,保证在鞘液流挤压下样本流宽度为<10μm;
[0079]
(3)单分子荧光信号检测与计数
[0080]
液流系统稳定后,打开荧光检测装置开始测量。先检测阴性对照,待液流系统稳定后,打开荧光检测装置开始测量,先检测阴性对照,根据其荧光信号的强度设定阈值,将稀释d1 x d2倍的荧光标记的核酸样本置于荧光成像装置上进行荧光信号的识别和采集,调节信号采样率和荧光放大倍数等参数,计数模块对待测溶液进行检测,每次测量1μl样本,记录原始计数结果n
r
(通过显示装置计数模块实时显示荧光信号强度和并统计计数结果,见图4。图4中的a为计数模块实时显示检测到的荧光颗粒的信号,每个峰表示检测到一个荧光信号。其中横坐标为采样时间,纵坐标为相对荧光强度。红线是阈值线,即超过该阈值的荧光信号都会被计数;图4中的b为a所示采集信号的示意图)。
[0081]
(4)原始计数结果的修正
[0082]
最后通过修正计数的数学计算处理模块,通过数学模型,对原始计数结果进行三方面的修正得到最终的核酸拷贝数浓度结果。
[0083]
实施例三:
[0084]
采用实施例二的方法测量λ-dna标准品的浓度,具体步骤为:
[0085]
1、样本制备:
[0086]
使用紫外分光光度计初测λ-dna标准品拷贝数浓度约为9.2ng/μl,根据下述公式(4)和(5),计算λ-dna浓度约为1.8
×
108拷贝/μl。
[0087]
平均分子量mw(dsdna)=碱基数
×
660道尔顿/碱基
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(4)
[0088]
浓度(concentration)=6.02
×
10
23
拷贝数/摩尔
×
质量浓度(克/摩尔)/mw
ꢀꢀꢀ
(5)
[0089]
用1
×
te将该溶液稀释103倍后(记d1=103),取出20μl稀释液后加入sybrgold染料染色(终浓度0.1x),避光反应30-60min。然后用1
×
te再稀释50倍(记d2=50)至约3600copies/μl。
[0090]
2、液流系统的调节
[0091]
通过压力泵泵在微流控芯片中先后通入少量疏水剂(约15min)和双蒸水(约5min),接着导入阴性对照溶液(1
×
te溶液中只含0.1x sybrgold)。通过荧光显微镜实时观察液路移动状态(如图5示意单个(a)和两个(b)核酸分子通过检测区的荧光成像结果),以确定通过压力泵控制样本流速为约0.5-1μl/min,使两路液体在经过“十字交叉处”后汇合形成稳定的层流,中央样本流宽度<10μm。
[0092]
3、单分子荧光检测
[0093]
流量计设置样本体积为1μl。先检测阴性对照,根据背景信号的信号强度设定阈值,统计产生的少量非特异信号产生的计数结果,重复四次,取平均计数结果n
noise
=84。接着上样稀释后的λ-dna溶液,在相同条件下重复测定λ-dna溶液6次,计数结果分别为3221、3178、3202、3369、3126和3425。
[0094]
4、计数结果的修正
[0095]
统计6次测量中每次的计数结果n
r
,测量时间(t),并将τ=0.005s代入公式(1),计算出6次测量的n0分别为3304.8、3261.6、3281.6、3463.1、3211.1和3518.4。
[0096]
使用软件origin分析原始数据(荧光强度和每个采样点的测量时间等),通过信号峰宽和峰高分别鉴定出二聚体/冲突事件数量n
dh
和n
dw
(见表1)。将n
noise
=84代入公式(2),计算出6次测量的n
c
分别为3463.8、3441.6、3439.6、3643.1、3376.1和3659.4。
[0097]
表1:六次重复计数的结果
[0098][0099]
将n
c
值分别代入公式(3),则可得到6次测量的平均浓度c
c
:(3463.8+3441.6+3439.6+3643.1+3376.1+3659.4)/6
×
(103×
50)=1.7519
×
108拷贝/μl。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1