一种便携式生物结皮种源及其制备方法
chodatii)a07020在中国微生物菌种保藏管理委员会普通微生物中心的保藏编号为cgmccno.3893;
10.2)将步骤1)中培养的石果衣共生菌endocarponpusillum f07020和共生藻diplosphaera chodatiia07020的培养物去除培养基质后烘干,得到单位体积石果衣共生菌和石果衣共生藻干重;
11.3)将石果衣共生菌和石果衣共生藻的混合匀浆离心沉淀加入到海藻酸钠水溶液中,得到混合液1;
12.4)将混合液1加入到硝酸钙水溶液中,固定,形成菌藻小球。
13.进一步,所述步骤1)中的培养步骤包括活化培养和扩大培养。
14.进一步,所述步骤2)中的烘干温度为105℃,烘干时间为2h。
15.进一步,所述步骤3)中海藻酸钠溶液的浓度为1g/150ml,每5ml海藻酸钠睡溶液中石果衣共生菌endocarponpusillum f07020的加入量为0.3g,共生藻diplosphaera chodatiia07020的加入量为0.1g;所述步骤4)中硝酸钙水溶液的浓度为0.5%(质量百分比),混合液1每次加入硝酸钙水溶液中的量为150μl。
16.本发明还提供一种用于制备便携式生物结皮种源的成套产品,包括独立包装的石果衣共生菌(endocarponpusillum)f07020、石果衣共生藻(diplosphaera chodatii)a07020和成型培养基质。
17.所述的便携式生物结皮种源或者所述制备方法在荒漠固沙中的应用也应在本发明的保护范围之内。
18.本发明还提供一荒漠固沙的方法,包括使用所述的便携式生物结皮种源或者所述制备方法制备的便携式生物结皮种源进行荒漠固沙。
19.本发明与其他方法相比,有益技术效果是:本发明对培育结皮专用的石果衣共生菌endocarpon pusillum f07020 cgmcc no.3893、共生藻diplosphaera chodatiia07020 cgmcc no.3892扩大培养,收集对数生长期的培养产物,按照菌藻比例3:1混合后,形成了可保湿的菌藻混合小球。在沙土培养基中,经过1个月培养,菌丝覆盖于菌藻混合物小球表面,石果衣共生菌与共生藻生长良好,并出现初级的菌藻接触结构。移接至野外的人工结皮出现共生菌藻分层结构。本发明有利于形成更接近自然状态下采集的地衣体的种源,可大规模应用到荒漠化土地治理工程中,有利于促进人工生物结皮的形成。
20.保藏说明
21.菌种名称:石果衣共生菌
22.拉丁名:endocarponpusillum
23.菌株编号:f07020
24.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
25.保藏机构简称:cgmcc
26.地址:北京市朝阳区北辰西路1号院3号
27.保藏日期:2010年05月31日
28.保藏中心登记入册编号:cgmcc no.3893
29.菌种名称:石果衣共生藻
30.拉丁名:diplosphaera chodatii
31.菌株编号:a07020
32.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
33.保藏机构简称:cgmcc
34.地址:北京市朝阳区北辰西路1号院3号
35.保藏日期:2010年05月31日
36.保藏中心登记入册编号:cgmcc no.3892
附图说明
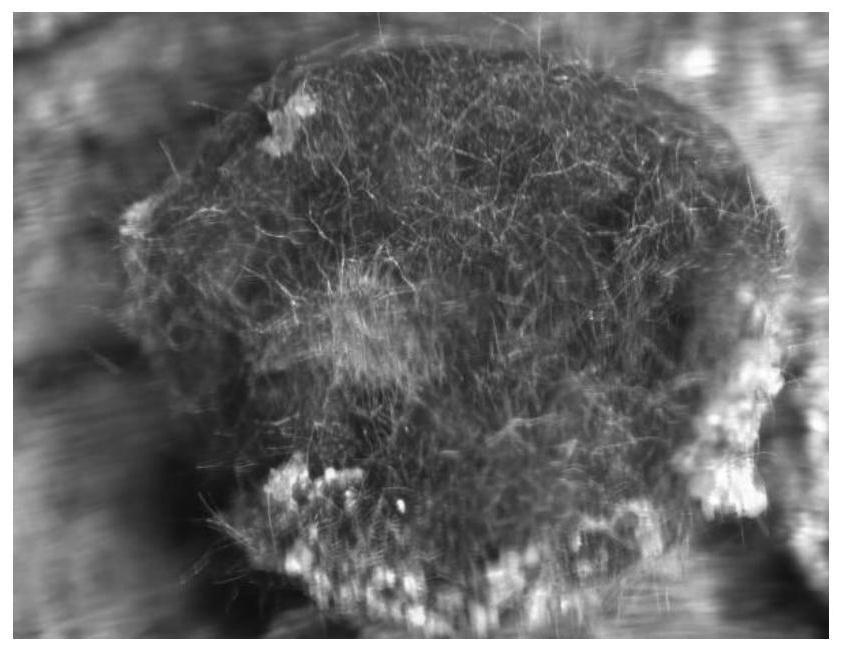
37.图1为实施例1中制备的种源形态。
38.图2为实施例1中石果衣共生菌endocarponpusillum f07020 cgmcc no.3893与石果衣共生藻diplosphaera chodatiia07020 cgmcc no.3892混合物培养1个月后的菌藻形态。
39.图3为实施例1培养1个月的石果衣共生菌endocarponpusillum f07020cgmcc no.3893与石果衣共生藻diplosphaera chodatiia07020 cgmcc no.3892的微观接触结构。
40.图4为实施例1后在野外样地移接培养的的人工生物结皮。
41.图5为实施例1后野外人工生物结皮种源的菌藻分层显微结构。
具体实施方式
42.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
43.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
44.本发明实施中使用的主要设备说明:
45.人工气候箱:宁波江南仪器公司,gxz智能型。
46.组织捣碎机:北京众力挽生物科技有限公司购入,美国waring公司lb20es型。
47.下述实施例中所用的培养基配方如下:
48.优化菌斜面培养基:酵母浸粉2g,大豆蛋白胨2g,蔗糖40g,土豆浸汁200g/l,琼脂粉20g,加蒸馏水至1l。其中,土豆浸汁的制备方法如下:土豆洗净去皮,称取200g切成小块,加蒸馏水,煮沸5-10分钟,待土豆可用玻璃棒戳破后,用八层纱布过滤,得到土豆浸汁,作为原料加入到优化菌液体培养基中。
49.优化藻斜面培养基:大豆蛋白胨5g,酵母浸粉1g,葡萄糖30g,琼脂粉20g,加蒸馏水至1l。
50.优化菌液体培养基:酵母浸粉2g,大豆蛋白胨2g,蔗糖40g,土豆浸汁200g/l,加蒸馏水至1l。
51.优化藻液体培养基:大豆蛋白胨5g,酵母浸粉1g,葡萄糖30g,加蒸馏水至1l。
52.沙土培养基:将沙土碾碎过60目筛后121℃灭菌30min,在无菌操作下每个直径90mm的培养皿分装50g沙土,喷洒5ml无菌水。
53.大豆蛋白胨:北京奥博星生物技术有限公司,01-004;酵母浸粉:angel yeast co.ltd,fm 888;蔗糖:沪试,10021418;葡萄糖:沪试,10010518;琼脂:bd,214010。
54.实施例1、便携式生物结皮种源的制备
55.1.活化培养
56.将石果衣共生菌f07020(其在cn201110261963.3中公开,于中国微生物菌种保藏管理委员会普通微生物中心的保藏编号:cgmcc no.3893)接种于优化菌斜面培养基上,活化15天,选取培养基上生长的石果衣共生菌接种到优化菌液体培养基中活化培养,培养条件是22℃,150rpm培养30天。
57.将石果衣共生藻diplosphaera chodatiia07020(其在专利cn201110262013.2中公开,于中国微生物菌种保藏管理委员会普通微生物中心的保藏编号:cgmcc no.3892)接种于优化藻斜面培养基上,活化15天后,选取培养基上生长的石果衣共生藻接种到优化藻液体培养基中活化培养,条件是22℃,150rpm,12h光照(光照强度2000lux)/12h暗培养20天。
58.2.扩大培养
59.将活化后的石果衣共生菌endocarponpusillum f07020静置过夜沉淀,弃去上清液。用组织捣碎机将石果衣共生菌endocarponpusillum f07020打碎均匀,捣碎机转速设置为9-10,每次15s,共三次,取10ml菌液加在130ml优化菌液体培养基中,150rpm,20℃摇床培养30天。
60.将活化后的石果衣共生藻diplosphaera chodatiia07020静置过夜沉淀,弃去上清液。取10ml沉淀石果衣共生藻diplosphaera chodatiia07020加在130ml优化藻液体培养基中,150rpm,20℃,2000lux培养7天。
61.3.石果衣共生菌endocarpon pusillum f07020及石果衣共生藻diplosphaera chodatiia07020的制备
62.收集培养至对数期的石果衣共生菌endocarponpusillum f07020,静置过夜沉淀,弃去上清液。用无菌的组织捣碎机将石果衣共生菌endocarpon pusillum f07020打碎,转速设置为9-10,每次15s,共打碎三次后将所得石果衣共生菌匀浆置于无菌容器中备用。将匀浆混合均匀,取5-10ml,3000rpm离心5min后弃上清液,用无菌水重悬一次后3000rpm离心5min后弃上清液,将沉淀物105℃烘干2h,干燥至恒重,可得到单位体积(ml)石果衣共生菌endocarpon pusillumf07020的干重。
63.收集培养至对数期的石果衣共生藻diplosphaera chodatiia07020培养液,静置过夜沉淀,弃去上清液,转置于无菌容器中备用。藻液混合均匀,得到石果衣共生藻液,取出5-10ml,3000rpm离心5min后弃上清液,用无菌水重悬一次后3000rpm离心5min后弃上清液,将沉淀物105℃烘干2h,干燥至恒重,可得到单位体积(ml)石果衣共生藻diplosphaera chodatiia07020的干重。
64.根据单位体积(ml)石果衣共生菌endocarponpusillum f07020及石果衣共生藻diplosphaera chodatii的干重,可得到实验中所需干重所对应的石果衣共生菌匀浆和石果衣共生藻液体积。
65.4.菌藻小球的制备
66.配制海藻酸钠水溶液(1g/150ml)和0.5%(质量百分比)的硝酸钙水溶液,121℃灭
菌30min,冷却备用。
67.每0.3g石果衣共生菌endocarponpusillum f07020所对应的匀浆与0.1g石果衣共生藻diplosphaera chodatiia07020所对应的藻液混合后,3000rpm离心5min弃去培养基上清液,使用无菌水重悬沉淀物,离心弃上清液,重复两次。加入无菌海藻酸钠水溶液5ml,根据菌藻混合物的量适当调整加入量,使用无菌玻璃棒搅拌混合均匀,吸取150μl混合物到无菌的硝酸钙水溶液中固定,形成菌藻小球,所述菌藻小球即为便携式生物结皮种源。
68.海藻酸钠水溶液与硝酸钙水溶液可组成成型培养基质。
69.实施例2便携式生物结皮种源的应用验证
70.将实施例1中制备的菌藻小球使用无菌镊子夹至沙土培养基上,接种密度为在90mm无菌平皿间隔接种9个。放置培养皿于人工气候箱培养,18℃,16h光照(光照强度2000lux)/8h黑暗培养,培养1个月后,利用环境扫描电子显微镜观察菌藻混合物小球的形态及内部结构,如图2和图3所示,从图2和图3中,可以看出,菌藻的生长状态良好,并且由于能够保证石果衣共生菌与石果衣共生藻的充分接触,最终产生了微观的菌藻接触结构。
71.在人工气候箱中培养3个月后,将平皿培养物即菌藻混合物小球连同土壤基质移接至野外试验田(如图4所示),使其经历室内适宜环境及野外干旱多风环境双重培养,在自然状态下生长2个月后将菌藻小球取回,对形成的结皮进行观察,如图5所示,可以看出室内培养3月后,再转接至野外培养2月,人工生物结皮出现菌藻分层结构。
72.本发明中,将石果衣共生菌endocarpon pusillum f07020与石果衣共生藻diplosphaera chodatiia07020按照3:1比例制备的人工生物结皮种源在培养过程中的形态稳定,菌藻的生长状态良好。能够促进石果衣共生菌与石果衣共生藻充分接触,最终产生了微观的菌藻接触结构。室内培养3月转接至野外培养2月后,人工生物结皮出现菌藻分层结构。按照一定比例构建的菌藻混合物小球作为人工生物结皮种源,能相对固定菌藻并创造紧密的接触机会,有利于菌藻共生形态的形成,促进石果衣结皮的形成,短期内可大量制备用于荒漠地区的人工生物结皮种源。
73.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1