虹鳟spindlin基因及其应用的制作方法
1.本发明涉及一种虹鳟的基因及其应用。
背景技术:
2.虹鳟(oncorhynchus mykiss)是我国主要的冷水性养殖鱼类之一,因其性成熟后个体伴有死亡率提高、生长率降低、肉质和外观较差等问题,在生产中广泛应用不育的三倍体虹鳟替代二倍体从而避免不必要的经济损失。然而,关于三倍体雌性虹鳟性腺败育的分子调控机制仍不明确,且缺乏一种鉴定虹鳟二、三倍体的有效手段。
技术实现要素:
3.本发明提供了一种鉴定虹鳟二、三倍体的有效手段。
4.本发明虹鳟spindlin基因的核苷酸序列如seq id no.1所示。
5.上述虹鳟spindlin基因的开放性读码框序列如seq id no.2所示。
6.本发明虹鳟spindlin基因编码的spindlin蛋白的氨基酸序列如seq id no.3所示。
7.本发明虹鳟spindlin基因的应用,用于鉴别虹鳟的染色体倍性;具体方法为检测雌性虹鳟卵巢中spindlin基因的表达量,spindlin基因表达量高的为二倍体雌性虹鳟,spindlin基因表达量低的为三倍体雌性虹鳟。
8.进一步,在雌性虹鳟240
‑
330dpf发育阶段进行spindlin基因表达量检测。
9.进一步,在雌性虹鳟240dpf进行spindlin基因表达量检测。
10.spindlin基因是减数分裂纺锤体相关的母体效应因子,从卵母细胞到早期胚胎发育的过渡期间,起到调节细胞周期的作用。本发明对虹鳟spindlin全长进行了克隆,选取240
‑
330dpf发育时期进行检测,利用spindlin基因在不同染色体组中表达的差异,作为鉴定不同倍性虹鳟的一种分子手段;从而可以在早期分辨雌性虹鳟是否为三倍体,为提高养殖经济效益提供可靠、准确的依据。
附图说明
11.图1是本发明虹鳟spindlin蛋白的氨基酸序列系统进化树;
12.图2是spindlin基因在虹鳟各组织表达情况图;
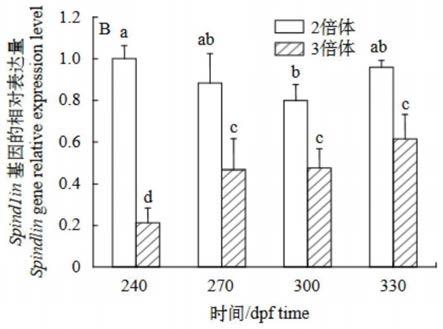
13.图3是spindlin基因在二倍体与三倍体虹鳟卵巢组织中不同发育时期表达情况图。
具体实施方式
14.本发明技术方案不局限于以下所列举具体实施方式,还包括各具体实施方式间的任意组合。
15.实施例1
16.本实施例虹鳟spindlin基因的核苷酸序列如seq id no.1所示。
17.制备上述的虹鳟spindlin基因方法:
18.一、提取虹鳟肝脏组织总rna,反转录得到cdna;
19.二、从ncbi数据库下载比对的相似基因(genbank:gfin01057112.1)的mrna序列,设计引物,以虹鳟cdna为模板,进行pcr扩增,胶回收,pcr产物连接到pmd
‑
18t,转化大肠杆菌后测序,得到omspindlin基因的中间片段;
20.三、获取omspindlin基因3’端序列;
21.四、获取omspindlin基因5’端序列;
22.五、将步骤二至四获得的序列片段进行拼接,获得omspindlin基因(虹鳟spindlin基因)全长序列;
23.其中,步骤二中pcr的上游引物为5
’‑
gtagctttcatgaggtggattctg
‑3’
,下游引物为5
’‑
tgcaggcagtaggtgtttgttc
‑3’
;
24.步骤三采用race技术获取omspindlin基因3’端序列,其中outer上游引物为5
’‑
catggctacatgctgacagcctactg
‑3’
,outer下游引物为5
’‑
cactcattcttctcaccgtcctc
‑3’
,inner上游引物为5
’‑
acagcctactgatgatcagtcgatg
‑3’
,inner下游引物为5
’‑
gatttaatgaacagttcgttaaggc
‑3’
;
25.步骤四采用race技术获取omspindlin基因5’端序列,其中outer上游引物为5
’‑
taccagctctgggacgactataag
‑3’
,outer下游引物为5
’‑
taccgtcgttccactagtgatttc
‑3’
,inner上游引物为5
’‑
cagagaacaaacacctactgcctg
‑3’
,inner下游引物为5
’‑
cgttccactagtgatttcactatagg
‑3’
。
26.本实施例虹鳟spindlin基因全长为4529bp;根据omspindlin基因全长序列,利用orf finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测该基因的开放阅读框orf长726bp(seq id no.2所示),编码241个氨基酸(seq id no.3所示)。本发明虹鳟spindlin蛋白的氨基酸序列系统进化树如图1所示。
27.步骤一、虹鳟肝脏组织总rna提取方法为:
28.(1)匀浆处理:将肝脏组织在液氮中磨碎,每100mg加入1ml trizol并反复震荡,样品体积不超过trizol体积的10%;
29.(2)将匀浆样品在室温放置10min,目的使核酸与蛋白复合物完全分离;
30.(3)4℃、10000g条件下离心10min,取上清液体加入新的ep管中;
31.(4)向上清液体中加入200μl氯仿,剧烈震荡30s,冰上放置5min;
32.(5)4℃、10000g条件下离心15min,之后将上清水相液体转移到新的ep管中;
33.(6)向上清水相液体中加入500μl异丙醇,冰上放置10min;
34.(7)4℃、10000g条件下离心10min,离心后的ep管底会出现白色沉淀;
35.(8)加入1ml 75%乙醇,洗涤沉淀,4℃、7000g离心10min,弃上清,注意保留沉淀(rna);
36.(9)室温放置干燥rna沉淀,约10min之后加入30μl rnase
‑
free水,将rna沉淀溶解;
37.(10)计算rna分子完整性(rna integrity number,rin),只有rin值在8到10之间的样品可用于后续实验,保存于
‑
80℃。
38.rna反转录cdna:操作步骤参照反转abi试剂盒k1622 revertaidtm first strand cdna synthesis kit;
39.反转体系为:
[0040][0041]
反转录pcr程序为:
[0042]
25℃10min
[0043]
37℃120min
[0044]
85℃5min
[0045]
反转录之后的cdna,分装好保存于
‑
20℃中,尽量避免反复冻融。
[0046]
实施例2
[0047]
实施例1步骤二中以虹鳟cdna为模板,进行pcr扩增,胶回收,pcr产物连接到pmd
‑
18t,转化大肠杆菌后测序中
[0048]
cdna pcr扩增反应体系为:
[0049][0050]
cdna pcr反应程序:94℃预变性5min;94℃变性30s、60℃退火30s、72℃延伸1min;35个循环;最后72℃延伸10min;4℃保存备用。
[0051]
反应产物进行琼脂糖凝胶电泳,110v、40min。凝胶成像系统,拍照后,对目的条带(726bp)进行切胶。
[0052]
胶回收操作步骤如下:
[0053]
(1)切取琼脂糖凝胶中的目的dna条带,放入干净的离心管中称重(0.1g=100μl);
[0054]
(2)加入3倍体积溶液gsb,于55℃水浴中溶胶约10分钟,2分钟间断混合,当胶块完
全融化后,观察溶液的颜色,若颜色为紫色,加入3m醋酸钠,调整颜色为gsb相同的黄色;
[0055]
(3)待融化的凝胶溶液降至室温,加入离心柱中静置1分钟,1000g离心1分钟,弃出废液;
[0056]
(4)加入650μl wb溶液,1000g离心1min,弃出废液;
[0057]
(5)1000g空离2min,弃出残留的废液;
[0058]
(6)将离心管柱置于一干净的离心管中,开盖静置1min,在柱的中央加入30μl提前55℃水浴预热的去离子水,室温静置1min;
[0059]
(7)1000g离心1min,洗脱纯化的dna,用于后续实验。
[0060]
pcr产物与pmd
‑
18t载体连接体系为:
[0061][0062]
连接条件为:16℃,30min。
[0063]
连接产物转化大肠杆菌感受态细胞操作步骤如下:
[0064]
(1)将250μl感受态细胞dh5α于冰上熔解2
‑
3min;
[0065]
(2)将10μl连接产物缓慢打入到感受态细胞中,冰上静置30min;
[0066]
(3)42℃热激90s,冰上静止2min;
[0067]
(4)加入500μl lb液体培养基,37℃下160rpm振荡培养60min;
[0068]
5000rpm离心1min收菌,去除500μl上清,剩余上清用于悬浮菌体,将重悬后的菌液涂布在含有amp抗生素的琼脂平板培养基上,正置培养1h后倒置,37℃培养12
‑
16h。
[0069]
经测序本实施例虹鳟spindlin基因的核苷酸序列如seq id no.2中核苷酸序列所示。
[0070]
实施例3
[0071]
虹鳟spindlin基因在不同组织中的表达:
[0072]
(1)引物设计:引物序列为f:tgaggcctatttcaactcaagtca;r:gttgcagagttccatttcaatcca
[0073]
(2)rna提取和cdna的合成步骤同实施例1;
[0074]
(3)利用荧光定量pcr检测spindlin在虹鳟的卵巢、肾、肝、脾、肌、鳃、心、眼、肠、鳍组织中的表达;
[0075]
(4)数据分析。
[0076]
其中,荧光定量pcr反应体系及程序如下:
[0077][0078]
反应程序为:预变性95℃、10min;95℃、10s;60℃、30s;共计40个循环。
[0079]
本实施例采取各时期的二倍体和三倍体雌性虹鳟的10个部位:卵巢、肾、肝、脾、肌、鳃、心、眼、肠、鳍。其中,步骤(4)中数据分析方法如下:所有实验设置3个重复,利用bio
‑
rad cfx96 touch荧光定量仪的2
‑
δδct
法检测spindlin基因在各组织的相对表达情况,用软件spss 21.0进行差异显著性检验。结果如图2所示,结果表明omspindlin基因在卵巢、肾、肝、脾、肌、鳃、心、眼、肠、鳍等组织中均有表达。且omspindlin基因在卵巢组织中的表达明显高于其他各组织,达到极显著差异(p<0.01)。在其他组织如肾、肝、脾、肌肉、鳃、眼、肠、鳍之间相对表达量差异不显著(p>0.05)。
[0080]
实施例4
[0081]
根据实施例1获得的虹鳟spindlin基因全长序列,设计实时荧光定量引物,以βactin作为内参,检测虹鳟spindlin基因在虹鳟中的组织表达特异性及在二、三倍体虹鳟卵巢组织不同发育时期的表达情况;其中虹鳟spindlin基因rt
‑
pcr的上游引物5
’‑
tgaggcctatttcaactcaagtca
‑3’
,虹鳟spindlin基因rt
‑
pcr的下游引物5
’‑
gttgcagagttccatttcaatcca
‑3’
,βactin上游引物5
’‑
ctacctgatgaagatcctgacgg
‑3’
,βactin下游引物5
’‑
cagcttctccttgatgtctcgta
‑3’
。
[0082]
数据分析,方法同实施例3。结果如图3所示,结果表明对于虹鳟雌性二倍体,在240
‑
330dpf发育阶段,240dpf表达量最高,是270dpf和240dpf的1.1和1.3倍;且在240dpf、270dpf、330dpf阶段之间差异不显著(p>0.05),但240dpf与300dpf差异显著(p<0.05)。对于虹鳟雌性三倍体,该基因在240
‑
330dpf阶段的表达量显著上升;240dpf表达量最低,与270dpf、300dpf和330dpf存在极显著差异(p<0.01),270dpf、300dpf和330dpf的表达量是240dpf的2.1、2.2和2.9倍。同一发育阶段中,spindlin基因在虹鳟雌性二倍体卵巢中的表达量较雌性虹鳟三倍体相对较高,且均存在极显著差异(p<0.01)。该结果表明三倍体虹鳟在减数分裂过程中出现异常与spindlin基因的低表达,该基因可作为二倍体和三倍体的鉴定基因。
[0083]
鉴别标准:在水温12℃条件下,240dpf被检测雌性虹鳟spindlin基因表达量显著低于0.65的确定为三倍体虹鳟。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1