门冬氨酸帕瑞肽及其中间体和其制备方法与流程
1.本发明涉及医药领域。具体地,本发明涉及门冬氨酸帕瑞肽的制备方法以及门冬氨酸帕瑞肽中间体及其制备方法。
背景技术:
2.库欣病(cushing’s disease)是垂体促肾上腺皮质激素(acth)腺瘤或acth细胞增生,分泌过多acth,引起肾上腺皮质增生,产生皮质醇增多症,导致一系列物质代谢紊乱和病理变化,临床上表现为库欣综合征(cushing’s syndrome),存在下丘脑-垂体-肾上腺轴机能紊乱,是一种耗竭性疾病,极少自行缓解,若不及时诊治,病死率高。
3.门冬氨酸帕瑞肽(pasireotide diaspartate),商品名为signifor,是一种多受体靶向生长抑素类似物,能够高亲和力结合5种促生长激素抑制素受体(ssts)亚型中的4种(sst1,2,3,5),阻止acth和gh的释放。在库欣病治疗中,通过抑制acth分泌,减少皮质醇的产生,降低尿游离皮质醇(ufc)和血清皮质醇的水平,从而缓解疾病症状。2012年4月25日首次由欧盟药品监管当局(ema)按照罕见病的相关法规批准上市,用于不能选择垂体手术或者手术没有治愈的成年库欣病患者,之后陆续在48个国家获准上市。
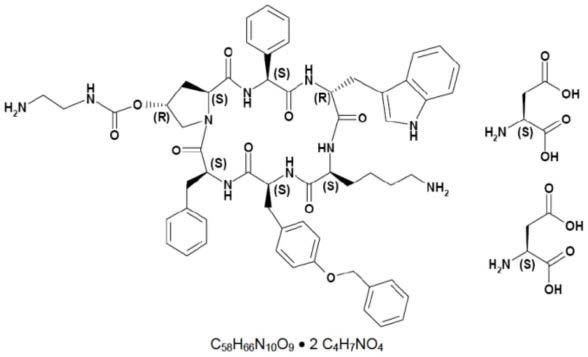
4.门冬氨酸帕瑞肽是一种环六肽生长抑素类似物,其结构式如下所示,是由帕瑞肽与门冬氨酸成盐所得。现有技术中,纯化存在收率低的问题,帕瑞肽(粗肽)纯化、成盐步骤的总收率低,造成帕瑞肽制备成本过高。
[0005][0006]
因此,提供一种提高帕瑞肽(粗肽)纯化、成盐收率的方法显得很有必要。
技术实现要素:
[0007]
本发明旨在至少在一定程度上解决现有技术中存在的技术问题至少之一。为此,本发明提出了中间体线性肽及其制备方法、制备帕瑞肽的方法、帕瑞肽的纯化方法和制备帕瑞肽盐的方法,该中间体线性肽制备得到的帕瑞肽(粗肽)纯度高,帕瑞肽(粗肽)纯化得到目标纯度帕瑞肽收率高。帕瑞肽与门冬氨酸可形成双分子门冬氨酸盐,成盐准确,门冬氨酸帕瑞肽中,tfa残留低于0.01%,整体制备方法操作简便、快捷、成本低,适于规模化生产。
[0008]
在本发明的一个方面,本发明提出了一种中间体线性肽。根据本发明的实施例,所述中间体线性肽具有如下序列:h-lys(r1)-tyr(4-bzl)-phe-(4-r
2-nh-c2h
4-nh-co-o)pro-phg-d-trp(r3)-oh,其中,r1、r2、r3为保护基。由此,所得帕瑞肽(粗肽)的纯度可高达90%以上,帕瑞肽(粗肽)纯化得到目标纯度帕瑞肽收率高。
[0009]
根据本发明的实施例,r1、r2、r3分别独立地选自boc、adpoc、iboc、poc、z(ome)、tmz、cbz或ddz。
[0010]
根据本发明的实施例,所述中间体线性肽具有如下序列:h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-oh。
[0011]
在本发明的另一个方面,本发明提出了一种制备前面所述中间体线性肽的方法。根据本发明的实施例,所述方法包括:以trp作为初始氨基酸,将被fmoc保护的所述初始氨基酸连接到固相载体上,脱除fmoc保护;重复如下步骤:加入被fmoc保护的氨基酸和偶联剂、脱除fmoc保护,得到h-lys(r1)-tyr(4-bzl)-phe-(4-r
2-nh-c2h
4-nh-co-o)pro-phg-d-trp(r3)-固相载体;切割所述h-lys(r1)-tyr(4-bzl)-phe-(4-r
2-nh-c2h
4-nh-co-o)pro-phg-d-trp(r3)-固相载体,得到所述中间体线性肽。
[0012]
采用多肽固相合成方法制备中间体线性肽的过程中,初始氨基酸设计为trp,按照trp
1-phg
2-hyp
3-phe
4-tyr
5-lys6的顺序(例如在连接有初始氨基酸的固相载体上依次偶联fmoc-phg-oh、fmoc-(4-r
2-nh-c2h
4-nh-co-o)pro-oh、fmoc-phe-oh、fmoc-tyr(bzl)-oh、fmoc-lys(r1)-oh)得到中间体线性肽,可以有效控制中间体线性肽在环化过程中羧基端差向异构化反应,降低差向异构化程度,所得帕瑞肽(粗肽)的纯度可高达90%以上,帕瑞肽(粗肽)纯化得到目标纯度帕瑞肽收率高。并且,该方法操作简便、快捷、成本低,适于规模化生产。
[0013]
根据本发明的实施例,所述固相载体选自2-氯三苯甲基氯树脂。
[0014]
根据本发明的实施例,所述2-氯三苯甲基氯树脂的替代度为0.6~1.2mmol/g。
[0015]
根据本发明的实施例,所述缩合剂选自dic和hobt。
[0016]
在本发明的又一方面,本发明提出了一种制备环化肽的方法。根据本发明的实施例,将前面所述中间体线性肽进行环化处理,得到所述环化肽。如前所述,本发明的中间体线性肽在环化过程中可以有效控制羧基端差向异构化反应,降低差向异构化程度。
[0017]
根据本发明的实施例,所述环化处理包括:步骤1):将环化剂溶于第一有机溶剂中,得到环化剂溶液;步骤2):将所述中间体线性肽溶于所述第一有机溶剂中,得到中间体线性肽溶液,将所述中间体线性肽溶液加入步骤1)所得到的环化剂溶液中进行反应,浓缩,得到所述环化肽。
[0018]
根据本发明的实施例,所述步骤2)中,控制中间体线性肽溶液的浓度为0.02~0.06mmol/l。
[0019]
根据本发明的实施例,所述步骤2)中,将所述中间体线性肽溶液滴入步骤1)所得到的环化剂溶液中。
[0020]
根据本发明的实施例,所述步骤2)中,控制所述中间体线性肽溶液的滴加速度为2~8ml/min。
[0021]
根据本发明的实施例,所述步骤2)中,控制所述中间体线性肽溶液的滴加温度及反应温度为20~30℃。
[0022]
根据本发明的实施例,所述步骤1)中,所述第一有机溶剂选自dmf和dcm中的一种或多种,优选dmf。
[0023]
在本发明的又一方面,本发明提出了一种制备帕瑞肽的方法。根据本发明的实施例,所述方法包括如下步骤:利用前面所述制备环化肽的方法制备环化肽;将所述环化肽与裂解剂进行裂解处理,得到裂解产物;将所述裂解产物与第二有机溶剂混合,纯化并收集沉淀,得到所述帕瑞肽。由此,以便脱除前面所得环化肽上的保护基,并纯化产物。所得帕瑞肽的纯度可高达90%以上,收率较高。
[0024]
根据本发明的实施例,含有所述环化肽与裂解剂的混合液中,控制所述环化肽的浓度为40~60mmol/l。
[0025]
根据本发明的实施例,所述裂解剂选自三氟乙酸、水和二氯甲烷的混合液。
[0026]
根据本发明的实施例,所述三氟乙酸、水和二氯甲烷的体积比为(85~95):(4~6):(4~6)。
[0027]
根据本发明的实施例,所述第二有机溶剂为冰乙醚。
[0028]
根据本发明的实施例,所述方法进一步包括:将所述帕瑞肽进行如下纯化处理:将所述帕瑞肽溶解于乙腈水溶液中,过滤,得到上样液;将所述上样液加入到液相色谱中,收集预定时间的馏分,得到纯化后的帕瑞肽。
[0029]
根据本发明的实施例,所述乙腈水溶液中乙腈浓度为20~30体积%。
[0030]
根据本发明的实施例,所述液相色谱所采用的色谱柱为c18柱;检测波长为220nm;采用梯度洗脱方式,其中,流动相a为0.05~0.2体积%的三氟乙酸水溶液,流动相b为乙腈。
[0031]
在本发明的又一方面,本发明提出了一种制备帕瑞肽盐的方法。根据本发明的实施例,所述方法包括:利用前面所述制备帕瑞肽的方法得到纯化后的帕瑞肽;将所述纯化后的帕瑞肽与酸进行成盐反应得到帕瑞肽盐,所述酸为门冬氨酸或双羟萘酸。
[0032]
根据本发明的实施例,所述酸为门冬氨酸,即,具体地,本发明提出了一种制备门冬氨酸帕瑞肽的方法,所述成盐处理包括:将所述纯化后的帕瑞肽在c18柱中先用乙腈和水进行洗脱,然后用第一洗脱液进行洗脱,洗脱后再用乙腈和水进行洗脱,最后用第二洗脱液进行梯度洗脱。
[0033]
根据本发明的实施例,所述第一洗脱液包括a相和b相,所述a相为门冬氨酸水溶液,所述b相为乙腈,所述门冬氨酸水溶液中门冬氨酸的浓度为0.05~0.2m,调节所述门冬氨酸水溶液的ph值为5~8,所述a相的含量为80~95体积%,所述b相的含量为5~20体积%。
[0034]
根据本发明的实施例,所述第二洗脱液包括a相和b相,所述a相为水,所述b相为乙腈。
[0035]
根据本发明的实施例,所述方法进一步包括:在所述成盐处理之后,将所得含有帕瑞肽盐的溶液进行冷冻干燥。
[0036]
在本发明的又一方面,本发明提出了前面所述的中间体线性肽在制备帕瑞肽或帕瑞肽盐中的用途。如前所述,本发明的中间体线性肽在环化过程中可以有效控制羧基端差向异构化反应,降低差向异构化程度,所得帕瑞肽(粗肽)的纯度可高达90%以上,帕瑞肽(粗肽)纯化得到目标纯度帕瑞肽收率高,进而,提高了帕瑞肽盐的收率。
[0037]
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变
得明显,或通过本发明的实践了解到。
附图说明
[0038]
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
[0039]
图1显示了根据本发明一个实施例的纯化后的帕瑞肽高效液相色谱图。
具体实施方式
[0040]
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
[0041]
需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
[0042]
本发明提出了中间体线性肽及其制备方法、制备环化肽的方法、制备帕瑞肽的方法、制备帕瑞肽盐的方法和中间体线性肽的用途,下面将分别对其进行详细描述。
[0043]
中间体线性肽
[0044]
在本发明的一个方面,本发明提出了一种中间体线性肽。根据本发明的实施例,所述中间体线性肽具有如下序列:h-lys(r1)-tyr(4-bzl)-phe-(4-r
2-nh-c2h
4-nh-co-o)pro-phg-d-trp(r3)-oh,其中,r1、r2、r3为保护基。发明人发现,以上序列的线性肽纯度高、消旋化率低,肽序列羧基端氨基酸为trp,环化过程中可以有效控制羧基端差向异构化反应,降低差向异构化程度,所得帕瑞肽(粗肽)的纯度可高达90%以上,帕瑞肽(粗肽)纯化过程收率较高。
[0045]
根据本发明的实施例,r1、r2、r3分别独立地选自boc、adpoc、iboc、poc、z(ome)、tmz、cbz或ddz。采用上述保护基均可以在反应过程中起到保护氨基酸的作用,在反应完毕之后,可以根据需要去除保护基,得到目的产物。所得帕瑞肽(粗肽)的纯度可高达90%以上,帕瑞肽(粗肽)纯化得到目标纯度帕瑞肽收率高。
[0046]
根据本发明的实施例,中间体线性肽具有如下序列:h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-oh。由此,所得帕瑞肽(粗肽)的纯度可高达90%以上,帕瑞肽(粗肽)纯化得到目标纯度帕瑞肽收率高。
[0047]
制备中间体线性肽的方法
[0048]
在本发明的另一方面,本发明提出了一种制备前面所述中间体线性肽的方法。根据本发明的实施例,该方法包括:以trp作为初始氨基酸,将被fmoc保护的所述初始氨基酸连接到固相载体上,脱除fmoc保护;重复如下步骤:加入被fmoc保护的氨基酸和偶联剂、脱除fmoc保护,得到h-lys(r1)-tyr(4-bzl)-phe-(4-r
2-nh-c2h
4-nh-co-o)pro-phg-d-trp(r3)-固相载体;切割所述h-lys(r1)-tyr(4-bzl)-phe-(4-r
2-nh-c2h
4-nh-co-o)pro-phg-d-trp(r3)-固相载体,得到所述中间体线性肽。
[0049]
采用多肽固相合成方法制备中间体线性肽的过程中,初始氨基酸设计为trp,按照trp
1-phg
2-hyp
3-phe
4-tyr
5-lys6的顺序偶联氨基酸,所得到的中间体线性肽在环化过程中
可以有效地降低羧基端差向异构化的发生,所得帕瑞肽(粗肽)的纯度可高达90%以上,帕瑞肽(粗肽)纯化得到目标纯度帕瑞肽收率高。并且,该方法操作简便、快捷、成本低,适于规模化生产。
[0050]
根据本发明的实施例,固相载体选自2-氯三苯甲基氯树脂。由此,以便提高固相合成效率。
[0051]
根据本发明的实施例,2-氯三苯甲基氯树脂的替代度为0.6~1.2mmol/g。采用0.6~1.2mmol/g替代度的2-氯三苯甲基氯树脂,可以有效地提高合成效率,所得目标多肽的收率高、纯度高。
[0052]
制备环化肽的方法
[0053]
在本发明的又一方面,本发明提出了一种制备环化肽的方法。根据本发明的实施例,该方法包括:将前面所述中间体线性肽进行环化处理,得到环化肽。如前所述,本发明的中间体线性肽在环化过程中可以有效控制羧基端差向异构化反应,降低差向异构化程度,所得帕瑞肽(粗肽)的纯度可高达90%以上,帕瑞肽(粗肽)纯化得到目标纯度帕瑞肽收率高。
[0054]
根据本发明的实施例,环化处理包括:步骤1):将环化剂溶于第一有机溶剂中,得到环化剂溶液;步骤2):将中间体线性肽溶于第一有机溶剂中,得到中间体线性肽溶液,将中间体线性肽溶液加入步骤1)所得到的环化剂溶液中进行反应,浓缩,得到环化肽。在环化剂的作用下,可以使中间体线性肽环化形成环化肽。
[0055]
根据本发明的实施例,步骤2)中,控制中间体线性肽溶液的浓度为0.02~0.06mmol/l。由此,以便提高环化效率,环化肽收率较高。
[0056]
根据本发明的实施例,步骤2)中,将中间体线性肽溶液滴入步骤1)所得到的环化剂溶液中。由此,以便提高环化效率,环化肽收率较高。
[0057]
根据本发明的实施例,步骤2)中,控制中间体线性肽溶液的滴加速度为2~8ml/min。由此,以便提高环化效率,环化肽收率较高。
[0058]
根据本发明的实施例,步骤2)中,控制中间体线性肽溶液的滴加温度及反应温度为20~30℃。
[0059]
根据本发明的实施例,第一有机溶剂选自dmf和dcm中的一种或多种,优选dmf。由此,以便溶解环化剂和中间体线性肽。
[0060]
需要说明的是,前面针对中间体线性肽所描述的特征和优点,同样适用于该制备环化肽的方法,在此不再赘述。
[0061]
制备帕瑞肽的方法
[0062]
在本发明的又一方面,本发明提出了一种制备帕瑞肽的方法。根据本发明的实施例,该方法包括如下步骤:利用前面所述制备环化肽的方法制备环化肽;将所述环化肽与裂解剂进行裂解处理,得到裂解产物;将所述裂解产物与第二有机溶剂混合,纯化并收集沉淀,得到所述帕瑞肽。在裂解剂的作用下除去保护基,再用第二有机溶剂使目标环化肽沉淀,以达到纯化收集的目的。
[0063]
根据本发明的实施例,含有环化肽与裂解剂的混合液中,控制浓缩物的浓度为40~60mmol/l。由此,可以有效地除去保护基。
[0064]
根据本发明的实施例,裂解剂选自三氟乙酸、水和二氯甲烷的混合液,优选地,所
述三氟乙酸、水和二氯甲烷的体积比为(85~95):(4~6):(4~6)。由此,可以有效地除去保护基。
[0065]
根据本发明的实施例,第二有机溶剂为冰乙醚。由此,以便沉淀环化肽。
[0066]
根据本发明的实施例,该方法进一步包括:将所述帕瑞肽进行如下纯化处理:将所述帕瑞肽溶解于乙腈水溶液中,过滤,得到上样液;将上样液加入到液相色谱中,收集预定时间的馏分,得到纯化后的帕瑞肽。由此,以便于对帕瑞肽(粗肽)进行纯化,提高产品的纯度。
[0067]
根据本发明的实施例,乙腈水溶液中乙腈浓度为20~30体积%。由此,以便于溶解帕瑞肽,进而便于后续上样,不影响液相色谱分离。
[0068]
根据本发明的实施例,液相色谱所采用的色谱柱为c18柱;检测波长为220nm;采用梯度洗脱方式,其中,流动相a为0.05~0.2体积%的三氟乙酸水溶液,流动相b为乙腈。由此,可以充分分离目标帕瑞肽,避免其他杂质干扰,收集的帕瑞肽纯度高,纯化过程收率高。
[0069]
需要说明的是,前面针对制备环化肽的方法所描述的特征和优点,同样适用于该制备帕瑞肽的方法,在此不再赘述。
[0070]
制备帕瑞肽盐的方法
[0071]
在本发明的又一方面,本发明提出了一种制备帕瑞肽盐的方法。根据本发明的实施例,该方法包括:利用前面所述制备帕瑞肽的方法得到纯化后的帕瑞肽;将所述纯化后的帕瑞肽与酸进行成盐反应得到帕瑞肽盐,所述酸为门冬氨酸或双羟萘酸。
[0072]
根据本发明的实施例,酸为门冬氨酸。即,本发明还提出了一种制备门冬氨酸帕瑞肽的方法。成盐处理包括:将所述纯化后的帕瑞肽在c18柱中先用乙腈和水进行洗脱,然后用第一洗脱液进行洗脱,洗脱后再用乙腈和水进行洗脱,最后用第二洗脱液进行梯度洗脱。
[0073]
在环化肽与裂解剂反应制备帕瑞肽过程中,三氟乙酸(裂解剂)会与环化肽形成盐,而三氟乙酸在临床使用中存在毒性,其会影响产品品质。进而,先用乙腈和水洗脱除去杂质,再用门冬氨酸水溶液与乙腈的混合液进行洗脱,以替换下与环化肽成盐的三氟乙酸,然后,再用乙腈和水洗脱除去杂质。可以通过液相色谱检测经上述处理所得帕瑞肽盐的含量。
[0074]
根据本发明的实施例,第一洗脱液包括a相和b相,a相为门冬氨酸水溶液,b相为乙腈,门冬氨酸水溶液中门冬氨酸的浓度为0.05~0.2m,调节门冬氨酸水溶液的ph值为5~8,a相的含量为80~95体积%,b相的含量为5~20体积%,第二洗脱液包括a相和b相,所述a相为水,所述b相为乙腈。由此,可以充分替换下与帕瑞肽成盐的三氟乙酸,几乎完全除去三氟乙酸,成盐准确,盐收率高、均一性好。
[0075]
采用成盐处理方法,几乎可以完全除去三氟乙酸,tfa残留明显低于ich q3a中低于0.2%的要求。另外门冬氨酸帕瑞肽中门冬氨酸含量为19.67wt%-20.07wt%,产品均一性好,成盐准确。
[0076]
根据本发明的实施例,方法进一步包括:在成盐处理之后,将所得含有帕瑞肽盐的溶液进行冷冻干燥。由此,便于保存。
[0077]
需要说明的是,前面针对制备帕瑞肽的方法所描述的特征和优点,同样适用于该制备帕瑞肽盐的方法,在此不再赘述。
[0078]
用途
[0079]
在本发明的又一方面,本发明提出了前面所述中间体线性肽在制备帕瑞肽或帕瑞肽盐中的用途。如前所述,本发明的中间体线性肽在环化过程中可以有效控制羧基端差向异构化反应,降低差向异构化程度,所得帕瑞肽(粗肽)的纯度可高达90%以上,帕瑞肽(粗肽)纯化得到目标纯度帕瑞肽收率高,进而,提高了帕瑞肽盐的收率。
[0080]
有益效果:
[0081]
本发明的中间体线性肽在环化时可以有效降低羧基端差向异构化的发生,所得帕瑞肽(粗肽)纯度达90%以上,帕瑞肽(粗肽)纯化过程收率高,成盐收率高,进而可以降低工艺成本。所得门冬氨酸帕瑞肽中,门冬氨酸(asp)含量为20wt%左右,成盐准确,所得门冬氨酸帕瑞肽均一性好。在帕瑞肽成盐后,所得门冬氨酸帕瑞肽中几乎无反离子三氟乙酸残留,几乎无乙腈残留。
[0082]
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0083]
实施例1fmoc-d-trp(boc)-ctc resin的制备
[0084]
实验组1
[0085]
称取替代度为0.6-0.8mmol/g的2-chlorotrityl chloride resin,dcm溶胀处理30min,以dcm、dmf进行洗涤抽干。称取fmoc-d-trp(boc)-oh(2eq)溶于dmf溶液,二异丙基乙胺(dipea,3eq)活化10min后,于室温条件下反应60min。抽滤,树脂依次用dmf清洗3次,加入甲醇液封闭反应8h。dmf洗涤6次,甲醇收缩后抽干,真空干燥得fmoc-d-trp(boc)-ctc resin,检测取代度为0.585mmol/g。
[0086]
实验组2
[0087]
称取替代度为0.8-1.0mmol/g的2-chlorotrityl chloride resin,dcm溶胀处理30min,以dcm、dmf进行洗涤抽干。称取fmoc-d-trp(boc)-oh(2eq)溶于dmf溶液,二异丙基乙胺(dipea,3eq)活化10min后,于室温条件下反应60min。抽滤,树脂依次用dmf清洗3次,加入甲醇液封闭反应8h。dmf洗涤6次,甲醇收缩后抽干,真空干燥得fmoc-d-trp(boc)-ctc resin,检测取代度为0.446mmol/g。
[0088]
实验组3
[0089]
称取替代度为1.0-1.2mmol/g的2-chlorotrityl chloride resin,dcm溶胀处理30min,以dcm、dmf进行洗涤抽干。称取fmoc-d-trp(boc)-oh(2eq)溶于dmf溶液,二异丙基乙胺(dipea,3eq)活化10min后,于室温条件下反应60min。抽滤,树脂依次用dmf清洗3次,加入甲醇液封闭反应8h。dmf洗涤6次,甲醇收缩后抽干,真空干燥得fmoc-d-trp(boc)-ctc resin,检测取代度为0.452mmol/g。
[0090]
实施例2
[0091]
h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-ctc resin的制备
[0092]
步骤1):将实施例1实验组1得到的替代度为0.585mmol/g的fmoc-d-trp(boc)-ctc resin,用dmf洗涤3次,用dmf溶胀树脂30分钟后,抽干dmf。加入20%哌啶/dmf溶液处理25min,脱除fmoc,抽干反应液,然后用dmf洗涤树脂6次。
[0093]
步骤2):称取fmoc-phg-oh(3eq)、dic(3eq)、hobt(3eq)溶于dmf中,然后加入上述树脂中,室温下偶联反应90min,以茚三酮法监测判断反应终点,如果树脂无色透明,则表示反应完全;树脂显色,则表示反应不完全,需要继续偶联反应,此判断标准适用于后续内容中茚三酮法检测判断反应终点。根据标准操作方法,脱除fmoc保护后加入相应氨基酸偶联的步骤,依次偶联fmoc-(4-boc-nh-c2h
4-nh-co-o)pro-oh、fmoc-phe-oh、fmoc-tyr(bzl)-oh、fmoc-lys(boc)-oh得到fmoc-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-ctc resin。
[0094]
步骤3):最后将步骤2)所得树脂肽进行fmoc脱除,洗涤后甲醇收缩,树脂肽真空干燥,称重得h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-ctc resin。
[0095]
实施例3
[0096]
h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-oh的制备
[0097]
将实施例2制备的h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-ctc resin置于裂解反应器中,以10ml/g树脂的比例冰水浴下加入裂解试剂(1%tfa/dcm=95/5(v/v)),搅拌反应30min,转入室温搅拌1.5h。抽滤,收集滤液,树脂再用少量1%tfa洗涤3次,合并滤液后减压浓缩至干。收率为94.5%,hplc纯度为85%。[ms]:(mh+=1366)。
[0098]
实施例4
[0099]
cycle[lys-tyr(4-bzl)-phe-(4-nh
2-c2h
4-nh-co-o)pro-phg-d-trp]+tfa制备
[0100]
实验组1
[0101]
称取pybop(1.5eq)、diepa(3eq)溶于适量无水dmf加入反应器中,将实施例3得到的h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-oh溶于无水dmf中,加至反应器中。控制温度为25℃,搅拌反应至完全,将反应液浓缩至干,得到环化肽,将环化肽转移至裂解反应器中,冰水浴下加入三氟乙酸(tfa)/tis/水/dcm=85/5/5/5(v/v/v/v),室温搅拌反应2h。加入8~14eq冰乙醚沉降1h,有大量白色析出物,将析出物离心3次并收集,真空干燥后得白色固体,为帕瑞肽(粗肽),hplc纯度为90.4%。
[0102]
实验组2
[0103]
称取pybop(2eq)、diepa(3eq)溶于适量无水dmf加入反应器中,将实施例3得到的h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-oh溶于无水dmf中,分别控制线性肽浓度为0.02、0.04、0.06、0.08mmol/l,加入反应器中。控制温度为25℃,搅拌反应至完全,将反应液浓缩至干,得到环化肽,将环化肽转移至裂解反应器中,冰水浴下加入tfa/tis/水/dcm=85/5/5/5(v/v/v/v),室温搅拌反应2h。加入8~14eq冰乙醚沉降1h,有大量白色析出物,将析出物离心3次并收集,真空干燥后得白色固体,为帕瑞肽(粗肽),不同浓度线性肽下帕瑞肽(粗肽)hplc纯度如表1所示。可以看出,采用浓度为0.02~0.06mmol/l的线性肽进行环化,所得帕瑞肽(粗肽)的纯度较高,若线性肽浓度过高,会导致帕瑞肽(粗肽)纯度降低。
[0104]
表1不同浓度线性肽对帕瑞肽(粗肽)纯度影响
[0105]
序号控制线性肽浓度帕瑞肽(粗肽)纯度(%)
10.02mmol/l91.220.04mmol/l91.830.06mmol/l91.340.08mmol/l90.3
[0106]
实验组3
[0107]
称取pybop(2eq)、diepa(3eq)溶于适量无水dmf加入反应器中,将实施例3得到的h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-oh溶于无水dmf中,控制线性肽浓度为0.04mmol/l,分两点滴加入反应器中,控制滴速为2、4、8、10ml/min。控制温度为25℃,搅拌反应至完全,将反应液浓缩至干,得到环化肽,将环化肽转移至裂解反应器中,冰水浴下加入tfa/tis/水/dcm=85/5/5/5(v/v/v/v),室温搅拌反应2h。加入8-14eq冰乙醚沉降1h,有大量白色析出物,将析出物离心3次并收集,真空干燥后得白色固体,为帕瑞肽(粗肽),不同滴速下帕瑞肽(粗肽)的hplc纯度如表2所示。可以看出,采用滴速为2~8ml/min,所得帕瑞肽(粗肽)的纯度较高,若滴速过快,会导致帕瑞肽(粗肽)纯度降低。
[0108]
表2不同滴速对帕瑞肽(粗肽)纯度影响
[0109][0110][0111]
实验组4
[0112]
称取pybop(2eq)、diepa(3eq)溶于适量无水dmf加入反应器中,将实施例3得到的h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-oh溶于无水dmf中,控制线性肽浓度为0.04mmol/l,分两点滴加入反应器中,控制滴速为4ml/min。控制温度为25℃,搅拌反应至完全,将反应液浓缩至干,得到环化肽,将环化肽转移至裂解反应器中,冰水浴下加入tfa/水/dcm=90/5/5(v/v/v),分别控制环化肽浓度为40、50、60、80mmol/l搅拌反应为30min。加入8~14eq冰乙醚沉降1h,有大量白色析出物,将析出物离心3次并收集,真空干燥后得白色固体,为帕瑞肽(粗肽),不同环化肽溶液浓度下帕瑞肽(粗肽)hplc纯度如表3所示。可以看出,采用环化肽溶液浓度为40~60mmol/l,所得帕瑞肽(粗肽)的纯度较高,若浓度过高,会导致帕瑞肽(粗肽)纯度降低。
[0113]
表3不同环化肽溶液浓度对帕瑞肽(粗肽)纯度影响
[0114][0115]
对比组1
[0116]
变换起始氨基酸,以实施例1实验组1、实施例2、实施例3方法制备得到h-phg-dtrp(boc)-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-oh,以得到的线性肽h-phg-dtrp(boc)-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-oh作为线性肽按实施例4实验组1的方法环化、去保护基,得到cycle[phg-d-trp-lys-tyr(4-bzl)-phe-(4-nh
2-c2h
4-nh-co-o)pro]+tfa,纯度为86.3%。
[0117]
对比组2
[0118]
变换起始氨基酸,以实施例1实验组1、实施例2、实施例3方法制备得到h-tyr(4-bzl)-phe-pro(4-boc-nh-c2h
4-nh-co-o)-phg-d-trp(boc)-lys(boc)-oh,该线性肽phg易产生缺失肽,以得到的线性肽h-tyr(4-bzl)-phe-pro(4-boc-nh-c2h
4-nh-co-o)-phg-d-trp(boc)-lys(boc)-oh按实施例4实验组1的方法环化、去保护基,得到cycle[tyr(4-bzl)-phe-pro(4-nh
2-c2h
4-nh-co-o)-phg-d-trp-lys]+tfa,纯度为70.5%。
[0119]
对比组3
[0120]
变换起始氨基酸,以实施例1实验组1、实施例2、实施例3方法制备得到h-phe-pro(4-boc-nh-c2h
4-nh-co-o)-phg-dtrp(boc)-lys(boc)-tyr(bzl)-oh,以得到的线性肽h-phe-pro(4-boc-nh-c2h
4-nh-co-o)-phg-dtrp(boc)-lys(boc)-tyr(bzl)-oh按实施例4实验组1的方法环化、去保护基,得到cycle[phe-pro(4-nh
2-c2h
4-nh-co-o)-phg-d-trp-lys-tyr(bzl)],纯度为79.4%。
[0121]
由实验组1、对比组1~3对比可知,当使用h-lys(boc)-tyr(4-bzl)-phe-(4-boc-nh-c2h
4-nh-co-o)pro-phg-d-trp(boc)-oh作为线性肽时,帕瑞肽(粗肽)纯度显著提升。
[0122]
表4帕瑞肽(粗肽)纯度
[0123][0124]
实施例5帕瑞肽的纯化
[0125]
实验组1
[0126]
步骤1)称取适量的实施例4实验组4第二组(50mmol/l)制备得到的帕瑞肽(粗肽),用纯乙腈/纯化水=25%/75%(v/v)的比例的溶液将帕瑞肽粗品溶解至20-30mg/ml,0.45um的有机滤膜过滤。
[0127]
步骤2)采用rp-hplc系统,daisogel c18-10-120a,50
×
250mm,波长220nm,流动相:a相:0.1%三氟乙酸水溶液/b相:acn,梯度洗脱;收集目标馏分,得纯化后的帕瑞肽(色谱图参见图1),收率为94.9%,纯度大于99.5%,最大单杂低于0.1%。
[0128]
实验组2
[0129]
称取实施例4实验组1制备得到的帕瑞肽(粗肽),按实验组1纯化方法纯化,得纯化后的帕瑞肽,收率为80.1%,纯度大于99.5%,最大单杂低于0.1%。
[0130]
对比组1
[0131]
称取实施例4对比组1制备得到的帕瑞肽(粗肽),按实验组1纯化方法纯化,得纯化后的帕瑞肽,收率为63.4%,纯度大于99.5%,最大单杂低于0.1%。
[0132]
表5纯化后的帕瑞肽评价
[0133]
序号纯化过程收率纯度最大单杂实验组194.9%大于99.5%低于0.1%实验组280.1%大于99.5%低于0.1%对比组163.4%大于99.5%低于0.1%
[0134]
实施例6门冬氨酸帕瑞肽的制备
[0135]
实验组1
[0136]
步骤1)将实施例5所得的合格品,在实施例5实验组1的rp-hplc系统上,用95%h2o/5%acn冲洗30min;然后用90%(0.05m asp水溶液,调节ph至5.5)/10%acn洗脱40min;再用95%h2o/5%acn冲洗40min;最后用70~10%h2o/30~90%acn梯度反向洗脱60min;进行成盐处理;
[0137]
步骤2)将成盐溶液进行冻干处理;
[0138]
步骤3)检测冻干后样品的溶残、盐含量、水分。
[0139]
检测冻干后样品的tfa残留为0.004%,乙腈残留为0.0086%,asp含量为20.27%,水分含量为3.646%。纯度大于99.5%,最大单杂低于0.1%,收率为91.3%。
[0140]
实验组2
[0141]
步骤1)将实施例5所得的合格品,用97%h2o/3%acn冲洗15min;然后用95%(0.1m asp水溶液,调节ph至6.0)/5%acn洗脱40min;再用97%h2o/3%acn冲洗40min,最后70~10%h2o/30~90%acn梯度反向洗脱60min;进行成盐处理;
[0142]
步骤2)将成盐溶液进行冻干处理;
[0143]
步骤3)检测冻干后样品的溶残、盐含量、水分。
[0144]
检测冻干后样品的tfa残留为0.003%,乙腈残留为0.005%,asp含量为20.07%,水分含量为3.84%。纯度大于99.5%,最大单杂低于0.1%,收率为89.9%。
[0145]
实验组3
[0146]
步骤1)将实施例5所得的合格品,用98%h2o/2%acn冲洗25min;然后用99%(0.2m asp水溶液,调节ph至8.0)/1%acn洗脱40min;再用98%h2o/2%acn冲洗40min,最后70~
10%h2o/30~90%acn梯度反向洗脱60min;进行成盐处理;
[0147]
步骤2)将成盐溶液进行冻干处理;
[0148]
步骤3)检测冻干后样品的溶残、盐含量、水分。
[0149]
检测冻干后样品的tfa残留为0.005%,乙腈残留为0.012%,asp含量为19.80%,水分含量为4.03%。纯度大于99.5%,最大单杂低于0.1%,收率为87.6%。
[0150]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0151]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1