一种细菌蛋白赖氨酸去乙酰化修饰酶及其应用的制作方法
本发明涉及一种细菌蛋白赖氨酸去乙酰化修饰酶及其应用,属于生物技术领域。
背景技术:
蛋白翻译后修饰(ptm))广泛存在于自然界的生命体中,它极大地扩充和延伸了由dna直接编码转录形成的蛋白质局限的功能范围,在细胞分化、识别信号、新陈代谢生理过程中起着重要作用。自从1964年,allfrey等在组蛋白中首次发现蛋白赖氨酸乙酰化修饰以来,人们对赖氨酸乙酰化修饰开展了较为深入的研究。目前已知该修饰在多种生物中都有举足轻重的地位,可以参与染色质结构、转录复制、代谢、信号转导等多种重要的生物调节过程。
另一方面,蛋白需要特异的赖氨酸去乙酰化修饰酶对ptms蛋白的功能进行可逆调控。当前在真核生物中赖氨酸去乙酰化修饰酶的功能与种类的研究最为深入。在真核细胞中有四类的赖氨酸去乙酰修饰酶(kdacs),其中i,ii和iv型是zn2+依赖型kdacs,iii型的kdacs又称为sirtuins需要nad+辅助因子。而sirtuins又可以分为7种类型(sirt1-7),它们分布在细胞不同空间且可能还具有其他去酰基酶的活性。而细菌中的kdacs往往与真核细胞的kdacs具有同源性,主要包括zn2+依赖型rplda(与ii型同源)、zn2+依赖型acuc(与i型同源)以及nad+依赖型sirtuins(与iii型同源)家族蛋白。其中以大肠杆菌cobb及其家族蛋白为代表的sirtuins分布最广,其作用的底物蛋白研究也最为广泛,在多个细菌物种中均有发现,涉及到细菌毒力、趋化、生长代谢等多种重要生理功能的调控。2015年tu等在elife期刊上还报道大肠杆菌ycgc是一类不依赖于zn2+和nad+的新型去乙酰化修饰酶,2016年naturereviewsmicrobiology期刊将该发现推荐为研究热点,说明发现新去乙酰化修饰酶的重要性,但其蛋白功能还有待进一步证实。除此以外,目前尚未发现新的细菌蛋白赖氨酸去乙酰化修饰酶。
但是,不同物种中赖氨酸乙酰化修饰蛋白的数目从数百到数千个不等,涉及上千个修饰位点,参与众多的生理功能与复杂的环境响应,理论上不大可能只由一个或者少数几个去乙酰化修饰酶来调控,但目前已知的细菌去乙酰化修饰酶种类明显与乙酰基化修饰蛋白的规模相差太多,细菌内很可能还有一些未知的kdacs对特异的蛋白底物起作用以维持细胞的正常生理功能。因此,寻找新的细菌蛋白赖氨酸去乙酰化修饰酶及其功能,是当前生物大分子修饰领域一个重要研究内容之一。
技术实现要素:
本发明目的在于一种细菌蛋白赖氨酸去乙酰化修饰酶及其应用。该蛋白不需要依赖zn2+与nad+辅助就可以显著的去除bsa乙酰化修饰,且与目前已知的去乙酰化修饰酶没有明显的同源性,是新的去乙酰基化酶家族蛋白家族。
一种细菌蛋白赖氨酸去乙酰化修饰酶为a0ki27,其氨基酸序列如seqidno.1所示。于嗜水气单胞菌atcc7966中发现,其基因编码为aha_1389。
seqidno.1:mivwtvanqkggvgktttvvslagilaqrgqrvllidtdphasltsyldfdsdrldgtlyelfqavkptaelvnkltlrtkfdnihllpasitlatldrvmgnregmglvlkrallriqdqydyvlidcppvlgvmmvnalaacdrilvpvqteflalkglermmktfeimqrskrekfrytviptmfdkrtraslmtlqsikeqhgnavwnavipidtkfrdasllhippsiyspssrgtyayetllnyldaqerqrahevts。
编码所述的细菌蛋白赖氨酸去乙酰化修饰酶的基因,所述基因序列如seqidno.2所示。
seqidno.2:gtgattgtttggacggttgccaaccaaaagggtggggtcggtaaaaccaccacagtggtctcgctggccggtattctggcccagcgcggccagcgggtgctgttgattgacaccgaccctcatgcctccctgacctcttatctcgattttgattccgaccggctggatggcactctttatgagctgtttcaggcggtcaaaccaacggcagagctcgtcaataaactgacgctgcgcaccaagtttgacaacattcatctgctgcccgcgtcaatcaccctggcgaccctggatcgggtaatgggcaatcgggaagggatgggacttgtgctcaagcgagcgttgctgcgcattcaggatcagtacgattatgtgctgatcgactgcccgcccgtcttgggggtcatgatggtcaatgcgctggcggcgtgtgaccggatcctggtgccggtacagaccgagtttctggcgctcaaagggctggagcggatgatgaagacgtttgaaatcatgcagcgctccaagcgggagaagttccgttataccgtcattcccaccatgtttgacaagcgaacccgtgcctcgctgatgactctgcagtccatcaaggagcagcacggcaatgcggtatggaatgccgtcatacccatagataccaaattccgggatgccagtttgcttcacattcccccctccatctattcgccgagcagccgtggcacctatgcctatgagaccctgctcaactatcttgatgcgcaagagcgtcagcgtgctcatgaggtaacatcatga。
所述的细菌蛋白赖氨酸去乙酰化修饰酶在赖氨酸去乙酰化修饰中的应用。
本发明的优点在于:
该蛋白不需要依赖zn2+与nad+辅助就可以显著的去除bsa乙酰化修饰,且与目前已知的去乙酰化修饰酶没有明显的同源性,是新的去乙酰基化酶家族蛋白家族。进一步完善了人们对蛋白修饰认识,对细菌复杂生理功能的研究起到了推动作用,有利于细菌的防治。
附图说明
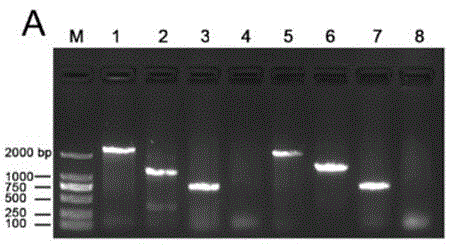
图1是具体实施方式中aha_1389基因缺失菌株的构建;(a)为cobb(771bp)和aha_1389(792bp)缺失菌株的pcr验证。泳道1与2分别以wt和δcobb为模板,扩增cobb基因上下游各约500bp片段;泳道3与4分别以wt和δahcobb为模板,扩增cobb基因片段;泳道5-8与前面顺序一样,扩增aha_1389目的片段。泳道2和6的pcr产物送公司测序验证符合预计,可见目的基因已成功敲除。
图2纯化所得嗜水气单胞菌cobb和a0ki27蛋白。a和b分别为镍柱纯化的6xhis标签cobb和a0ki27蛋白。
图3doltblotting验证嗜水气单胞菌cobb和aha_1389缺失后导致蛋白乙酰修饰水平升高。表示在δcobb、δaha_1389和野生型嗜水气单胞菌不同蛋白稀释梯度下,乙酰修饰情况,上部分为pvdf膜g350染色显示蛋白上样量,下部分为抗特异性ptm抗体的doltblotting结果。
图4嗜水气单胞菌cobb和aha_1389缺失菌株乙酰化修饰免疫印迹分析。分别为δcobb、δaha_1389和野生型嗜水气单胞菌全蛋白的sds-page考马斯亮蓝染色(a)以及抗乙酰化(b)的westernblotting结果。在上样量基本一致的情况下,δcobb和δaha_1389均显著提高这乙酰化修饰水平。
图5westernblotting验证体外乙酰化bsa;2个泳道分别为乙酰化抗体验证体外经处理的乙酰化bsa与未处理的bsa的免疫印迹实验。
图6是具体实施方式中去乙酰化修饰实验结果图;westernblotting实验显示嗜水气单胞菌a0ki27、ahcobb和乙酰化bsa在nad+下孵育后,其bsa乙酰化修饰变化情况。图上部分为各种样品在不同处理下在乙酰化修饰水平,图下部分为其pvdf膜的g350染色,显示样品的上样量基本一致,以上结果重复至少3次。
图7结构域比较分析图,其中显示嗜水气单胞菌cobb和a0ki27蛋白属于不同的蛋白家族;嗜水气单胞菌cobb属于sirtuin蛋白家族,而a0ki27与其他物种的染色体分裂atpase、维生素b12合成蛋白、质粒分配蛋白等蛋白同源,均具有一个属于p-loop_ntpase的aaa_31pfam。
具体实施方式
实施例1
1、材料方法
实验材料本实验所需的载体pet-32a(+)、pre112、嗜水气单胞菌atcc7966为本实验室保存,酶购买自thermo公司,大肠杆菌bl21感受态细胞购买于全式金生物技术有限公司;胶回收试剂盒和质粒提取试剂盒购自omega公司;抗体购自ptmbiolabs公司,其他相关试剂购自sigma公司,引物由福州博尚生物公司合成。
2、实验步骤
2.1基因缺失菌株构建
根据嗜水气单胞菌atcc7966的全基因组序列,分别取目的基因a0ki27、cobb上下游各500bp左右片段,设上游片段两端引物分别为其对应的p1、p2,下游片段两端引物分别为p3、p4,目的基因两端引物分别为p5、p6。另外在p1上游100bp左右片段设引物p7,同理在p4下游100bp左右片段设引物p8;接着,分别扩增出目的基因上下游各500bp片段,将片段利用无缝连接酶(c113-01/02,vazymebiotechco.ltd)连接到酶切好的pre112质粒上,转入mc1061感受态,挑取单克隆,37℃,200rpm摇菌,pcr(p1p4)验证,提质粒测序,-20℃保菌。
将上述步骤中的阳性质粒转入大肠杆菌s17-1感受态中,挑取单克隆,37℃,200rpm摇菌,pcr(p1p4)验证,-20℃保菌备用;下一步,将上述正确的s17-1菌与嗜水气单胞菌atcc7966分别摇至od1.0,再按4:1的比例混匀,4000rpm,离心5min,弃上清,加50μl新鲜lb培养基重悬,全部滴于放置在空白lb培养基的滤纸片(已灭菌)上,37℃静置培养18h;接下来,将上一步骤中含培养物的滤纸片取出,置于ep管内,取500μl新鲜lb反复清洗,将培养物完全清洗下来,弃去滤纸片,离心,弃上清。如此反复清洗2-3次,最后用500μl新鲜lb重悬沉淀,取100μl菌液涂于含氨苄(100μg/ml)和氯霉素(30μg/ml)抗性的lb平板上,挑取单克隆,30℃,200rpm摇菌,菌液pcr(p1p4),送测序,-20℃保菌备用;最后,取上一步验证正确的过夜菌株,稀释1000倍后,取100μl稀释后的菌液涂于含有20%蔗糖的lb平板上,挑取单克隆,30℃,200rpm摇4h,接着,取2μl菌液点在画有格子的氯霉素板上,选取在氯霉素板上不长的菌做pcr验证,送测序,稳定遗传,-80℃保菌备用。最终获得cobb缺失菌株及aha_1389基因缺失菌株。
结果如图1所示,泳道1与2分别以wt和δcobb(cobb缺失菌株)(2.1就是基因缺失的方法)为模板,扩增cobb基因上下游各约500bp片段;泳道3与4分别以wt和δcobb为模板,扩增cobb基因片段;泳道5-8与前面顺序一样,扩增aha_1389目的片段。泳道2和6的pcr产物送公司测序验证符合预计,可见目的基因已成功敲除。
2.2a0ki27蛋白纯化
以嗜水气单胞菌atcc7966总基因组为模板,用aha_1389和cobb基因引物分别进行pcr扩增。所得特异性片段与分别用hindiii和ecori进行双酶切的pet-32a质粒进行连接得到重组质粒,转化至e.colibl21感受态细胞中,涂布在lb(含100μg/mlamp.)平板上,37℃培养过夜。将挑取的阳性单克隆培养过夜。然后转移至200ml新鲜lb培养液(含100μg/mlamp)中,37℃,200rpm培养至od600=0.3-0.6,加入1mmol/liptg于16℃诱导菌株12h。然后在4℃、10000×g下离心,弃上清,并用磷酸盐缓冲液(pbs)洗涤两次,将菌体重悬于5mmol/l咪唑溶液中,进行超声破碎处理。离心后将上清通过ni-nta树脂柱进行纯化,sds-page检测所纯化条带(图2),并将获得的蛋白存放于-20℃。由图2可以看出纯化获得的目的蛋白条带单一,大小符合预期。
经过测序获得目的蛋白为a0ki27,其氨基酸序列如seqidno.1所示。
2.3dot-spot
将约10µg蛋白点样到pvdf膜上。将样品风干后,将膜用含5%bsa的tbst封闭4h,然后与抗赖氨酸乙酰基修饰抗体10µl(购自杭州景杰,(ptmbiolabsinc.,hangzhou,china))一起孵育过夜。接着,在tbs中清洗五遍后,将样品与含有3%bsa的小鼠抗体辣根过氧化物酶偶联的山羊抗兔抗体(comwin,beijing,china)(二抗)中孵育1h。使用claritywesternecl底物检测来自斑点印迹的膜,并在chemidocmp成像系统上通过imagelab软件(biorad)进行可视化。最后,用考马斯r-350对pvdf膜进行染色,以验证加载量是否相等。结果如图3所示,δcobb、δaha_1389的乙酰修饰水平较之野生型嗜水气单胞菌明显变强,这是由于缺少去乙酰化修饰的酶所导致的,该结果与蛋白功能相符。
2.4westernblotting
通过sds-page分离约20µg蛋白质样品,然后使用trans-blotturbotransfersystem(biorad)将其转移到pvdf膜上。接着,用含5%脱脂乳的pbs缓冲液封闭后,将膜与抗赖氨酸乙酰基修饰抗体(购自杭州景杰)在室温下孵育2小时,然后用pbst缓冲液洗涤3次,然后将膜与二抗在室温下孵育2h。最后,使用claritywesternecl底物(biorad)来检测蛋白印迹的膜,并在chemidocmp成像系统(biorad,hercules,ca,美国)上通过imagelab软件(biorad)进行可视化。最后,用考马斯r-350对pvdf膜进行染色,以验证上样量是否相等。结果由图4可以看出,在上样量基本一致的情况下,δcobb和δaha_1389均显著提高乙酰化修饰水平。说明该蛋白具有去乙酰化修饰的作用。
2.5制备乙酰化修饰bsa
称取1mgbsa溶于1ml0.1mna2co3中,在缓慢摇动的同时加入0.04g乙酸酐(反应总体积的4%)。接着,将上述溶液静置于室温(37℃)下孵育反应3小时。最后,向反应混合物中加入20µl1mtris以终止反应,wb验证后(图5),置于4℃备用。如图中所示,跟未经修饰处理的bsa相比,经处理后的bsa具有明显条带,表示修饰成功。
2.6a0ki27去乙酰化修饰功能验证
将1µg上述2.5中被修饰的bsa与0.2µga0ki27在150mmtris-hcl(ph8.0)、10mmmgcl2、0.5mmatp、0.25mmnad+和10%甘油中孵育,37℃静置4小时,然后进行westernblotting验证(图6)。实验显示在上样量一致的情况下,嗜水气单胞菌ahcobb在存在nad+的情况下,具有明显的去除bsa乙酰化修饰的效果,而a0ki27无论是否存在nad+都可以显著地去除乙酰化修饰,这显示其不需要依赖zn2+与nad+辅助,就可以去乙酰化修饰。
2.7生物信息学分析
通过ncbi的blast获取cobb和a0ki27相似性较高的蛋白家族序列,使用mega_7.0.14软件构建进化树,同时利用pfam数据库(https://pfam.xfam.org/)预测蛋白结构域,再使用在线软件itol(https://itol.embl.de/)生成图形(图7)。如图7所示,嗜水气单胞菌cobb属于sirtuin蛋白家族,而a0ki27与其他物种的染色体分裂atpase、维生素b12合成蛋白、质粒分配蛋白等蛋白同源,均具有一个属于p-loop_ntpase的aaa_31pfam。这表明本发明发现的a0ki27与目前已知的去乙酰化修饰酶没有明显的同源性,是新的去乙酰基化酶家族蛋白家族。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
sequencelisting
<110>福建农林大学
<120>一种细菌蛋白赖氨酸去乙酰化修饰酶及其应用
<130>22
<160>22
<170>patentinversion3.3
<210>1
<211>264
<212>prt
<213>人工序列
<400>1
metilevaltrpthrvalalaasnglnlysglyglyvalglylysthr
151015
thrthrvalvalserleualaglyileleualaglnargglyglnarg
202530
valleuleuileaspthraspprohisalaserleuthrsertyrleu
354045
asppheaspseraspargleuaspglythrleutyrgluleuphegln
505560
alavallysprothralagluleuvalasnlysleuthrleuargthr
65707580
lyspheaspasnilehisleuleuproalaserilethrleualathr
859095
leuaspargvalmetglyasnarggluglymetglyleuvalleulys
100105110
argalaleuleuargileglnaspglntyrasptyrvalleuileasp
115120125
cysproprovalleuglyvalmetmetvalasnalaleualaalacys
130135140
aspargileleuvalprovalglnthrglupheleualaleulysgly
145150155160
leugluargmetmetlysthrphegluilemetglnargserlysarg
165170175
glulyspheargtyrthrvalileprothrmetpheasplysargthr
180185190
argalaserleumetthrleuglnserilelysgluglnhisglyasn
195200205
alavaltrpasnalavalileproileaspthrlyspheargaspala
210215220
serleuleuhisileproproseriletyrserproserserarggly
225230235240
thrtyralatyrgluthrleuleuasntyrleuaspalaglngluarg
245250255
glnargalahisgluvalthrser
260
<210>2
<211>795
<212>dna
<213>人工序列
<400>2
gtgattgtttggacggttgccaaccaaaagggtggggtcggtaaaaccaccacagtggtc60
tcgctggccggtattctggcccagcgcggccagcgggtgctgttgattgacaccgaccct120
catgcctccctgacctcttatctcgattttgattccgaccggctggatggcactctttat180
gagctgtttcaggcggtcaaaccaacggcagagctcgtcaataaactgacgctgcgcacc240
aagtttgacaacattcatctgctgcccgcgtcaatcaccctggcgaccctggatcgggta300
atgggcaatcgggaagggatgggacttgtgctcaagcgagcgttgctgcgcattcaggat360
cagtacgattatgtgctgatcgactgcccgcccgtcttgggggtcatgatggtcaatgcg420
ctggcggcgtgtgaccggatcctggtgccggtacagaccgagtttctggcgctcaaaggg480
ctggagcggatgatgaagacgtttgaaatcatgcagcgctccaagcgggagaagttccgt540
tataccgtcattcccaccatgtttgacaagcgaacccgtgcctcgctgatgactctgcag600
tccatcaaggagcagcacggcaatgcggtatggaatgccgtcatacccatagataccaaa660
ttccgggatgccagtttgcttcacattcccccctccatctattcgccgagcagccgtggc720
acctatgcctatgagaccctgctcaactatcttgatgcgcaagagcgtcagcgtgctcat780
gaggtaacatcatga795
<210>3
<211>42
<212>dna
<213>人工序列
<400>3
cgatcccaagcttcttctagacttgggataggtggtgaacgg42
<210>4
<211>33
<212>dna
<213>人工序列
<400>4
ggaatcagtcgctattgtgcgactggacagttg33
<210>5
<211>34
<212>dna
<213>人工序列
<400>5
gcacaatagcgactgattccctctggctacttct34
<210>6
<211>41
<212>dna
<213>人工序列
<400>6
catgaattcccgggagagctcgcgagcagagcgtctacctg41
<210>7
<211>25
<212>dna
<213>人工序列
<400>7
tcagggaccgcgcatctccatccag25
<210>8
<211>25
<212>dna
<213>人工序列
<400>8
atggtgcagtcagcgaaacacatcg25
<210>9
<211>19
<212>dna
<213>人工序列
<400>9
gcaaccaacagcagtttgt19
<210>10
<211>13
<212>dna
<213>人工序列
<400>10
gccctgccgctga13
<210>11
<211>43
<212>dna
<213>人工序列
<400>11
catgaattcccgggagagctccgagctgagctcaggtctgttg43
<210>12
<211>26
<212>dna
<213>人工序列
<400>12
ctctgtatcaatcctgcctcgttgtt26
<210>13
<211>38
<212>dna
<213>人工序列
<400>13
gaggcaggattgatacagagataccacccaagttcggg38
<210>14
<211>39
<212>dna
<213>人工序列
<400>14
cgatcccaagcttcttctagactcggtcaacggcaccgc39
<210>15
<211>21
<212>dna
<213>人工序列
<400>15
gtgattgtttggacggttgcc21
<210>16
<211>23
<212>dna
<213>人工序列
<400>16
gatgttacctcatgagcacgctg23
<210>17
<211>25
<212>dna
<213>人工序列
<400>17
tgcagccacgcagcgacggtttgct25
<210>18
<211>25
<212>dna
<213>人工序列
<400>18
ggcgccatttgacctggtcacgatg25
<210>19
<211>42
<212>dna
<213>人工序列
<400>19
gctgatatcggatccgaattcatggtgcagtcagcgaaacac42
<210>20
<211>39
<212>dna
<213>人工序列
<400>20
ctcgagtgcggccgcaagctttcagggaccgcgcatctc39
<210>21
<211>42
<212>dna
<213>人工序列
<400>21
gctgatatcggatccgaattcgtgattgtttggacggttgcc42
<210>22
<211>45
<212>dna
<213>人工序列
<400>22
ctcgagtgcggccgcaagctttcatgatgttacctcatgagcacg45
- 还没有人留言评论。精彩留言会获得点赞!