谷氨酰胺类似物的前药的制作方法
谷氨酰胺类似物的前药
1.本案是申请日为2016年7月29日,题为《谷氨酰胺类似物的前药》的中 国发明专利申请201680057659.8的分案申请。
2.相关申请的交叉引用
3.本申请要求2015年7月31日提交的美国临时申请no.62/199,566的优先权, 其全部内容通过引用并入本文。
背景技术:
4.前药方法是改善潜在药物分子的物理化学、生物药剂学和药代动力学性质 的成熟策略。约5
‑
7%的全球批准的药物是前药,2013年销售额为112亿美元。 大多数前药是原始分子的简单化学衍生物。酯类前药是最常见的前药,占所有 市售前药的49%。酯类前药普及的原因包括它们通常是直接合成的,它们改善 的亲脂性和膜渗透性,以及酯酶的普遍存在。制备酯类前药的方法的一个实例 是用亲脂性烷基或烷氧基甲基酯(即,新戊酰氧基甲基(pom)或丙氧基
‑
羰基 氧基甲基(poc);例如,依那普利(enalapril)、阿德福韦(adefovir))封端酸 性部分(moiety)。另一种方法是用氨基酸封端酸性部分以制备可被血浆中的酰 胺酶/肽酶识别而水解的酰胺,或使其成为转运蛋白例如肽转运蛋白1(pept1) (例如,pomaglumetad methionil,伐昔洛韦(valacyclovir))的底物。
5.谷氨酰胺拮抗剂,例如6
‑
重氮
‑5‑
氧代
‑
l
‑
正亮氨酸(don)和氮杂
‑
丝氨酸, 已经在许多已发表的临床前和几项临床研究中显示出呈现广谱抗病毒(antiviralres.1997;33(3):165
‑
75;antiviral res.1994;25(3
‑
4):269
‑
79)、抗感染(j.bacteriol. 1965;89:1348
‑
53)、抗癌(参见,例如,yoshioka等人,1992;tokushima j.exp. med.39(1
‑
2):69
‑
76)、抗炎、和免疫抑制活性(kulcsar等人,2014;111:16053
‑
58;maciolek等人,2014;curr opin immunol.27:60
‑
74;carr等人,2010;j immunol. 185:1037
‑
1044;colombo等人,2010;proc natl acad sci usa.107:18868
‑
73), 以及抑制惊厥(proc r soc lond b biol sci.1984apr 24;221(1223):145
‑
68)、多 发性硬化症(tohoku,j.exp.med.2009;217(2):87
‑
92)、癫痫、和病毒性脑炎(j. neurovirol.2015apr;21(2):159
‑
73.doi:10.1007/s13365
‑
015
‑
0314
‑
6)。然而,当以 治疗剂量水平施用这种谷氨酰胺拮抗剂时,严重毒性(例如,剂量限制性gi毒 性,例如口腔粘膜炎、胃出血、恶心和呕吐、腹痛、白细胞减少症、血小板减 少症等)的发生阻碍了它们临床发展。
6.先前试图减轻与谷氨酰胺拮抗剂如don相关的严重毒性的尝试未成功。例 如,分割每日剂量并每四至六小时施用don显然使don的毒性潜力加倍 (mggill等,1957)。在另一个实例中,涉及don与谷氨酰胺酶一起给药以减 少血浆谷氨酰胺从而降低don剂量的治疗的开发,在临床试验公布之后停止。
技术实现要素:
7.本申请公开的主题提供了谷氨酰胺拮抗剂的前药及其药学上可接受的盐和 酯。在一些方面,本申请公开的主题提供了谷氨酰胺拮抗剂的前药或其药学上 可接受的盐或
酯,所述前药具有式(i)的结构:
[0008][0009]
其中:x选自由键、
‑
o
‑
和
‑
(ch2)
n
‑
组成的组,其中n是选自由1、2、3、4、5、 6、7和8组成的组的整数;r1选自由h和能够形成盐或酯的第一前药形成部分 组成的组;并且r2是h或能够与相邻于r2的氮形成酰胺键、氨基甲酸酯键、 氨基磷酸酯键或二氨基磷酸酯键的第二前药形成部分;r2’
选自由h、c1‑
c6烷基、 取代的c1‑
c6烷基组成的组,或者r2和r2’
一起形成包含
–
c(=o)
–
g
–
c(=o)
–
的环 结构,其中g选自由以下组成的组:c1‑
c8亚烷基、c1‑
c8杂亚烷基、c5‑
c8环亚 烷基、c6‑
c
12
亚芳基、c5‑
c
14
杂亚芳基、二价c4‑
c
10
杂环,其各自可任选地被取 代;或者r1和r2’
一起形成包含与r1相邻的氧原子和与r2’
相邻的氮原子的4 至6元杂环;条件是所述化合物具有至少一个选自由第一和第二前药形成部分 组成的组的前药形成部分。
[0010]
在其他方面,本申请公开的主题提供了一种药物组合物,其包含式(i)化 合物和药学上可接受的载体、稀释剂或赋形剂。
[0011]
在某些方面,本申请公开的主题提供了一种用于治疗疾病或病况的方法, 所述方法包含以有效治疗所述疾病或病况的量,向需要其治疗的受试者施用式 (i)化合物或其药物组合物。在其他方面,本申请公开的主题提供了式(i)化 合物或其药物组合物用于治疗疾病或病况的用途。在一些实施方案中,所述疾 病或病况选自由感染、癌症、自身免疫疾病、炎性疾病和神经退行性疾病或神 经系统疾病组成的组。
[0012]
在又一方面,本申请公开的主题提供了式(i)化合物或其药学组合物,其 用作药剂。
[0013]
在又一方面,本申请公开的主题提供了式(i)化合物或其药学组合物,其 用于治疗疾病或病况,优选地,所述疾病或病况选自由感染、癌症、自身免疫 疾病、炎性疾病和神经退行性疾病或神经系统疾病组成的组。
[0014]
在又一方面,本申请公开的主题提供了式(i)化合物或其药学组合物用于 治疗谷氨酰胺活性过量和/或异常。
[0015]
已经在上文中陈述了本申请公开的主题的某些方面,其全部或部分地由当 前公开的主题来解决,其他方面将随着结合所附实施例和附图进行的描述变得 显而易见,如最佳描述在下文中。
附图说明
[0016]
已经概括描述了当前公开的主题,现在将参考附图,附图不一定按比例绘 制,并且其中:
[0017]
图1显示了为试图合成本公开主题的各种缓慢释放的don前药而对don 进行的示例性氨基(r)和羧基(r’)修饰;
[0018]
图2a和图2b显示在试图合成don前药时遇到的化学稳定性挑战,包括 由don酯(图2a)和具有游离末端羧酸酯的don化合物(图2b)呈现的稳 定性问题;
[0019]
图3a、图3b、图3c和图3d展示了设计don前药的某些尝试的失败的化 学和差的药代动力学。图3a、图3b、图3c和图3d显示,当在小鼠中口服施 用时,与don相比,具有游离羧酸基团的大多数don前药表现出可忽略不计 的暴露(除了26,其显示出一些释放,图3a),包括29(图3b)、23(图3c) 和30(图3d),其在口服施用时在小鼠血浆中显示出很少的don释放。注意, 给药后30分钟和5小时时,don前药ltp073的释放低于所有小鼠血浆样品中 的定量限(未示出);
[0020]
图4a、图4b、图4c和图4d显示与don相比,施用本申请公开主题的示 例性don释放前药后0.5h和5h后,血浆中don释放的百分比。图4a和图 4b显示了小鼠中的药代动力学研究的结果,显示在施用don(1.6mg/kg p.o.) 和don前药(以1.6mg/kg当量的don给药),例如22(图4a;2.5mg/kg p.o.) 和25(图4b;2.9mg/kg p.o.)后的血浆don浓度。有趣的是,在0.5h时22 显示出较少释放(don的65%),然而,在5h时水平与don的水平相似(几 乎100%)。图4c和图4d显示了小鼠中药代动力学研究的结果,显示了在施用 don(1.6mg/kg i.p.)和don前药17(图4c;3.5mg/kg p.o.)和6(图4d; 3.7mg/kg p.o.)后的血浆don浓度;
[0021]
图5显示了30min和60min后,don前药25在磷酸盐缓冲盐水(pbs) 和模拟胃液(sgf)中的稳定性;
[0022]
图6显示了30min和60min后,don前药25在小鼠、猴、猪和人血浆中 的体外代谢稳定性筛选结果。发现25在所有受试物种的血浆中都不稳定,由于 乙酯和亮氨酸酯都被血浆酯酶水解;
[0023]
图7显示了包含异丙基酯羧基修饰的某些细胞靶向don前药的一般结构;
[0024]
图8显示了30min和60min后,靶向细胞的磷酰胺don前药4在小鼠、 猴、猪和人血浆中的体外代谢稳定性筛选结果。发现4在小鼠血浆中不稳定, 但在所有其他受试物种的血浆中稳定;
[0025]
图9显示了30min和60min后,don前药7在小鼠、猴、猪和人血浆中 的体外代谢稳定性筛选结果。发现7在小鼠血浆中不稳定,但在所有其他受试 物种的血浆中稳定;
[0026]
图10显示了30min和60min后,don前药9在狗、小鼠、猴、猪和人血 浆中的体外代谢稳定性筛选结果。发现9在所有受试物种的血浆中都不稳定。 代谢鉴定显示亮氨酸水解,但异丙基酯稳定,用于淋巴细胞内的特异性释放;
[0027]
图11a、图11b、图11c、图11d、图11e和图11f显示了20μm的don (图11a)和don前药4(图11b)、7(图11c)、9(图11d)、13(图11e) 和14(图11f)在人全血中孵育30分钟后,比较don和don前药在血浆、血 细胞、红细胞(rbc)和外周血单核细胞(pbmc)中的积累的离体研究结果;
[0028]
图12a、图12b、图12c和图12d显示了20μm don(图12a)和don 前药,包括20μm 4(图12b)、7(图12c)和9(图12c)在食蟹猴(cynomolgous monkey)全血样品中孵育30分钟后,比较don和don前药在食蟹猴血浆、 血细胞、rbc和pbmc中的积累的离体研究结果;
[0029]
图13a、图13b和图13c显示20μm don(图13a)和don前药,包括 20μm 7(图13b)和9(图13c)在猪全血样品中孵育30分钟后,比较don 和don前药在猪血浆、血细胞、rbc和pbmc中的积累的离体研究结果;
[0030]
图14显示每日高剂量治疗导致don处理的小鼠体重减轻。在25处理的小 鼠中没有观察到体重减轻;
[0031]
图15显示每日高剂量处理导致don处理的小鼠全血细胞减少 (pan
‑
cytopeniain)。用25处理的小鼠表现出一些白细胞减少症;
[0032]
图16显示用高剂量don或25处理的小鼠的肾和肝功能未受影响;
[0033]
图17a和图17b显示,25和don处理治愈淋巴瘤;don小鼠死于该处理, 而25耐受良好;
[0034]
图18a、图18b和图18c显示,与在小鼠中等摩尔剂量的don相比,化 合物25(图18a)降低c
max
;(图18b)增强肿瘤与肠道的比例;并(图18c) 在小鼠中引起较少的gi毒性。给予ova牛痘病毒感染,然后每日用溶媒(veh)、 don(0.8mg/kg)和25(0.8mg/kg当量)处理5天。在最后一次给药后1小时, 处死动物,取出小肠,用dpbs ph 7.4灌注,并使用“瑞士作用(swiss role)
”ꢀ
技术和固定剂纵向滚动,用于石蜡包埋。上图显示放大4倍的空肠
‑
回肠的苏木 精和伊红(h&e)染色切片;下图显示10倍放大的相同切片。don引起显著 的炎症,由多灶性隐窝畸变(左下图左圆圈)和柱状上皮形态丧失的扩张(左 下图右圆圈)组成。don前药看起来更类似于溶媒处理的小鼠,具有轻微的细 胞增生隐窝,但没有变形(右下图左圆圈)和正常的柱状形态(右下图右圆圈);
[0035]
图19a和图19b显示(图19a)在25的两次14天有效给药方案后;(图 19b)在采用长期25给药方案后(48天)没有观察到骨髓抑制;
[0036]
图20显示了don和基于don的前药的示例性结构;
[0037]
图21a和图21b显示don(1)体内抑制谷氨酰胺代谢和多形性胶质母细 胞瘤(gbm)肿瘤生长。图21a显示化合物don(1)(0.8mg/kg,i.p.)抑制谷 氨酰胺代谢,由以下证明:相对于溶媒处理的对照,在施用后2小时,侧翼gbm 肿瘤中内源性谷氨酰胺浓度增加;*p<0.05。图21b显示在药效研究中,与第0 天基线相比,溶媒处理的小鼠在实验过程中表现出侧翼gbm肿瘤的显著生长。 相比之下,全身施用1(0.8mg/kg,i.p,q.d.1
‑
6天)引起肿瘤尺寸显著减小;*** p<0.001,****p<0.0001;
[0038]
图22a、图22b和图22c显示了口服施用don(1)和14后,化合物don (1)在小鼠中的体内脑和血浆药代动力学。1和14通过口服灌胃以0.8mg/kg 当量向小鼠给药,并通过lc/ms评估化合物1的血浆和脑浓度。口服施用化合 物1和14表现出类似的血浆和脑药代动力学特征,这是由于14在小鼠血浆中 完全并快速地代谢成1;
[0039]
图23a、图23b和图23c显示了静脉内(i.v.)施用don(1)和14后, don在猴血浆和脑脊液(csf)中的体内药代动力学。1和14通过i.v.施用以1 的1.6mg/kg当量向两只短尾猴(pigtail macaque)给药,并通过lc/ms评估don 的血浆(0.25
‑
6h)和csf(30min)浓度。相对于1,14递送显著较低的don 血浆浓度。在csf中观察到相反的结果,其中14递送显著更高的don csf浓 度,在给药后30分钟,csf与血浆比率提高10倍;
[0040]
图24显示14的物种特异性血浆稳定性;14在人、猪、狗和猴的血浆中稳 定,但在小鼠血浆中迅速代谢;
[0041]
图25显示了don和基于don的前药25、9、38和60的示例性结构;不 同的n
‑
氨基酸前体部分(promoeity)(例如亮氨酸、色氨酸)提供差异性血浆和 微粒体稳定性;
[0042]
图26a、图26b、图26c、图26d显示don前药9、25、38和60的体外 血浆稳定性。通过去除n
‑
保护基团发生代谢;乙酯和异丙酯在猪和人的血浆中 均稳定;
[0043]
图27a、图27b、27c、图27d显示don前药9、25、38和60的体外肝微 粒体稳定性;所有
前药均在人和猪的微粒体中显示出中
‑
高度稳定性;
[0044]
图28a、图28b、图28c、图28d、图28e、图28f、图28g、图28h、28i、 28j显示了9、25、38和60在人全血和猪全血中的离体研究;与血浆相比,don 前药选择性地将don递送至人和猪中的pbmc;与don相比,pbmc/血浆比 提高了10
‑
100+倍;
[0045]
图29a、图29b、图29c、图29d和图29e显示了用don前药9、25、38 和60进行的猪体内研究;与血浆相比,don前药选择性地将don递送至pbmc; 与don相比,pbmc/血浆比提高了6倍至10倍;
[0046]
图30a、30b、30c显示化合物甲基
‑
pom 14及其衍生物的血浆稳定性;
[0047]
图31显示了用于细胞内靶向和脑渗透的基于n
‑
酰基烷氧基don的前药类 似物的示例性结构;向“桥”添加空间位阻可能导致较慢的水解;
[0048]
图32a、32b、图32c显示了用don前药的猪i.v.研究:与don相比,在 猪体内don前药选择性地将don递送至pbmc;
[0049]
图33显示了pbmc与血浆auc(0‑
t
)比率比较,与don相比,don前药 达到>6倍更好比率(基于auc0‑
t
);
[0050]
图34a和图34b显示用don前药14的猴iv研究显示较低的血浆浓度但 较高的csf浓度,相对于don,实现了倍>csf/血浆比率;
[0051]
图35显示了静脉输注化合物1、9、14a、25和60后1小时的csf与血浆 比率;
[0052]
图36显示don(1)和38在5天观察期中的临床发现,与38相比,don 处理的猪呈现出更多的不利临床体征;选择don(1.6mg/kg)和38(1.5mg/kg) 剂量以提供等同的pbmc暴露;药物经静脉给药,2h/天,持续5天(n=2头猪); 进行密切的临床监测以评估药物毒性(例如,嗜睡、厌食、腹泻、胃肠道出血 等);给药5天后,将猪安乐死并收集组织以用于pk和组织病理学;
[0053]
图37a、图37b、图37c和图37d显示,宏观上,与38相比,don处理 的猪呈现出更严重的胃毒性;胃肠道和其他组织的组织病理学毒性评分尚未确 定;以及
[0054]
图38显示,在等同的pbmc暴露下,与施用don相比,施用38向gi组 织递送更少的don;与38相比,施用don似乎会导致更多的不良临床效应。
[0055]
专利或申请文件含有至少一个彩图。本专利或专利申请公开带有彩图的复 印件将由专利局根据要求提供并支付必要的费用。
具体实施方式
[0056]
现在将在下文中参照附图更充分地描述本公开的主题,其中示出了本发明 的一些实施方案但非全部。相同的数字通篇指代相同的元件。本公开的主题可 以以许多不同的形式来实施,而不应被解释为限于在此阐述的实施方式;而是, 提供这些实施方式以使本公开将满足适用的法律要求。事实上,本文所阐述的 本申请公开的主题的许多修改和其它实施方案将被本领域技术人员想到,其具 有在前面的描述和相关附图中给出的教导的益处。因此,应当理解的是,本申 请公开的主题不限于所公开的具体实施方案,并且旨在将修改和其他实施方案 包括在所附权利要求的范围内。
[0057]
i.谷氨酰胺拮抗剂的前药
[0058]
don是1953年从链霉菌中分离出来的一种抗生素。don是l
‑
谷氨酰胺的 重氮类似
物,其干扰核酸和蛋白质合成中的多种反应,其中l
‑
谷氨酰胺提供氮, 封闭多种识别谷氨酰胺的酶,例如谷氨酰胺酶,调节脑谷氨酸水平,并参与能 量代谢等等。
[0059]
改善包括gbm治疗在内的各种治疗方案的don治疗指数的一种策略将会 增加其大脑暴露,同时限制其全身暴露并因此具有毒性(upadhyay,2014)。前 药方法是一种改变药物分子的药代动力学和组织分布的成熟策略,然而综合来 说,这种方法对don具有挑战性。鉴于don的不稳定重氮基团对其谷氨酰胺 拮抗活性至关重要,因此前体部分的添加必须在温和条件下进行以保护重氮酮 基团。
[0060]
本申请公开的主题提供了新的物质组合物,其中将前体部分添加至谷氨酰 胺拮抗剂,如6
‑
重氮
‑5‑
氧代
‑
正亮氨酸(don)和氮杂
‑
丝氨酸。
[0061]
本申请公开的谷氨酰胺拮抗剂的前药是通过掩蔽胺和/或羧酸酯官能团来改 变don的药代动力学而制备的,其提供了较慢的释放动力学和细胞靶向以增强 耐受性。此外,在一些实施方案中,本申请公开的前药选择性地将活性谷氨酰 胺拮抗剂靶向特定的细胞或提供don的较慢释放,从而降低药物分子的毒性。
[0062]
本申请公开的主题表明,掩蔽待衍生的α
‑
氨基和羧基官能团增强了前药的 稳定性和口服生物利用度。本申请公开的前药还呈现出与游离don相当的稳定 性。
[0063]
表1中提供了代表性don前药的结构。
[0064]
[0065]
[0066]
[0067]
[0068]
[0069]
[0070]
[0071]
[0072]
[0073]
[0074]
[0075]
[0076][0077]
本领域技术人员将会理解,表1中所示的don前药的代表性结构与本文公 开的指导相结合将使本领域技术人员能够合成其他谷氨酰胺类似物(例如 l
‑
donv、氮杂
‑
丝氨酸)的前药,如式(i)的一般结构所例举的。换句话说, 应当理解的是,其他谷氨酰胺拮抗剂(如l
‑
donv、氮杂
‑
丝氨酸)的前药,可 以用与表1中所示的don前药相同的取代基r1、r2和r2’
来合成。
[0078]
因此,在一个方面,本申请公开的主题提供了谷氨酰胺拮抗剂的前药或其 药学上可接受的盐或酯,所述前药具有式(i)的结构:
[0079][0080]
其中:x选自由键、
‑
o
‑
和
‑
(ch2)
n
‑
组成的组,其中n是选自由1、2、3、4、5、 6、7和8组成的组的整数;r1选自由h和能够形成盐或酯的第一前药形成部分 组成的组;并且r2是h或能够与相邻于r2的氮形成酰胺键、氨基甲酸酯键、 氨基磷酸酯键或二氨基磷酸酯键的第二前药形成部分;r2’
选自由h、c1‑
c6烷基、 取代的c1‑
c6烷基组成的组,或者r2和r2’
一起形成包含
–
c(=o)
–
g
–
c(=o)
–
的环 结构,其中g选自由以下组成的组:c1‑
c8亚烷基、c1‑
c8杂亚烷基、c5‑
c8环亚 烷基、c6‑
c
12
亚芳基、c5‑
c
14
杂亚芳基、二价c4‑
c
10
杂环,其各自可任选地被取 代;或者r1和r2’
一起形成包含与r1相邻的氧原子和与r2’
相邻的氮原子的4 至6元杂环;条件是所述化合物具有至少一个选自由第一和第二前药形成部分 组成的组的前药形成部分。
[0081]
如本文所用,术语“酰胺键”包含由下式表示的结构:
[0082]
其中r
v
选自由烷基、取代的烷基、环烷基、取代的环烷基、芳 基、取代的芳基、芳烷基、取代的芳烷基、杂环基、取代的杂环基、烯基、取 代的烯基、环烯基、取代的环烯基、烷基胺、取代的烷基胺、杂芳基和取代的 杂芳基组成的组。
[0083]
如本文所用,术语“氨基甲酸酯键”包含由下式表示的结构:
[0084]
其中r
w
选自由烷基、取代的烷基、环烷基、取代的环烷基、 芳基、取代的芳基、芳烷基、取代的芳烷基、杂环基、取代的杂环基、烯基、 取代的烯基、环烯基、取代的环烯基、烷基胺、取代的烷基胺、杂芳基和取代 的杂芳基组成的组。
[0085]
如本文所用,术语“氨基磷酸酯键”包含由下式表示的结构:
[0086]
其中r
x
和r
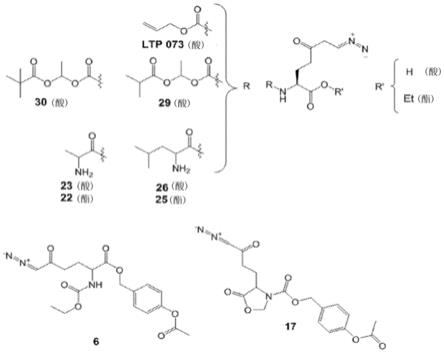
x’各自独立地选自由烷基、取代的烷基、环烷基、 取代的环烷基、芳基、取代的芳基、芳烷基、取代的芳烷基、杂环基、取代的 杂环基、烯基、取代的烯基、环烯基、取代的环烯基、烷基胺、取代的烷基胺、 杂芳基和取代的杂芳基组成的组。
[0087]
如本文所用,术语“二氨基磷酸酯键”包含由下式表示的结构:
[0088]
其中r
y
和r
z
各自独立地选自由h、烷基、取代的烷基、环烷 基、取代的环烷基、杂环基、取代的杂环基、烯基、取代的烯基、环烯基、取 代的环烯基、
‑
(cr3r4)
m
‑
z、
‑
(cr3r4)
m
‑
q
‑
z、芳基、取代的芳基、烷基胺、取代 的烷基胺、杂芳基、取代的杂芳基和组成的组。
[0089]
在一些实施方案中,x是
‑
ch2‑
,并且n是1。
[0090]
在其他实施方案中,x是
‑
o
‑
。在一些实施方案中,前药化合物具有第一前 药形成部分和第二前药形成部分。在一些实施方案中,谷氨酰胺类似物是谷氨 酰胺拮抗剂,即,前
药是拮抗谷氨酰胺途径的谷氨酰胺类似物的前药。示例性 的谷氨酰胺拮抗剂包括但不限于6
‑
重氮
‑5‑
氧代
‑
正亮氨酸(don)、氮杂
‑
丝氨酸 和5
‑
重氮
‑4‑
氧代
‑
l
‑
正缬氨酸(l
‑
donv)。
[0091]
在一些实施方案中,本申请公开的主题提供了don的前药。在一些实施方 案中,don的前药具有式(i)的结构。在一些实施方案中,本申请公开的主题 提供了l
‑
donv的前药。一些实施方案中,l
‑
donv的前药具有式(i)的结构。 在一些实施方案中,本申请公开的主题提供了氮杂丝氨酸的前药。一些实施方 案中,氮杂丝氨酸的前药具有式(i)的结构。
[0092]
在一些实施方案中,式(i)的r1包含前药形成部分的残基pro1,其与碱 性部分和末端羟基基团一起形成盐。
[0093]
在一些实施方案中,式(i)的r1包含前药形成部分的残基pro1,其与烷 基基团和相邻羟基基团的氧一起形成酯。
[0094]
在一些实施方案中,式(i)的r1包含前药形成部分的残基pro1,其与烷 基基团和邻近r2’
基团的氮一起形成二氢唑酮或噁唑烷酮。
[0095]
在一些实施方案中,式(i)的r1选自由以下组成的组:h、烷基、取代的 烷基、环烷基、取代的环烷基、烯基、取代的烯基、炔基、取代炔基、环烯基、 取代的环烯基、三(烃基)铵和四(烃基)铵。优选的烷基基团、环烷基基团、烯基 基团、炔基基团和环烯基基团取代基包括烷基、取代的烷基、卤素、芳基氨基、 酰基、羟基、芳氧基、烷氧基、烷硫基、芳硫基、芳烷氧基、芳烷硫基、羧基、 烷氧羰基、氧代和环烷基。
[0096]
在一些实施方案中,式(i)的r1不是h。在一些实施方案中,当r2和r2’ꢀ
是h时,式(i)的r1不是h。在一些实施方案中,当r1不是h时,式(i)的 r2和r2’
均是h。
[0097]
在一些实施方案中,式(i)的r1选自由以下组成的组:c1‑6直链烷基、取 代的c1‑6直链烷基、c1‑6支链烷基、取代的c1‑6支链烷基、三(c1‑
c8‑
烷基)铵、四 (c1‑
c8‑
烷基)铵、三苯基铵、三(羟基
‑
c1‑
c8‑
烷基)铵和四(羟基
‑
c1‑
c8‑
烷基)铵。
[0098]
在一些实施方案中,式(i)的r1选自由以下组成的组:甲基、乙基、异丙 基、环戊基、环己基、三甲基铵、三乙基铵、三(羟乙基)铵、三丙基铵和三(羟 丙基)铵。在一些实施方案中,式(i)的r1是甲基。在一些实施方案中,式(i) 的r1是乙基。在一些实施方案中,式(i)的r1是异丙基。
[0099]
在一些实施方案中,式(i)的r2包含第二前药形成部分的残基pro2,其 与羰基、氧羰基或膦酰基基团和相邻nh的氮一起形成酰胺、氨基甲酸酯、氨 基磷酸酯或二氨基磷酸酯键。
[0100]
在一些实施方案中,式(i)的r2包含选自由以下组成的组的基团:氨基酸、 n
‑
取代的氨基酸、肽、取代的肽、单环、取代的单环、双环、取代的双环、嘌 呤核苷、取代的嘌呤核苷、嘧啶核苷和取代的嘧啶核苷。
[0101]
如本文所用,术语“氨基酸”包括具有羧酸基团和氨基基团的部分。因此术语 氨基酸包括天然氨基酸(包括蛋白质氨基酸)和非天然氨基酸。术语“天然氨基 酸”还包括在翻译期间可以掺入至蛋白质中的其他氨基酸(包括吡咯赖氨酸和硒 代半胱氨酸)。此外,术语“天然氨基酸”还包括在中间代谢期间形成的其它氨基 酸,例如在尿素循环中由精氨酸产生的鸟氨酸。表2中总结了天然氨基酸:
[0102][0103]
天然或非天然氨基酸可任选地被取代。在一个实施方案中,氨基酸选自蛋 白质氨基酸。蛋白质氨基酸包括甘氨酸,丙氨酸,缬氨酸,亮氨酸,异亮氨酸, 天冬氨酸,谷氨酸,丝氨酸,苏氨酸,谷氨酰胺,天冬酰胺,精氨酸,赖氨酸, 脯氨酸,苯丙氨酸,酪氨酸,色氨酸,半胱氨酸,甲硫氨酸和组氨酸。术语氨 基酸包括α氨基酸和β氨基酸,例如但不限于β丙氨酸和2
‑
甲基β丙氨酸。术 语氨基酸还包括天然氨基酸的某些内酰胺类似物,例如但不限于焦谷
氨酰胺 (pyroglutamine)。术语氨基酸还包括氨基酸同系物,包括高瓜氨酸,高精氨酸, 高丝氨酸,高酪氨酸,高脯氨酸和高苯丙氨酸。
[0104]
氨基酸残基或肽的末端部分可以是游离酸的形式,即,以
‑
cooh基团终止, 或者可以是掩蔽的(保护的)形式,例如以羧酸酯或羧酰胺的形式。在某些实 施方案中,氨基酸或肽残基以氨基基团终止。在一个实施方案中,残基以羧酸 基团
‑
cooh或氨基基团
‑
nh2终止。在另一个实施方案中,残基以羧酰胺基团终 止。在另一个实施方案中,残基以羧酸酯终止。
[0105]
如上文所公开的,术语“氨基酸”包括具有—cooh基团和—nh2基团的化合 物。取代的氨基酸包括具有被单或双取代的氨基基团的氨基酸。在特定实施方 案中,氨基基团可以被单取代。(蛋白质氨基酸可以在来自其氨基基团的另一个 位点被取代,以形成氨基酸,其是取代的蛋白质氨基酸)。因此,术语取代的氨 基酸包括天然氨基酸的n
‑
取代的代谢物,包括但不限于n
‑
乙酰半胱氨酸、n
‑ꢀ
乙酰丝氨酸和n
‑
乙酰苏氨酸。
[0106]
例如,术语“n
‑
取代的氨基酸”包括n
‑
烷基氨基酸(例如,c1‑6n
‑
烷基氨基 酸,例如肌氨酸、n
‑
甲基
‑
丙氨酸、n
‑
甲基
‑
谷氨酸和n
‑
叔丁基甘氨酸),其可以 包括c1‑6n
‑
取代的烷基氨基酸(例如n
‑
(羧基烷基)氨基酸(例如,n
‑
(羧基甲基) 氨基酸)和n
‑
甲基环烷基氨基酸(例如,n
‑
甲基环丙基氨基酸));n,n
‑
二
‑
烷基 氨基酸(例如,n,n
‑
二
‑
c1‑6烷基氨基酸(例如n,n
‑
二甲基氨基酸));n,n,n
‑
三
‑ꢀ
烷基氨基酸(例如,n,n,n
‑
三
‑
c1‑6烷基氨基酸(例如,n,n,n
‑
三甲基氨基酸));n
‑
酰基氨基酸(例如,c1‑6n
‑
酰基氨基酸);n
‑
芳基氨基酸(例如,n
‑
苯基氨基 酸,例如n
‑
苯基甘氨酸);n
‑
脒基氨基酸(例如,n
‑
脒氨基酸,即,其中胺基基 团被胍基基团替代的氨基酸)。
[0107]
术语“氨基酸”还包括氨基酸烷基酯(例如,氨基酸c1‑6烷基酯);和氨基酸 芳基酯(例如,氨基酸苯基酯)。
[0108]
对于在侧链上存在羟基基团的氨基酸,术语“氨基酸”还包括o
‑
烷基氨基酸 (例如,c1‑6o
‑
烷基氨基酸醚);o
‑
芳基氨基酸(例如,o
‑
苯基氨基酸醚);o
‑ꢀ
酰基氨基酸酯;和o
‑
氨基甲酰基氨基酸。
[0109]
对于在侧链上存在巯基基团的氨基酸,术语“氨基酸”还包括s
‑
烷基氨基酸 (例如,c1‑6s
‑
烷基氨基酸,例如s
‑
甲基甲硫氨酸,其可以包括c1‑6s
‑
取代的烷 基氨基酸和s
‑
甲基环烷基氨基酸(例如,s
‑
甲基环丙基氨基酸));s
‑
酰基氨基酸 (例如,c1‑6s
‑
酰基氨基酸);s
‑
芳基氨基酸(例如,s
‑
苯基氨基酸);含硫氨基 酸的亚砜类似物(例如,甲硫氨酸亚砜)或s
‑
烷基氨基酸的亚砜类似物(例如, s
‑
甲基半胱氨酸亚砜)或s
‑
芳基氨基酸。
[0110]
换句话说,本申请公开的主题还考虑天然氨基酸的衍生物,例如上面提到 的那些,其已经通过本领域已知的简单合成转化进行了官能化(例如,在t wgreene和p g m wuts的“protective groups in organic synthesis”,john wiley& sons inc.(1999)中描述的)以及其中的参考文献。
[0111]
非蛋白质氨基酸的实例包括但不限于:瓜氨酸,羟脯氨酸,4
‑
羟脯氨酸,β
‑ꢀ
羟基缬氨酸,鸟氨酸,β
‑
氨基丙氨酸,合欢氨酸(albizziin),4
‑
氨基
‑
苯丙氨酸, 联苯丙氨酸,4
‑
硝基
‑
苯丙氨酸,4
‑
氟
‑
苯丙氨酸,2,3,4,5,6
‑
五氟
‑
苯丙氨酸,正亮 氨酸,环己基丙氨酸,α
‑
氨基异丁酸,α
‑
氨基丁酸,α
‑
氨基异丁酸,2
‑
氨基异丁 酸,2
‑
氨基茚满
‑2‑
羧酸,硒代蛋氨酸,羊毛硫氨酸,脱氢丙氨酸,γ
‑
氨基丁酸, 萘丙氨酸,氨基己酸,哌可酸,2,3
‑
二氨基丙酸,四氢异喹啉
‑3‑
羧酸,叔亮氨酸, 叔丁基丙氨酸,环丙基甘氨酸,环己基甘氨酸,4
‑
氨基哌啶
‑
4
‑
羧酸,二乙基甘 氨酸,二丙基甘氨酸及其衍生物,其中胺氮已被单烷基化或二烷基化。
[0112]
除非另有说明,否则术语“肽”是指由2至9个氨基酸组成的氨基酸链。在优 选的实施方案中,用于本发明的肽的长度为2或3个氨基酸。在一个实施方案 中,肽可以是支链肽。在该实施方案中,肽中的至少一个氨基酸侧链与另一个 氨基酸(通过末端或侧链之一)结合。
[0113]
术语“n
‑
取代的肽”是指由2至9个氨基酸组成的氨基酸链,其中一个或多个 nh基团被取代,例如被本文关于取代的氨基基团的其它地方所描述的取代基取 代。任选地,n
‑
取代的肽其n
‑
末端氨基基团被取代,并且在一个实施方案中, 酰胺键是未被取代的。
[0114]
在一个实施方案中,氨基酸侧链与另一个氨基酸结合。在另一个实施方案 中,侧链通过氨基酸的n
‑
末端、c
‑
末端或侧链与氨基酸结合。
[0115]
天然氨基酸侧链的实例包括氢(甘氨酸),甲基(丙氨酸),异丙基(缬氨酸), 仲丁基(异亮氨酸),
‑
ch2ch(ch3)2(亮氨酸),苄基(苯丙氨酸),对羟基苄基(酪氨 酸),
‑
ch2oh(丝氨酸),
‑
ch(oh)ch3(苏氨酸),
‑
ch2‑3‑
吲哚基(色氨酸),
ꢀ‑
ch2cooh(天冬氨酸),
‑
ch2ch2cooh(谷氨酸),
‑
ch2c(o)nh2(天冬酰胺),
ꢀ‑
ch2ch2c(o)nh2(谷氨酰胺),
‑
ch2sh(半胱氨酸),
‑
ch2ch2sch3(甲硫氨酸),
ꢀ‑
(ch2)4nh2(赖氨酸),
‑
(ch2)3nhc(=nh)nh2(精氨酸)和
‑
ch2‑3‑
咪唑基(组氨酸)。
[0116]
示例性的单环和双环包括但不限于苯、嘧啶和嘌呤,更一般地包括芳基和 杂芳基环。示例性的杂芳基包括但不限于吡啶基、嘧啶基、吡嗪基、呋喃基、 噻吩基、吡唑基、噁唑基、噻唑基、异噻唑基、异噁唑基、吡咯基、咪唑基、 吲哚基、吲哚啉基和咪唑并哒嗪基。芳基包括苯基(c6)、苄基、萘基(c
10
)和联苯 基(c
12
)。示例性的嘧啶包括但不限于胞嘧啶、胸腺嘧啶和尿嘧啶。示例性的嘌 呤包括但不限于嘌呤、腺嘌呤、n
‑
取代的腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤、 可可碱、咖啡因、尿酸和异鸟嘌呤。示例性的嘌呤核苷包括但不限于腺嘌呤和 鸟嘌呤。
[0117]
在一些实施方案中,式(i)的r2选自由以下组成的组:h,烷基,
‑
c(=o)
‑
ar,
ꢀ‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
ar,
‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
nr5r6,
‑
p(=o)(or7)
n
(nhr9)
o
,
‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
ar
‑
o
‑
c(=o)
‑
r8,
‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
ar
‑
o
‑
r8,
ꢀ‑
c(=o)
‑
o
‑
(cr3r4)
m
‑
o
‑
c(=o)
‑
r
10
,
‑
c(=o)
‑
o
‑
r9,
ꢀ‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
ar
‑
o
‑
c(=o)
‑
ar,和
‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
ar
‑
nr5r6;其中:y 是
–
o
–
或键;m是选自由0、1、2、3、4、5、6、7和8组成的组的整数;每个 n和o均是从0至2的整数,条件是n和o的和为2;r3和r4独立地为h,c1‑
c6烷基或取代的c1‑
c6烷基,芳基或取代的芳基,
‑
(cr3r4)
m
‑
nr5r6,或者每个r5和r6独立地为h,烷基,
‑
c(=o)
‑
(cr3r4)
m
,
‑
c(=o)
‑
(nr5r6) 或
‑
c(=o)
‑
(cr3r4)
m
‑
nr5r6;每个r7独立地选自由以下组成的组:h、烷基、取 代的烷基、环烷基、取代的环烷基、杂环基、取代的杂环基、烯基、取代的烯 基、环烯基、取代的环烯基、
‑
(cr3r4)
m
‑
z、
‑
(cr3r4)
m
‑
q
‑
z,其中q是单糖、芳 基、取代的芳基、杂芳基、取代的杂
芳基,并且其中z是或者其中r7与它所连接的氧原子一起形成嘌呤或嘧啶核苷;每个r9独立地选自 由以下组成的组:h、烷基、取代的烷基、环烷基、取代的环烷基、杂环基、取 代的杂环基、烯基、取代的烯基、环烯基、取代的环烯基、
‑
(cr3r4)
m
‑
z、芳基、 取代的芳基、杂芳基、取代的杂芳基和其中r1和x如上所定 义,条件是r1不是h;
[0118]
每个r8独立地为烷基、取代的烷基、环烷基、取代的环烷基、单糖、酰化 的单糖、芳基、取代的芳基、杂芳基、取代的杂芳基;每个r
10
独立地为烷基、 取代的烷基、环烷基、取代的环烷基、单糖、酰化的单糖、芳基、取代的芳基、 杂芳基、取代的杂芳基;并且ar是芳基、取代的芳基、杂芳基或取代的杂芳基。 应当理解的是,除了z的氨基基团上的取代之外,还可以对z的5或6元环进 行一个或多个r3、r4、r5和/或r6取代。
[0119]
在特定实施方案中,ar是
[0120]
在另一个特定实施方案中,ar是
[0121]
在又一个特定实施方案中,ar是苄基。
[0122]
在特定实施方案中,式(i)的前药化合物是
[0123]
在一些实施方案中,式(i)的r2是
‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
nr5r6;其中:(i) y是键;m是1;r5和r6均是h;(ii)y是键;m是1;r5是h;r6是
‑
c(=o)
‑
(cr3r4)
m
。
[0124]
在特定实施方案中,式(i)的前药化合物选自由以下组成的组:
[0125][0126][0127]
在这种实施方案中,应当理解,上面所示的式(i)化合物的末端羧基基团 可用于形成盐。在一个示例性的实施方案中,如本领域技术人员将会理解的, 当h被net3替代时,可以形成任意上述式(i)化合物的盐。
[0128]
在一些实施方案中,式(i)的r2是
‑
p(=o)(or7)
n
(nhr9)
o
;其中:n是2并 且o是0;n是1并且o是1;或者n是0并且o是2。
[0129]
在特定实施方案中,式(i)的前药化合物选自由以下组成的组:
[0130][0131]
在一些实施方式中,式(i)的r2是
‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
ar
‑
o
‑
c(=o)
‑
r8或
ꢀ‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
ar
‑
o
‑
r8;其中:y是
‑
o
‑
;m是0;并且ar是苄基。
[0132]
在特定实施方案中,式(i)的前药化合物选自由以下组成的组:
[0133]
[0134][0135]
在一些实施方案中,式(i)的r2是
‑
c(=o)
‑
o
‑
(cr3r4)
m
‑
o
‑
c(=o)
‑
r
10
;其中: (i)m是1;r3是h;并且r4是甲基、ipr或芳基;(ii)m是1;r3和r4均是 h;或(vi)m是1;r3和r4均是甲基。
[0136]
在特定实施方案中,式(i)的前药化合物选自由以下组成的组:
[0137]
[0138]
[0139]
[0140][0141]
在特定实施方案中,式(i)的前药化合物是式:其中r1如上述定义。
[0142]
在特定实施方案中,式(i)的前药化合物选自由以下组成的组:
[0143][0143]
[0144]
在一些实施方案中,式(i)的r2是
‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
nr5r6;其中y是 键;每个m均是1;每个r5均是h;每个r6独立地是h或
‑
c(=o)
‑
(cr3r4)
m
‑
nr5r6。
[0145]
在特定实施方案中,式(i)的前药化合物选自由以下组成的组:
[0146][0147]
在一些实施方案中,式(i)的r2是
‑
c(=o)
‑
ar,或
ꢀ‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
ar
‑
o
‑
c(=o)
‑
ar。
[0148]
在特定实施方案中,式(i)的前药化合物选自由以下组成的组:
[0149][0150]
在一些实施方案中,式(i)的r2是
‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
ar
‑
nr5r6;其中:y 是o;每个m独立地是0、1或3;每个r3独立地是h、c1‑
c6烷基或
ꢀ‑
(cr3r4)
m
‑
nr5r6;每个r4均是h;每个r5独立地是h、
‑
c(=o)
‑
(cr3r4)
m
、
ꢀ‑
c(=o)
‑
nr5r6或
‑
c(=o)
‑
(cr3r4)
m
‑
nr5r6;每个r6均是h。
[0151]
在特定实施方案中,式(i)的前药化合物选自由以下组成的组:
[0152][0153]
在一些实施方案中,式(i)的r2是
‑
c(=o)
‑
y
‑
(cr3r4)
m
‑
nr5r6,其中:y是 键;m是1、2或3;每个r3独立地是h、c1‑
c6烷基或
‑
(cr3r4)
m
‑
nr5r6;每个 r4均是h;每个r5独立地是h、
‑
c(=o)
‑
(cr3r4)
m
、
‑
c(=o)
‑
nr5r6或
‑
c(=o)
‑
(cr3r4)
m
‑
nr5r6;每个r6均是h。
[0154]
在特定实施方案中,式(i)的前药化合物选自由以下组成的组:
[0155][0156]
在一些实施方案中,式(i)的r2是h并且r1选自由烷基和取代的烷基组 成的组。
[0157]
在特定实施方案中,式(i)的前药化合物选自由以下组成的组:
[0158]
[0159]
应当理解,在结构式中描述为don的前药的所有式(i)化合物仅是谷氨 酰胺类似物(例如,l
‑
donv和氮杂
‑
丝氨酸)的前药的示例,其可以使用本申 请公开的主题的指导来合成。
[0160]
ii.药物组合物和施用
[0161]
另一方面,本公开提供了一种药物组合物,其包括式(i)的前药化合物, 所述式(i)的前药化合物单独或与一种或多种额外治疗剂组合,并与药学上可 接受的赋形剂混合。因此,在一些实施方式中,本申请公开的主题提供了一种 药物组合物,其包含式(i)化合物和药学上可接受的载体、稀释剂或赋形剂。 本领域技术人员将认识到,所述药物组合物包括上述化合物的药学上可接受的 盐。
[0162]
药学上可接受的盐通常为本领域普通技术人员所熟知,并且包括根据本文 所述化合物上存在的特定取代部分,用相对无毒的酸或碱制备的活性化合物的 盐。当本公开的化合物含有相对酸性的官能团时,可以通过在无溶剂(neat)条 件下或在合适的惰性溶剂中或通过离子交换(由此离子复合物中的一个碱性抗 衡离子(碱)被另一个取代),使这种化合物的中性形式与足够量的所需碱接触 来获得碱加成盐。药学上可接受的碱加成盐的实例包括钠盐、钾盐、钙盐、铵 盐、有机氨基盐或镁盐或类似的盐。
[0163]
当本公开的化合物含有相对碱性的官能团时,可以通过直接在无溶剂条件 下或在合适的惰性溶剂中或通过离子交换(由此离子复合物中的一个酸性抗衡 离子(酸)被另一个取代),使这种化合物的中性形式与足够量的所需酸接触来 获得酸加成盐。药学上可接受的酸加成盐的实例包括衍生自无机酸如盐酸、氢 溴酸、硝酸、碳酸、一氢碳酸、磷酸、一氢磷酸、二氢磷酸、硫酸、一氢硫酸、 氢碘酸或亚磷酸等的盐,以及衍生自相对无毒的有机酸如乙酸、丙酸、异丁酸、 马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、乳酸、扁桃酸、苯二甲 酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸、甲磺酸等的盐。还包括氨基酸如 精氨酸等的盐,和有机酸如葡糖醛酸或半乳糖醛酸等的盐(参见,例如,berge 等人,“pharmaceutical salts,"journal of pharmaceutical science,1977,66,1
‑
19)。 本公开的某些具体化合物同时含有碱性和酸性官能团,其允许化合物转化为碱 或酸加成盐。
[0164]
因此,适合与本申请公开的主题一起使用的药学上可接受的盐包括,例如 但不限于乙酸盐,苯磺酸盐,苯甲酸盐,碳酸氢盐,酒石酸氢盐,溴化物,依 地酸钙,carnsylate,碳酸盐,柠檬酸盐,依地酸盐,乙二磺酸盐,依托酸盐 (estolate),乙磺酸盐(esylate),富马酸盐,葡庚糖酸盐,葡糖酸盐,谷氨酸盐, 乙醇酰对氨基苯基砷酸盐(glycollylarsanilate),己基间苯二酚盐 (hexylresorcinate),羟萘酸盐(hydroxynaphthoate),碘化物,羟乙磺酸盐,乳 酸盐,乳糖醛酸盐,苹果酸盐,马来酸盐,扁桃酸盐,甲磺酸盐,粘酸盐,萘 磺酸盐,硝酸盐,双羟萘酸盐(pamoate或embonate),泛酸盐,磷酸盐/二磷酸 盐,聚半乳糖醛酸盐,水杨酸盐,硬脂酸盐,次乙酸盐,琥珀酸盐,硫酸盐, 鞣酸盐,酒石酸盐或茶氯酸盐(teoclate)。其他药学上可接受的盐可见于例如 remington:the science and practice of pharmacy(第20版)lippincott,williams& wilkins(2000)。
[0165]
在特定实施方案中,盐是三(烃基)铵或四(烃基)铵盐。在又更特定实施方案 中,盐选自由以下组成的组:三(c1‑
c8烷基)铵、四(c1‑
c8烷基)铵、三苯基铵、 三(羟基
‑
c1‑
c8烷基)铵和四(羟基
‑
c1‑
c8烷基)铵盐。在甚至更特定的实施方案中, 盐选自由以下组成的组:
三甲基铵、三乙基铵、三(羟乙基)铵、三丙基铵和三(羟 丙基)铵盐。
[0166]
在治疗和/或诊断应用中,本公开的化合物可以配制用于多种施用模式,包 括口服(舌下、颊)、经口(peroral)、舌下、全身和外用(topical)或局部化(localized) 施用。技术和制剂通常可见于例如remington:the science and practice ofpharmacy(第20版)lippincott,williams&wilkins(2000)。
[0167]
根据所治疗的具体病况,可以将这种药剂配制成液体剂型(例如,溶液剂、 混悬剂或乳剂)或固体剂型(胶囊剂或片剂)并全身或局部施用。如本领域技 术人员已知的,药剂可以例如以定时释放、控制释放或持续缓慢释放形式递送。 用于制剂和施用的技术可见于remington:the science and practice of pharmacy (第20版)lippincott,williams&wilkins(2000)。合适的途径可以包括口服、 颊、经吸入喷雾、舌下、直肠、透皮、阴道、透粘膜、鼻或肠道施用;肠道外 递送,包括肌内、皮下、髓内注射,以及鞘内(intrathecal)、直接心室内、静脉 内、关节内、胸骨内、滑膜内、肝内、病灶内、颅内、腹膜内、鼻内或眼内注 射或其他递送模式。在一些实施方案中,药物组合物口服施用。在一些实施方 案中,药物组合物静脉内施用。在一些实施方案中,药物组合物肌内施用。在 一些实施方案中,药物组合物鞘内施用。在一些实施方案中,药物组合物皮下 施用。
[0168]
对于注射,本公开的药剂可以在水溶液中配制和稀释,例如在生理上相容 的缓冲液如hank's溶液、林格溶液或生理盐水缓冲液中。对于这种透粘膜施用, 在制剂中使用适合于待透过的屏障的渗透剂。这种渗透剂在本领域中通常是已 知的。
[0169]
使用药学上可接受的惰性载体配制本文公开的化合物以将本公开实践成适 于全身施用的剂量在本公开的范围内。通过恰当选择载体和合适的制造实践, 本公开的组合物,特别是配制成溶液的那些组合物可以肠胃外施用,例如通过 静脉内注射。可以使用本领域熟知的药学上可接受的载体很容易地将化合物配 制成适于口服施用的剂量。这种载体能够使本公开的化合物配制成用于被待治 疗的受试者(例如,患者)口服摄取的片剂,丸剂,胶囊剂,液体剂,凝胶剂, 糖浆剂,浆剂,混悬剂等。
[0170]
对于经鼻或吸入递送,本公开的药剂也可以通过本领域技术人员已知的方 法配制,并且可以包括,例如但不限于以下实例:增溶物质、稀释物质或分散 物质,例如盐水;防腐剂,如苯甲醇;吸收促进剂;和碳氟化合物。
[0171]
适用于本公开的药物组合物包括这样的组合物:其中含有有效量的活性成 分以实现其预期目的。有效量的确定在本领域技术人员的能力范围内是熟知的, 特别是根据本文提供的详细公开。通常,根据本公开的化合物在很宽的剂量范 围内是有效的。例如,在成年人的治疗中,可以使用的剂量的实例为每日从0.01 至1000mg,从0.5至100mg,从1至50mg,和每日从5至40mg的剂量。一 个非限制性剂量是每日10至30mg。确切的剂量将取决于施用途径,化合物的 施用形式,待治疗的受试者,待治疗的受试者的体重,化合物的生物利用度, 化合物的吸附、分布、代谢和排泄(adme)毒性和主治医师的偏好和经验。
[0172]
除了活性成分之外,这些药物组合物还可以含有合适的药学上可接受的载 体,所述药学上可接受的载体包含促进活性化合物加工成可药用制剂的赋形剂 和助剂。所配制的用于口服施用的制剂可以是片剂、糖衣丸、胶囊或溶液的形 式。
[0173]
用于口服使用的药物制剂可通过将活性化合物与固体赋形剂组合,任选地 研磨所得混合物,并在加入合适的助剂(如果需要)后,加工颗粒混合物以获 得片剂或糖衣丸芯
(dragee core)来获得。合适的赋形剂是,特别是填充剂,例 如糖,包括乳糖、蔗糖、甘露糖醇或山梨糖醇;纤维素制剂,例如玉米淀粉、 小麦淀粉、大米淀粉、马铃薯淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基 纤维素、羧甲基纤维素钠(cmc)和/或聚乙烯吡咯烷酮(pvp:聚维酮)。如果 需要,可以加入崩解剂,例如交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐,例 如海藻酸钠。
[0174]
糖衣丸芯具有合适的包衣。为此,可以使用浓缩的糖溶液,其可以任选地 含有阿拉伯树胶,滑石,聚乙烯吡咯烷酮,卡波普凝胶,聚乙二醇(peg)和/ 或二氧化钛,漆溶液(lacquer solution)和合适的有机溶剂或溶剂混合物。可将 染料或颜料加入到片剂或糖衣丸包衣中以鉴定或表征不同组合的活性化合物剂 量。
[0175]
可以口服使用的药物制剂包括由明胶制成的推入适配式胶囊(push
‑
fitcapsule),以及由明胶和增塑剂如甘油或山梨糖醇制成的密封软胶囊。推入适配 式胶囊可以含有与填充剂(例如乳糖)、粘合剂(例如淀粉)和/或润滑剂(例如 滑石粉或硬脂酸镁)和任选的稳定剂混合的活性成分。在软胶囊中,可将活性 化合物溶解或悬浮于合适的液体中,例如脂肪油、液体石蜡或液体聚乙二醇 (peg)。另外,可以加入稳定剂。
[0176]
iii.治疗疾病或病症的方法
[0177]
本申请公开的化合物是谷氨酰胺类似物(谷氨酰胺拮抗剂)的口服生物可 利用的低毒性前药,对于涉及谷氨酰胺活性过量和/或异常的疾病或病况,其允 许临床可接受的剂量规范。如本文所用,术语“谷氨酰胺拮抗剂”是指干扰谷氨酰 胺代谢途径的谷氨酰胺类似物,所述干扰谷氨酰胺代谢途径例如抑制或阻断谷 氨酰胺下游的代谢途径,在其中谷氨酰胺充当一种或多种非谷氨酰胺化合物的 前体。这种代谢途径的实例是众所周知的(参见,例如hensley等人,"glutamineand cancer:cell biology,physiology,and clinical opportunities"j clin invest.2013; 123(9):3678
‑
3684;deberardinis等人,"q's next:the diverse functions of glutaminein metabolism,cell biology and cancer"oncogene.2009;29(3):313
‑
324;和medina 等人,"relevance of glutamine metabolism to tumor cell growth"mol cell biochem. 1992;113(1):1
‑
15))。在一些情况下,术语谷氨酰胺拮抗剂还包括谷氨酰胺类似 物,其抑制细胞摄取谷氨酰胺,由此降低其生物活性。其中涉及谷氨酰胺活性 过量和/或异常的疾病或病况包括但不限于感染、癌症、自身免疫疾病和神经退 行性疾病或神经系统疾病和其他中枢神经系统病症。
[0178]
通常,本申请公开的方法导致受试者中疾病或病况的严重程度降低。术语“降 低”是指抑制(inhibit)、抑制(suppress)、减弱(attenuate)、减少(diminish)、 阻止(arrest)或稳定(stabilize)疾病或病况的症状。
[0179]
如本文所用,术语“治疗”等是指减轻(reduce)或改善疾病或病况和/或与其 相关的症状。应当理解,虽然不排除,但治疗疾病或病况不需要病症、病况或 与其相关的症状完全消除。
[0180]
因此,在一些实施方案中,本申请公开的主题提供了一种用于治疗疾病或 病况的方法,所述方法包含以有效治疗所述疾病或病况的量,向需要其治疗的 受试者施用式(i)化合物或其任意药物组合物。
[0181]
本申请公开的主题考虑使用式(i)前药或包含式(i)前药的药物组合物, 其任选地与至少一种抗微生物剂(例如,抗生素、抗病毒剂等)一起使用,以 治疗感染。
[0182]
如本文所用,“感染”是指致病生物侵入宿主生物的身体组织、其繁殖以及宿 主组织对这些生物和它们产生的毒素的反应。考虑使用式(i)化合物或任意其 药物组合物来治疗感染性疾病,例如由任意细菌或病毒引起的感染。
[0183]
在一些实施方案中,感染包含细菌感染。已经在大肠杆菌中证明了don的 抗菌作用(参见coggin等人,"6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine inhibition of escherichia coli,"journal of bacteriology.1965;86)。在一些实施方案中,式(i) 化合物或其任意药物组合物抑制细菌生长和/或存活。
[0184]
在一些实施方案中,感染包含病毒感染。谷氨酰胺类似物,例如don的抗 病毒作用已被证明(参见,例如,cinatl等人,"antiviral effects of 6
‑
diazo
‑5‑
oxo
‑
l
ꢀ‑
norleucine on replication of herpes simplex virus type 1"antiviral research.1997; 33:165
‑
175;nishio等人,"antiviral effect of 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine,antagonistofγ
‑
glutamyl transpeptidase,on replication of human parainfluenza virus type 2," journal of general virology.1990;71:61
‑
67)。考虑使用式(i)化合物或其任意药 物组合物来治疗的病毒感染的实例包括但不限于1型单纯疱疹病毒(hsv
‑
1),2 型单纯疱疹病毒(hsv
‑
2),人巨细胞病毒(hcmv),人2型副流感病毒(hpiv
‑
2), 马罗尼白血病病毒(maloney leukemia virus,mlv),腮腺炎(mumps),副粘病 毒,脊髓灰质炎病毒,3型呼肠孤病毒,呼吸道合胞病毒(rsv),仙台病毒和 水泡性口炎病毒(vsv)。
[0185]
在一些实施方案中,式(i)的化合物或其任意药物组合物抑制病毒复制。 在一些实施方案中,式(i)的化合物或其任意药物组合物抑制1型单纯胞疹病 毒(hsv
‑
1)的复制。在一些实施方案中,式(i)的化合物或其任意药物组合 物抑制2型单纯胞疹病毒(hsv
‑
2)的复制。在一些实施方案中,式(i)的化 合物或其任意药物组合物抑制人巨细胞病毒(hcmv)的复制。在一些实施方 案中,式(i)的化合物或其任意药物组合物抑制人2型副流感病毒(hpiv
‑
2) 的复制。在一些实施方案中,式(i)的化合物或其任意药物组合物抑制马罗尼 白血病病毒(mlv)的复制。在一些实施方案中,式(i)的化合物或其任意药 物组合物抑制腮腺炎的复制。在一些实施方案中,式(i)的化合物或其任意药 物组合物抑制副粘病毒的复制。在一些实施方案中,式(i)的化合物或其任意 药物组合物抑制脊髓灰质炎病毒的复制。在一些实施方案中,式(i)的化合物 或其任意药物组合物抑制3型呼肠孤病毒的复制。在一些实施方案中,式(i) 的化合物或其任意药物组合物抑制呼吸道合胞病毒(rsv)的复制。在一些实 施方案中,式(i)的化合物或其任意药物组合物抑制仙台病毒的复制。在一些 实施方案中,式(i)的化合物或其任意药物组合物抑制水泡性口炎病毒(vsv) 的复制。
[0186]
在一些实施方案中,病毒感染是流感。如本文所用,“流感”是指流感病毒a、 b或c型,副流感病毒和任意其他流感样病毒(参见,例如,u.s.公开no. 2006/0276438,其整体通过引用并入本文,其公开了使用don和重氮丝氨酸用 于治疗流感)。
[0187]
在一方面,本申请公开的主题涉及式(i)化合物或其药物组合物,任选地 与抗病毒剂一起,用于制造用于治疗病毒感染和/或抑制复制的药物的用途。
[0188]
如本文所用,“抗病毒剂”包括抑制病毒在细胞、组织或生物体中的复制的化 合物。考虑与式(i)前药或包含式(i)前药的药物组合物组合使用的抗病毒剂 的实例包括但不限于,阿昔洛韦(acyclovir)(2
‑
氨基
‑
1,9
‑
二氢
‑9‑
[(2
‑
羟乙氧基) 甲基]
‑
6h
‑
嘌呤
‑6‑
酮),伐昔洛韦(valacyclovir)(l
‑
缬氨酸,2
‑
[(2
‑
氨基
‑
1,6
‑
二氢
ꢀ‑6‑
氧代
‑
9h
‑
嘌呤
‑9‑
基)甲氧基]乙酯,喷昔洛韦(pencyclovir)(9
‑
[4
‑
羟基
‑3‑
(羟甲 基丁基)]鸟嘌呤),泛昔洛韦(famcyclovir)(2
‑
[2
‑
(氨基
‑
9h
‑
嘌呤
‑9‑
基)]乙基
‑
1,3
‑ꢀ
丙二醇二乙酸酯),利巴韦林(ribavirin)(1
‑
β
‑
d
‑
呋喃核糖基
‑1‑
h
‑
1,2,4
‑
三氮唑
‑3‑ꢀ
羧酰胺),拉米夫定(lamivudine)((2r,顺式)
‑4‑
氨基
‑1‑
(2
‑
羟甲基
‑
1,3
‑
氧硫杂环 戊
‑5‑
基)
‑
(1h)
‑
嘧啶
‑2‑
酮),金刚烷胺(amantadine)(1
‑
金刚烷胺盐酸盐),和金 刚烷乙胺(α
‑
甲基三环(3.3.1.1/3.7癸
‑1‑
甲胺盐酸盐)。
[0189]
本申请公开的主题考虑使用式(i)前药或包含式(i)前药的药物组合物, 任选地与至少一种化疗剂、至少一种放射治疗剂和/或至少一种免疫治疗剂一起 来治疗癌症。在一些实施方案中,这种治疗包括用放射疗法、免疫疗法、光动 力疗法、质子疗法和/或手术的任何组合的治疗。
[0190]“化疗剂”用于意指在癌症治疗中施用的化合物或组合物。考虑与式(i)前 药或包含式(i)前药的药物组合物组合使用的化疗剂包括但不限于烷化剂类 (alkylating agents),例如塞替派(thiotepa)和环磷酰胺(cyclophosphamide); 烷基磺酸酯类(alkyl sulfonates),例如白消安(busulfan)、英丙舒凡(improsulfan) 和哌泊舒凡(piposulfan);氮丙啶类(aziridines),例如苯佐替派(benzodepa)、 卡波醌(carboquone)、美妥替派(meturedepa)和乌瑞替派(uredepa);乙撑亚 胺类(ethylenimines)和甲基蜜胺类(methylamelamines),包括六甲蜜胺 (altretamine)、三乙撑蜜胺(triethylenemelamine)、三乙撑磷酰胺 (triethylenephosphoramide)、三乙撑硫代磷酰胺(triethylenethiophosphoramide) 和三羟甲蜜胺(trimethylolomelamine);氮芥类(nitrogen mustards),例如苯丁 酸氮芥(chlorambucil)、萘氮芥(chlornaphazine)、氯磷酰胺(cholophosphamide)、 雌莫司汀(estramustine)、异环磷酰胺(ifosfamide)、双氯乙基甲胺 (mechlorethamine)、盐酸氧氮芥(mechlorethamine oxide hydrochloride)、美法 仑(melphalan)、新氮芥(novembichin)、苯芥胆甾醇(phenesterine)、泼尼莫 司汀(prednimustine)、曲磷胺(trofosfamide)、尿嘧啶氮芥(uracil mustard); 亚硝基脲类(nitrosoureas),诸如卡莫司汀(carmustine)、氯脲菌素(chlorozotocin)、 福莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)和雷莫 司汀(ranimustine);抗生素类,例如阿克拉霉素(aclacinomycin)、放线菌素 (actinomycin)、氨茴霉素(anthramycin)、偶氮丝氨酸(azaserine)、博来霉素 (bleomycin)、放线菌素c(cactinomycin)、卡奇霉素(calicheamicin)、carabicin、 洋红霉素(carminomycin)、嗜癌素(carzinophilin)、色霉素(chromomycin)、 放线菌素d(dactinomycin)、柔红霉素(daunorubicin)、地托比星(detorubicin)、 6
‑
重氮
‑5‑
氧代
‑
l
‑
正亮氨酸、多柔比星(doxorubicin)、表柔比星(epirubicin)、 依索比星(esorubicin)、伊达比星(idarubicin)、麻西罗霉素(marcellomycin)、 丝裂霉素类(mitomycins)、霉酚酸(mycophenolic acid)、诺拉霉素(nogalamycin)、 橄榄霉素(olivomycin)、培洛霉素(peplomycin)、泊非霉素(potfiromycin)、 嘌呤霉素(puromycin)、三铁阿霉素(quelamycin)、罗多比星(rodorubicin)、 链黑菌素(streptonigrin)、链佐星(streptozocin)、杀结核菌素(tubercidin)、乌 苯美司(ubenimex)、净司他丁(zinostatin)、佐柔比星(zorubicin);抗代谢物 类,例如甲氨蝶呤和5
‑
氟尿嘧啶(5
‑
fu);
叶酸类似物,例如二甲叶酸(denopterin)、 甲氨蝶呤、蝶罗呤(pteropterin)、三甲曲沙(trimetrexate);嘌呤类似物,例如 氟达拉滨(fludarabine)、6
‑
巯基嘌呤(mercaptopurine)、硫咪嘌呤(thiamiprine)、 硫鸟嘌呤(thioguanine);嘧啶类似物,例如安西他滨(ancitabine)、阿扎胞苷 (azacitidine)、6
‑
氮尿苷、卡莫氟(carmofur)、阿糖胞苷(cytosine arabinoside)、 双脱氧尿苷(dideoxyuridine)、去氧氟尿苷(doxifluridine)、依诺他滨(enocitabine)、 氟尿苷(floxuridine)、5
‑
fu;雄激素类,例如卡鲁睾酮(calusterone)、丙酸屈 他雄酮(dromostanolone propionate)、环硫雄醇(epitiostanol)、美雄烷 (mepitiostane)、睾内酯(testolactone);抗肾上腺类,例如氨鲁米特 (aminoglutethimide)、米托坦(mitotane)、曲洛司坦(trilostane);叶酸补充剂, 例如亚叶酸(folinic acid);醋葡醛内酯(aceglatone);醛磷酰胺糖苷 (aldophosphamide glycoside);氨基乙酰丙酸(aminolevulinic acid);恩尿嘧啶 (eniluracil);安吖啶(amsacrine);bestrabucil;比生群(bisantrene);依达曲沙 (edatraxate);地磷酰胺(defosfamide);地美可辛(demecolcine);地吖醌 (diaziquone);elfornithine;依利醋铵(elliptinium acetate);依托格鲁(etoglucid); 硝酸镓;羟脲(hydroxyurea);香菇多糖(lentinan);氯尼达明(lonidamine); 米托胍腙(mitoguazone);莫哌达醇(mopidamol);二胺硝吖啶(nitracrine); 喷司他丁(pentostatin);蛋氨氮芥(phenamet);吡柔比星(pirarubicin);鬼臼 酸(podophyllinic acid);2
‑
乙基酰肼(ethylhydrazide);丙卡巴肼(procarbazine); 雷佐生(razoxane);西索菲兰(sizofiran);锗螺胺(spirogermanium);细交链 孢菌酮酸(tenuazonic acid);三亚胺醌(triaziquone);2,2
′
,2
″‑
三氯三乙胺;乌拉 坦(urethan);长春地辛(vindesine);达卡巴嗪(dacarbazine);甘露醇氮芥 (mannomustine);二溴甘露醇(mitobronitol);二溴卫矛醇(mitolactol);哌泊 溴烷(pipobroman);gacytosine;阿糖胞苷(arabinoside)(“ara
‑
c”);紫杉烷类 (taxoids),例如紫杉醇(paclitaxel)和多西他塞(doxetaxel);苯丁酸氮芥 (chlorambucil);吉西他滨(gemcitabine);6
‑
硫鸟嘌呤(thioguanine);巯基嘌 呤(mercaptopurine);铂类似物,例如顺铂(cisplatin)和卡铂(carboplatin); 长春碱(vinblastine);铂;依托泊苷(etoposide);异环磷酰胺(ifosfamide); 丝裂霉素(mitomycin c);米托蒽醌(mitoxantrone);长春新碱(vincristine); 长春瑞滨(vinorelbine);诺维本(navelbine);能灭瘤(novantrone);替尼泊苷 (teniposide);道诺霉素(daunomycin);氨基蝶呤(aminopterin);希罗达(xeloda); 伊本膦酸盐(ibandronate);cpt11;拓扑异构酶抑制剂rfs 2000;二氟甲基鸟 氨酸(difluoromethylornithine);视黄酸(retinoic acid);埃斯波霉素类 (esperamicins);卡培他滨(capecitabine);以及任何上述物质的药学上可接受 的盐、酸或衍生物。化疗剂还包括用于调节或抑制激素对肿瘤的作用的抗激素 剂,例如抗雌激素药,包括例如他莫昔芬(tamoxifen)、雷洛昔芬(raloxifene)、 抑制芳香酶的4(5)
‑
咪唑类(aromatase inhibiting 4(5)
‑
imidazoles)、4
‑
羟基他莫昔 芬(hydroxytamoxifen)、曲沃昔芬(trioxifene)、可莫昔芬(keoxifene)、ly117018、 奥那司酮(onapristone)和托瑞米芬(toremifene)(fareston);和抗雄激素药, 例如氟他胺(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、亮 丙瑞林(leuprolide)和戈舍瑞林(goserelin);和任意上述物质的药学上可接受 的盐、酸或衍生物。
[0191]
在一些实施方案中,化疗剂是拓扑异构酶抑制剂。拓扑异构酶抑制剂是干 扰拓扑
难治性的。如本文所用的癌症包括新诊断的或复发的癌症,包括但不限于急性 成淋巴细胞性白血病,急性骨髓性白血病,晚期软组织肉瘤,脑癌,转移性或 侵袭性乳腺癌症,乳腺癌(carcinoma),支气管癌,绒毛膜癌,慢性粒细胞白血 病,结肠癌,结肠直肠癌,尤因氏肉瘤(ewing's sarcoma),胃肠道癌,神经胶 质瘤,多形性胶质母细胞瘤,头颈部鳞状细胞癌,肝细胞癌,何杰金氏病 (hodgkin's disease),颅内室管膜母细胞瘤(intracranial ependymoblastoma),大 肠癌,白血病,肝癌,肺癌,lewis肺癌(lewis lung carcinoma),淋巴瘤,恶 性纤维组织细胞瘤,乳房肿瘤,黑素瘤,间皮瘤,成神经细胞瘤,骨肉瘤,卵 巢癌,胰腺癌,脑桥肿瘤,绝经前乳腺癌,前列腺癌,横纹肌肉瘤,网状细胞 肉瘤,肉瘤,小细胞肺癌,实体瘤,胃癌,睾丸癌和子宫癌。
[0197]
在一些实施方案中,癌症是急性白血病。在一些实施方案中,癌症是急性 成淋巴细胞性白血病。在一些实施方案中,癌症是急性骨髓性白血病。在一些 实施方案中,癌症是晚期软组织肉瘤。在一些实施方案中,癌症是脑癌。在一 些实施方案中,癌症是乳腺癌症(例如,转移性或侵袭性乳腺癌)。在一些实施 方案中,癌症是乳腺癌。在一些实施方案中,癌症是支气管癌。在一些实施方 案中,癌症是绒毛膜癌。在一些实施方案中,癌症是慢性粒细胞白血病。在一 些实施方案中,癌症是结肠癌(例如,腺癌)。在一些实施方案中,癌症是结肠 直肠癌症(例如,结肠直肠癌)。在一些实施方案中,癌症是尤因氏肉瘤(ewing's sarcoma)。在一些实施方案中,癌症是胃肠道癌。在一些实施方案中,癌症是神 经胶质瘤。在一些实施方案中,癌症是多形性胶质母细胞瘤。在一些实施方案 中,癌症是头颈部鳞状细胞癌。在一些实施方案中,癌症是肝细胞癌。在一些 实施方案中,癌症是何杰金氏病。在一些实施方案中,癌症是颅内室管膜母细 胞瘤。在一些实施方案中,癌症是大肠癌。在一些实施方案中,癌症是白血病。 在一些实施方案中,癌症是肝癌症。在一些实施方案中,癌症是肺癌症(例如 肺癌)。在一些实施方案中,癌症是lewis肺癌。在一些实施方案中,癌症是淋 巴瘤。在一些实施方案中,癌症是恶性纤维组织细胞瘤。在一些实施方案中, 癌症包含乳房肿瘤。在一些实施方案中,癌症是黑素瘤。在一些实施方案中, 癌症是间皮瘤。在一些实施方案中,癌症是成神经细胞瘤。在一些实施方案中, 癌症是骨肉瘤。在一些实施方案中,癌症是卵巢癌症。在一些实施方案中,癌 症是胰腺癌症。在一些实施方案中,癌症包含脑桥肿瘤。在一些实施方案中, 癌症是绝经前乳腺癌症。在一些实施方案中,癌症是前列腺癌症。在一些实施 方案中,癌症是横纹肌肉瘤。在一些实施方案中,癌症是网状细胞肉瘤。在一 些实施方案中,癌症是肉瘤。在一些实施方案中,癌症是小细胞肺癌症。在一 些实施方案中,癌症包含实体瘤。在一些实施方案中,癌症是胃癌症。在一些 实施方案中,癌症是睾丸癌症。在一些实施方案中,癌症是子宫癌。
[0198]
在一些实施方案中,癌症包含谷氨酰胺依赖性癌症,其中谷氨酰胺是癌症 (例如,造血肿瘤、肝细胞瘤、埃里希氏癌(ehrilich carcinoma)(参见huber 等人,"uptake of glutamine antimetabolites 6
‑
diazo
‑5‑
oxo
‑
l l
‑
norleucine(don)insensitive and resistant tumor cell lines,"int.j.cancer.1988;41:752
‑
755))中细胞能 量的重要燃料源。
[0199]
在一些实施方案中,癌症是myc依赖性癌症。如本文所用,“myc依赖性癌 症”是指呈现出c
‑
myc的激活、过表达和/或扩增的癌症。在一些情况下,“myc 依赖性癌症”是其中c
‑
myc在增加癌细胞中的谷氨酰胺代谢中起作用的癌症。 myc
‑
依赖性癌症的实例包括但不限
于淋巴瘤、成神经细胞瘤和小细胞肺癌。
[0200]
在一些实施方案中,癌症是mtorc1依赖性癌症。如本文所用,“mtorc1 依赖性癌症”是指其中mtorc1以谷氨酰胺依赖性方式被激活的癌症,即, mtorc1在增加癌细胞中的谷氨酰胺代谢中起作用。
[0201]
本申请公开的主题考虑使用式(i)前药或包含式(i)前药的药物组合物, 任选地与至少一种免疫抑制剂和/或抗炎剂一起,来治疗自身免疫疾病、免疫病 症或炎性病症。
[0202]
如本文所用,“免疫抑制剂”是指可用于免疫治疗以降低或预防细胞、器官、 组织或受试者中的免疫应答的药剂。考虑与式(i)前药或包含式(i)前药的药 物组合物组合使用的免疫抑制剂的实例包括但不限于皮质类固醇激素,钙调磷 酸酶抑制剂,抗增殖剂,sip受体激动剂,激酶抑制剂,单克隆抗淋巴细胞抗体 和多克隆抗淋巴细胞抗体。皮质类固醇激素的非限制性实例包括强的松 (prednisone)(和)和甲基强的松龙(methylprednisolone) 钙调磷酸酶抑制剂的非限制性实例包括环孢霉素 (cyclosporine)(环孢霉素a,sangcya,), isa,tx247,abt
‑
281,asm 981和他克莫司(tacrolimus)(fk506)。 抗增殖剂的非限制性实例包括麦考酚酸酯(mycophenolate mofetil) azathioprene和西罗莫司(sirolimus)sip受体激动 剂的非限制性实例包括fty 720或其类似物。激酶抑制剂的非限制性实例包括 mtor激酶抑制剂,其是靶向、降低或抑制丝氨酸/苏氨酸mtor家族成员的活 性和/或功能的化合物、蛋白质或抗体。它们包括但不限于cci
‑
779,abt578, sar543,雷帕霉素(rapamycin)和其衍生物或类似物,包括40
‑
o
‑
(2
‑
羟乙基)
‑ꢀ
雷帕霉素,雷帕霉素类似物(rapalogs),包括ariad的ap23573、ap23464、ap23675 和ap23841,依维莫司(everolimus)(certican,rad001),咗他莫司(biolimus) 7,咗他莫司9和西罗莫司(rapamune)。激酶抑制剂还包括蛋白激酶c抑制 剂,其包括pct公开wo 2005/097108和wo 2005/068455中描述的化合物,其 整体通过引用并入本文。单克隆抗淋巴细胞抗体的非限制性实例包括莫罗单抗 (muromonab)
‑
cd3(orthoclone)、白细胞介素
‑
2受体拮抗剂 (basiliximab,)和达利珠单抗(daclizumab)多克隆 抗淋巴细胞抗体的非限制性实例包括抗胸腺细胞球蛋白
‑
马和抗胸腺 细胞球蛋白
‑
兔(ratg,)。其它免疫抑制剂包括但不限于在美 国专利公开no.2004/0029801中描述的serp
‑
1,一种由恶性兔纤维瘤病毒 (mrv)和粘液瘤病毒(myx)产生的丝氨酸蛋白酶抑制剂,美国专利公开 no.2004/0029801通过引用并入本文。
[0203]
如本文所用,“抗炎剂”是指可用于预防或减少细胞、组织、器官或受试者中 的炎性反应或炎症的药剂。考虑与式(i)前药或包含式(i)前药的药物组合物 组合使用的示例性抗炎剂包括但不限于甾体抗炎剂、非甾体抗炎剂或其组合。 在一些实施方案中,抗炎剂包括氯倍他索(clobetasol),阿氯芬酸(alclofenac), 双丙酸阿氯米松(alclometasone dipropionate),丙酮缩二羟孕酮(algestoneacetonide),α淀粉酶(alpha amylase),安西法尔(amcinafal),安西非特 (amcinafide),氨芬酸钠(amfenac sodium),盐酸氨普立糖
(amiprilosehydrochloride),阿那白滞素(anakinra),阿尼罗酸(anirolac),阿尼扎芬 (anitrazafen),阿扎丙宗(apazone),巴柳氮二钠(balsalazide disodium),苄达 酸(bendazac),苯噁洛芬(benoxaprofen),盐酸苄达明(benzydaminehydrochloride),菠萝蛋白酶(bromelains),溴哌莫(broperamole),布地奈德 (budesonide),卡布洛芬(carprofen),环洛芬(cicloprofen),辛喷他宗(cintazone), 克利洛芬(cliprofen),丙酸氯倍他索(clobetasol propionate),丁酸氯倍他松 (clobetasone butyrate),氯苯吡咯酸(clopirac),丙酸氯硫卡松(cloticasonepropionate),醋酸三氟米松(cormethasone acetate),去氧可的松(cortodoxone), 地夫可特(deflazacort),丙缩羟强龙(desonide),去羟米松(desoximetasone), 地塞米松(dexamethasone),醋酸地塞米松(dexamethasone acetate),二丙酸地 塞米松(dexamethasone dipropionate),双氯芬酸钾(diclofenac potassium),双 氯芬酸钠(diclofenac sodium),双醋二氟拉松(diflorasone diacetate),二氟米酮 钠(diflumidone sodium),双氟尼酸(diflunisal),二氟泼尼酯(difluprednate), 地弗他酮(diftalone),二甲基亚砜,羟西奈德(drocinonide),甲地松(endrysone), 恩莫单抗(enlimomab),依诺利康钠(enolicam sodium),依匹唑,依托度酸 (etodolac),依托芬那酯,联苯乙酸(felbinac),非那莫(fenamole),芬布芬 (fenbufen),芬氯酸(fenclofenac),苯克洛酸(fenclorac),芬度柳(fendosal), 苯吡噁二酮(fenpipalone),芬替酸(fentiazac),夫拉扎酮(flazalone),氟扎可 特(fluazacort),氟芬那酸,氟咪唑(flumizole),醋酸氟尼缩松(flunisolide acetate), 氟尼辛(flunixin),氟尼辛葡甲胺(flunixin meglumine),氟考丁酯(fluocortinbutyl),醋酸氟米龙(fluorometholone acetate),氟喹宗(fluquazone),氟比洛芬 (flurbiprofen),氟瑞托芬(fluretofen),丙酸氟替卡松(fluticasone propionate), 呋喃洛芬(furaprofen),呋罗布芬(furobufen),哈西奈德(halcinonide),丙酸 卤倍他索(halobetasol propionate),醋酸卤泼尼松(halopredone acetate),异丁 芬酸(ibufenac),布洛芬,布洛芬铝,布洛芬吡啶甲醇(ibuprofen piconol),伊 洛达普(ilonidap),吲哚美辛(indomethacin),吲哚美辛钠,吲哚布洛芬 (indoprofen),吲哚克索(indoxole),吲四唑(intrazole),醋酸异氟泼尼龙 (isoflupredone acetate),伊索克酸(isoxepac),伊索昔康(isoxicam),酮洛芬 (ketoprofen),盐酸洛非咪唑(lofemizole hydrochloride),氯诺昔康(lomoxicam), 依碳酸氯替泼诺(loteprednol etabonate),甲氯灭酸钠(meclofenamate sodium), 甲氯灭酸(meclofenamic acid),二丁酸甲氯松(meclorisone dibutyrate),甲芬那 酸(mefenamic acid),美沙拉秦,美西拉宗(meseclazone),磺庚甲泼尼龙 (methylprednisolone suleptanate),momiflumate,萘丁美酮(nabumetone),甲 氧萘丙酸,甲氧萘丙酸钠,萘普索(naproxol),尼马宗(nimazone),奥沙拉秦 钠(olsalazine sodium),奥古蛋白(orgotein),奥帕诺辛(orpanoxin),奥沙普 秦(oxaprozin),羟布宗(oxyphenbutazone),盐酸瑞尼托林(paranyline hydrochloride),戊聚硫钠(pentosan polysulfate sodium),甘油保泰松钠 (phenbutazone sodium glycerate),吡非尼酮,吡罗昔康(piroxicam),肉桂酸吡 罗昔康,吡罗昔康乙醇胺,吡洛芬(pirprofen),泼那扎特(prednazate),普立 非酮(prifelone),普罗度酸(prodolic acid),普罗喹宗(proquazone),普罗沙 唑(proxazole),枸橼酸普罗沙唑,利美索龙(rimexolone),氯马扎利(romazarit), 柳胆来司(salcolex),沙那西定(salnacedin),双水杨酯(salsalate),血根氯铵, 司克拉宗
(seclazone),丝美辛(sermetacin),舒多昔康(sudoxicam),舒林酸 (sulindac),舒洛芬(suprofen),他美辛(talmetacin),他尼氟酯(talniflumate), 他洛柳酯(talosalate),特丁非隆(tebufelone),替尼达普(tenidap),替尼达普 钠(tenidap sodium),替诺昔康(tenoxicam),替昔康(tesicam),苄叉异喹酮 (tesimide),四氢甲吲胺(tetrydamine),硫平酸(tiopinac),替可的松匹伐酯 (tixocortol pivalate),托美丁(tolmetin),托美丁钠(tolmetin sodium),三氯奈 德(triclonide),三氟米酯(triflumidate),齐多美辛(zidometacin),佐美酸钠 (zomepirac sodium),阿司匹林(乙酰水杨酸),水杨酸,皮质类固醇,糖皮质 激素,他克莫司,吡美莫司(pimecorlimus),其前药,其联合药物及其组合。 抗炎剂还可以是促炎信号传导分子的生物抑制剂,包括这种生物炎症信号传导 分子的抗体。
[0204]
自身免疫是生物体无法将其自身组成部分(低至亚分子水平)识别为“自我”, 其导致针对其自身细胞和组织的免疫应答。由这种异常免疫应答引起的任何疾 病均称为自身免疫疾病。例如,不需要的免疫应答可以是与自身免疫病症、过 敏症或炎性病症相关的免疫应答。术语“免疫病症”是涉及免疫系统的疾病,其可 以包括但不限于过敏症、自身免疫疾病、免疫复合物疾病、免疫缺陷疾病和免 疫系统癌症。在一些实施方案中,自身免疫疾病、免疫病症或炎性病症是多发 性硬化症。
[0205]
本申请公开的主题考虑使用式(i)前药或包含式(i)前药的药物组合物, 任选地与至少一种神经保护剂和/或至少一种神经营养因子和/或至少一种神经 再生剂一起,来治疗神经退行性或神经系统病症或疾病。
[0206]“神经退行性病症”是以神经元结构或功能的逐渐丧失(例如,神经元或其他 神经细胞的退化或功能障碍)为特征的疾病、病症或病况。谷氨酰胺酶催化的 谷氨酰胺水解为谷氨酸是脑谷氨酸的主要来源。正常中枢神经系统(cns)突 触传递利用谷氨酸作为主要兴奋性氨基酸神经递质。据信,过度的谷氨酸能信 号传导(被称为兴奋性中毒)会在各种神经退行性疾病如中风、肌萎缩性侧索 硬化症(als)、亨廷顿舞蹈病、阿尔茨海默病和hiv相关性痴呆中引起cns 损伤。因此,不希望受理论束缚,相信本申请公开的前药可以用于治疗这种神 经退行性疾病,例如通过抑制谷氨酰胺酶以改善由于过量的谷氨酸能信号传导 引起的兴奋性中毒导致的cns损伤。
[0207]
在特定实施方案中,神经退行性病症是多发性硬化症(ms)。don已被证 明可有效改善实验性自身免疫性脑脊髓炎(experimental autoimmuneenchaphalomyelitis,eae),一种多发性硬化(ms)动物模型(参见,例如,shijie, 等人,"blockade of glutamate release from microglia attenuates experimentalautoimmune encephalomyelitis in mice,"tohoku j.exp.med.2009;217:87
‑
92)。在 特定实施方案中,神经退行性病症是hiv相关性痴呆(had)。在特定实施方 案中,神经退行性病症是局部缺血(例如,短暂性缺血性脑损伤)。在特定实施 方案中,神经退行性病症是中风。在特定实施方案中,神经退行性病症是肌萎 缩性侧索硬化(als)。在特定实施方案中,神经退行性病症是亨廷顿舞蹈病。 在特定实施方案中,神经退行性病症是阿尔兹海默病。
[0208]
在一些实施方案中,本申请公开的主题提供了用于抑制在患有疾病或病况 的受试者中发现的谷氨酰胺活性过量和/或异常的方法。如本文所用,术语“抑制
”ꢀ
是指降低(decrease)或减少在受试者中发现的谷氨酰胺活性过量和/或异常。术 语“抑制”还可意指
降低、抑制(supress)、减弱(attenuate)、减少、阻止(arrest) 或稳定(stabilize)疾病或病况的发展或进展。例如,与未治疗的对照受试者或 未患疾病或病症的受试者相比,抑制可以发生至少10%,20%,30%,40%,50%,60%,70%,80%,90%,95%,98%,99%或甚至100%。如本文所用, 术语“谷氨酰胺活性过量”是指与未患类似疾病或病况的受试者中的谷氨酰胺活 性相比,患有疾病或病况的受试者中的谷氨酰胺活性增加,例如增加约100%, 100%,200%,300%,400%,500%,600%,700%,800%,900%,1000% 或更多。如本文所用,术语“谷氨酰胺活性异常”是指与未患类似疾病或病况的受 试者中的谷氨酰胺活性相比,患有疾病或病况的受试者中的谷氨酰胺的生物活 性变化,例如在恶性、瘤性或其他病理性细胞过程的生长和/或增殖中利用谷氨 酰胺的变化。
[0209]
在一些实施方案中,疾病或病况涉及谷氨酰胺活性过量和/或异常。在这些 方面,所述方法进一步包括当施用式(i)化合物或其任意药物组合物时,抑制 过量的和/或异常的谷氨酰胺活性。
[0210]
在另一方面,本申请公开的主题涉及式(i)化合物或其任意药物组合物用 于治疗疾病或病况的用途。在一些实施方案中,式(i)化合物或其任意药物组 合物被用于治疗疾病或病况,所述疾病或病况选自由感染、癌症、自身免疫疾 病、炎性疾病和神经退行性疾病或神经系统疾病组成的组。在一些实施方案中, 式(i)化合物或其任意药物组合物被用于治疗疾病或病况,所述疾病或病况选 自由多发性硬化症、惊厥、癫痫和病毒性脑炎组成的组。在一些实施方案中, 式(i)化合物或其任意药物组合物被用于治疗涉及谷氨酰胺活性过量和/或异常 的疾病或病况。在这些方面,所述用途涉及当使用式(i)化合物或其任意药物 组合物来治疗疾病或病况时,抑制过量的和/或异常的谷氨酰胺活性。
[0211]
iv.一般定义
[0212]
虽然本文使用了具体术语,但是它们仅以一般和描述性的意义使用,而不 是为了限制的目的。除非另外定义,否则本文使用的所有技术和科学术语具有 与本申请描述的主题所属领域的普通技术人员通常理解的相同的含义。
[0213]
尽管以下关于式(i)化合物的术语被认为是本领域普通技术人员很好理解 的,但是仍阐述以下定义以便于解释本申请公开的主题。这些定义旨在补充和 说明,而非排除本领域普通技术人员在阅读本公开后将显而易见的定义。
[0214]
如本文所用,术语取代的(无论前面是否有术语“任选地”)和取代基是指, 如本领域技术人员所理解的,将分子上的一个官能团改变为另一个官能团的能 力,条件是维持所有原子的化合价。当任意给定结构中多于一个位置可以被选 自规定组的多于一个取代基取代时,取代基在每个位置可以相同或不同。取代 基还可以被进一步取代(例如,芳基基团取代基可以具有另一个取代基,例如 在一个或多个位置被进一步取代的另一个芳基基团)。
[0215]
当以其常规化学式(从左至右书写)来说明取代基基团或连接基团时,它 们同样涵盖从右向左书写结构而导致的化学上相同的取代基,例如
‑
ch2o
‑
等同 于
‑
och2‑
;
‑
c(=o)o
‑
等同于
‑
oc(=o)
‑
;
‑
oc(=o)nr
‑
等同于
‑
nrc(=o)o
‑
等。
[0216]
当使用术语“独立地选择”时,所提及的取代基(例如r基团,如基团r1、 r2等,或变量如“m”和“n”)可以是相同的或者不同的。例如,r1和r2都可以是 取代的烷基,或者r1可以是氢,r2可以是取代的烷基等。
[0217]
当用于提及本文取代基的基团时,术语“一个”意指至少一个。例如,当化合 物被“一个”烷基或芳基取代时,该化合物任选地被至少一个烷基和/或至少一个 芳基取代。此外,当一个部分(moiety)被r取代基取代时,该基团可以被称 为“r
‑
取代的”。当一个部分是r
‑
取代的时,该部分被至少一个r取代基取代并 且任选地每个r取代基是不同的。
[0218]
除非本文另有指定,否则所命名的“r”或基团通常具有本领域公认的对应于 具有该名称的基团的结构。出于说明的目的,如上所阐述的某些代表性“r”基团 定义如下。
[0219]
本公开的化合物的描述受本领域技术人员已知的化学键合原理的限制。因 此,在基团可以被一个或多个取代基取代的情况下,选择这种取代是为了符合 化学键合的原理并提供非固有不稳定化合物和/或在环境条件下,例如水性、中 性和几种已知的生理条件下将会被本领域普通技术人员认为可能不稳定的化合 物。例如,根据本领域技术人员已知的化学键合原理,杂环烷基或杂芳基通过 环杂原子与分子的其余部分连接,从而避免固有不稳定化合物。
[0220]
除非另有明确定义,否则如本文所用,“取代基基团”包括选自以下部分中的 一种或多种的官能基团,其在本文定义为:
[0221]
如本文所用,术语烃(hydrocarbon)是指包含氢和碳的任意化学基团。烃 可以是被取代的或未被取代的。如本领域技术人员所知,在进行任何取代时, 所有化合价都必须得到满足(satisfied)。烃可以是不饱和的,饱和的,支链的, 非支链的,环状的,多环的或杂环的。示例性的烃在下文中进一步定义,并且 包括例如甲基,乙基,正丙基,异丙基,环丙基,烯丙基,乙烯基,正丁基, 叔丁基,乙炔基,环己基等。
[0222]
此外,更一般地,“二价碳基(carbyl)”是指充当二价基团的碳原子或包含 一个或多个充当二价基团的碳原子的部分。
[0223]
除非另有说明,否则术语“烷基”自身或作为另一个取代基的一部分是指直链 (即,非支链)或支链、无环或环状烃基或其组合,其可以是完全饱和的、单 不饱和的或多不饱和的并且可以包括二价和多价基团,其具有指定的碳原子数 目(即,c1‑
c
10
指一至十个碳,包括1、2、3、4、5、6、7、8、9和10个碳)。 在特定实施方案中,术语“烷基”是指c1‑
20
(包括端点),包括1、2、3、4、5、6、 7、8、9、10、11、12、13、14、15、16、17、18、19和20个碳的线性(即“直 链”)、支链或环状,饱和的或至少部分不饱和的和在一些情况下完全不饱和的 (即烯基和炔基)烃基,其通过除去单个氢原子而衍生自含有一至二十个碳原 子的烃部分。
[0224]
代表性的饱和烃基包括但不限于甲基,乙基,正丙基,异丙基,正丁基, 异丁基,仲丁基,叔丁基,正戊基,仲戊基,异戊基,新戊基,正己基,仲己 基,正庚基,正辛基,正癸基,正十一烷基,十二烷基,环己基,(环己基)甲基, 环丙基甲基及其同系物和异构体。
[0225]“支链”是指其中低级烷基基团,例如甲基、乙基或丙基,连接至线性烷基链 的烷基基团。“低级烷基”是指具有1至约8个碳原子的烷基基团(即c1‑8烷基), 例如1、2、3、4、5、6、7或8个碳原子。“高级烷基”是指具有约10至约20 个碳原子的烷基基团,例如10、11、12、13、14、15、16、17、18、19或20 个碳原子。在某些实施方案中,“烷基”特别是指c1‑8直链烷基。在某些实施方案 中,“烷基”特别是指c1‑8支链烷基。
[0226]
烷基基团可以任选地被一个或多个烷基基团取代基取代(“取代的烷基”), 所述烷基基团取代基可以相同或不同。术语“烷基基团取代基”包括但不限于烷 基、取代的烷基、卤素、芳基氨基、酰基、羟基、芳氧基、烷氧基、烷硫基、 芳硫基、芳烷氧基、芳烷硫基、羧
基、烷氧羰基、氧代和环烷基。可以任选地 沿烷基链插入一个或多个氧、硫或取代的或未取代的氮原子,其中氮取代基为 氢、低级烷基(在本文中也称为“烷基氨基烷基”)或芳基。
[0227]
因此,如本文所用,术语“取代的烷基”包括如本文所定义的烷基基团,其中 烷基基团的一个或多个原子或官能团被另一个原子或官能团替代,所述另一个 原子或官能团包括例如烷基,取代的烷基,卤素,芳基,取代的芳基,烷氧基, 羟基,硝基,氨基,烷基氨基,二烷基氨基,硫酸根和巯基。
[0228]
除非另有说明,否则术语“杂烷基”本身或与其他术语组合意指稳定的直链或 支链、或环状烃基、或其组合,其由至少一个碳原子和至少一个杂原子组成, 所述杂原子选自由o、n、p、si和s组成的组,并且其中氮、磷和硫原子可以 任选地被氧化并且氮杂原子可以任选地被季铵化。杂原子o、n、p和s和si 可以位于杂烷基基团的任意内部位置,或者位于烷基基团与分子的其余部分连 接的位置。实例包括但不限于
‑
ch2‑
ch2‑
o
‑
ch3,
‑
ch2‑
ch2‑
nh
‑
ch3,
ꢀ‑
ch2‑
ch2‑
n(ch3)
‑
ch3,
‑
ch2‑
s
‑
ch2‑
ch3,
‑
ch2‑
ch
25
‑
s(o)
‑
ch3,
ꢀ‑
ch2‑
ch2‑
s(o)2ch3,
‑
ch=ch
‑
o
‑
ch3,
‑
si(ch3)3,
‑
ch2‑
ch=n
‑
och3,
ꢀ‑
ch=chn(ch3)
‑
ch3,o
‑
ch3,
‑
o
‑
ch2‑
ch3和
‑
cn。多达两个或三个杂原子可以 是连续的,例如
‑
ch2‑
nh
‑
och3和ch2‑
o
‑
si(ch3)3。
[0229]
如上所述,如本文所用,杂烷基基团包括那些通过杂原子与分子的其余部 分连接的基团,例如
‑
c(o)
n
r’,
‑
nr’r”,
‑
or’,
‑
sr,
‑
s(o)r,和/或
‑
s(o2)r’。 当列举“杂烷基”,随后列举具体的杂烷基基团,例如
‑
nr’r等时,应当理解,术 语杂烷基和
‑
nr’r”不是多余的或相互排斥的。而是,列举具体的杂烷基基团以 增加清楚性。因此,术语“杂烷基”在本文中不应被解释为排除具体的杂烷基基团, 例如
‑
nr’r”等。
[0230]“环状”和“环烷基”是指约3至约10个碳原子,例如3、4、5、6、7、8、9 或10个碳原子的非芳族单环或多环环体系。环烷基基团可以任选地是部分不饱 和的。环烷基基团还可以任选地被如本文所定义的烷基基团取代基、氧和/或亚 烷基取代。可以任选地沿环烷基链插入一个或多个氧、硫或取代的或未取代的 氮原子,其中氮取代基为氢、未取代的烷基、取代的烷基、芳基或取代的芳基, 由此提供杂环基团。代表性的单环环烷基环包括环戊基、环己基和环庚基。多 环环烷基环包括金刚烷基,八氢萘基,萘烷,樟脑,莰烷和去甲金刚烷基 (noradamantyl),以及稠环体系,例如二氢萘和四氢萘等。
[0231]
如本文所用,术语“环烷基烷基”是指如上文所定义的环烷基基团,其通过同 样如上所定义的烷基基团连接至母体分子部分。环烷基烷基的实例包括环丙基 甲基和环戊基乙基。
[0232]
术语“环杂烷基”或“杂环烷基”是指非芳族环体系、不饱和或部分不饱和环体 系,例如3元至10元取代的或未取代的环烷基环体系,其包括一个或多个杂原 子,所述杂原子可以相同或不同,并且选自由氮(n)、氧(o)、硫(s)、磷(p) 和硅(si)组成的组,并且任选地可以包括一个或多个双键。
[0233]
环杂烷基环可以任选地与其他环杂烷基环和/或非芳族烃环稠合或以其它方 式连接。杂环的环包括具有一至三个杂原子的那些,所述杂原子独立地选自氧、 硫和氮,其中氮和硫杂原子可以任选地被氧化并且氮杂原子可以任选地被季铵 化。在某些实施方案中,术语杂环是指非芳族5元、6元或7元环或多环基团, 其中至少一个环原子是选自o、s和n的杂原子(其中氮和硫杂原子可以任选 地被氧化),其包括但不限于双环或三环基团,其包含具有一至三个杂原子的稠 合六元环,所述杂原子独立地选自氧、硫和氮,其中(i)每个5元
环具有0至 2个双键,每个6元环具有0至2个双键,并且每个7元环具有0至3个双键, (ii)氮和硫杂原子可以任选地被氧化,(iii)氮杂原子可以任选地被季铵化,以 及(iv)任意上述杂环的环可以与芳基或杂芳基环稠合。代表性环杂烷基环体系 包括但不限于吡咯烷基,吡咯啉基,咪唑烷基,咪唑啉基,吡唑烷基,吡唑啉 基,哌啶基,哌嗪基,二氢吲哚基,奎宁环基,吗啉基,硫代吗啉基,噻二嗪 基(thiadiazinanyl),四氢呋喃基等。
[0234]
除非另有说明,否则术语“环烷基”和“杂环烷基”本身或与其它术语组合,分 别表示“烷基”和“杂烷基”的环状形式。另外,对于杂环烷基,杂原子可以占据杂 环与分子的其余部分连接的位置。环烷基的实例包括但不限于环戊基,环己基, 1
‑
环己烯基,3
‑
环己烯基,环庚基等。杂环烷基的实例包括但不限于1
‑
(1,2,5,6
‑ꢀ
四氢吡啶基),1
‑
哌啶基,2
‑
哌啶基,3
‑
哌啶基,4
‑
吗啉基,3
‑
吗啉基,四氢呋喃
ꢀ‑2‑
基,四氢呋喃
‑3‑
基,四氢噻吩
‑2‑
基,四氢噻吩
‑3‑
基,1
‑
哌嗪基,2
‑
哌嗪基等。 术语“环亚烷基”和“杂环亚烷基”分别指环烷基和杂环烷基的二价衍生物。
[0235]
不饱和烷基基团是具有一个或多个双键或三键的基团。不饱和烷基基团的 实例包括但不限于乙烯基,2
‑
丙烯基,巴豆基(crotyl),2
‑
异戊烯基,2
‑
(丁二烯 基),2,4
‑
戊二烯基,3
‑
(1,4
‑
戊二烯基),乙炔基,1
‑
丙炔基和3
‑
丙炔基,3
‑
丁炔基 和更高级的同系物和异构体。限于烃基的烷基基团被称为“同烷基(homoalkyl)”。
[0236]
更特别地,如本文所用的术语“烯基”是指衍生自c1‑
20
(包括端值)直链或 支链烃部分的单价基团,其通过除去单个氢分子而具有至少一个碳
‑
碳双键。烯 基基团包括例如乙烯基(ethenyl(i.e.,vinyl)),丙烯基,丁烯基,1
‑
甲基
‑2‑
丁烯
ꢀ‑1‑
基,戊烯基,己烯基,辛烯基,丙二烯基和丁二烯基。
[0237]
如本文所用的术语“环烯基”是指含有至少一个碳
‑
碳双键的环烃。环烯基基 团的实例包括环丙烯基,环丁烯基,环戊烯基,环戊二烯,环己烯基,1,3
‑
环己 二烯,环庚烯基,环庚三烯基和环辛烯基。
[0238]
如本文所用的术语“炔基”是指衍生自指定数目碳原子的直链或支链c1‑
20
烃 的单价基团,其含有至少一个碳
‑
碳三键。“炔基”的实例包括乙炔基,2
‑
丙炔基 (炔丙基),1
‑
丙炔基,戊炔基,己炔基和庚炔基等。
[0239]
术语“亚烷基”本身或作为另一取代基的一部分是指衍生自具有1至约20个 碳原子,例如1、2、3、4、5、6、7、8、19、10、11、12、13、14、15、16、 17、18、19或20个碳原子的烷基基团的直链或支链二价脂族烃基。亚烷基基团 可以是直链、支链或环状的。亚烷基基团还可以任选地是不饱和的和/或被一个 或多个“烷基基团取代基”取代。可以任选地沿亚烷基基团插入一个或多个氧、硫 或取代的或未取代的氮原子(在本文中也称为“烷基氨基烷基”),其中氮取代基 是如前所述的烷基。示例性亚烷基基团包括亚甲基(
‑
ch2‑
);亚乙基(
‑
ch2‑
ch2‑
); 亚丙基(
‑
(ch2)3‑
);亚环己基(
‑
c6h
10
‑
);
‑
ch=ch
–
ch=ch
‑
;
‑
ch=ch
–
ch2‑
;
ꢀ‑
ch2ch2ch2ch2‑
、
‑
ch2ch=chch2‑
、
‑
ch2cscch2‑
、
ꢀ‑
ch2ch2ch(ch2ch2ch3)ch2‑
、
‑
(ch2)q
‑
n(r)
‑
(ch2)r
‑
,其中q和r各自独立地为 0至约20的整数,例如0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、 15、16、17、18、19或20,并且r为氢或低级烷基;亚甲二氧基(methylenedioxyl) (
‑
o
‑
ch2‑
o
‑
);和亚乙基二氧基(ethylenedioxyl)(
‑
o
‑
(ch2)2‑
o
‑
)。亚烷基基团 可以具有约2至约3个碳原子并且可以进一步具有6
‑
20个碳。典型地,烷基(或 亚烷基)基团将具有1至24个碳原子,具有10个或更少个碳原子的那些基团 是本公开的一些实施方案。“低级烷基”或
“
低级亚烷基”是较短链的烷基或亚烷基 基团,其通常具有八个或更少的碳原子。
[0240]
术语“杂亚烷基”本身或作为另一个取代基的一部分意指衍生自杂烷基的二 价基团,例如但不限于
‑
ch2‑
ch2‑
s
‑
ch2‑
ch2‑
和
‑
ch2‑
s
‑
ch2‑
ch2‑
nh
‑
ch2‑
。对于 杂亚烷基基团,杂原子也可占据任一个或两个链末端(例如,亚烷氧基,亚烷 基二氧基,亚烷基氨基,亚烷基二氨基等)。而且,对于亚烷基和杂亚烷基连接 基团,连接基团的式子的书写方向不暗示连接基团的取向。例如,式
‑
c(o)or
’ꢀ
代表
‑
c(o)or’和
‑
r’oc(o)。
[0241]
除非另有说明,否则术语“芳基”是指芳族烃取代基,其可以是单环或稠合在 一起或共价连接的多环(例如1至3个环)。芳基包括苯基(c6)、萘基(c
10
)和联 苯基(c
12
)。
[0242]
术语“杂芳基”是指含有一至四个杂原子(在多环的情况下在每个独立的环 中)的芳基基团(或环),所述杂原子选自n、o和s,其中氮和硫原子任选地 被氧化,并且氮原子任选地被季铵化。杂芳基基团可以通过碳或杂原子与分子 的其余部分连接。芳基和杂芳基基团的非限制性实例包括苯基,1
‑
萘基,2
‑
萘基, 4
‑
联苯基,1
‑
吡咯基,2
‑
吡咯基,3
‑
吡咯基,3
‑
吡唑基,2
‑
咪唑基,4
‑
咪唑基,吡 嗪基,2
‑
噁唑基,4
‑
噁唑基,2
‑
苯基
‑4‑
噁唑基,5
‑
噁唑基,3
‑
异噁唑基,4
‑
异噁 唑基,5
‑
异噁唑基,2
‑
噻唑基,4
‑
噻唑基,5
‑
噻唑基,2
‑
呋喃基,3
‑
呋喃基,2
‑ꢀ
噻吩基,3
‑
噻吩基,2
‑
吡啶基,3
‑
吡啶基,4
‑
吡啶基,2
‑
嘧啶基,4
‑
嘧啶基,5
‑ꢀ
苯并噻唑基,嘌呤基,2
‑
苯并咪唑基,5
‑
吲哚基,1
‑
异喹啉基,5
‑
异喹啉基,2
‑ꢀ
喹喔啉基,5
‑
喹喔啉基,3
‑
喹啉基和6
‑
喹啉基。上述芳基和杂芳基环体系中的每 一个的取代基选自下面描述的可接受的取代基组。术语“亚芳基”和“杂亚芳基
”ꢀ
分别指芳基和杂芳基的二价形式。
[0243]
在进一步的实施方案中,术语“杂芳基”是指c5‑
c
20
芳族环,其中至少一个碳 原子被选自o、s、n的杂原子替代,其任选地被至少一个取代基取代,所述取 代基选自由以下组成的组:c1‑
c6烷基,羟基,c1‑
c4烷氧基,巯基,c1‑
c4烷硫 基,氨基,
‑
nh(c1‑
c6烷基),
‑
n(c1‑
c6烷基)2,
‑
o(c6‑
c
12
芳基),
‑
n(c6‑
c
12
芳基)2,
ꢀ‑
nh(c6‑
c
12
芳基),
‑
s(c6‑
c
12
芳基),卤素,
‑
cf3,
‑
so3h,
‑
cooh,
‑
coo(c1‑
c8烷基),
‑
so2nh2,
‑
so2nh(c1‑
c6烷基或c6‑
c
12
芳基),
‑
cn,
‑
no3,
‑
c(o)(c1‑
c8烷基),
‑
c(o)(c6‑
c
12
芳基),
‑
n(c1‑
c6烷基或h)c(o)(c1‑
c6烷基或h),
‑
c(o)
n
(c1‑
c6烷基或h)2。
[0244]
示例性的杂芳基包括但不限于吡啶基、嘧啶基、吡嗪基、呋喃基、噻吩基、 吡唑基、噁唑基、噻唑基、异噻唑基、异噁唑基、吡咯基、咪唑基、吲哚基、 吲哚啉基和咪唑并哒嗪基。
[0245]
在进一步的实施方案中,术语“芳基”还可以指任选地被至少一个取代基取代 的c6‑
c
14
芳基,所述取代基选自由以下组成的组:c1‑
c6烷基,羟基,c1‑
c4烷 氧基,巯基,c1‑
c4烷硫基,氨基,
‑
nh(c1‑
c6烷基),
‑
n(c1‑
c6烷基)2,
‑
o(c6‑
c
12
芳基),
‑
n(c6‑
c
12
芳基)2,
‑
nh(c6‑
c
12
芳基),
‑
s(c6‑
c
12
芳基),卤素,
‑
cf3,
‑
so3h,
ꢀ‑
cooh,
‑
coo(c1‑
c8烷基),
‑
so2nh2,
‑
so2nh(c1‑
c6烷基或c6‑
c
12
芳基),
‑
cn,
ꢀ‑
no3,
‑
c(o)(c1‑
c8烷基),
‑
c(o)(c6‑
c
12
芳基),
‑
n(c1‑
c6烷基或h)c(o)(c1‑
c6烷基或h),
‑
c(o)
n
(c1‑
c6烷基或h)2.
[0246]
为简洁起见,当与其它术语(例如,芳氧基、芳硫氧基(arylthioxy)、芳基 烷基)组合使用时,术语“芳基”包括如上定义的芳基和杂芳基环。因此,术语“芳 基烷基”和“杂芳基烷基”意在包括其中芳基或杂芳基基团与烷基基团连接的那些 基团(例如,苄基、苯乙基、吡啶基甲基、呋喃基甲基等),其包括其中碳原子 (例如亚甲基)已经被例如氧原子取代的那些烷基基团(例如苯氧基甲基、2
‑ꢀ
吡啶氧基甲基、3
‑
(1
‑
萘氧基)丙基等)。然而,如本文所用,术语“卤代芳基”意在 仅覆盖被一个或多个卤素取代的芳基。
[0247]
当杂烷基、杂环烷基或杂芳基包括具体数目的成员(例如“3至7元”)时, 术语“成员”是指碳或杂原子。
[0248]
进一步地,如本文所用,通常由下式表示的结构:
[0249][0250]
是指环结构,例如但不限于3
‑
碳、4
‑
碳、5
‑
碳、6
‑
碳、7
‑
碳等脂族和/或芳香族环 状化合物,包括饱和的环结构、部分饱和的环结构和不饱和的环结构,其包含 取代基r基团,其中r基团可以存在或不存在,并且当存在时,一个或多个r 基团可以各自在环结构的一个或多个可用碳原子上被取代。r基团的存在或不存 在以及r基团的数目由变量“n”的值确定,变量“n”是一个整数,其值的范围通 常为从0至环上可用于取代的碳原子数目。如果有多于一个r基团,则每个r 基团在环结构的可用碳上而不是在另一个r基团上被取代。例如,上述结构(其 中n为0至2)将包含包括但不限于以下的化合物基团:
[0251][0252]
等。
[0253]
在环状环结构中表示键的虚线表示该环中可以存在或不存在该键。即,在 环状环结构中表示键的虚线表示该环结构选自由以下组成的组:饱和的环结构、 部分饱和的环结构和不饱和的环结构。
[0254]
符号表示一个部分与分子的其余部分的连接点。
[0255]
当芳香环或杂环芳香环的被命名的原子被定义为“不存在”时,所述被命名的 原子被直接键(a direct bond)代替。
[0256]
每个上述术语(例如“烷基”,“杂烷基”,“环烷基”和“杂环烷基”,“芳基”,“杂 芳基”,“膦酸酯”和“磺酸酯”以及它们的二价衍生物)意在包括指定基团的取代 和未取代形式。下面提供了每类基团的可选取代基。
[0257]
烷基、杂烷基、环烷基、杂环烷基单价和二价衍生基团(包括通常被称为 亚烷基、烯基、杂亚烷基、杂烯基、炔基、环烷基、杂环烷基、环烯基和杂环 烯基的那些基团)的取代基可以是选自以下但不限于以下的多种基团中的一个 或多个:
‑
or’,=o,=nr’,=n
‑
or’,
‑
nr’r”,
‑
sr’,
‑
卤素,
‑
sir’r”r
”’
,
‑
oc(o)r’,
ꢀ‑
c(o)r’,
‑
co2r’,
‑
c(o)
n
r’r”,
‑
oc(o)
n
r’r”,
‑
nr”c(o)r’,
‑
nr
’‑
c(o)
n
r”r
”’
,
ꢀ‑
nr”c(o)or’,
‑
nr
‑
c(nr’r”)=nr
”’
,
‑
s(o)r’,
‑
s(o)2r’,
‑
s(o)2nr’r”,
ꢀ‑
nrso2r’,
‑
cn和
‑
no2,数目范围为从0至(2m’+l),其中m’是这些基团中碳原 子的总数。r’、r”、r
”’
和r
””
各自可以独立地指氢、取代的或未取代的杂烷基、 取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳 基(例如,被1
‑
3个卤素取代的芳基)、取代的或未取代的烷基、烷氧基或硫代 烷氧基基团或芳基烷基基团。如
本文所用,“烷氧基”基团是通过二价氧与分子的 其余部分连接的烷基。当本公开的化合物包括多于一个r基团时,例如,当存 在多于一个这些基团时,各r基团独立地选择,各自为r’、r”、r
”’
和r
””
基团。 当r’和r”与相同的氮原子连接时,它们可以与氮原子组合形成4元,5元,6 元或7元环。例如,
‑
nr’r”意在包括但不限于1
‑
吡咯烷基和4
‑
吗啉基。从以上 关于取代基的讨论中,本领域技术人员将理解,术语“烷基”意在包括这样的基团: 该基团包括与除氢基以外的基团结合的碳原子,例如卤代烷基(例如
‑
cf3和
ꢀ‑
ch2cf3)和酰基(例如,
‑
c(o)ch3,
‑
c(o)cf3,
‑
c(o)ch2och3等)。
[0258]
与上述关于烷基基团描述的取代基类似,芳基和杂芳基基团(以及它们的 二价衍生物)的示例性取代基是多样的并且选自例如:卤素,
‑
or’,
‑
nr’r”,
ꢀ‑
sr’,sir’r”r
”’
,
‑
oc(o)r’,
‑
c(o)r’,
‑
co2r’,
‑
c(o)nr’r”,
‑
oc(o)nr’r”,
ꢀ‑
nr”c(o)r’,
‑
nr
’‑
c(o)nr”r
”’
,
‑
nr”c(o)or’,
‑
nr
‑
c(nr’r”r
”’
)=nr
””
,
ꢀ‑
nr
‑
c(nr’r”)=nr
”’‑
s(o)r’,
‑
s(o)2r’,
‑
s(o)2nr’r”,
‑
nrso2r’,
‑
cn和
‑
no2, r’,
‑
n3,
‑
ch(ph)2,氟代(c1‑
c4)烷氧基和氟代(c1‑
c4)烷基,数量范围为0 至芳香环体系上的开放化合价的总数;并且其中r’,r”,r
”’
和r
“”
可独立地选 自氢、取代的或未取代的烷基、取代的或未取代的杂烷基、取代的或未取代的 环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基和取代的或未取 代的杂芳基。当本公开的化合物包括多于一个r基团时,例如,当存在多于一 个这些基团时,各r基团独立地选择,各自为r’,r”,r
”’
和r
””
基团。
[0259]
芳基或杂芳基环的相邻原子上的两个取代基可任选地形成式
ꢀ‑
t
‑
c(o)
‑
(crr’)q
‑
u
‑
的环,其中t和u独立地为
‑
nr
‑
,
‑
o
‑
,
‑
crr
’‑
或单键,并 且q是0至3的整数。或者,芳基或杂芳基环的相邻原子上的两个取代基可以 任选地被式
‑
a
‑
(ch2)r
‑
b
‑
的取代基取代,其中a和b独立地为
‑
crr
’‑
,
‑
o
‑
,
‑
nr
‑
,
ꢀ‑
s
‑
,
‑
s(o)
‑
,
‑
s(o)2‑
,
‑
s(o)2nr
’‑
或单键,并且r是1至4的整数。
[0260]
如此形成的新环的单键之一可以任选地被双键替代。或者,芳基或杂芳基 环的相邻原子上的两个取代基可以任选地被式
‑
(crr’)s
‑
x
’‑
(c”r
”’
)
d
‑
的取代基取 代,其中s和d独立地为0至3的整数,并且x’是
‑
o
‑
,
‑
nr
’‑
,
‑
s
‑
,
‑
s(o)
‑
,
‑
s(o)2‑
, 或
‑
s(o)2nr
’‑
。取代基r’,r”,r
”’
和r
””
可独立地选自氢、取代的或未取代的 烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取 代的芳基、取代的或未取代的杂芳基。
[0261]
如本文所用,术语“酰基”是指其中羧基基团的
‑
oh已被另一个取代基替代并 且具有通式rc(=o)
‑
的有机酸基团,其中r是如本文所定义的烷基,烯基,炔 基,芳基,碳环,杂环或芳族杂环基团)。这样,术语“酰基”具体包括芳基酰基 基团,例如2
‑
(呋喃
‑2‑
基)乙酰基)
‑
和2
‑
苯基乙酰基。酰基基团的具体实例包括乙 酰基和苯甲酰基。酰基基团还旨在包括酰胺
‑
rc(=o)nr’,酯
‑
rc(=o)or’,酮
ꢀ‑
rc(=o)r’,和醛
‑
rc(=o)h。
[0262]
术语“烷氧基”(“alkoxyl”或“alkoxy”)在本文中可互换使用,并且是指通过 氧原子与母体分子部分连接的饱和的(即烷基
‑
o
‑
)或不饱和的(即烯基
‑
o
‑
和炔 基
‑
o
‑
)基团,其中术语“烷基”、“烯基”和“炔基”如前所述,并且可以包括c1‑
20 (包括端值)线性、支链或环状的饱和或不饱和的氧代烃链,包括例如,甲氧 基,乙氧基,丙氧基,异丙氧基,正丁氧基,仲丁氧基,叔丁氧基和正戊氧基, 新戊氧基,正己氧基等。
[0263]
如本文所用的术语“烷氧基烷基”是指烷基
‑
o
‑
烷基醚,例如甲氧基乙基或乙 氧基甲基基团。
[0264]“芳氧基”是指芳基
‑
o
‑
基团,其中芳基基团如前所述,包括取代的芳基。如 本文所用的术语“芳氧基”可以指苯氧基或己氧基、和烷基、取代的烷基、卤素或 烷氧基取代的苯氧基或己氧基。
[0265]“芳烷基”是指芳基
‑
烷基
‑
基团,其中芳基和烷基如前所述,并且包括取代的 芳基和取代的烷基。示例性的芳烷基基团包括苄基、苯乙基和萘甲基。
[0266]“芳烷氧基”是指芳烷基
‑
o
‑
基团,其中芳烷基基团如前所述。示例性的芳烷 氧基基团是苄氧基,即c6h5‑
ch2‑
o。芳烷氧基基团可以任选地被取代。
[0267]“烷氧基羰基”是指烷基
‑
o
‑
c(=o)
‑
基团。示例性的烷氧基羰基基团包括甲氧 基羰基,乙氧基羰基,丁氧基羰基和叔丁氧基羰基。
[0268]“芳氧基羰基”是指芳基
‑
o
‑
c(=o)
‑
基团。示例性的芳氧基羰基基团包括苯氧 基
‑
羰基和萘氧基
‑
羰基。
[0269]“芳烷氧基羰基”是指芳烷基
‑
o
‑
c(=o)
‑
基团。示例性的芳烷氧基羰基是苄氧 基羰基。
[0270]“氨基甲酰基”是指式
‑
c(=o)nh2的酰胺基团。“烷基氨基甲酰基”是指 r’rn
‑
c(=o)
‑
基团,其中r和r’中的一个是氢并且r和r’中的另一个是如前所 述的烷基和/或取代的烷基。“二烷基氨基甲酰基”是指r’rn
‑
c(=o)
‑
基团,其中r 和r’各自独立地是如前所述的烷基和/或取代的烷基。
[0271]
如本文所用,术语羰基二氧基指的是式
‑
oc(=o)
‑
or的碳酸酯基团。
[0272]“酰基氧基”是指酰基
‑
o
‑
基团,其中酰基如前所述。
[0273]
术语“氨基”是指
‑
nh2基团,并且还指通过用有机基团替代一个或多个氢基 团而衍生自氨的如本领域已知的含氮基团。例如,术语“酰基氨基”和“烷基氨基
”ꢀ
分别指具有酰基和烷基取代基基团的具体的n
‑
取代的有机基团。
[0274]
如本文所用的“氨基烷基”是指与亚烷基连接子共价结合的氨基。更特别地, 如本文所用的术语烷基氨基、二烷基氨基和三烷基氨基分别指通过氮原子与母 体分子部分连接的一个、两个或三个如前所定义的烷基基团。术语烷基氨基是 指具有结构
‑
nhr’的基团,其中r’是如前所定义的烷基基团;而术语二烷基氨 基是指具有结构
‑
nr’r”的基团,其中r’和r”各自独立地选自由烷基基团组成的 组。术语三烷基氨基是指具有结构
‑
nr'r”r
”’
的基团,其中r’、r”和r
”’
各自独 立地选自由烷基基团组成的组。另外,r’、r”和/或r
”’
一起可以任选地为
‑
(ch2)
k
‑
, 其中k为2至6的整数。实例包括但不限于甲基氨基,二甲基氨基,乙基氨基, 二乙基氨基,二乙基氨基羰基,甲基乙基氨基,异丙基氨基,哌啶基,三甲基 氨基和丙基氨基。
[0275]
氨基基团是
‑
nr’r”,其中r’和r”通常选自氢、取代的或未取代的烷基、取 代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷 基、取代的或未取代的芳基、或取代的或未取代的杂芳基。
[0276]
术语烷基硫醚和硫代烷氧基是指通过硫原子与母体分子部分连接的饱和 (即烷基
‑
s
‑
)或不饱和(即烯基
‑
s
‑
和炔基
‑
s
‑
)基团。硫代烷氧基部分的实例包 括但不限于甲硫基,乙硫基,丙硫基,异丙硫基,正丁硫基等。
[0277]“酰胺基”是指酰基
‑
nh
‑
基团,其中酰基如前所述。“芳酰基氨基”是指芳酰基
ꢀ‑
nh
‑
基团,其中芳酰基如前所述。
[0278]
术语“羰基”是指
‑
c(=o)
‑
基团,并且可以包括由通式r
‑
c(=o)h表示的醛基 基团。
[0279]
术语“羧基”是指
‑
cooh基团。这样的基团在本文中也被称为“羧酸”部分。
[0280]
如本文所用的术语“卤代”、“卤化物”或“卤素”是指氟,氯,溴和碘基团。此 外,术语如“卤代烷基”意在包括单卤代烷基和多卤代烷基。例如,术语“卤代 (c1‑
c4)烷基”意指包括但不限于三氟甲基,2,2,2
‑
三氟乙基,4
‑
氯丁基,3
‑
溴丙基 等。
[0281]
术语“羟基”是指
‑
oh基团。
[0282]
术语“羟烷基”是指被
‑
oh基团取代的烷基基团。
[0283]
术语“巯基”是指
‑
sh基团。
[0284]
如本文所用的术语“氧代”是指与碳原子或另一元素双键连接的氧原子。
[0285]
术语“硝基”是指
‑
no2基团。
[0286]
术语“硫代”是指本文前述的化合物,其中碳或氧原子被硫原子替代。
[0287]
术语“硫酸根(sulfate)”是指
‑
so4基团。
[0288]
如本文所用,术语硫羟基或硫醇是指式
‑
sh的基团。
[0289]
更特别地,术语“硫化物(sulfide)”是指具有式
‑
sr基团的化合物。
[0290]
术语“砜”是指具有磺酰基基团
‑
s(o2)r的化合物。
[0291]
术语“亚砜”是指具有亚磺酰基基团
‑
s(o)r的化合物。
[0292]
术语脲基是指式
‑
nh
‑
co
‑
nh2的脲基基团。
[0293]
在整篇说明书和权利要求书中,给定的化学式或名称应当包括所有互变异 构体、同类物、和光学异构体和立体异构体,以及存在这些异构体和混合物的 外消旋混合物。
[0294]
本公开的某些化合物可以具有不对称碳原子(光学或手性中心)或双键; 对映异构体、外消旋体、非对映异构体、互变异构体、几何异构体、立体异构 体形式(其可按照绝对立体化学被定义为(r)
‑
或(s)
‑
,或对于氨基酸被定义为d
‑ꢀ
或l
‑
)以及单独的异构体被包含在本公开的范围内。本公开的化合物不包括本 领域已知的对于合成和/或分离而言太不稳定的化合物。本公开意在包括外消旋、 非外消旋混合的(scalemic)和光学纯形式的化合物。可以使用手性合成子或手 性试剂制备,或使用常规技术拆分光学活性(r)
‑
和(s)
‑
异构体或d
‑
和l
‑
异构体。 除非另有说明,否则当本文所述的化合物含有烯键(olefenic bond)或其他几何 不对称中心时,其意指化合物包括e和z几何异构体。
[0295]
除非另有说明,否则本文所述的结构还意在包括结构的所有立体化学形式; 即,每个不对称中心的r和s构型。因此,本发明化合物的单一立体化学异构 体以及对映体和非对映体混合物在本公开的范围之内。
[0296]
对于本领域技术人员显而易见的是,本公开的某些化合物可以以互变异构 形式存在,所有这些化合物的互变异构形式均在本公开的范围之内。如本文所 用,术语“互变异构体”是指平衡存在的并且容易从一种异构体形式转化为另一种 异构体形式的两种或更多种结构异构体中的一种。
[0297]
除非另有说明,否则本文所述的结构还意在包括这样的化合物:该化合物 的不同之处仅在于一个或多个同位素富集的原子的存在。例如,具有本申请的 结构,氢被氘或氚替代,或碳被
13
c或
14
c富集的碳替代的化合物,在本公开的 范围内。
[0298]
本公开的化合物还可以在构成这些化合物的一个或多个原子处含有非天然 比例
的原子同位素。例如,可以用放射性同位素例如氚(3h)、碘
‑
125(
125
i)或 碳
‑
14(
14
c)放射性标记化合物。本公开化合物的所有同位素变体,不管是否是 放射性的,都包括在本公开的范围之内。
[0299]
本公开的化合物可以以盐的形式存在。本公开包括这种盐。适用的盐形式 的实例包括盐酸盐,氢溴酸盐,硫酸盐,甲磺酸盐,硝酸盐,马来酸盐,乙酸 盐,柠檬酸盐,富马酸盐,酒石酸盐(例如(+)
‑
酒石酸盐、(
‑
)
‑
酒石酸盐或其混合 物,包括外消旋混合物,琥珀酸盐,苯甲酸盐,和与氨基酸如谷氨酸的盐。这 些盐可以通过本领域技术人员已知的方法制备。还包括碱加成盐,如钠、钾、 钙、铵、有机氨基或镁盐或类似的盐。当本公开的化合物含有相对碱性的官能 团时,可以通过在无溶剂条件下或在合适的惰性溶剂中或通过离子交换,使这 种化合物的中性形式与足够量的所需酸接触来获得酸加成盐。可接受的酸加成 盐的实例包括衍生自无机酸如盐酸、氢溴酸、硝酸、碳酸、一氢碳酸、磷酸、 一氢磷酸、二氢磷酸、硫酸、一氢硫酸、氢碘酸或亚磷酸等的盐,以及衍生自 有机酸如乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、 富马酸、乳酸、扁桃酸、苯二甲酸、苯磺酸、对甲苯磺酸(p
‑
tolylsulfonic)、柠 檬酸、酒石酸、甲磺酸等的盐。还包括氨基酸如精氨酸等的盐,和有机酸如葡 糖醛酸或半乳糖醛酸等的盐。本公开的某些具体化合物同时含有碱性和酸性官 能团,其允许化合物转化为碱或酸加成盐。
[0300]
化合物的中性形式可以通过以常规方式使盐与碱或酸接触并分离母体化合 物而再生。化合物的母体形式在某些物理性质(例如在极性溶剂中的溶解度) 方面不同于各种盐形式。
[0301]
本公开的某些化合物可以以非溶剂化形式以及溶剂化形式存在,包括水合 形式。通常,溶剂化形式等同于非溶剂化形式,并且包括在本公开的范围内。 本公开的某些化合物可以以多晶(multiple crystalline)或无定形形式存在。通常, 对于本公开所考虑的用途,所有物理形式是等同的,并且旨在包括在本公开的 范围内。
[0302]
除了盐形式之外,本公开提供了前药形式的化合物。本文所述化合物的前 药是在生理条件下容易经历化学变化以提供本公开化合物的那些化合物。另外, 前药可以在离体环境中通过化学或生物化学方法转化为本公开的化合物。例如, 当置于具有合适的酶或化学试剂的透皮贴剂储库中时,前药可以缓慢转化为本 公开的化合物。
[0303]
遵循长期的专利法规约,当在本申请,包括权利要求书中使用时,术语“一”,
ꢀ“
一个”和“该”是指“一个或多个”。因此,例如,除非上下文明确相反(例如,多 个主题),否则提及“一个主题”包括多个主题,等等。
[0304]
在整篇说明书和权利要求书中,除非上下文另有要求,否则术语“包含”以非 排他性的含义使用。同样,术语“包括”及其语法变体意指非限制性的,使得列表 中的项目的逐一列举不是排除可被取代或添加到所列项目的其他类似项目。
[0305]
出于本说明书和所附权利要求书的目的,除非另外指明,否则说明书和权 利要求书中使用的表示量、大小、尺寸、比例、形状、配方、参数、百分比、 量、特性和其他数值的所有数字都被理解为在所有情况下均由术语“约”修饰,尽 管术语“约”可能未明确地与该值、量或范围一起出现。因此,除非有相反指示, 否则在下面的说明书和所附权利要求书中阐述的数字参数不是也不必是精确 的,而是根据本公开主题试图获得的预期性质因为预期、反映公差、转换因子、 舍入、测量误差等,以及本领域技术人员已知的其他因素,其可以是
近似的和/ 或更大或更小。例如,当提及数值时,术语“约”可以意指涵盖在一些实施方式中 具体量的
±
100%变化,一些实施方式中
±
50%,一些实施方式中
±
20%,一些实 施方式中
±
10%,一些实施方式中
±
5%,一些实施方式中
±
1%,一些实施方式中
ꢀ±
0.5%,一些实施方式中
±
0.1%,因为这样的变化适于执行所公开的方法或者使 用所公开的组合物。
[0306]
此外,当与一个或多个数字或数字范围结合使用时,术语“约”应理解为指代 所有这种数字,包括范围内的所有数字,以及通过延伸边界至高于或低于所述 数值来修改该范围。通过端点限定的数值范围的记载包括包含在该范围内的所 有数字,例如整数,包括其分数(例如,1至5的记载包括1、2、3、4和5, 及其分数,例如1.5、2.25、3.75、4.1等)以及该范围内的任意范围。
[0307]
实施例
[0308]
包括以下实施例以向本领域的普通技术人员提供用于实践本公开主题的代 表性实施方式的指导。根据本公开和本领域的普通技术水平,技术人员可以理 解,以下实施例仅旨在作为示例,并且可以在不脱离本公开主题的范围的情况 下采用多种改变、修改和变更。以下的合成描述和具体实施例仅用于说明的目 的,并且不被解释为以任何方式限制通过其他方法制备本公开的化合物。
[0309]
实施例1
[0310]
方法
[0311]
一般程序:原样使用市售的hplc级甲醇、催化剂和试剂级材料。在硅胶 60f254涂覆的铝片(merck)上进行tlc,并且通过ce(so4)2溶液检测斑点。 4h2o(1%)和h3p(mo3o
10
)4(2%)于硫酸(10%)中。使用isolera one hpfc 系统(biotage公司)在硅胶60(0.040
‑
0.063mm,fluka)上或在 kp
‑
c18
‑
hs或snap盒上进行快速色谱法。所有化学品均购自 sigma
‑
aldrich,并且不经进一步纯化而使用。在400.1mhz、500.1mhz或600.1mhz处测量1h nmr谱,在100.8mhz、125.7mhz或150.9mhz处测量
13
c nmr 谱。对于1h nmr谱的标准化,使用tms的内部信号(δ0.0,cdcl3)或溶剂 的残余信号(对于cdcl3为δ7.26,对于cd3cocd3为δ2.05,对于cd3od为 δ3.31)。在
13
c谱的情况下,使用溶剂的残余信号(对于cdcl3为δ77.00,对 于cd3cocd3为δ29.84和δ206.26,对于cd3od为δ49.00)。化学位移以δ标 度给出,偶合常数j以hz给出。使用zq微质量质谱仪(waters)记录esi质 谱,所述zq微质量质谱仪配备有esci多模离子源并由masslynx软件控制。 或者,使用四极正交加速飞行时间串联质谱仪(q
‑
tof micro,waters)记录低分 辨率esi质谱,使用混合ft质谱仪结合线性离子阱ms和orbitrap质量分析仪 (ltq orbitrap xl,thermo fisher scientific)记录高分辨率esi质谱。在esiorbitrap源(氮气的鞘气流速35a.u.,辅助气流速10a.u.,源电压4.3kv,毛细 管电压40v,毛细管温度275℃,套管透镜电压(tube lens voltage)155v)中 针对合适的电离对这些条件进行了优化。将样品溶解于甲醇中并通过直接注射 应用。使用autopol iv仪器(rudolph research analytical)在chcl3或dmf中 测量旋光度。在chcl3或kbr中测量ir光谱。
[0312]
小鼠功效研究。所有小鼠功效研究均根据约翰霍普金斯大学动物护理和使 用委员会批准的方案#mo13m69进行。获得25至30g的雌性无胸腺 (rh
‑
foxn1nu小鼠)小鼠(harlan sprague dawley公司,indianapolis,indiana), 并保持12小时的明暗循环,随意取用食物和水。在每只小鼠侧腹的四个分开的 位置皮下注射u87人神经胶质瘤细胞(5
×
106个细胞于100ml pbs中)。当肿瘤 生长至约200mm3的平均体积时,将小鼠随机分配至溶媒(hepes
‑
缓冲盐水, i.p.)或don(1;0.8mg/kg,i.p.)中。在一个队列中,向小鼠施用单剂量的适 当溶液,两小时后,如前所述(le等人,2012)定量肿瘤中的谷氨酰胺水平。 简而言之,收集肿瘤,速冻,并在液n2中均质化,然后使用甲醇和di水进行 代谢物提取。使用agilent 6520四极杆飞行时间(q
‑
tof)质谱仪和agilent 1290 hplc并使用agilent mass hunter和agilent定性和定量分析软件包进行定量。 对于每个单独肿瘤(n=3
‑
4/组),谷氨酰胺含量按组平均,描绘为相对强度,并 且通过单尾t检验分析。在第二个队列中,进行了功效实验。小鼠每日注射一次, 持续六天;在治疗开始后2、4和6天使用数字卡尺测量并且根据下式计算肿瘤 体积:[体积=(最大肿瘤尺寸)
×
(最小肿瘤尺寸)2×
0.52]。将每个单独的肿瘤 (n=8
‑
10/组)标准化至其预处理体积,平均化并通过重复测量双向方差分析 (anova)进行分析。如果有显著性,随后应用bonferroni事后检验。将显著 性定义为p<.05。
[0313]
体外稳定性研究:将大多数前药的储备溶液制备成10mm的dmso溶液以 进行体外研究。
[0314]
使用模拟胃液(sgf;ph 1.2)和磷酸盐缓冲盐水(pbs;ph 7.4)评估前 药的化学稳定性。简而言之,在各自的溶液中掺入前药(10μm),并在37℃孵 育1h。在预定时间点(0、30和60min),取出100μl的等分试样并用100μl 的水稀释。使用如下所述的开发的液相色谱和串联质谱(lc/ms/ms)方法监测 前药消失。
[0315]
对于代谢稳定性,使用血浆(狗,人,猴,小鼠和猪和人)。对于稳定性, 在每个基质中掺入前药(10μm),并在37℃的定轨摇床中孵育。在预定的时间 (0、30和60min),取出三份100μl的混合物等分试样,通过加入三倍体积的 掺入了内标(氯沙坦0.5μm)的冰冷乙腈淬灭反应。将样品涡旋30s并12000g 离心10min。将用50μl水稀释的50μl上清液转移至用teflon帽密封的250μl 聚丙烯小瓶中。使用如下所述的液相色谱和串联质谱(lc/ms/ms)方法随时间 监测前药消失。
[0316]
对于lc/ms/ms,在安捷伦c18(100
×
2.1mm内径)uplc柱上用偶联到 accela开放式自动进样器的thermo scientific accela uplc系统分离前药。自动 进样器是温度控制的并且在10℃下操作。用于色谱分离的流动相由含有0.1%甲 酸的乙腈/水组成,并使用梯度洗脱以0.5ml/分钟的流速运行4.5分钟。使用tsqvantage三重四极杆质谱检测器监测色谱柱流出物,该检测器配备有以正离子化 模式设置的电喷雾探头。样品通过加热的雾化探头(350℃)引入至电离源中。
[0317]
对于剩余化合物的定量,由分析物的峰面积与is的比测量前药的消失。剩 余百分比按以下方式计算:
[0318][0319]
其中响应=[(分析物的面积)/(内标的面积)]
[0320]
*平均响应是两个样本在每个时间点的平均值。
[0321]
小鼠中的药代动力学研究。根据约翰霍普金斯大学动物护理和使用委员会 批准的方案(#mo13m113)进行小鼠中的所有药代动力学研究。从harlan获 得25至30g的c57bl/6小鼠,并保持12小时的明暗循环,随意取用食物和水。 为了评估don和其前药5c的脑和血浆
药代动力学,向8
‑
12周龄的c57bl/6施 用don(1;0.8mg/kg,p.o.于磷酸盐缓冲盐水中)和其前药5c(以0.8mg/kg 相当的don(1),p.o.于具有5%etoh和5%吐温
‑
80的磷酸盐缓冲盐水中)。在 施用药物后10、30和90分钟通过戊巴比妥注射处死小鼠,并通过心脏穿刺收 集血液并放入冰冻的edta包被的bd微量采血管中。将血样以2000g离心15 分钟,去除血浆并储存于
‑
80℃。收集血液后收集脑组织并立即在液氮中快速冷 冻并储存在
‑
80℃直至lc/ms分析。
[0322]
非人类灵长类中的药代动力学研究。所有猴研究均根据约翰霍普金斯大学 动物护理和使用委员会批准的方案(#pr15m298)进行。将两只雌性短尾猴(约 3.5kg,未用药(non
‑
drug naive))相邻地置于社交互动架(a social interaction rack) 上的不锈钢笼中(含有4个笼,每个32.5”宽
×
28”深
×
32”高),根据美国农业部 动物福利法(美国农业部动物福利法案(9cfr,第1,2和3部分)),维持温 度64
‑
84f,湿度30
‑
70%,14
‑
10小时明/暗循环交替。每天以适合于动物大小和 年龄的量提供食物,并且通过笼内lixit阀门随意提供ro净化水。周一至周五 提供丰富的食物。施用药物之前,在施用测试物品之前,肌内注射氯胺酮使短 尾猴镇静。通过血液和脑脊液(csf)样品采集,用起始速率为15mg/kg的氯 胺酮维持镇静,在第一小时期间添加剂量为20
‑
30mg。在随后的时间点,以10
‑
15 mg/kg给予氯胺酮。以1ml/kg的剂量体积,向动物静脉注射施用(1.6mg/kg 当量)don(50mm hepes缓冲盐水)和5c(非对映异构体1)(含有5%乙醇 和5%吐温的50mm hepes缓冲盐水)。在给药后30min,通过经皮穿刺小脑 延髓池(cisterna magna)获得csf样品(目标50μl)。通过经皮穿刺外周静脉, 在给药后15、30、1、2、4和6h收集血液样品(1ml)。对样品进行血浆处理 (在4℃的温度下,在3,000xg下离心10分钟)。在整个处理过程中,将所有样 品在冰上保持冰冷。将样品收集在微量离心管中,快速冷冻,并置于冰箱中保 持
‑
80℃,直至lc/ms分析。
[0323]
don的生物分析。先前已经发表了用于在生物基质中分析don的高度灵 敏的方法(alt,等人,2015)。然而,由于don及其前药的化学不稳定性,因此 开发并验证了一种使用丹磺酰氯(dabsyl chloride)的温和衍生方法。简言之, 通过在低保留管中涡旋振荡,用250μl含有谷氨酸盐
‑
d5(10μm istd)的甲醇 从样品(50mg)中提取don。将样品在16,000
×
g下离心5分钟以沉淀蛋白质。 将上清液(200μl)移至新管中并在45℃下在真空下干燥1小时。向每个管中 加入50μl的0.2m碳酸氢钠缓冲液(ph 9.0)和100μl的10mm丹磺酰氯的 丙酮溶液。涡旋后,将样品在60℃孵育15分钟以进行衍生化。注射样品(2μl), 并在配备有agilent eclipse plus c18rrhd 2.1
×
100mm柱的agilent 1290上经 过20
‑
95%乙腈+0.1%甲酸的2.5分钟梯度分离,并在agilent 6520qtof质谱 仪上定量。使用加权因子为1/(标称浓度)的线性回归,由分析物与内标物的 峰面积比构建don在血浆和csf中.005
‑
17.1μg/ml范围内的校准曲线。在所 有分析运行中获得大于0.99的相关系数。对于所有分析物的标准和qc的反向 计算浓度的平均预测相对标准偏差在85至115%的范围内,除了在80至120% 的范围内的最低浓度,其总准确度(accuracy)和精密度(precision)分别为6.7% 和6.6%。
[0324]
药代动力学分析。平均浓度
‑
时间数据用于药代动力学分析。使用(版本5.3)中的非房室分析模块来评估药代动力学参数。峰值血浆 浓度(c
max
)和到c
max
的时间(t
max
)是观察值。通过对数
‑
线性梯形规则计算 曲线下面积(auc)至样品收集结束(auc
last
)。
[0325]
用于药物代谢动力学分析don从其前药释放的程序:
[0326]
通过在低保留管中涡旋振荡,用250μl含有谷氨酸盐
‑
d5(10μm istd)的 甲醇从样品(50μl)中提取don。将样品在16,000
×
g下离心5分钟以沉淀蛋 白质。将上清液(200μl)移至新管中并在45℃下在真空下干燥(近1小时)。 向每个管中加入50μl的0.2m碳酸氢钠缓冲液(ph 9.0)和100μl的丹磺酰氯 储备液。涡旋后,将样品在60℃孵育15分钟以进行衍生化。注射样品(2
‑
10μl), 并在配备有sb
‑
aq柱的agilent 1290上经过20
‑
95%乙腈+0.1%甲酸的4分钟 梯度分离,并在agilent 6520qtof质谱仪上定量。
[0327]
实施例2
[0328]
前药策略
‑
掩蔽羧酸酯官能团
[0329]
在一个实施方案中,通过使用具有未保护的α
‑
氨基基团的don的烷基酯仅 掩蔽羧酸酯官能团来设计don前药。然而,一些具有未保护的α
‑
氨基官能团的 don烷基酯被发现经历了环化形成5元环状schiff's碱。所观察到的环化是ph 依赖性的,并且在ph 5
‑
7时快速。在较低ph下,其通常会阻止或逆转环化, 重氮官能团变得不稳定。结果,环化实际上是不可逆的,使得一些不含n
‑
α的 烷基酯不适合作为don前药(图1)。
[0330]
实施例3
[0331]
前药策略
‑
掩蔽氨基官能团
[0332]
在另一个实施方案中,通过使用具有未保护的羧基官能团的don的n
‑
保 护的衍生物仅掩蔽氨基官能团来设计don前药。具有未保护的羧基官能团的 don的n
‑
保护的衍生物(图1和图1)也不稳定。更具体地说,酸性羧基官能 团引起重氮基团逐渐缓慢分解。在某些盐形式中,羧酸根阴离子使n
‑
α
‑
保护基 团不稳定。更进一步,如图1、图1、图1、图1和图1所示,当口服给药时, 与don相比,具有游离羧酸酯的许多测试前药(除26以外)暴露量可忽略不 计,进一步表明衍生化羧酸酯和胺官能团对于口服利用度的益处。
[0333]
实施例4
[0334]
合成
[0335]
代表性前药化合物的合成方案如下所示(方案1、方案2、方案3、方案4、 方案5、方案6、方案7和方案8)。
[0336]
方案1
[0337][0338]6‑
重氮
‑2‑
((二苯氧磷酰基)氨基)
‑5‑
氧代己酸异丙酯(4)的合成 [0339]1‑
(9h
‑
芴
‑9‑
基甲基)2
‑
(1
‑
甲基乙基)5
‑
氧代吡咯烷
‑
1,2
‑
二羧酸酯(1)。参考方 mmol,0.95当量)的溶液,并将该溶液在相同温度下搅拌15min。在
‑
78℃下通 过套管将所得的黄色混合物转移至fmoc氯化物(22.2g,85.8mmol,5当量) 的无水thf(90ml)溶液中。将反应混合物在
‑
78℃下搅拌2h。这段时间之后, 将反应用饱和的nh4cl(100ml)淬灭。然后用乙酸乙酯(3
×
50ml)萃取,将 合并的有机层用水(40ml)、盐水(40ml)洗涤并经无水mgso4干燥。将有 机溶剂真空蒸发。将残余物在硅胶(己烷
‑
乙酸乙酯2:1)上层析,得到所需产 物1(6.2g,92%),为无色固体。1h nmr(400mhz,cdcl3):1.23(3h,d,j=6.2), 1.26(3h,d,j=6.3),2.06
–
2.13(1h,m),2.34
–
2.45(1h,m),2.53
–
2.61(1h,m), 2.67
–
7.76(1h,m),4.31(1h,t,j=7.5),4.40
–
4.44(1h,m),4.53
–
4.57(1h,m), 4.65(1h,dd,j=9.4,2.6),5.07(1h,hept,j=6.3),7.31
–
7.35(2h,m),7.39
–
7.43 (2h,m),7.71
–
7.78(4h,m).
13
c nmr(101mhz,cdcl3):21.69,21.78,22.01, 31.31,46.64,58.99,69.20,69.78,120.06,120.08,125.43,125.57,127.32(2c), 127.98(2c),141.31,141.33,143.39,143.43,151.56,170.58,172.92.旋光度:[α]
22d
ꢀ‑
24.1
°
(c 0.332,chcl3).ir(chcl3):3068w,3029m,2985m,2939w,2883vw, 1797s,1758s,sh,1739vs,1724vs,sh,1609vw,1580vw,1479w,1463m,1452s, 1421w,1386s,1377m,1305vs,1194m,1105s,1045m,1033m,621w,425wcm
‑1.esi ms:416([m+na]
+
).hr esi ms:c
23
h
23
o5nna的计算值416.14684; 实测416.14694。
[0340]2‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)
‑6‑
重氮
‑5‑
氧代己酸异丙酯(2)。参考方 案1,在氩气下将三甲基硅烷基重氮甲烷溶液(2m于二 m于己烷中,4.9ml,12.23mmol,1.23当量)的溶液,并将该溶液在
‑
98℃ 下搅拌30min。在
‑
116℃下通过套管将所得的混合物转移至先前化合物1(3.91 g,9.94mmol,1当量)的无水thf(100ml)溶液中。将反应混合物缓慢升温 至
‑
78℃,然后用饱和的nh4cl淬灭。然后用乙酸乙酯(3
×
50ml)萃取,将合 并的有机层用水(40ml)、盐水(40ml)洗涤并经无水mgso4干燥。将有机 溶剂真空蒸发。将残余物在硅胶(氯仿
‑
丙酮20:1)上层析,得到所需产物2 (3.68g,85%),为淡黄色固体。1h nmr(400mhz,cdcl3):1.25
–
1.28(6h,m), 1.95
–
2.04(1h,m),2.17
–
2.26(1h,m),2.31
–
2.52(2h,m),4.22(1h,t,j=7.1), 4.29
–
4.43(3h,m),5.06(1h,hept,j=6.1),5.27(1h,s),5.59(1h,d,j=8.2),7.30
ꢀ–
7.34(2h,m),7.38
–
7.42(2h,m),7.59
‑
7.62(2h,m),7.75
–
7.77(2h,m).
13
cnmr(101mhz,cdcl3):21.81,21.84,27.69,36.56,47.21,53.67,67.10,69.62, 120.08,120.09,125.18,125.21,127.16(2c),127.81(2c),141.35,141.37,143.75, 143.96,156.16,171.50,193.67.旋光度:[α]
22d
+15.1
°
(c 0.674,chcl3).ir (chcl3):3428m,3116w,3068w,2985m,2940w,2882w,2110vs,1731vs,sh, 1719vs,1641s,1608w,sh,1580vw,1509s,1478m,1466m,1451s,1418w,sh, 1386s,sh,1377s,1349s,1232s,1105s,1052s,1033m,622w,539m,488m,426 w cm
‑1.esi ms:458([m+na]
+
).hr esi ms:c
24
h
25
o5nan的计算值 458.16864;实测458.16873。
[0341]2‑
氨基
‑6‑
重氮
‑5‑
氧代己酸异丙酯(3)。参考方案1,将先前的化合物2(900 mg,2.07mmol)溶解于二氯甲烷(10ml)中。加入 在硅胶(氯仿
‑
甲醇30:1)上层析,得到所需产物(290mg,66%),为黄色 油状物。1h nmr(400mhz,cdcl3):1.21(3h,d,j=1.8),1.23(3h,d,j=1.8), 1.52(2h,bs),1.74
–
1.85(1h,m),2.02
–
2.10(1h,m),2.36
–
2.53(2h,bm),3.37 (1h,dd,j=8.4,5.0),5.00(1h,hept,j=6.3),5.27(1h,s).
13
c nmr(101mhz, cdcl3):21.87,21.89,29.65,36.99,53.94,68.64,175.21,194.25.旋光度:[α]
22d
+ 6.5
°
(c 0.444,chcl3).ir(chcl3):3390w,3323vw,3116w,2984s,2939m,2877 w,2109vs,1725vs,1640s,1467m,1454m,1439w,sh,1388s,sh,1376vs,1349s, 1199s,1106vs cm
‑1.esi ms:236([m+na]
+
);hr esi ms:c9h
15
o3n3na的计算 值236.1006;实测236.1007。
[0342]6‑
重氮
‑2‑
((二苯氧磷酰基)氨基)
‑5‑
氧代己酸异丙酯(4)。参考方案1,将异 μl,0.75mmol,2当量)。将反应混合物在0℃下搅拌30min,然后除去冷浴。 然后将反应混合物室
温下搅拌2h。将有机溶剂真空蒸发。将残余物在硅胶(氯 仿
‑
丙酮30:1)上层析,得到所需产物(131mg,78%),为黄色固体。1h nmr (400mhz,cdcl3):1.19(3h,d,j=1.0),1.21(3h,d,j=1.0),1.84
–
1.93(1h,m), 2.07
–
2.16(1h,m),2.19
–
2.41(2h,m),3.79
–
3.84(1h,m),4.97(1h,hept,j=6.2),5.07(1h,s).
13
c nmr(101mhz,cdcl3):21.75,21.81,29.34,35.88,54.29, 69.80,80.90,120.32(2c,d,jc
,p
=5.0),120.39(2c,d,jc
,p
=4.9),125.23(2c,d, jc
,p
=1.0),125.28(2c,d,jc
,p
=1.0),130.00(2c),150.68(d,jc
,p
=5.8),150.75(d, jc
,p
=6.2),171.93(d,jc
,p
=5.9),193.51.
31
p nmr(101mhz,cdcl3):0.32旋光 度:[α]
22d
+15.1
°
(c 0.337,chcl3).ir(chcl3):3383w,3115w,3101vw,3063vw, 2985m,2938w,2878vw,2110vs,1731s,1642s,1600m,sh,1591m,1490s,1467 w,1456m,1448vw,sh,1426m,1385s,sh,1377s,1350m,1191vs,1163s,1071w, 1026m,941vs,904m,821w,690m,617w,487m cm
‑1.esi ms:468([m+na]
+
). hr esi ms:c
21
h
24
o6n3nap的计算值468.12949;实测468.12952。
[0343]2‑
((((4
‑
乙酰氧基苄基)氧)羰基)氨基)
‑6‑
重氮
‑5‑
氧代己酸乙酯(6)的合成ml)溶液。将反应混合物在相同的温度下搅拌过夜。真空除去挥发物,并将产 物氯甲酸4
‑
(乙酰氧基)苄基酯溶解于thf(5ml)中,不经任何纯化使用。在 氩气下将焦谷氨酸乙酯(800mg,5.1mmol)溶解于无水thf(13ml)中,并 冷却至
‑
78℃。逐滴加入lihmds(1m于己烷中,6.12ml,6,12mmol,1.2当 量)的溶液,并将该溶液在相同温度下搅拌15min。在
‑
78℃下通过套管将所得 的黄色混合物转移至氯甲酸4
‑
(乙酰氧基)苄基酯(5.6mmol,1当量)的溶液中。 将反应混合物在
‑
78℃下搅拌2h。这段时间之后,将反应用饱和的nh4cl(100 ml)淬灭。然后用乙酸乙酯(3
×
50ml)萃取,将合并的有机层用水(40ml)、 盐水(40ml)洗涤并经无水mgso4干燥。将有机溶剂真空蒸发。将残余物在 硅胶(己烷
‑
乙酸乙酯1:1)上层析,得到所需产物5(1.16g,65%),为无色 固体。1h nmr(400mhz,cdcl3):1.16(3h,t,j=7.2),1.99
–
2.06(1h,m),2.25 (3h,s),2.28
–
2.36(1h,m),2.42
–
2.50(1h,m),2.55
–
2.64(1h,m),4.11(1h,qd, j=7.1,2.6),4.62(1h,dd,j=9.4,2.7),5.16(1h,d,j=12.4),4.25(1h,d,j=12.4), 7.02
–
7.05(2h,m),7.35
–
7.39(2h,m).
13
c nmr(101mhz,cdcl3):14.02,21.08, 21.79,30.99,58.74,61.82,67.58,121.75,129.46,132.62,150.70,150.83,169.28, 170.97,172.93.旋光度:[α]
22d
‑
30.7
°
(c 0.298,chcl3).ir(chcl3):2968w, 2942vw,2876vw,1797s,1753vs,1717s,sh,1609w,1597vw,1510m,1476vw, 1463w,1450w,1447w,1421w,1402w,sh,1380m,1372m,1303s,1288s,1259 m,1198vs,1166s,1107vw,1045m,1019m,1012m,sh,913w,846w,596w,cm
‑1. esi ms:372([m+na]
+
).hr esi ms:c
17
h
19
o7nna的计算值372.10537;实测 372.10541。
[0344]2‑
((((4
‑
乙酰氧基苄基)氧)羰基)氨基)
‑6‑ꢀ
量)溶解于无水thf(17ml)中,并冷却至
‑
98℃。逐滴加入正丁基锂(2.5m 于己烷中,1.4ml,3.52mmol,1.23当量)的溶液,并将该溶液在
‑
98℃下搅 拌30min。在
‑
116℃下通过套管将所得的混合物转移至先前化合物5(1.0g, 2.86mmol,1当量)的无水thf(27ml)溶液中。将反应混合物缓慢升温至
‑
78℃, 然后用饱和的nh4cl淬灭。然后用乙酸乙酯(3
×
50ml)萃取,将合并的有机层 用水(40ml)、盐水(40ml)洗涤并经无水mgso4干燥。将有机溶剂真空蒸 发。将残余物在硅胶(氯仿
‑
丙酮20:1)上层析,得到所需产物6(460mg,41%), 为淡黄色固体。1h nmr(400mhz,cdcl3):1.25(3h,t,j=7.1),1.92
–
2.03(1h, m),2.13
–
2.23(1h,m),2.28(3h,s),2.32
–
2.43(1h,m),4.18(1h,q,j=7.1),4.29
ꢀ–
4.34(1h,m),5.04(1h,d,j=12.4),5.10(1h,d,j=12.1)5.22(1h,s),7.31(1h,d, j=8.2),7.04
–
7.07(2h,m),7.34
–
7.37(2h,m).
13
c nmr(101mhz,cdcl3): 14.22,21.19,27.53,36.45,53.62,61.78,66.38,121.78,129.52,134.01,150.59, 156.01,169.51,171.90,193.60.旋光度:[α]
22d
+15.5
°
(c 0.129,chcl3).ir (chcl3):3428w,3116w,2966w,2110s,1721vs,1742s,sh,1641m,1609w,sh, 1595vw,sh,1509s,1418vw,1381s,sh,1371s,1344m,1197vs,1166m,1106vw, 1053m,br,1019m,1012m,sh,913w,848w,595w,492w cm
‑1.esi ms:414([m +na]
+
).hr esi ms:c
18
h
21
o7n3na的计算值414.12717;实测414.12713。
[0345]1‑
甲基乙基2,6
‑
双[4
‑
(1λ5‑
重氮炔亚基(diazynylidene))
‑3‑
氧代丁基]
‑9‑
甲基
ꢀ‑7‑
氧代
‑4‑
苯氧基
‑8‑
氧杂
‑
3,5
‑
重氮
‑4‑
磷杂癸烷
‑1‑
酸酯4
‑
氧化物(7)的合成
[0346]1‑
甲基乙基2,6
‑
双[4
‑
(1λ5‑
重氮炔亚基)
‑3‑
氧代丁基]
‑9‑
甲基
‑7‑
氧代
‑4‑
苯氧 基
‑8‑
氧杂
‑
3,5
‑
重氮
‑4‑
磷杂癸烷
‑1‑
酸酯4
‑
氧化物(7)。参考方案1,将异丙基 (31.6μl,0.21mmol,0.45当量)。将反应混合物在0℃下搅拌30min,然后除 去冷浴。然后将反应混合物室温下搅拌2h。将有机溶剂真空蒸发。将残余物在 硅胶(乙酸乙酯
‑
甲醇40:1)上层析,得到所需产物(78mg,66%),为黄色 油状物。1h nmr(400mhz,cdcl3):1.21
–
1.24(12h,m),1.81
–
1.93(2h,m), 2.09
–
2.19(2h,m),2.24
–
2.52(4h,m),3.61
–
3.70(2h,m),3.90
–
3.98(2h,m), 4.99(1h,hept,j=6.3)4.99(1h,hept,j=6.2),5.24(1h,s),5.33(1h,s),7.10
–ꢀ
7.14(1h,m),7.17
–
7.20(2h,m),7.28
–
7.31(2h,m).
13
c nmr(101mhz,cdcl3): 21.81(4c),29.26,29.43,36.21(2c),53.78(d,jc
,p
=1.7),53.97,69.54,69.66, 120.43(d,jc
,p
=4.8),124.76,129.76(2c),151.03(2c,d,jc
,p
=6.8),172.47(d, jc
,p
=5.5),172.64(d,jc
,p
=5.2),194.07(2c).
31
p nmr(101mhz,cdcl3):11.08. 旋光度:[α]
22d
+6.4
°
(c 0.313,chcl3).ir(chcl3):3099w,3303w,2104vs,1732 s,1639s,1592w,1492m,1385sh,m,1376s,1240sh,m,1211s,1183sh,m,1167 m,1144m,1132sh,m,1106s,1072w,1025w,1006m,923m,832sh,w,771w, m,692w cm
‑1.
[0347]
esi ms:587([m+na]
+
).hr esi ms:c
24
h
33
n6o8pna的计算值587.19897; 实测587.19899。
[0348]2‑
(2
‑
氨基
‑4‑
甲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸异丙酯(9)的合成
[0349]2‑
(2
‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)
‑4‑
甲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸 3当量),然后加入nh2‑
don
‑
cooipr(448mg,2.25mmol,1当量)的干燥 dcm(5ml)溶液。将反应混合物在惰性气氛下在室温下搅拌2h。加入dcm (20ml)并将有机相用饱和nahco3(40ml)、1m hcl(40ml)、水(2
×
40ml) 和饱和nacl(40ml)洗涤,用mgso4干燥。蒸发dcm。通过柱色谱法 (dcm/etoac 4:1,rf0.27)纯化粗产物,获得淡黄色固体(949mg),产率79%。 1
h nmr(400mhz,cdcl3):0.91
–
0.96(6h,m),1.23
–
1.25(6h,m),1.51
–
1.73 (3h,m),1.93
–
2.02(1h,m),2.14
–
2.24(1h,m),2.26
–
2.44(2h,m),4.16
–
4.24 (2h,m),4.33
–
4.37(1h,m),4.39
–
4.44(1h,m),4.47
–
4.52(1h,m),4.96
–
5.08 (1h,m),5.18(1h,s),5.36(1h,d,j=8.2),6.84(1h,d,j=7.8),7.30(2h,tt,j=7.4, 1.2),7.37
–
7.42(2h,m),7.58(2h,d,j=7.4),7.75(2h,d,j=7.5).
13
c nmr (101mhz,cdcl3):21.70,21.72,22.04,22.92,24.66,27.04,36.37,41.75,47.14, 52.05,53.56,67.08,69.47,119.98,120.01,125.06,125.13,127.10,127.11,127.74, 127.75,141.28(2c),143.76,143.81,156.14,170.95,172.29,193.80.旋光度:[α]
22d
ꢀ‑
6.1
°
(c 0.472,chcl3).ir(chcl3):3304m,sh,3067w,3018w,2105s,1730s, 1704s,1659vs,1639sh,m,1612sh,w,1580sh,w,1539s,1478m,1451m,1467 m,1386sh,s,1375s,1244s,1172sh,m,1145m,1106s,834sh,w,759m,740s, 621m,427cm
‑1.esi ms:571([m+na]
+
).hr esi ms:c
24
h
33
o4n4na的计算 值571.25271;实测571.25271。
[0350]2‑
(2
‑
氨基
‑4‑
甲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸异丙酯(9)。使用与先前的化 合物3相同的制备方法。参考方案1,化合物8(90mg,0.164mmol)、二氯甲 烷(1ml)、哌啶(41μl 0.41mmol,2.5equiv.)。硅胶层析(氯仿
‑
甲醇20:1)。 6.4),1.25(3h,d,j=2.8),1.26(3h,d,j=2.8),1.35
–
1.42(1h,m),1.76
–
1.79(2h, m),1.95
–
2.04(1h,m),2.17
–
2.25(1h,m),2.33
–
2.49(2h,m),3.48(1h,dd,j= 9.7,4.1),4.52(1h,td,j=8.5,4.7),5.04(1h,hept,j=6.3),5.35(1h,s),7.87(1h,d, j=8.3).
13
c nmr(101mhz,cdcl3):27.59,28.19,33.40,66.39,80.90, 124.87,128.33,128.35,128.66,136.10,140.58,166.01,172.75.旋光度:[α]
22d
+
°
(c 0.33,ch2cl2).ir(chcl3):3412w,3343w,2110vs,1731s,1663s,1643sh,s, 1603sh,w,1510s,1413w,1386sh,s,1376sh,s,1370sh,s,1349m,1145m,1105 s cm
‑1.esi ms:327([m+h]
+
).hr esi ms:c
15
h
27
o4n4na的计算
值327.20268; 实测327.20280。
[0351]
l
‑
亮氨酰
‑
l
‑
亮氨酰
‑6‑
(1l5‑
重氮炔亚基)
‑5‑
氧代
‑
l
‑
正亮氨酸1
‑
甲基乙基酯 (11)的合成
[0352]
n
‑
[(9h
‑
芴
‑9‑
基甲氧基)羰基]
‑
l
‑
亮氨酰
‑
l
‑
亮氨酰
‑6‑
(1l5‑
重氮炔亚基)
‑5‑
氧代
ꢀ‑
l
‑
正亮氨酸1
‑
甲基乙基酯(10)。将 无水二氯甲烷(5ml)并加入二异丙基乙基胺(301μl,1.73mmol,3当量)。 将反应混合物室温下搅拌30min。然后通过注射器加入9(188mg,0.58mmol) 的干燥二氯甲烷(3ml)溶液。将反应混合物在惰性气氛下在室温下搅拌2h。 将有机溶剂真空蒸发。将残余物在硅胶(己烷
‑
乙酸乙酯1:1)上层析,得到所 需产物10(188mg,49%),为淡黄色无定形固体。1h nmr(400mhz,cdcl3): 0.86
–
0.98(12h,m),1.24(3h,d,j=5.0),1.25(3h,d,j=5.0),1.47
–
1.56(2h,m), 1.57
–
1.72(4h,m),1.91
–
2.04(1h,m),2.14
–
2.24(1h,m),2.26
–
2.48(2h,m), 4.14
–
4.22(1h,m),4.21(1h,t,j=6.8),4.36
–
4.49(4h,m),5.03(1h,hept,j= 6.3),5.14(1h,d,j=7.5),5.32(1h,s),6.41(1h,d,j=7.7),6.83(1h,d,j=6.8), 7.32(2h,tt,j=7.4,1.3),7.41(2h,tt,j=7.5,1.5),7.58(2h,d,j=7.5),7.77(2h,tt, j=7.6,1.1).
13
c nmr(101mhz,cdcl3):21.82,21.84,21.96,22.22,22.91,23.14, 24.83(2c),27.22,36.46,41.29,41.39,47.26,51.94,52.12,53.74,55.00,67.22, 69.54,120.12,120.14,125.11,125.15,127.22(2c),127.88,127.89,141.42(2c), 143.77,143.89,156.42,171.03,171.81,172.39,193.97.旋光度:[α]
22d
‑
25.2
°
(c 0.385,chcl3).ir(chcl3):3426m,3332w,sh,3116w,3068w,2961s,2873m, 2110s,1726vs,1672vs,1640sh,m,1610sh,w,1579sh,w,1541m,1506vs,1479 m,1468m,1387s,1371sh,s,1377s,1349m,1286m,1234s,1171sh,m,1146m, 1105s,1046m,1023sh,w,824w,585w,488w,sh,426w cm
‑1.esi ms:684([m +na]
+
).hr esi ms:c
36
h
47
o7n5na的计算值684.33677;实测684.33607。
[0353]
l
‑
亮氨酰
‑
l
‑
亮氨酰
‑6‑
(1l5‑
重氮炔亚基)
‑5‑
氧代
‑
l
‑
正亮氨酸1
‑
甲基乙基酯67%),为黄色无定形固体。1h nmr(400mhz,cdcl3):):0.88
–
0.98(12h,m), 1.24(3h,d,j=5.2),1.26(3h,d,j=5.3),1.37
–
1.47(1h,m),1.50
–
1.79(5h,m), 1.91
–
2.07(1h,m),2.08
–
2.28(3h,m),2.31
–
2.50(2h,m),3.52(1h,dd j=9.5, 3.8),4.39(1h,td,j=8.7,5.3),4.46(1h,td,j=8.0,4.6),5.03(1h,hept,j=6.2), 5.37(1h,s),7.02(1h,d,j=7.4),7.77
(1h,d,j=8.1).
13
c nmr(101mhz, cdcl3):21.46,21.83,21.86,22.05,23.09,23.53,24.95,25.01,27.13,36.52,40.89, 43.94,51.55,52.16,53.61,55.01,69.49,171.09,172.36,175.91,194.21.旋光度: [α]
22d
‑
31.7
°
(c 0.439,chcl3).ir(chcl3):3415w,3343w,br,3117w,2984m, 2961s,2936m,2873m,2855w,2110vs,1731s,1665vs,br,1653vs,br,1630s,sh, 1509s,1468m,1454w,1450w,1440w,1386s,1377s,1370s,1349m,1201m, 1183w,1146m,1105s cm
‑1.esi ms:440([m+h]
+
).hr esi ms:c
21
h
38
o5n5的 计算值440.28675;实测440.28674。
[0354]
方案2
[0355][0356]6‑
(1λ5‑
重氮炔亚基)
‑
n
‑
{[(5
‑
甲基
‑2‑
氧代
‑
1,3
‑
二氧杂环戊烯
‑4‑
基)甲氧基]羰 基}
‑5‑
氧代
‑
l
‑
正亮氨酸1
‑
甲基乙基酯(13)的合成
[0357]
碳酸2,5
‑
二氧代吡咯烷
‑1‑
基
‑
((5
‑
甲基
‑2‑
氧代
‑
1,3
‑
二氧杂环戊烯
‑4‑
基)甲酯mg,619μl,7.69mmol,1当量),最后滴加硫代氯碳酸s
‑
乙酯(s
‑
ethylcarbonochloridothionate)(1.04g,874μl,8.38mmol,1.09当量)的干燥et2o (8ml)溶液。将混合物在0℃下搅拌1h,并在室温下过夜(18h)。真空除 去et2o并加入dcm(70ml)。反应混合物用饱和nahco3(40ml)并用水(3
×
40 ml)洗涤,用mgso4干燥,并旋转蒸发去除dcm。通过柱色谱法(己烷/etoac5:1,rf 0.24)纯化粗产物。获得淡黄色液体(1.29g),产率77%。将o
‑
((5
‑
甲基
ꢀ‑2‑
氧代
‑
1,3
‑
二氧杂环戊烯
‑4‑
基)甲基)硫代碳酸s
‑
乙酯(800mg,3.67mmol,1eq.) 和n
‑
羟基琥珀酰亚胺(844mg,7.33mmol,2eq.)悬浮在干燥dcm(8ml)中。 将溶液冷却至0℃,并在10分钟内滴加过乙酸(836mg(100%),2.32g(36%), 11.00mmol,3当量,36%乙酸溶液)。最终混合物在0℃下搅拌30分钟,在室 温下搅拌2h。加入dcm(20ml),并用水(2
×
35ml)和饱和nacl(35ml) 洗涤有机相。蒸发dcm,获得产物12,为无色固体化合物(750mg),产率76%。 1
h nmr(400mhz,
cdcl3):2.20(3h,s),2.86(4h,s),5.05(2h,s).
13
c nmr(101 mhz,cdcl3):9.67,25.58,59.89,131.61,142.20,151.65,168.39.ir(chcl3):1842 m,1824s,1819s,1792s,1749vs,1431w,1386w,1309m,1195s,935w,900w, 811vw cm
‑1.esi ms:294([m+na]
+
).hr esi ms:c
10
h9o8nna的计算值 294.02204;实测294.02213。
[0358]6‑
(1λ5‑
重氮炔亚基)
‑
n
‑
{[(5
‑
甲基
‑2‑
氧代
‑
1,3
‑
二氧杂环戊烯
‑4‑
基)甲氧基]羰 基}
‑5‑
氧代
‑
l
‑
正亮氨酸1
‑
甲基乙基酯(13)。参考方案2,将化合物12(70mg, 将有机溶剂真空蒸发。将残余物在硅胶(氯仿
‑
丙酮10:1)上层析,得到所需 产物13(72mg,83%),为黄色油状物。1h nmr(400mhz,cdcl3):1.24(3h,d, j=3.4),1.26(3h,d,j=5.6),1.94
–
2.04(1h,m),2.13
–
2.24(1h,m),2.16(3h,s), 2.32
–
2.49(2h,m),4.23
–
4.28(1h,m),4.77
–
4.87(2h,m),5.04(1h,hept,j= 6.3),5.28(3h,s),5.66(1h,d,j=7.9).
13
c nmr(101mhz,cdcl3):9.51,21.82, 21.85,27.32,36.33,53.86,54.57,69.79,133.93,140.07,152.31,155.25,171.12, 193.50.旋光度:[α]
22d
+15.1
°
(c 0.417,chcl3).ir(chcl3):3424w,3012w,2984 w,2935w,2111s,1836sh,s,1821vs,1736sh,vs,1725vs,1641m,1603sh,w, 1509s,1391sh,m,1383s,1366sh,m,1105s cm
‑1.esi ms:392([m+na]
+
).hr esi ms:c
15
h
19
o8n3na的计算值392.10644;实测392.10650。
[0359]6‑
(1λ5‑
重氮炔亚基)
‑
n
‑
({1
‑
[(2,2
‑
二甲基丙酰基)氧]乙氧基}羰基)
‑5‑
氧代
‑
l
‑
正 亮氨酸1
‑
甲基乙基酯(14a)和(14b)的合成
[0360]
特戊酸1
‑
((((2,5
‑
二氧代吡咯烷
‑1‑
基)氧基)羰基)氧基)
[0361][0362]
根据文献程序(wo 2008033572a1)制备该化合物。
[0363]6‑
(1λ5‑
重氮炔亚基)
‑
n
‑
({1
‑
[(2,2
‑
二甲基丙酰基)氧基]乙氧基}羰基)
‑5‑
氧代
‑
l
‑ꢀ
正亮氨酸1
‑
甲基乙基酯(14a)和(14b)。参照方案2,使用二氯甲烷(8ml) 和特戊酸1
‑
((((2,5
‑
二氧代吡咯烷
‑1‑
基)氧)羰基)氧)乙基酯(297mg,1.032mmol, 1.1当量),如制备13所述,由3(200mg,0.938mmol)制备化合物14a和14b, 14b(50mg,rf=0.2),为黄色油状物(39%)。1h nmr(400mhz,cdcl3):1.18 (9h,s),1.25(3h,d,j=3.0),1.26(3h,d,j=3.1),1.46(3h,d,j=5.4),1.94
–
2.04 (1h,m),2.15
–
2.24(1h,m),
2.31
–
2.49(2h,m),4.24
–
4.30(1h,m),5.04(1h, hept,j=6.2),5.28(1h,s),5.50(1h,d,j=7.9),6.77(1h,q,j=5.4).
13
c nmr (101mhz,cdcl3):19.78,21.83,21.85,27.00(3c),27.79,36.56,38.79,53.58, 69.76,89.70,153.90,171.16,176.61,193.59.ir(chcl3):3427w,3116w,2984m, 2960sh,m,2937w,2875w,2857sh,w,2110s,1745sh,vs,1730sh,vs,1641m, 1508s,1480m,1467sh,w,1461w,1455sh,w,1392sh,s,1383sh,s,1377s,1371 sh,s,1365sh,s,1350m,1027m cm
‑1.旋光度(14a):[α]
22d
+22.0
°
(c 0.191, chcl3).旋光度(14b):[α]
22d
+7.6
°
(c 0.158,chcl3).esi ms(14a):408([m +na]
+
).esi ms(14b):408([m+na]
+
).hr esi ms(14a):c
17
h
27
o7n3na 的计算值408.17412;实测408.17425。hr esi ms(14b):c
17
h
27
o7n3na的计 算值408.17412;实测408.17421。非对映异构体14a用于所有生物学研究。
[0364]6‑
重氮
‑2‑
(((1
‑
((3
‑
甲基丁酰基)氧)乙氧基)羰基)氨基)
‑5‑
氧代己酸异丙酯 (jam0335)的合成
[0365]
异丁酸1
‑
((((2,5
‑
二氧代吡咯烷
‑1‑
基)氧)羰基)氧)乙酯(ltp 150)
[0366][0367]6‑
重氮
‑2‑
(((1
‑
((3
‑
甲基丁酰基)氧)乙氧基)羰基)氨基)
‑5‑
氧代己酸异丙酯0.235mmol),二氯甲烷(1ml),硅胶色谱(氯仿
‑
丙酮20:1)。分离产物(31 mg,66%),为黄色油状物。1h nmr(400mhz,cdcl3):1.48(9h,s),2.54
–
2.64 (4h,m),5.11(2h,s),5.48(1h,m),6.07(1h,d,j=1.2),7.30
–
7.40(5h,m).
13
cnmr(101mhz,cdcl3):27.59,28.19,33.40,66.39,80.90,124.87,128.33,128.35, 128.66,136.10,140.58,166.01,172.75.esi ms:313([m+na]
+
).hr esi ms: c
17
h
22
o4na的计算值313.14103;实测313.14103。
[0368]6‑
(1λ5‑
重氮炔亚基)
‑
n
‑
({1
‑
[(2
‑
甲基丙酰基)氧]乙氧基}羰基)
‑5‑
氧代
‑
l
‑
正亮 氨酸1
‑
甲基乙基酯(15)的合成
[0369]6‑
(1λ5
‑
重氮炔亚基)
‑
n
‑
({1
‑
[(2
‑
甲基丙酰基)氧]乙氧基}羰基)
‑5‑
氧代
‑
l
‑
正亮 氨酸1
‑
甲基乙基酯(15)。如关于制备13所描述的,使用2
‑
甲基丙酸1
‑
[[[(2,5
‑ꢀ
二氧代吡咯烷
‑1‑
基)氧]羰基]氧]乙酯(通过wo 1)。黄色油状物(426mg,82%)。1h nmr(400mhz,cdcl3):1.13
–
1.17(6h,m), 1.24
–
1.26(6h,m),1.46(3h,d,j=5.4),1.89
–
2.03(1h,m),2.15
–
2.26(1h,m), 2.31
–
2.58(3h,m),4.25
–
4.31(1h,m),5.03(1h,hept,j=6.3),5.29and 5.34(1h, 2x s),5.48and 5.52(1h,2x d,j=8.2and 7.9),6.75
–
6.81(1h,m).
13
c nmr(101 mhz,cdcl3):18.78(2c),19.83,21.81,21.84,27.81,33.98,36.40,53.47,54.92, 69.75,89.53,153.87,171.12,175.19,193.60.ir(chcl3):
将反应混合物在
‑
15℃再搅拌30分钟,然后除去冷却浴。然后将反应混合物室温 下搅拌2h。将有机溶剂真空蒸发。将残余物在硅胶(己烷
‑
乙酸乙酯1:1)上层 析,得到所需产物(220mg,66%),为黄色无定形固体。1h nmr(400mhz, cdcl3):2.14(2h,m),2.29(3h,s),2.32
–
2.56(2h,m),4.34(1h,t,j=6.2),5.11
–ꢀ
5.25(4h,m),5.51(1h,s),7.07
–
7.10(2h,m),7.37
–
7.40(2h,m).
13
c nmr(101 mhz,cdcl3):21.19,25.80,35.36,54.12,67.49,77.89,122.06(2c),129.96(2c), 130.02,150.97,152.98,169.49,171.81,192.64.ir(chcl3):3116w,2964vw,2922 w,2111s,1802s,1768m,sh,1756s,1716vs,1642m,1610w,1597vw,sh,1510m, 1423m,1410s,1383m,1371s,1355s,1197vs,1167s,1128m,1106w,1019m, 1013m,914m,850w,596w,492w,cm
‑1.esi ms:398([m+na]
+
).hr esi ms: c
17
h
17
o7n3na的计算值398.09587;实测398.09596。
[0375]
方案4
[0376][0377]2‑
(2
‑
氨基丙酰胺)
‑6‑
重氮
‑5‑
氧代己酸乙酯(22)的合成
[0378]1‑
(9h
‑
芴
‑9‑
基甲基)
‑2‑
乙基
‑5‑
氧代吡咯烷
‑
1,2
‑
二羧酸酯(18)。参考方案4,lihmds(1m于thf中,24.2ml,24.18mmol,0.95当量)的溶液,并将该 溶液在相同温度下搅拌20min。在
‑
78℃下通过套管将所得的黄色混合物转移至 fmoc氯化物(32.9g,127.3mmol,5当量)的无水thf(90ml)溶液中。将 反应混合物在
‑
78℃下搅拌2h,并在室温下过夜(18h)。这段时间之后,将反 应用饱和的nh4cl(34ml)和水(18ml)淬灭。然后用etoac(60ml)萃取 水相,将合并的有机部分用盐水(2
×
100ml)洗涤,并经无水mgso4干燥。将 有机溶剂在真空下蒸发。将残余物在硅胶上进行层析(己烷:etoac 3:1至1:1), 最后在反向lc(meoh:h2o,2:1至100%meoh)上进行层析得到所需产物18 (8.40g,87%)为无色固体。1h nmr(400mhz,cdcl3):1.26(3h,d,j=7.1),2.12 (1h,ddt,j=13.4,9.4,2.9),2.40(1h,ddt,j=13.4,10.8,9.3),
2.57(1h,ddd,j= 17.5,9.2,3.1),2.72(1h,ddd,j=17.5,10.7,9.4),4.20(2h,q,j=7.1),4.30(1h,t,j =7.3),4.44(1h,dd,j=10.5,7.4),4.57(1h,dd,j=10.6,7.3),4.65(1h,dd,j=9.4, 2.5),7.33(2h,tt,j=7.4,1.1),7.41(2h,tdd,j=6.9,1.3,0.6),7.71(1h,dd,j=7.5, 1.0),7.75(1h,dd,j=7.5,1.0),7.77(2h,dd,j=7.8,1.0).
13
c nmr(101mhz, cdcl3):14.14,21.96,31.21,46.62,58.76,61.92,69.03,119.99,120.01,125.30, 125.44,127.26(2c),127.91(2c),141.27,141.29,143.35,143.40,151.44,170.80, 172.99.旋光度:[α]
22d
‑
17.2
°
(c 0.285,chcl3).ir(chcl3):3068m,2985m,2941 w,2898w,2875w,1797vs,1745vs,br,1723vs,1609w,1580vw,1478m,1463m, 1452s,1400m,sh,1385s,1197vs,1116vw,sh,1104m,1097w,sh,1033s,621m, 426w,cm
‑1.esi ms:402([m+na]
+
).hr esi ms:c
22
h
21
o5nna的计算值 402.1312;实测402.1313。
[0379]2‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)
‑6‑
重氮
‑5‑
氧代己酸乙酯(19)。在氩气 下将三甲基硅烷基重氮甲烷溶液(2m于二乙醚中,7.9ml, 在
‑
116℃下通过套管将所得的混合物转移至18(5.00g,13.18mmol,1当量) 的无水thf(120ml)溶液中。将反应混合物在此温度下搅拌30分钟,然后缓 慢升温至
‑
78℃,并用饱和nh4cl(150ml)淬灭。然后用乙酸乙酯(3
×
50ml) 萃取水相,将合并的有机层用盐水(200ml)洗涤并经无水mgso4干燥。将有 机溶剂真空蒸发。将残余物在硅胶(chcl3:丙酮20:)上层析,得到所需产物 19(4.42g,80%),为淡黄色固体。1h nmr(400mhz,cdcl3):1.29(3h,t,j=7.1), 1.93
–
2.10(1h,m),2.17
–
2.29(1h,m),2.33
–
2.53(2h,m),4.22(3h,t,j=7.1), 4.32
–
4.43(3h,m),5.27(1h,bs),5.56(1h,d,j=8.1),7.32(2h,tt,j=7.4,1.3), 7.41(2h,t,j=7.5),7.60(2h,t,j=6.6),7.77(2h,dd,j=7.6,1.0).
13
c nmr(101 mhz,cdcl3):14.30,27.63,36.56,47.26,53.63,54.96,61.89,67.17,120.11,120.14, 125.22,125.24,127.20(2c),127.86(2c),141.40,141.43,143.78,143.99,156.18, 172.03,193.65.旋光度:[α]
22d
+10.6
°
(c 0.265,chcl3).ir(chcl3):3428w, 3116w,3068w,2985w,2942w,2907vw,2110s,1740s,sh,1721vs,1642m,1510 s,1478w,1465w,1451m,1381s,1105w,1052m,1033m,622w,426w cm
‑1.esims:444([m+na]
+
).hr esi ms:c
23
h
23
o5n3na的计算值444.15299;实测 444.15292。
[0380]2‑
氨基
‑6‑
重氮
‑5‑
氧代己酸乙酯(20)。如制备3所述,使用二氯甲烷(10ml) 和哌啶(58μl,0.59mmol,2.5当量)从19(100mg,0.237mmol)2.40
–
2.54(2h,bm),3.44(1h,dd,j=8.3,5.1),4.17(2h,q,j=7.1),5.27(1h,s). 13
c nmr(101mhz,cdcl3):14.24,29.56,36.86,53.77,54.56,61.05,175.58, 194.15.旋光度:[α]
22d
+
°
(c 0.33,ch2cl2).ir(chcl3):3410w,vbr,3327,vw,vbr, 2986m,2941w,2910w,2874w,
2110s,1739vs,1641m,1605m,sh,1586m, 1552w,1513w,br,1476w,1463m,1446m,1395m,sh,1377s,1200s,1115m, 1096m cm
‑1.esi ms:182([m
–
h2o+h]
+
).hr esi ms:c
12
h
12
n3o2的计算值 182.0930;实测182.0931。
[0381]2‑
(2
‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)丙酰胺)
‑6‑
重氮
‑5‑
氧代己酸乙酯 (21)。将fmoc
‑
nh
‑
(l)
‑
ala
‑
cooh(483mg,1.55mmol,1.1eq.)和hbtu(642 dcm(3ml)溶液。反应混合物在惰性气氛下在室温下搅拌2h。加入dcm(15 ml)并将有机相用饱和nahco3(25ml)、1m hcl(25ml)、水(2
×
25ml) 和饱和nacl(25ml)洗涤,用mgso4干燥。蒸发dcm。通过柱色谱法(dcm: etoac,1:1,rf 0.40)纯化粗产物,得到21,为淡黄色固体(452mg,65%)。1hnmr(400mhz,cdcl3):1.28(3h,t,j=7.5),1.42(3h,d,j=7.1),1.98
–
2.08(1h, m),2.16
–
2.28(1h,m),2.30
–
2.48(2h,m),4.15
‑
4.30(4h,m),4.39(2h,d,j=7.3), 4.53(1h,td,j=8.0,4.5),5.21(1h,s),5.38(1h,d,j=7.4),6.81(1h,d,j=7.8), 7.32(2h,t,j=7.5),7.41(2h,t,j=7.5),7.60(2h,d,j=7.5),7.77(2h,d,j=7.5). 13
c nmr(101mhz,cdcl3):14.25,18.86,27.00,36.48,38.74,47.22,50.65,55.11, 61.84,67.24,120.11,120.13,125.20,125.24,127.22(2c),127.87(2c),141.40(2c), 143.92(2c),156.01,171.58,172.47,193.99.旋光度:[α]
22d
+0.4
°
(c 0.225,chcl3). ir(chcl3):3424m,3330w,br,3116vw,3068vw,2986m,2941w,2908w,2875 vw,2110s,1731vs,1720vs,sh,1682vs,1639m,1585vw,1503vs,1478m,1451s, 1377s,1233s,1116m,1105m,sh,1095w,1032m,622w,424w,cm
‑1.esi ms: 515([m+na]
+
).hr esi ms:c
26
h
28
o6n4na的计算值515.19011;实测 515.19044。
[0382]2‑
(2
‑
氨基丙酰胺)
‑6‑
重氮
‑5‑
氧代己酸乙酯(22)。将化合物21(225mg,0.457 为淡黄色固体(101mg,82%)。1h nmr(400mhz,cdcl3):1.22(3h,t,j=7.1), 1.28(3h,d,j=7.0),1.89
–
1.94(2h,m),1.94
–
2.01(1h,m),2.10
–
2.21(1h,m), 2.27
–
2.43(2h,m),3.47(1h,q,j=7.0),4.13(2h,q,j=7.1),4.47(1h,td,j=8.4, 4.9),5.32(1h,s),7.81(1h,d,j=8.4).
13
c nmr(101mhz,cdcl3):14.28,18.56, 27.44,36.80,51.63,55.05,58.55,61.74,171.90,175.25,193.93.旋光度:[α]
22d
‑ꢀ
31.1
°
(c 0.260,chcl3+dmf).ir(chcl3):3393w,3336vw,br,3211vw,br,3116 vw,2958m,2927s,2871m,2856m,2110s,1736m,1684vs,1639m,1517w, 1379s,1115vw,sh,1097w,cm
‑1.esi ms:271([m+h]
+
).hr esi ms: c
11
h
19
o4n4的计算值271.14008;实测271.14024。
[0383]2‑
(2
‑
氨基丙酰胺)
‑6‑
重氮
‑5‑
氧代己酸(23)的合成
[0384]2‑
(2
‑
氨基丙酰胺)
‑6‑
重氮
‑5‑
氧代己酸(23)。参考方案4,将化合物22(225 mg,0.457mmol,1eq.)悬浮于etoh(3ml)和thf 至干燥。粗产物用et3n/ch3cooh缓冲液通过制备性hplc纯化。获得所需产 物23,为淡橘色固体(50mg),产率52%。1h nmr(400mhz,cdcl3):1.45(3h, d,j=7.0),2.06
–
2.22(2h,m),2.45
–
2.56(2h,m),4.01
–
4.13(2h,m),5.86(1h, brs).
[0385]2‑
(2
‑
氨基
‑4‑
甲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸乙酯(25)的合成
[0386]2‑
(2
‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)
‑4‑
甲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸 乙酯(24)。参考方案4,将fmoc
‑
nh
‑
(l)
‑
leu
‑
cooh(874mg,2.47mmol,1.1eq.) 和hbtu(1023mg,2.70mmol,1.2eq.)悬浮在干燥dcm(15ml)中。通过(40ml)、1m hcl(40ml)、水(2
×
40ml)和饱和nacl(40ml)洗涤,经 mgso4干燥。蒸发dcm。通过柱色谱法(dcm:etoac 4:1,rf 0.27)纯化粗产 物,得到24,为淡黄色固体(949mg,79%)。1h nmr(400mhz,cdcl3):0.95(6h, d,j=5.9),1.26(3h,t,j=7.5),1.50
–
1.59(1h,m),1.62
–
1.75(2h,m),1.95
–
2.05 (1h,m),2.17
–
2.27(1h,m),2.29
–
2.45(2h,m),4.14
–
4.25(4h,m),4.34
–
4.45 (2h,m),4.49
–
4.58(1h,m),5.19(1h,s),5.27(1h,d,j=8.4),6.80(1h,d,j=7.6), 7.31(2h,t,j=7.4),7.40(2h,t,j=7.8),7.59(2h,d,j=7.5),7.76(2h,d,j=7.6). 13
c nmr(101mhz,cdcl3):14.12,22.03,22.92,24.66,26.96,36.33,41.65,47.14, 51.94,53.56,55.00,61.73,67.09,120.00,120.03,125.05,125.13,127.12(2c), 127.76,127.77,141.29,143.64,143.75,143.79,156.15,171.46,172.26,193.81.旋 光度:[α]
22d
‑
9.7
°
(c 0.109,dmf).ir(chcl3):3304m,sh,3067w,3018w,2105s, 1730s,1704s,1659vs,1639sh,m,1612sh,w,1580sh,w,1539s,1478m,1451m, 1467m,1386sh,s,1375s,1244s,1172sh,m,1145m,1106s,834sh,w,759m,740 s,621m,427cm
‑1.esi ms:557([m+na]
+
).hr esi ms:c
29
h
34
o6n4na的计算 值557.23706;实测557.23707。
[0387]2‑
(2
‑
氨基
‑4‑
甲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸乙酯(25)。参考方案4,将 化合物24(945mg,1.77mmol,1eq.)溶解于干燥dcm
91%)。1h nmr(400mhz,cdcl3):0.94(6h,dd,j=14.0,6.3),1.27(3h,t,j=7.1), 1.28
–
1.37(1h,m),1.45(2h,s),1.57
–
1.83(2h,m),1.92
–
2.08(1h,m),2.16
–ꢀ
2.26(1h,m),2.26
–
2.49(2h,m),3.39(1h,dd,j=10.0,3.9),4.19(2h,dq,j=7.1, 1.4),4.54(1h,dt,j=8.5,4.8),5.30(1h,s),7.85(1h,d,j=8.3).
13
c nmr(101 mhz,cdcl3):14.25,21.40,23.54,24.97,27.71,36.82,44.29,51.48,53.60,54.86, 61.65,171.99,175.99,193.67.旋光度:[α]
22d
‑
54.8
°
(c 0.323,chcl3).ir(chcl3): 3412w,3343w,2110vs,1731s,1663s,1643sh,s,1603sh,w,1510s,1413w, 1386sh,s,1376sh,s,1370sh,s,1349m,1145m,1105s cm
‑1.esi ms:335([m+ na]
+
).hr esi ms:c
14
h
25
o4n4的计算值313.18703;实测313.18712。
[0388]2‑
(2
‑
氨基
‑4‑
甲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸三乙基铵盐(26)的合成
[0389]2‑
(2
‑
氨基
‑4‑
甲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸三乙基铵盐(26)。将化合物 eq.)溶液,并将混合物搅拌15分钟。用1m甲酸(408μl,0.95当量)淬灭反 应,搅拌10分钟后,将混合物蒸发至干燥。粗产物用et3n/ch3cooh缓冲液 通过制备性hplc纯化。获得所需产物26,为淡橘色固体(46mg),产率40%。 1
h nmr(400mhz,cdcl3):1.10(6h,d,j=6.4),1.50
–
1.61(1h,m),1.63
–
1.83 (2h,m),1.96
–
2.06(1h,m),2.11
–
2.23(1h,m),2.33
–
2.48(1h,m),3.67(1h, dd,j=8.6,5.6),4.27(1h,dd,j=7.0,5.1),5.51(1h,brs).
[0390]2‑
(2
‑
(2
‑
氨基
‑4‑
甲基戊酰胺基)
‑4‑
甲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸乙酯 (28)的合成。
[0391]
11
‑
(4
‑
重氮
‑3‑
氧代丁基)
‑1‑
(9h
‑
芴
‑9‑
基)
‑
5,8
‑
二异丁基
‑
3,6,9
‑
三氧
‑2‑
氧杂
ꢀ‑
4,7,10
‑
三氮杂癸
‑
12
‑
酸乙酯(27)。参考方案4,将fmoc
‑
nh
‑
(l)
‑
leu
‑
cooh(125 mg,0.352mmol,1.1eq.)和hbtu(146mg,0.384mmol, dcm(3ml)溶液。将反应混合物在惰性气氛下在室温下搅拌3h。加入dcm (10ml)并将有机相用饱和nahco3(20ml)、1m hcl(20ml)、水(2
×
20ml) 和饱和nacl(20ml)洗涤,用mgso4干燥。蒸发dcm。通过柱色谱法 (dcm:etoac 2:1,rf 0.35)纯化粗产物,得到27,为无色固体(145mg,
79%)。 1
h nmr(400mhz,cdcl3):0.92(6h,d,j=6.5),0.95(6h,d,j=6.1),1.28(3h,t, j=7.1),1.49
–
1.59(2h,m),1.60
–
1.74(4h,m),1.95
–
2.06(1h,m),2.18
–
2.28 (1h,m),2.30
–
2.50(2h,m),4.17
–
4.27(4h,m),4.32
–
4.64(4h,m),5.29(1h,d,j =8.0),5.35(1h,s),6.54(1h,d,j=8.0),7.00(1h,d,j=7.7),7.31(2h,t,j=7.5, 2.6),7.40(2h,td,j=7.3,2.2),7.57(2h,d,j=7.5),7.76(2h,d,j=7.5).
13
c nmr (101mhz,cdcl3):14.26,21.96,22.17,22.94,23.15,24.85,27.12,29.84,36.48, 38.28,41.17,41.33,47.27,51.94,52.03,61.79,67.22,120.14,120.16,125.10, 125.14,127.23(2c),127.90,127.91,141.43,143.75,143.89,156.43,171.54,171.81, 172.39,194.00.旋光度:[α]
22d
‑
34.5
°
(c 0.109,dmf).ir(chcl3):3426m,3317 w,br,3116w,3068w,2961s,2873m,2109s,1795w,1731vs,1719vs,1667vs,br, 1635s,sh,1508vs,1478m,1468m,1451s,1385s,1375s,1371s,1233s,1045m, 1033m,622w,426w,cm
‑1.esi ms:670([m+na]
+
).hr esi ms:c
35
h
45
o7n5na 的计算值670.32112;实测670.32122。
[0392]2‑
(2
‑
(2
‑
氨基
‑4‑
甲基戊酰胺基)
‑4‑
甲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸乙酯 (28)。将化合物27(136mg,0.210mmol,1eq.) 物,得到28,为淡黄色油状物(77mg,87%)。1h nmr(400mhz,cdcl3):0.92 (6h,t,j=6.0),0.95(6h,t,j=5.9),1.26(3h,t,j=7.1),1.34
–
1.41(1h,m),1.52
–ꢀ
1.61(1h,m),1.60
–
1.79(4h,m),1.95
–
2.03(1h,m),2.15
–
2.25(1h,m),2.30
–ꢀ
2.52(2h,m),3.48(1h,dd,j=9.5,4.1),3.96(2h,s),4.18(2h,q,j=7.1),4.41(1h, td,j=8.8,5.4),4.49(1h,td,j=8.0,4.6),5.36(1h,s),7.08
–
7.17(1h,m),7.74 (1h,d,j=8.2).
13
c nmr(101mhz,cdcl3):14.25,21.51,22.02,23.06,23.45, 24.91,24.97,27.03,36.49,40.77,43.77,51.63,52.04,53.54,55.13,61.76,171.60, 172.44,175.74,194.29.旋光度:[α]
22d
‑
25.8
°
(c 0.124,dmf).ir(kbr):3413s, vbr,3314s,vbr,3072m,br,2105s,1739s,1655vs,br,1539s,br,1468s,1386s, 1370s,1208s,br,1029s,cm
‑1.esi ms:426([m+h]
+
).hr esi ms:c
20
h
36
o5n5的计算值426.27110;实测426.27124。
[0393]
方案5
[0394][0395]6‑
重氮
‑2‑
(((1
‑
(异丁烯酰氧基)乙氧基)羰基)氨基)
‑5‑
氧代己酸三乙基铵盐 (29)的合成
[0396]6‑
重氮
‑2‑
(((1
‑
(异丁烯酰氧基)乙氧基)羰基)氨基)
‑5‑
氧代己酸三乙基铵盐 和2
‑
甲基丙酸1
‑
[[[(2,5
‑
二氧代吡咯烷
‑1‑
基)氧]羰基]氧]乙酯(ltp 150)(183mg, 0.668mmol,1.1eq.)的thf(3ml)溶液。将该溶液在室温下再搅拌2h。用1 m甲酸(607μl,1当量)淬灭反应,搅拌5分钟后,将混合物蒸发至干燥。粗 产物用et3n/ch3cooh缓冲液通过制备性hplc纯化,得到29,为淡橘色固体 (106mg,53%)。1h nmr(400mhz,cdcl3):1.11(6h,d,j=6.4),1.35
–
1.46 (3h,m),1.84
–
2.32(2h,m),2.36
–
2.75(2h,m),4.15
–
4.48(1h,m),4.60
–
4.97 (1h,m),5.70
–
6.12(1h,m),6.67
–
6.82(1h,m),8.40(1h,bs).
[0397]6‑
重氮
‑2‑
(((1
‑
(新戊酰氧基)乙氧基)羰基)氨基)
‑5‑
氧代己酸三乙基铵盐(30) 的合成
[0398]6‑
重氮
‑2‑
(((1
‑
(新戊酰氧基)乙氧基)羰基)氨基)
‑5‑
氧代己酸三乙基铵盐(30)。 二氧代
吡咯烷
‑1‑
基)氧)羰基)氧)乙酯(ltp174)(141mg,0.490mmol,1.1eq.)的 thf(1.5ml)溶液。将该溶液在室温下再搅拌2h。用1m甲酸(446μl,1 当量)淬灭反应,搅拌5分钟后,将混合物蒸发至干燥。粗产物用et3n/ch3cooh 缓冲液通过制备性hplc纯化,得到30,为淡橘色固体(64mg),产率42%。 1
h nmr(400mhz,cdcl3):1.18(9h,s),1.36
–
1.59(3h,m),1.94
–
2.36(2h,m), 2.40
–
2.77(2h,m),4.18
–
4.48(1h,m),4.53
–
4.97(1h,m),5.45
–
6.07(1h,m), 6.68
–
6.84(1h,m),8.87(1h,bs).
[0399]6‑
重氮
‑2‑
(((1
‑
(异丁烯酰氧基)乙氧基)羰基)氨基)
‑5‑
氧代己酸乙酯(31)的合 成
[0400]6‑
重氮
‑2‑
(((1
‑
(异丁烯酰氧基)乙氧基)羰基)氨基)
‑5‑
氧代己酸乙酯(31)。将 2
‑
甲基丙酸1
‑
[[[(2,5
‑
二氧代吡咯烷
‑1‑
基)氧]羰基]氧]乙酯(226mg,0.828mmol, 1.1eq)混悬于干燥dcm(6ml)中。将反应混合物冷却 15分钟,然后在室温下搅拌1h。通过柱色谱法(etoac/己烷1:10至1:2)纯化 粗产物,获得所需化合物31,产率56%(150mg),为黄色油状物(两种立体异 构体的1:1混合物)。1h nmr(400mhz,cdcl3,立体异构体1):1.14(6h,d,j= 6.7),1.27(3h,t,j=7.1),1.46(3h,d,j=5.4),1.88
–
2.09(1h,m),2.16
–
2.29(1h, m),2.34
–
2.47(2h,m),2.51(1h,sep,j=7.1),4.19(2h,q,j=7.1),4.27
–
4.36 (1h,m),5.29(1h,brs),5.49(1h,d,j=8.3),6.78(1h,q,j=7.7).
13
c nmr(101 mhz,cdcl3,立体异构体1):14.26,18.78,18.80,19.84,27.73,33.99,36.35,53.39, 54.92,61.92,89.54,153.87,171.62,175.18,193.54.1h nmr(400mhz,cdcl3,立 体异构体2):1.16(6h,d,j=6.7),1.27(3h,t,j=7.1),1.46(3h,d,j=5.4),1.88
–ꢀ
2.09(1h,m),2.16
–
2.29(1h,m),2.34
–
2.47(2h,m),2.51(1h,sep,j=7.1),4.20 (2h,q,j=7.1),4.27
–
4.36(1h,m),5.29(1h,brs),5.53(1h,d,j=8.1),6.80(1h,q, j=7.7).
13
c nmr(101mhz,cdcl3,立体异构体2):14.26,18.80,18.85,19.87, 27.84,33.99,36.47,53.50,54.97,61.92,89.72,153.95,171.79,175.30,193.77.旋 光度:[α]
22d
+19.8
°
(c 0.177,chcl3).ir(chcl3):3428w,3116w,2981m,2940w, 2877w,2856w,2110vs,1741vs,br,1641m,1510s,1469m,1388s,1377s,1232 m,1199m,cm
‑1.esi ms:380([m+na]
+
).hr esi ms:c
15
h
24
o7n3的计算值 358.16088;实测358.16118。
[0401]
方案6
[0402][0403]
试剂和条件:(a)pom
‑
nhs,dcm,40%(b)me
‑
pom
‑
nhs,dcm,68%
[0404]6‑
重氮
‑2‑
(((1
‑
(新戊酰氧基)乙氧基)羰基)氨基)
‑5‑
氧代己酸乙酯(32)的合成
[0405]6‑
重氮
‑2‑
(((1
‑
(新戊酰氧基)乙氧基)羰基)氨基)
‑5‑
氧代己酸乙酯(32)。参考0.753mmol,1当量)的干燥dcm(3ml)溶液。将混合物在0℃下搅拌15分 钟,然后在室温下搅拌1h。通过柱色谱法(etoac/己烷1:10至1:2)纯化粗产 物,获得所需化合物32,产率68%(190mg),为黄色油状物(两种立体异构 体的1:1混合物)。1h nmr(400mhz,cdcl3,立体异构体1):1.16(9h,s),1.26 (3h,t,j=7.1),1.43(3h,s),1.88
–
2.05(1h,m),2.14
–
2.26(1h,m),2.30
–
2.50 (2h,m),4.18(2h,q,j=7.1),4.24
–
4.34(1h,m),5.31(1h,brs),5.51(1h,d,j= 7.7),6.74(1h,q,j=7.3).
13
c nmr(101mhz,cdcl3,立体异构体1):14.23, 19.72,26.95,27.57,36.31,38.74,53.33,54.89,61.85,89.66,153.87,171.61,176.56, 193.56.1h nmr(400mhz,cdcl3,立体异构体2):1.18(9h,s),1.26(3h,t,j= 7.1),1.45(3h,s),1.88
–
2.05(1h,m),2.14
–
2.26(1h,m),2.30
–
2.50(2h,m),4.18 (2h,q,j=7.1),4.24
–
4.34(1h,m),5.33(1h,brs),5.55(1h,d,j=7.9),6.76(1h,q, j=7.3).
13
c nmr(101mhz,cdcl3,立体异构体2):14.24,19.74,26.97,27.80, 36.46,38.75,53.48,54.89,61.87,89.81,153.95,171.77,176.68,193.75.旋光度: [α]
22d
+16.2
°
(c 0.259,chcl3).ir(chcl3):3428m,3358w,3116w,2982s,2874 m,2110s,1740vs,1640s,1510s,1480m,1393s(sh),1377s,1349s,1284s,1232 s,1025s,cm
‑1.esi ms:394([m+na]
+
).hr esi ms:c
16
h
25
o7n3na的计算值 394.15847;实测394.15886。
[0406]
方案7
(chcl3/meoh 20:1至10:1,rf 0.29)纯化粗产物,获得无色固体34(96mg), 产率50%。1h nmr(400mhz,cdcl3):1.27(3h,t,j=7.0),1.57(2h,bs),1.91
–ꢀ
2.01(1h,m),2.06
–
2.27(3h,m),3.05(1h,dd,j=14.4,8.1),3.30(1h,dd,j=14.4, 4.0),3.75(1h,dd,j=8.1,4.2),4.18(1h,qd,j=7.1,2.0),4.55(1h,td,j=8.3,4.1), 5.11(1h,bs),7.09(1h,d,j=2.4),7.12(1h,ddd,j=8.1,7.0,1.1),7.20(1h,ddd,j =8.1,7.0,1.2),7.37(1h,dt,j=8.2,1.0),7.68(1h,dd,j=7.9,1.1),7.88(1h,d,j= 8.3),8.31(1h,bs).
13
c nmr(101mhz,cdcl3):14.29,27.60,30.82,36.58,51.56, 54.77,55.50,61.71,111.36,111.49,119.23,119.79,122.39,123.45,127.69,136.52, 171.92,175.02,193.81.旋光度:[α]
22d
‑
57.6
°
(c 0.210,dmf).ir(chcl3):3479m, 3355w,3215vw,3116w,2982m,2930m,2872w,2855w,2110vs,1737s,1687s, 1641m,1511m,1373m,1353m,1336m,sh,1191m,1115w,1092m,1009w, cm
‑1.esi ms:408([m+na]
+
).hr esi ms:c
19
h
23
o4n5na的计算值408.16423; 实测408.16435。
[0413]6‑
重氮
‑2‑
((((5
‑
甲基
‑2‑
氧代
‑
1,3
‑
二氧杂环戊烯
‑4‑
基)甲氧基)羰基)氨基)
‑5‑
氧 代己酸三乙基铵盐(35)的合成
[0414]6‑
重氮
‑2‑
((((5
‑
甲基
‑2‑
氧代
‑
1,3
‑
二氧杂环戊烯
‑4‑
基)甲氧基)羰基)氨基)
‑5‑
氧 代己酸三乙基铵盐(35)。参考方案5,将化合物20(238 的thf(10ml)溶液。将该溶液在室温下再搅拌2h。用1m甲酸(1.15ml, 0.95当量)淬灭反应,搅拌5分钟后,将混合物蒸发至干燥。粗产物用 et3n/ch3cooh缓冲液通过制备性hplc纯化。获得所需产物35,为淡橘色固 体(50mg),产率13%。1h nmr(400mhz,cdcl3):1.96
–
2.28(2h,m),2.15(3h, s),2.37
–
2.70(2h,m),4.40
–
4.76(1h,m),4.98(2h,s).
[0415]
方案8
[0416][0417]
试剂和条件:(a)硫代氯碳酸s
‑
乙酯,吡啶,et2o;nhs,过乙酸,dcm 58%; (b)dcm,0℃
‑
rt,65%
[0418]6‑
重氮
‑2‑
((((5
‑
甲基
‑2‑
氧代
‑
1,3
‑
二氧杂环戊烯
‑4‑
基)甲氧基)羰基)氨基)
‑5‑
氧 代己酸乙酯(36)的合成
[0419]6‑
重氮
‑2‑
((((5
‑
甲基
‑2‑
氧代
‑
1,3
‑
二氧杂环戊烯
‑4‑
基)甲氧基)羰基)氨基)
‑5‑
氧 代己酸乙酯(36)。参考方案8,使化合物12(180mg,0.663mmol,1.1eq)悬浮 于干燥dcm(5ml)中。将反应混合物冷却至0℃, 1:1)纯化粗产物,获得所需化合物36,产率65%(139mg),为黄色油状物。 1
h nmr(400mhz,cdcl3):1.27(3h,t,j=7.1),1.95
–
2.06(1h,m),2.10
–
2.27 (1h,m),2.16(3h,s),2.31
–
2.50(2h,m),4.19(2h,q,j=7.1),4.29(1h,td,j=8.1, 4.8),4.82(2h,dd,j=13.9),5.29(1h,brs),5.72(1h,d,j=7.7).
13
c nmr(101 mhz,cdcl3):9.48,14.24,27.18,36.32,53.76,54.58,55.00,61.92,133.90,140.08, 152.30,155.26,171.63,193.52.旋光度:[α]
22d
+12.2
°
(c 0.229,chcl3).ir (chcl3):3425m,3345w,vbr,3116w,2111vs,1838s,sh,1820vs,1736vs,1722 vs,sh,1640s,1511s,1229s,1200s,1114m,1097m,1045s,cm
‑1.esi ms:378 ([m+na]
+
).hr esi ms:c
14
h
17
o8n3na的计算值378.09079;实测378.09102。
[0420]2‑
(2
‑
氨基
‑3‑
(1h
‑
吲哚
‑3‑
基)丙酰胺)
‑6‑
重氮
‑5‑
氧代己酸异丙酯(38)的合成7,将fmoc
‑
nh
‑
(l)
‑
trp
‑
cooh(880mg,2.06mmol,1.1eq.)和hbtu(854mg, 2.25mmol,1.2eq.)悬浮在干燥dmf(14ml)中。通过注射器加入diea(727 mg,980μl,5.63mmol,3eq.),然后加入3(400mg,1.88mmol,1当量)的干 燥dmf(5ml)溶液。将反应混合物在惰性气氛下在室温下搅拌4h。蒸发dmf, 加入dcm(100ml)并将有机相用饱和nahco3(100ml)、水(100ml)、1mhcl(100ml)、水(100ml)和饱和nacl(100ml)洗涤,用mgso4干燥。 蒸发dcm。通过柱色谱法(dcm:etoac 5:1,rf 0.15)纯化粗产物,得到37, 为淡黄色固体(540mg),产率46%。1h nmr(400mhz,cdcl3):1.19(3h,d,j =6.3),1.23(3h,t,j=6.3),1.81
–
1.92(1h,m),2.01
–
2.28(3h,m),3.18(1h,dd,j =14.5,7.1),3.39(1h,dd,j=14.2,5.2),4.20(1h,t,j=7.1),4.30
–
4.48(3h,m), 4.54(1h,q,j=6.9),4.88
–
4.99(1h,m),5.07(1h,bs),5.50(1h,d,j=7.9),6.59 (1h,d,j=7.4),7.07(1h,bs),7.14(1h,t,j=7.0),7.20(1h,t,j=7.2),7.30(2h, tdd,j=7.5,2.5,1.1),7.36(1h,d,j=8.0),7.40(2h,t,j=7.5),7.56(2h,t,j=6.6), 7.67(1h,d,j=7.9),7.77(2h,d,j=7.6),8.23(1h,bs).
13
c nmr(101mhz, cdcl3):21.78,21.83,27.20,28.47,36.20,47.23,52.19,54.91,55.75,67.23,69.22, 110.28,111.40,118.88,120.03,120.10,120.12(2c),122.45,123.66,125.25,125.30, 127.23(2c),127.61,127.86(2c),136.35,141.40(2c),143.85,143.96,156.09, 170.80,171.42,193.92.旋光度:[α]
22d
‑
32.0
°
(c 0.193,dmf).ir(kbr):3424s, 3300m,3130vw,2980w,
2932s,2110m,1722s,1695s,1654s,1625m,1547m, sh,1532m,1520m,sh,1478w,1385m,1375m,1353m,1343m,1288m,1236m, 1182w,11145m,1105m,1031m
‑
w,1010w,852w,798w,758m,741m,621w, 427w
‑
m,cm
‑1.esi ms:644([m+na]
+
).hr esi ms:c
35
h
35
o6n5na的计算值 644.24795;实测644.24811。
[0421]2‑
(2
‑
氨基
‑3‑
(1h
‑
吲哚
‑3‑
基)丙酰胺)
‑6‑
重氮
‑5‑
氧代己酸异丙酯(38)。参考方 案7,将化合物37(500mg,0.804mmol,1eq.)溶解于干燥dcm(15ml)中。 通过注射器加入哌啶(342mg,393μl,4.02mmol,5eq.)。将 黄色无定形固体(170mg),产率53%。1h nmr(400mhz,cdcl3):1.24(3h,d, j=6.0),1.25(3h,d,j=6.0),1.50(2h,bs),1.88
–
2.00(1h,m),2.04
–
2.27(3h,m), 3.04(1h,dd,j=14.4,8.2),3.30(1h,ddd,j=14.2,4.2,0.9),3.74(1h,dd,j=8.1, 4.2),4.51(1h,td,j=8.3,4.0),5.02(1h,hept,j=6.0),5.11(1h,bs),7.08(1h,d,j =2.3),7.11(1h,ddd,j=8.0,7.1,1.0),7.19(1h,ddd,j=8.1,7.1,1.1),7.36(1h,d, j=8.1),7.67(1h,d,j=7.9),7.88(1h,d,j=8.2),8.45(1h,bs).
13
c nmr(101 mhz,cdcl3):21.83,27.65,30.81,36.55,51.64,54.80,55.51,69.49,111.37(2c), 119.17,119.72,122.31,123.48,127.67,136.53,171.42,175.09,193.92.旋光度: [α]
22d
‑
1.2
°
(c 0.012,chcl3).ir(chcl3):3311m,vbr,2980w,2924w,2874w,vs, 2853w,2104vs,1731s,1650s,br,1618m,sh,1512m,1388m,sh,1375s,1253m, 1232m,1183m,1145m,1105s,1010w,972vw,933vw,744m,cm
‑1.esi ms: 422([m+na]
+
).hr esi ms:c
20
h
25
o4n5na的计算值422.17988;实测 422.17992。
[0422]6‑
重氮
‑2‑
(((2
‑
甲基
‑1‑
(新戊酰氧基)丙氧基)羰基)氨基)
‑5‑
氧代己酸异丙酯 (40)的合成
[0423]
特戊酸1
‑
((((2,5
‑
二氧代吡咯烷
‑1‑
基)氧)羰基)氧)
‑2‑
甲基丙酯(39)。将氯碳mmol,1当量)和etsh(727mg,866μl,11.69mmol,1当量)溶解于干燥 et2o(10ml)中的混合物。将反应混合物在室温下搅拌过夜(23h),将沉淀物 在硅藻土垫上过滤,并在减压下除去溶剂。将粗产物硫代碳酸o
‑
(1
‑
氯
‑2‑
甲基丙 基)s
‑
乙基酯(无色液体,2.20g,96%)不经纯化用于下一步。将硫代碳酸o
‑
(1
‑ꢀ
氯
‑2‑
甲基丙基)s
‑
乙基酯(1.20g,6.10mmol,1eq.)溶解于特戊酸(3.74g,4.20ml, 36.61mmol,6eq.)并分几次加入新鲜制备的特戊酸(1.87g,2.10ml,18.31mmol, 3eq.)和diea(2.37g,3.19ml,18.31mmol,3eq.)的盐。将反应混合物升温至 60℃,持续70h。加入etoac(100ml),并将有机相用水(50ml)、饱和nahco
3 (3
×
50ml)、饱和nacl(50ml)萃取,经mgso4干燥并蒸发溶剂。将粗产物 特戊酸1
‑
(((乙硫基)羰基)氧)
‑2‑
甲基丙酯(淡黄色液体,1.32g,83%)不经纯化 用于下一步。将特戊酸1
‑
(((乙硫基)羰基)
氧)
‑2‑
甲基丙酯(1.28g,4.88mmol,1eq.) 溶解于干燥dcm(13ml)中,加入n
‑
羟基琥珀酰亚胺(1.12g,9.76mmol,2eq.), 并将悬浮液冷却至0℃。在10分钟内滴加过乙酸(1.11g(100%),3.09g(36%), 14.64mmol,3当量,36%乙酸溶液)。最终的混合物在0℃下搅拌60分钟并在 室温下搅拌2h。加入dcm(40ml)并将有机相用水(20ml)和饱和nacl (20ml)洗涤,并用mgso4干燥。蒸发dcm,并通过lc(己烷/etoac 5:3,rf 0.26)纯化产物。获得产物39,为淡黄色油状物(863mg),产率56%(3个步 骤的)。1h nmr(400mhz,cdcl3):1.00(6h,d,j=6.9),1.21(9h,s),2.08
‑
2.19 (1h,m),2.81(4h,s),6.55(1h,d,j=5.0).
13
c nmr(101mhz,cdcl3):16.06, 16.38,25.55,26.89,31.84,39.05,98.19,150.37,168.48,176.14.旋光度:[α]
22d
‑ꢀ
3.0
°
(c 0.230,chcl3).ir(chcl3):2978m,2938w,2878w,1821s,1795s,1748 vs,br,1481m,1463w,1432m,1396w,1373m,1366m,sh,1279m,1199s,1046 m,998m,sh,987m,932s cm
‑1.esi ms:338([m+na]
+
).hr esi ms: c
14
h
21
o7nna的计算值338.12102;实测338.12115。
[0424]
反应混合物冷却至0℃,逐滴加入化合物3(300mg, 1.41mmol,1eq.)的干燥dcm(3ml)溶液。将混合物在0℃下搅拌15分钟, 然后在室温下搅拌2h。通过柱色谱法(etoac/己烷1:2,rf 0.29和0.31)纯化粗 产物,获得所需化合物40,产率54%(285mg),为黄色油状物(两种立体异 构体的1:1混合物)。1h nmr(400mhz,cdcl3,立体异构体1):0.94(6h,d,j= 6.8),1.16(9h,s),1.23(6h,t,j=6.3),1.83
–
2.50(4h,m),4.22
–
4.31(1h,m),5.02 (1h,hept,j=6.8),5.29(1h,bs),5.48(1h,d,j=8.3),6.52(1h,d,j=4.9).
13
cnmr(101mhz,cdcl3,立体异构体1):16.40,16.54,27.00,28.05,31.87,36.29, 38.96,53.38,54.82,69.64,94.21,154.28,171.31,176.56,193.87.1h nmr(400 mhz,cdcl3,立体异构体2):0.93(6h,d,j=6.8),1.18(9h,s),1.22(6h,t,j=6.3), 1.83
–
2.50(4h,m),4.22
–
4.31(1h,m),5.00(1h,sept,j=6.8),5.37(1h,bs),5.45 (1h,d,j=8.3),6.48(1h,d,j=4.9).
13
c nmr(101mhz,cdcl3,立体异构体2): 16.37,16.54,26.98,27.74,31.91,36.55,38.92,53.54,54.82,69.66,93.87,154.22, 171.17,176.81,193.58.旋光度:[α]
22d
+11.5
°
(c 0.261,chcl3).ir(chcl3):3428 m,3116w,2982s,2936m,2878m,2110vs,1741vs,br,1731vs,sh,1641s,1508s, 1480m,1463m,1400m,sh,1385s,sh,1377s,1365s,sh,1281s,1231s,1183m, 1146s,1105s,990s,941m cm
‑1.esi ms:436([m+na]
+
).hr esi ms: c
19
h
31
o7n3na的计算值436.20542;实测436.20553。
[0425]6‑
重氮
‑5‑
氧代
‑2‑
((((新戊酰氧基)甲氧基)羰基)氨基)己酸异丙酯(42)的合成
[0426]
特戊酸((((2,5
‑
二氧代吡咯烷
‑1‑
基)氧)羰基)氧)甲酯(41)。将氯碳酸氯甲酯 (2.00g,1.38ml,15.51mmol,1当量)溶于干燥et2o1当量)和etsh(964mg,1.15ml,15.51mmol,1当量)溶解于干燥et2o(5 ml)中的混合物。将反应混合
物在室温下搅拌过夜(25h),将沉淀物在硅藻土 垫上过滤,并在减压下除去溶剂。粗产物硫代碳酸o
‑
(氯甲基)s
‑
乙基酯(无色 液体)不经纯化用于下一步。将硫代碳酸o
‑
(氯甲基)s
‑
乙基酯(2.40g,15.51mmol, 1eq.)溶解于特戊酸(9.51g,93.14mmol,6eq.)并分几次加入新鲜制备的特戊 酸(4.76g,46.57mmol,3eq.)和diea(6.02g,8.1ml,46.57mmol,3eq.)的盐。 将反应混合物升温至60℃,持续22h。加入etoac(100ml),并将有机相用 水(100ml)、饱和nahco3(3
×
100ml)、饱和nacl(100ml)萃取,经mgso4干燥并蒸发溶剂。将粗产物特戊酸(((乙硫基)羰基)氧)甲酯(淡黄色液体,3.30g, 97%)不经纯化用于下一步。将特戊酸(((乙硫基)羰基)氧)甲酯(3.20g,14.53mmol, 1eq.)溶解于干燥dcm(40ml)中,加入n
‑
羟基琥珀酰亚胺(3.34g,29.05mmol, 2eq.)并将混悬液冷却至0℃。在15分钟内滴加过乙酸(3.31g(100%),9.21g (36%),43.58mmol,3eq.,于乙酸中的36%溶液)。最终混合物在0℃下搅拌60 分钟,在室温下搅拌2h。加入dcm(50ml),并将有机相用水(30ml)和饱 和nacl(30ml)洗涤,并经mgso4干燥。蒸发dcm,并通过lc(己烷:etoac, 2:1,rf 0.27)纯化产物。获得产物41,为无色固体(2.54g),产率64%(3个 步骤的)。1h nmr(400mhz,cdcl3):1.24(9h,s),2.84(4h,s),5.86(2h,s).
13
cnmr(101mhz,cdcl3):25.56(2c),26.86(3c),38.96,83.67,150.90,168.34(2c), 176.54.ir(chcl3):2979m,2939w,2876w,1823s,1796vs,1649vs,1481m, 1463m,1456w,1431m,1398w,1371m,1367m,1280m,1199vs,1110vs,1047 m,998s,986s,942m,sh,924s,853w,cm
‑1.esi ms:296([m+na]
+
).hr esims:c
11
h
15
o7nna的计算值296.07407;实测296.07410。
[0427]6‑
重氮
‑5‑
氧代
‑2‑
((((新戊酰氧基)甲氧基)羰基)氨基)己酸异丙酯(42)。参考 方案6,使化合物41(320mg,1.17mmol,1.0eq)悬浮于干燥dcm(6ml)中。 通过柱色谱法(etoac:己烷,1:2,rf 0.21)纯化粗产物,获得所需化合物42,产 率40%(175mg),为黄色油状物。1h nmr(400mhz,cdcl3):1.19(9h,s),1.23 (3h,d,j=6.2),1.24(3h,d,j=6.2),1.90
–
2.05(1h,m),2.14
–
2.25(1h,m),2.31
ꢀ–
2.51(2h,m),4.28(1h,td,j=8.2,4.7),5.03(1h,hept,j=6.2),5.27(1h,bs), 5.65(1h,d,j=8.1),5.69(1h,d,j=5.7),5.73(1h,d,j=5.7).
13
c nmr(101mhz, cdcl3):21.79,21.81,26.97,36.34,38.86,53.63,54.90,69.75,80.33,154.40,171.01, 177.51,193.43.旋光度:[α]
22d
+13.0
°
(c 0.184,chcl3).ir(chcl3):3424m,3354 w,br,3116w,2984s,2937m,2875s,2110vs,1747vs,1730vs,sh,1642s,1512s, 1481m,1466m,1453m,1377s,1282s,1182m,1145s,1105s,994s,942m,cm
‑1. esi ms:394([m+na]
+
).hr esi ms:c
16
h
25
o7n3na的计算值394.15847;实测 394.15855。
[0428]6‑
重氮
‑5‑
氧代
‑2‑
((((2
‑
(新戊酰氧基)丙
‑2‑
基)氧)羰基)氨基)己酸异丙酯(44) 的合成
[0429]
特戊酸2
‑
(((4
‑
硝基苯氧基)羰基)氧)丙
‑2‑
基酯(43)。将(4
‑
硝基苯基)碳酸2
‑ꢀ
氯丙
‑2‑
基酯(按照us 2006/229361a1中报告的方法制备,300mg,1.16mmol,
[0430]
1eq.)溶解于干燥dcm(15ml)中。加入特戊酸汞(559mg,1.39mmol,1.2 eq.),并在惰性气体下在室温下搅拌反应混合物过夜(19h)。通过过滤除去固 体沉淀物(hgcl2),加入dcm(15ml),并将rm用饱和nahco3(15ml)、 饱和盐水(15ml)萃取,用mgso4干燥并蒸发溶剂。获得产物43,为淡黄色 油状物(301mg),产率80%。1h nmr(400mhz,cdcl3):1.20(9h,s),1.91(6h, s),7.34
–
7.40(2h,m),8.24
–
8.30(2h,m).
13
c nmr(101mhz,cdcl3):25.28(2c), 27.02(3c),39.59,107.71,121.98(2c),125.40(2c),145.50,149.07,155.41,175.97. ir(chcl3):3031w,2976w,2875w,1777m,1736m,1618w,1595w,1528m
‑
s, 1493m,1481w,1439w,1396w,1376w,1349m,1322w,1264m,1191m,1112vs, 1094s,sh,1030w,980w,859m,682vw,491vw cm
‑1.esi ms:348([m+na]
+
). hr esi ms:c
15
h
19
o7nna的计算值348.10537;实测348.10543。
[0431]6‑
重氮
‑5‑
氧代
‑2‑
((((2
‑
(新戊酰氧基)丙
‑2‑
基)氧)羰基)氨基)己酸异丙酯(44)。
[0432]
mmol,2.5eq.)。反应混合物在惰性气体下在0℃过夜搅拌3h。蒸发dmf, 并通过lc(己烷:etoac,2:1)纯化粗混合物。获得产物44,为淡黄色油状物 (49mg),产率83%。1h nmr(400mhz,cdcl3):1.19(9h,s),1.23(3h,d,j= 6.3),1.24(3h,d,j=6.3),1.80(3h,s),1.83(3h,s),1.90
–
2.01(1h,m),2.14
–
2.27 (1h,m),2.29
–
2.51(2h,m),4.24(1h,dt,j=8.3,4.7),5.05(1h,hept,j=6.3),5.31 (1h,bs),5.44(1h,d,j=8.2).
13
c nmr(101mhz,cdcl3):21.80,21.82,25.76, 25.91,27.07(3c),27.79,36.46,39.48,53.26,54.87,69.59,105.44,153.16,171.31, 176.21,193.63.旋光度:[α]
22d
+12.8
°
(c 0.133,chcl3).ir(chcl3):3430w,3116 w,2984m,2936m,2874m,2110s,1732vs,br,1641m,1502s,1481m,1466m, 1462m,1455m,1452m,1397m,sh,1384s,1374s,1365s,sh,1198s,1184s, 1147m,sh,1128s,1112s,1105s,1045m,942w cm
‑1.
[0433]6‑
重氮
‑5‑
氧代
‑2‑
(((苯基(新戊酰氧基)甲氧基)羰基)氨基)己酸异丙酯(47)的 合成
[0434]
(4
‑
硝基苯基)碳酸氯(苯基)甲酯(45)。将氯碳酸氯(苯基)甲酯(按照 us20110319422制备,900mg,4.39mmol,1eq.)溶解于干燥dcm(20ml)中。 加入4
‑
硝基苯酚(611mg,4.39mmol,1eq.),并将混合物冷却至0℃。在5分 粗产物。获得产物45,为无色固体(520mg),产率39%。1h nmr(400mhz, cdcl3):7.33(1h,s),7.41
–
7.50(5h,m),7.58
–
7.63(2h,m),8.28
–
8.34(2h,m).
13
cnmr(101mhz,cdcl3):87.37,121.83(2c),125.59(2c),126.41(2c),129.07(2c), 130.56,136.35,145.91,150.50,155.07.旋
光度:[α]
22d
‑
0.9
°
(c 0.318,chcl3).ir (chcl3):3119w,3088w,3071vw,3032w,1788vs,1772s,sh,1619m,1595m, 1530vs,1492s,1456m,1349vs,1317m,1296m,1232vs,sh,1178m,sh,1165m, 1111m,1105w,sh,1078m,1054s,1029m,1014m,1002w,978s,920w,872s, 854s,830vw,708s,695m,sh,680w,626vw,618vw,530vw,495w,403w cm
‑1. esi ms:329([m+na]
+
).hr esi ms:c
14
h
10
o5nclna的计算值330.01397;实测 330.01367。
[0435]
特戊酸(((4
‑
硝基苯氧基)羰基)氧)(苯基)甲酯(46)。将化合物45(100mg, 温下搅拌过夜(16h)。加入dcm(10ml),并用饱和nahco3(10ml)和盐 水(10ml)洗涤反应混合物,用mgso4干燥有机相,并蒸发dcm。获得产物 46(115mg),产率95%,并不经纯化用于进一步的步骤。1h nmr(400mhz, cdcl3):1.28(9h,s),7.38
–
7.43(2h,m),7.44
–
7.50(3h,m),7.57
–
7.60(1h,m),7.61 (1h,s),8.23
–
8.33(2h,m).
13
c nmr(101mhz,cdcl3):27.02(3c),39.11,93.80, 121.86(2c),125.47(2c),126.84(2c),128.97(2c),130.48,134.39,145.69,150.73, 155.32,176.44.旋光度:[α]
22d
‑
6.0
°
(c 0.201,chcl3).ir(chcl3):3118w,3087 w,3072w,3031m,2980m,2875w,1775vs,1747s,1618m,1595m,1529vs, 1493s,1480m,1459m,1399m,1365m,1349vs,1279vs,1248vs,1165s,1123vs,
[0436][0437]
1112s,sh,1030s,1014m,1003m,970s,br,943s,918m,865s,860s,832w,697 s,682w,633w,619vw,530vw,495w,403vw cm
‑1.esi ms:396([m+na]
+
).hr esi ms:c
19
h
19
o7nna的计算值396.10537;实测396.10546。
[0438]
mmol,1.1eq.)。将反应混合物在惰性气氛下在室温下搅拌过夜(24h)。进一 步加入溶解于干燥dcm(2ml)中的don ipr酯(72mg,0.339mmol,1.1eq.), 并继续再搅拌24h。蒸发dcm,并通过制备性hplc(acn/h2o,hcooh)纯 化粗混合物。获得产物47,为淡棕色油状物(66mg),产率48%。1h nmr(400 mhz,cdcl3):1.17
–
1.31(15h,m),1.90
–
2.06(1h,m),2.12
–
2.31(1h,m),2.31
–ꢀ
2.54(2h,m),4.27
–
4.36(1h,m),5.03(1h,hept,j=6.3),5.29(1h,bs),5.59(1h,d, j=8.1),7.36
–
7.42(3h,m),7.46
–
7.51(2h,m),7.61(s,1h).
13
c nmr(101mhz, cdcl3):21.82(2c),26.99(3c),27.70,36.35,38.99,53.55,54.90,69.79,90.93, 126.57(2c),128.66(2c),129.64,135.95,153.82,171.10,176.33,193.51.旋光度: [α]
22d
+12.5
°
(c 0.246,chcl3).ir(chcl3):3425w,3116w,3098vw,3070vw, 3029m,2984m,2937m,2875w,2110s,1735vs,br,1641s,1590w,1507s,1480 m,1457m,1398m,1377s,1367s,sh,1366s,sh,
基)
‑6‑
重氮
‑5‑
氧代己酸异丙酯(52)。将化合物51(100mg,0.162mmol)溶于 干燥dmf(2ml)中,并向该溶液中滴加二异丙基乙基胺(144μl,0.842mmol, [0447]2‑
(2
‑
(2
‑
氨基
‑3‑
甲基丁酰胺基)
‑5‑
脲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸异丙酯 (56)的合成
[0448]2‑
(2
‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)
‑5‑
脲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸
[0449][0450]
异丙酯(53)。将fmoc
‑
cit
‑
cooh(2.05g,5.16mmol,1.1equiv.)和tbtu(1.81g, 5.63mmol,1.2equiv.)溶于无水dmf(40ml)中并加入二异丙基乙基胺(2.51 ml,14.07mmol,3equiv.)。将反应混合物在室温下搅拌30min。然后通过注 射器加入3(1.0g,4.69mmol)的无水dmf(20ml)溶液。将反应混合物在 惰性气氛下在室温下搅拌2h。将有机溶剂真空蒸发。将残余物在硅胶(氯仿: 甲醇15:1)上层析,得到所需产物53(1.84g,66%),为黄色无定形固体。 1
h nmr(400mhz,dmso):1.16(3h,d,j=4.6),1.17(3h,d,j=4.4),1.37
–
1.57 (3h,m),1.61
–
1.70(1h,m),1.76
–
1.86(1h,m),1.94
–
2.03(1h,m),2.33
–
2.46 (2h,m),2.94
–
3.03(2h,m),4.03
–
4.08(1h,m),4.15
–
4.31(4h,m),4.88(1h, hept,j=6.3),5.42(2h,s),5.96(1h,t,j=5.8),6.01(1h,s),7.31
–
7.34(2h,m), 7.39
–
7.43(2h,m),7.53(1h,d,j=8.1),7.73
–
7.74(2h,m),7.88(2h,d,j=7.5), 8.28(1h,d,j=7.5).
13
c nmr(101mhz,dmso):21.45,21.49,25.91,26.72, 29.39,36.22,38.77,46.68,51.48,54.06,65.67,68.02,120.10(2c),125.36(2c), 127.09(2c),127.65(2c),140.72(2c),143.80,143.91,155.96,158.87,171.05, 172.29,194.04.ir(kbr):3435vs,br,3348vs,br,sh,3068m,2979m,2936m, 2871w,2105s,1723s,1678vs,br,1610s,sh,1540s,br,1478s,1466m,sh,1450 m,1386s,sh,1376s,1252s,1220m,sh,1184m,sh,1146m,1105s,1052m,1032 m,760m,741m,621m,427s cm
‑1.esi ms:615([m+na]
+
).hr esi ms: c
30
h
36
o7n6na的计算值615.25377;实测615.25383。
[0451]2‑
(2
‑
氨基
‑5‑
脲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸异丙酯(54)。将化合物53 胶(氯仿:甲醇2:1)上层析,得到所需产物54(874mg, 76%),为白色无定形固体。1h nmr(400mhz,
j=6.3),5.37(2h,s),5.91(1h,t,j=5.8),6.05(1h,s),8.04(1h,d,j=7.8),8.34 (1h,d,j=7.4).
13
c nmr(101mhz,dmso):17.49,18.76,21.46,21.50,25.86, 26.44,29.61,30.44,36.08,38.64,51.45,51.93,57.96,68.04,158.99,169.93,170.95, 171.58,194.03.ir(kbr):3500w,br,sh,3338m,vbr,3116w,2984s 2965s,2936 m,2874m,2109s,1731s,1653vs,br,1602s,br,sh,1552s,br,1517s,1466m, 1452m,1387s,sh,1376s,1234s,1183m,1145s,1106s cm
‑1.旋光度:[α]
22d
‑ꢀ
13.0
°
(c 0.270,dmso).esi ms:470([m+h]
+
).hr esi ms:c
20
h
36
o6n7的计算 值470.27216;实测470.27208。
[0454]2‑
(2
‑
(2
‑
乙酰胺基
‑3‑
甲基丁酰胺基)
‑5‑
脲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸异 丙酯(57)的合成
[0455]2‑
(2
‑
(2
‑
乙酰胺基
‑3‑
甲基丁酰胺基)
‑5‑
脲基戊酰胺基)
‑6‑
重氮
‑5‑
氧代己酸异 丙酯(57)。将化合物56(50mg,0.107mmol)溶解于干燥dmf(1ml)中, 向该溶液中滴加二异丙基乙胺(95μl,0.543mmol,5.1当量),随后滴加乙酸 酐(50μl,0.532mmol,5.0当量)。将反应混合物在室温下搅拌2h。将有机 j=7.1),1.16(3h,d,j=4.8),1.17(3h,d,j=4.9),1.31
–
1.53(3h,m),1.60
–
1.68 (1h,m),1.73
–
1.82(1h,m),1.86(3h,s),1.89
–
2.00(2h,m),2.31
–
2.44(2h,m), 2.93
–
2.97(2h,m),4.12
–
4.17(2h,m),4.21
–
4.26(1h,m),4.87(1h,hept,j= 6.3),5.39(2h,s),5.92(1h,t,j=5.8),6.02(1h,s),7.86(1h,d,j=8.7),7.97(1h,d, j=7.6),8.20(1h,d,j=7.5).
13
c nmr(101mhz,cdcl3):18.20,19.21,21.45, 21.49,22.51,25.95,26.56,29.36,30.40,36.10,38.77,51.33,52.11,57.67,68.01, 158.80,169.37,170.97,171.05,171.70,194.05.旋光度:[α]
22d
‑
22.6
°
(c 0.257, dmso).esi ms:534([m+na]
+
).hr esi ms:c
22
h
37
o7n7na的计算值 534.26467;实测513.26456。
[0456]
(s)
‑6‑
重氮
‑5‑
氧代
‑2‑
((((4
‑
(((2s,3r,4s,5s,6r)
‑
3,4,5
‑
三羟基
‑6‑
(羟甲基)四氢
ꢀ‑
2h
‑
吡喃
‑2‑
基)氧)苄基)氧)羰基)氨基)己酸酯(59)的合成
[0457]
三乙酸2
‑
(乙酰氧基甲基)
‑6‑
(4
‑
((((6
‑
重氮
‑1‑
乙氧基
‑
1,5
‑
二氧代己烷
‑2‑
基)氨方法
入乙酸酐(130mg,121μl,1.28mmol,1.2eq.)。将反应混合物在惰性气氛下在 室温下搅拌2h。蒸发dmf。通过柱lc(chcl3:meoh,20:1)纯化粗产物,得 到423mg的产物60,为黄色无定形固体(90%产率)。1h nmr(400mhz,cdcl3): 1.20(3h,d,j=6.3),1.24(3h,d,j=6.3),1.81
–
1.94(1h,m),1.98(3h,s),2.04
–ꢀ
2.33(3h,m),3.17(1h,dd,j=14.6,7.2),3.33(1h,dd,j=14.7,5.4),4.37(1h,td,j =7.7,4.4),4.75(1h,td,j=7.4,5.4),4.95(1h,hept,j=6.3),5.16(1h,bs),6.22(d, j=7.6),6.64(1h,d,j=7.3),7.09
–
7.14(2h,m),7.18(1h,ddd,j=8.2,7.0,1.3), 7.32
–
7.38(1h,m),7.66(1h,dd,j=7.9,1.1),8.31(1h,bs).
13
c nmr(101mhz, cdcl3):21.77,21.82,23.38,26.97,28.29,36.25,52.28,54.07,54.95,69.54,110.38, 111.42,118.78,119.79,122.27,123.57,127.74,136.35,170.25,170.85,171.58, 194.04.旋光度:[α]
22d
‑
11.6
°
(c 0.284,chcl3).ir(chcl3):3478m,3417m,3329 w,vbr,3117w,2986m,2934w,2874vw,2855w,2110s,1732s,1660vs,br,1635s, sh,1600w,sh,1554m,br,sh,1505s,br,1467w,1457m,1385s,sh,1377w,vbr, 1350m,1183m,1146m,1105s,1093m,sh,1012w.esi ms:464([m+na]
+
).hr esi ms:c
22
h
27
o5n5na的计算值464.19044;实测464.19050。
[0461]
方案9
[0462][0463]
试剂和条件:(a)lihmds,fmoc
‑
cl,thf,
‑
78℃,对于7a为87%,对 于7b为92%;(b)n
‑
buli,tms重氮甲烷,thf,
‑
116至
‑
78℃,对于8a为 80%,对于8b为85%;(c)哌啶,dcm,rt,对于2a为66%并且对于2b为66%; (d)ch3cn,60℃,对于9a为50%,cdcl3,室温,过夜,对于9b为41%。
[0464]5‑
(重氮甲基)
‑
3,4
‑
二氢
‑
2h
‑
吡咯
‑2‑
羧酸乙酯(9a)参考方案9,将化合物20
[0465]
(117mg,0.588mmol,1eq.)溶解于ch3cn(1ml)中。将反应混合物在惰 性气氛下在60℃下加热2h。蒸发ch3cn,并通过hplc(ch3cn/h2o,hcooh) 纯化粗产物,获得淡橙色油状物(53mg),产率50%。1h nmr(cdcl3):1.27(3h, t,j=7.1),2.83
–
2.93
(1h,m),2.93
–
3.07(2h,m),3.09
–
3.20(1h,m),4.24(2h, dq,j=7.1,2.4),5.17(1h,dd,j=9.2,3.5),7.43(1h,s);
13
c nmr(101mhz, cdcl3):14.11,19.98,34.19,59.06,62.53,126.82,142.77,168.70;ir(chcl3):2942 w,2910w,2875vw,2103vw,1747vs,1475w,1676m,1605vw,1552w,1462w, 1446w,1396w,1377m,1202vs,1177m,1116w,1095m,cm
‑1;esi ms:182([m +h]
+
);hr esi ms:c8h
12
o2n3的计算值182.0930;实测182.0931。
[0466]5‑
(重氮甲基)
‑
3,4
‑
二氢
‑
2h
‑
吡咯
‑2‑
羧酸异丙酯(9b)。参考方案9,将化合物 (ch3cn/h2o,hcooh)纯化粗产物,获得淡橙色油状物 (41mg),产率45%。1h nmr(cdcl3):1.25(3h,d,j=6.1),1.27(3h,d,j=6.1), 2.81
–
2.95(2h,m),2.96
–
3.06(1h,m),3.08
–
3.18(1h,m),5.09(1h,hept,j= 6.1),5.13(1h,dd,j=9.1,3.4),7.43(1h,s);
13
c nmr(101mhz,cdcl3):20.00, 21.69(2c),21.75,34.24,59.20,70.48,126.84,142.71,168.25;旋光度:[α]
22d
‑ꢀ
31.8
°
(c 0.110,chcl3);ir(chcl3):2104w,1741vs,1675w,1644w,1551w,1465 m,1388m,sh,1376m,1209s,1182m,1147m,1106s,cm
‑1;esi ms:196([m+ h]
+
);hr esi ms:c9h
14
o2n3的计算值196.10805;实测196.10808。
[0467]
实施例5
[0468]
don前药的评估
[0469]
概述。尽管观察到了明显的毒性,但是本公开的主题证明了don在gbm 的鼠模型中的深远功效。为了提高don的治疗指数,系统地合成了几种don 前药。最初的策略涉及用简单的烷基酯,如乙酯20和异丙酯3来掩蔽don的 羧酸(图20)。然而,3和20表现出化学不稳定性,其环化形成独特的重氮亚 胺。考虑到这种不稳定性,随后用前药部分掩蔽了don的伯胺和羧酸根。使用 了三种类型的胺前体部分,包括氨基甲酸(氧代二氧杂环戊烯基)甲基酯(13和 36)、二肽(9和25)和新戊酰
‑
氧基
‑
甲基(pom)基酯(14、32和42)。含有 双前体部分的前药导致足够的化学稳定性,允许在体外代谢稳定性测定中进一 步评估。尽管所有前药在小鼠血浆中表现出快速代谢,但一些在猴和人类中提 供了优异的血浆稳定性。当在体内评估时,与don相比,最稳定的don前药 (5c,甲基
‑
pom
‑
don
‑
异丙基酯)在猴中的脑:血浆比例增强了10倍,这为 don在gbm患者中的利用提供了可能的临床途径。
[0470]
化学过程。方案9概述了don的基于酯的前药20和3的合成和表征以及 它们随后环化成新的重氮亚胺9a
‑
b。焦谷氨酸酯6a
‑
b(d'andrea,等人,2008) 被fmoc保护以提供化合物18和1。使用tms重氮甲烷以良好的收率完成了 重氮甲酮19和2的形成。用哌啶快速去保护得到基于酯的前药20和3。即使在 温和条件下(例如在室温下在氯仿中搅拌)也观察到了意想不到的慢环化,得 到新的重氮亚胺9a和9b。据信,这是化学文献中描述的这个官能团的第一个实 例。试图通过形成盐以使胺质子化来避免20和3的环化,导致重氮基团的不稳 定性。此外,与大多数亚胺不同,即使在酸性ph下,也发现5元环状重氮亚胺 9a
‑
b是稳定的,并且不转变回don酯(结果未示出)。
[0471][0472]
鉴于它们的足够的化学稳定性,将化合物20和3用作合成中间体用于制备 双前体部分前药(方案8和2)。如方案8和2中概述的那样合成氨基甲酸(氧代 二氧杂环戊烯基)甲基酯加合物36和13。使4
‑
(羟甲基)
‑5‑
甲基
‑
1,3
‑
二氧杂环戊烯
ꢀ‑2‑
酮与硫代氯碳酸s
‑
乙酯反应(keicher等人,2009),然后与n
‑
羟基琥珀酰亚胺 反应,得到12。20和3与12反应,得到氨基甲酸(氧代二氧杂环戊烯基)甲基酯 36和13,收率极好。
[0473]
方案1、4和7概述了don二肽酯的合成。使用hbtu以高收率使don 酯20和3与fmoc
‑
l
‑
亮氨酸或fmoc
‑
l
‑
色氨酸偶联,形成受保护的二肽33和37 (方案7)。用二乙胺或哌啶去保护得到所需的亮氨酸
‑
don 25(方案4)和9(方 案1)和色氨酸
‑
don前药34和38(方案7)。
[0474]
如方案6所示,使用pom
‑
n
‑
羟基琥珀酸酯(gallop等人,2008)由20合 成pom衍生物42,收率为40%。在pom酯中引入甲基基团导致形成甲基
‑
pom 衍生物32(方案6)和14(方案2),并具有增加的手性中心。使用特戊酸1
‑
((((2,5
‑ꢀ
二氧代吡咯烷
‑1‑
基)氧)羰基)氧)乙基酯由20和3合成32和14(gallop,等人, 2008)。作为两种非对映异构体的混合物(1:1比例)获得了32,产率为68%。 还作为非对映异构体混合物(1:1)比例获得了14,但进一步纯化为其相应的 非对映异构体1和2,其中非对映异构体1用于如下所述的随后的生物测试。
[0475]
结果与讨论。
[0476]
don在鼠gbm模型中显示出强烈抑制谷氨酰胺代谢和抗肿瘤效力。尽管 有几条证据表明在gbm中靶向谷氨酰胺代谢的潜在治疗功效,但don对gbm 肿瘤生长的影响尚未在体内报道。使用gbm的u87侧腹异种移植小鼠模型 (eshleman等人,2002)首次证实,全身施用don(0.8mg/kg,i.p)抑制了谷 氨酰胺代谢,由以下体现:与其他模型系统(willis等人,1977;windmueller 等人,1974)相似,内源性谷氨酰胺在肿瘤中聚积(图21a;p<0.05)。然后评 估其抗肿瘤效力,并观察到don不仅阻止肿瘤生长,而且还有效诱导肿瘤消退。 具体而言,在实验过程中,溶媒处理的小鼠表现出显著的肿瘤生长,而don处 理的小鼠(0.8mg/kg,ip,q.d.)显示肿瘤体积减少>50%(图21b;时间主效应 [f(3,48)=6.049,p=0.0014];处理[f(1,16)=33.42,p<0.0001];相互作用 [f(3,48)=21.70,p<0.0001])。尽管don表现出
优异的抗肿瘤效力,但是所 有接受don的小鼠均显示出显著的毒性征兆,包括体重减轻(12
±
4.1%)、拱 起背部、上睑下垂和嗜睡。这些发现与don在体外和体内的功效和毒性的其他 报道一致(fogal等人,2015;cervantes
‑
madrid等人,2015;potter等人,2015)
[0477]
一些简单的don烷基酯前药被发现是不稳定的。掩蔽don的羧酸根和胺 官能团增强了某些前药的稳定性。通常采用前药策略来增强组织渗透和改变有 效药物的药代动力学参数。事实上,前药策略在药物开发中是常见的,因为5
‑
7% 的批准的全球药物是前药(rautio等人,2008)。don的最初前药策略涉及用简 单的烷基酯,如乙基20和异丙基3掩蔽羧酸。这两种衍生物的合成直接以高收 率得到化合物20和3。令人惊讶的是,60多年来,don化学和效用已被许多研 究组描述(magill等人,1957;dion,等人,1956;magill等人,1956;coffey 等人,1956),但以前在化学文献中没有报道过这些简单的don烷基酯。一个 潜在的原因是已经发现20和3是不稳定的,其缓慢环化形成独特的重氮亚胺9a 和9b。发现这两种独特的衍生物即使在酸性ph下也是化学稳定的,从而排除 了它们作为don前药的用途。
[0478]
鉴于某些简单的酯前药的不稳定性,don的伯胺和羧酸根都用前药部分掩 蔽。这种双前体部分策略是合理的,消除了环化的可能性,并可能进一步改善 亲脂性。使用了三种胺前体部分,包括(氧代二氧杂环戊烯基)甲基氨基甲酸酯(图 20,化合物36、13),二肽(25和38)和基于新戊酰
‑
氧基
‑
甲基(pom)的酯 (42、32、14)。选择这些前体部分是因为它们分别靶向不同的代谢酶,包括对 氧磷酶、氨肽酶和羧酸酯酶。为了赋予pom衍生物进一步的代谢稳定性(表3, 42),制备了相应的甲基
‑
pom类似物(32、14)。所有含有双前体部分的前药都 表现出足够的化学稳定性以允许进一步评估。
[0479]
所有don前药都在小鼠血浆中快速代谢,然而,发现32和14在人和猴血 浆中稳定。表3概述了don前药36、13、25、9、34、38、42、32和14的血 浆稳定性。在60min的孵育时间内,所有前药均在小鼠血浆中完全代谢。然而 在猴和人血浆中,前药32和14(分别在胺上具有甲基
‑
pom和在羧酸根上具有 乙基或异丙基酯)表现出中度/高度的稳定性,在60分钟的孵育时间内,60
‑
75% 的前药保留在猴血浆中,80
‑
90%保留在人血浆中。鉴于14在人血浆中具有最好 的稳定性,选择它用于药代动力学研究中的进一步评估,并将其与don渗透大 脑并释放don的能力进行比较。
[0480][0481]
先导(lead)前药14增强了don在猴中的脑递送,但不增加在小鼠中的脑 递送。正如由在小鼠血浆中完全代谢的don前药所预期的,当向小鼠给药时, 已经发现口服施用don(1)(0.8mg/kg)和14(0.8mg/kg当量)表现出相似的 don血浆(图22a)和脑(图22b)浓度曲线。在施用don和14后,血浆中 don的auc0‑
t
分别为1.25nmol*h/ml和1.22nmol*h/ml,表明在体内don迅 速并完全从14释放。类似地,在小鼠脑中,施用don或14后don的auc0‑
t
分别为0.57nmol*h/g和0.69nmol*h/g,来自don的脑/血浆约为0.46,而来自 前药14的为0.56。这些药代动力学结果证实了体外代谢研究,表明在小鼠血浆 中14完全转化为don。
[0482]
在小鼠研究之后,在猴中评估了don和14a的药代动力学,因为猴更好地 模拟了人类血浆稳定性特征。在短尾猴中,i.v.施用don和14(1.6mg/kg don 当量)表现出显著不同的don血浆曲线(图23a)。don施用提供了高血浆暴 露,auc0‑
t
为42.7nmol*h/ml。相比之下,施用14使don的血浆暴露量降低 约7倍,auc0‑
t
为5.71nmol*h/ml。在csf中看到了相反的观察结果,在其中 施用14后观察到增强的don水平。给药后30min,在csf中,施用don导 致0.33nmol/g don,而施用14则递送1.43nmol/g don。当在30min比较血浆 与csf比例时,与don相比,14表现出don csf递送的10倍增强(图23b)。
[0483]
谷氨酰胺拮抗剂6
‑
重氮
‑5‑
氧代
‑
l
‑
正亮氨酸(don,1)在临床前和临床研 究中显示出强烈的抗癌功效,但由于显著的全身毒性,停止了其开发。在此, 已经证实don在鼠胶质母细胞瘤模型中抑制谷氨酰胺代谢并提供抗肿瘤功效, 尽管观察到了毒性。为了提高don的治疗指数,使用前药策略来增加其脑部递 送并限制全身暴露。出乎意料的是,基于简单的烷基酯的前药由于化学不稳定 性环化形成独特的重氮亚胺而无效。然而,掩蔽don的胺和羧酸酯官能团赋予 了足够生物测试的化学稳定性。尽管这些双部分前药在小鼠血浆中表现出快速 代谢,但几种双部分前药在猴和人血浆中提供了优异的稳定性。最稳定的化合 物(14,甲基
‑
pom
‑
don
‑
异丙基酯)在来自猴、人、猪和狗的血浆中高度稳定, 但在小鼠血浆中快速代谢。当以等摩尔剂量在猴中评估时,与don相比,14 递送较低水平的don至血浆但在csf中有较高水平,其脑:血浆比例增加了 10倍。该策略可能为don在gbm患者中的利用
提供了途径。
[0484]
参考文献
[0485]
说明书中提到的所有出版物、专利申请、专利和其他参考文献指示了本公 开主题所属领域的技术人员的水平。所有的出版物、专利申请、专利和其他参 考文献通过引用并入本文,其程度如同每个出版物、专利申请、专利和其他参 考文献被具体地和单独地通过引用并入。应当理解的是,尽管本文提及了许多 专利申请、专利和其他参考文献,但是这种参考文献并不构成承认任意这些文 献中构成本领域公知常识的一部分。如果说明书与所引用的任何参考文献之间 存在冲突,则以该说明书(包括其任何修改,该修改能基于并入的参考文献) 为准。除非另有说明,否则本文使用术语的标准领域接受的含义。本文使用各 种术语的标准缩写。
[0486]
ahluwalia,g.s.;grem,j.l.;hao,z.;cooney,d.a.metabolism and action of amino acid analog anti
‑
cancer agents.pharmacol ther 1990,46,243
‑
271.
[0487]
alt,j.;potter,m.c.;rojas,c.;slusher,b.s.bioanalysis of 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine in plasma and brain by ultra
‑
performance liquid chromatography mass spectrometry.anal biochem 2015,474,28
‑
34.
[0488]
barclay,r.k.;phillipps,m.a.effects of 6
‑
diazo
‑5‑
oxol
‑
norleucine and other tumor inhibitors on the biosynthesis of nicotinamide adenine dinucleotide in mice. cancer res 1966,26,282
‑
286.
[0489]
cervantes
‑
madrid,d.;romero,y.;duenas
‑
gonzalez,a.reviving lonidamine and 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine to be used in combination for metabolic cancer therapy.biomed res int 2015,2015,690492.
[0490]
coffey,g.l.;ehrlich,j.;fisher,m.w.;hillegas,a.b.;kohberger,d.l.; machamer,h.e.;rightsel,w.a.;roegner,f.r.6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine,a new tumor
‑
inhibitory substance.i.biologic studies.antibiot chemother(northfield)1956, 6,487
‑
497.
[0491]
d'andrea,s.;zheng,z.;scola,p.inhibitors of hepatitis c virus.in google patents:2008.
[0492]
dion,h.w.;fusari,s.a.;jakubowski,z.l.;zora,j.g.;bartz,q.r. 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine,a new tumor
‑
inhibitory substance.ii.1isolation and characterization.j.am.chem.soc.,1956,78,3075
–
3077.
[0493]
dranoff,g.;elion,g.b.;friedman,h.s.;bigner,d.d.combination chemotherapy in vitro exploiting glutamine metabolism of human glioma and medulloblastoma.cancer res 1985,45,4082
‑
4086.
[0494]
dranoff,g.;elion,g.b.;friedman,h.s.;campbell,g.l.;bigner,d.d. influence of glutamine on the growth of human glioma and medulloblastoma in culture.cancer res 1985,45,4077
‑
4081.
[0495]
eagan,r.t.;frytak,s.;nichols,w.c.;creagan,e.t.;ingle,j.n.phase ii study on don in patients with previously treated advanced lung cancer.cancer treat rep 1982,66,1665
‑
1666.
[0496]
earhart,r.h.;amato,d.j.;chang,a.y.;borden,e.c.;shiraki,m.;dowd,m. e.;comis,r.l.;davis,t.e.;smith,t.j.phase ii trial of 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine versus aclacinomycin
‑
a in advanced sarcomas and mesotheliomas.invest new drugs 1990,8,113
‑
119.
[0497]
earhart,r.h.;koeller,j.m.;davis,h.l.phase i trial of 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine(don)administered by 5
‑
day courses.cancer treat rep 1982,66,1215
‑
1217.
[0498]
erickson,j.w.;cerione,r.a.glutaminase:a hot spot for regulation of cancer cell metabolism?oncotarget 2010,1,734
‑
740.
[0499]
eshleman,j.s.;carlson,b.l.;mladek,a.c.;kastner,b.d.;shide,k.l.; sarkaria,j.n.inhibition of the mammalian target of rapamycin sensitizes u87 xenografts to fractionated radiation therapy.cancer res 2002,62,7291
‑
7297.
[0500]
fogal,v.;babic,i.;chao,y.;pastorino,s.;mukthavaram,r.;jiang,p.;cho,y. j.;pingle,s.c.;crawford,j.r.;piccioni,d.e.;kesari,s.mitochondrial p32 is upregulated in myc expressing brain cancers and mediates glutamine addiction. oncotarget 2015,6,1157
‑
1170.
[0501]
gallop,m.a.;xu,f.;phan,t.;dilip,u.;peng,g.acyloxyalkyl carbamate prodrugs,methods of synthesis and use.in google patents:2008.
[0502]
grayzel,a.i.;seegmiller,j.e.;love,e.suppression of uric acid synthesis in the gouty human by the use of 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine.j clin invest 1960,39, 447
‑
454.
[0503]
gross,m.i.;demo,s.d.;dennison,j.b.;chen,l.;chernov
‑
rogan,t.;goyal, b.;janes,j.r.;laidig,g.j.;lewis,e.r.;li,j.;mackinnon,a.l.;parlati,f.; rodriguez,m.l.m.;shwonek,p.j.;sjogren,e.b.;stanton,t.f.;wang,t.;yang,j.; zhao,f.y.;bennett,m.k.antitumor activity of the glutaminase inhibitor cb
‑
839 in triple
‑
negative breast cancer.mol cancer ther 2014.
[0504]
harding,j.j.t.,m.l.;munster,p.n.;le,m.h.;molineaux,c.;bennett, m.k.;mittra,e.;burris,h.a.;clark,a.s.;dunphy,m.;meric
‑
bernstam,f.; patel,m.r.;demichele,a.;infante,j.r.safety and tolerability of increasing doses of cb
‑
839,a first
‑
in
‑
class,orally administered small molecule inhibitor of glutaminase,in solid tumors.j clin oncol 2015.
[0505]
hensley,c.t.;wasti,a.t.;deberardinis,r.j.glutamine and cancer:cell biology,physiology,and clinical opportunities.j clin invest 2013,123,3678
‑
3684.
[0506]
hofer,a.;steverding,d.;chabes,a.;brun,r.;thelander,l.trypanosoma brucei ctp synthetase:a target for the treatment of african sleeping sickness.proc natl acad sci u s a 2001,98,6412
‑
6416.
[0507]
hu,x.;stern,h.m.;ge,l.;o'brien,c.;haydu,l.;honchell,c.d.;haverty,p. m.;peters,b.a.;wu,t.d.;amler,l.c.;chant,j.;stokoe,d.;lackner,m.r.; cavet,
g.genetic alterations and oncogenic pathways associated with breast cancer subtypes.mol cancer res 2009,7,511
‑
522.
[0508]
keicher,j.d.;roberts,c.d.;rajwanshi,v.k.;griffith,r.c.;zheng,x.;liehr, s.j.r.;prhavc,m.;kim,c.u.;ray,a.s.amino tricyclic
‑
nucleoside compounds, compositions,and methods of use.in google patents:2009.
[0509]
konopleva,m.y.;flinn,i.w.;wang,e.;dinardo,c.d.;bennett,m.; molineaux,c.;le,m.;maris,m.;frankfurt,o.in phase 1 study:safety and tolerability of increasing doses of cb
‑
839,an orally
‑
administered small molecule inhibitor of glutaminase,in acute leukemia,haematologica,2015;ferrata storti foundation via giuseppe belli 4,27100 pavia,italy:2015;pp 378
‑
379.
[0510]
le,a.;lane,a.n.;hamaker,m.;bose,s.;gouw,a.;barbi,j.;tsukamoto,t.; rojas,c.j.;slusher,b.s.;zhang,h.;zimmerman,l.j.;liebler,d.c.;slebos,r.j.; lorkiewicz,p.k.;higashi,r.m.;fan,t.w.;dang,c.v.glucose
‑
independent glutamine metabolism via tca cycling for proliferation and survival in b cells.cell metab 2012,15,110
‑
121.
[0511]
lee,y.z.;yang,c.w.;chang,h.y.;hsu,h.y.;chen,i.s.;chang,h.s.;lee, c.h.;lee,j.c.;kumar,c.r.;qiu,y.q.;chao,y.s.;lee,s.j.discovery of selective inhibitors of glutaminase
‑
2,which inhibit mtorc1,activate autophagy and inhibit proliferation in cancer cells.oncotarget 2014,5,6087
‑
6101.
[0512]
lynch,g.;kemeny,n.;casper,e.phase ii evaluation of don (6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine)in patients with advanced colorectal carcinoma.am j clin oncol 1982,5,541
‑
543.magill,g.b.;myers,w.p.alterations in calcium metabolism in cancer patients treated with 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine.proc soc exp biol med 1956,93,314
‑
318.
[0513]
magill,g.b.;myers,w.p.;reilly,h.c.;putnam,r.c.;magill,j.w.;sykes, m.p.;escher,g.c.;karnofsky,d.a.;burchenal,j.h.pharmacological and initial therapeutic observations on 6
‑
diazo
‑5‑
oxo
‑1‑
norleucine(don)in human neoplastic disease.cancer 1957,10,1138
‑
1150.
[0514]
mcdermott,l.a.;iyer,p.;vernetti,l.;rimer,s.;sun,j.;boby,m.;yang,t.; fioravanti,m.;o'neill,j.;wang,l.;drakes,d.;katt,w.;huang,q.;cerione,r. design and evaluation of novel glutaminase inhibitors.bioorg med chem 2016,24, 1819
‑
1839.
[0515]
ostrom,q.t.;gittleman,h.;fulop,j.;liu,m.;blanda,r.;kromer,c.; wolinsky,y.;kruchko,c.;barnholtz
‑
sloan,j.s.cbtrus statistical report: primary brain and central nervous system tumors diagnosed in the united states in 2008
‑
2012.neuro oncol 2015,17 suppl 4,iv1
‑
iv62.
[0516]
potter,m.c.;baxter,v.k.;mathey,r.w.;alt,j.;rojas,c.;griffin,d.e.; slusher,b.s.neurological sequelae induced by alphavirus infection of the cns are attenuated by treatment with the glutamine antagonist 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine.j neurovirol 2015,21,159
‑
173.
[0517]
rahman,a.;smith,f.p.;luc,p.t.;woolley,p.v.phase i study and clinical pharmacology of 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine(don).invest new drugs 1985,3, 369
‑
374.
[0518]
rautio,j.;kumpulainen,h.;heimbach,t.;oliyai,r.;oh,d.;jarvinen,t.; savolainen,j.prodrugs:design and clinical applications.nat rev drug discov 2008,7,255
‑
270.
[0519]
ru,p.;williams,t.m.;chakravarti,a.;guo,d.tumor metabolism of malignant gliomas.cancers(basel)2013,5,1469
‑
1484.
[0520]
schulze,a.;harris,a.l.how cancer metabolism is tuned for proliferation and vulnerable to disruption.nature 2012,491,364
‑
373.
[0521]
shukla,k.;ferraris,d.v.;thomas,a.g.;stathis,m.;duvall,b.;delahanty,g.; alt,j.;rais,r.;rojas,c.;gao,p.;xiang,y.;dang,c.v.;slusher,b.s.;tsukamoto, t.design,synthesis,and pharmacological evaluation of bis
‑2‑
(5
‑
phenylacetamido
‑
1,2,4
‑
thiadiazol
‑2‑
yl)ethyl sulfide 3(bptes)analogs as glutaminase inhibitors.j med chem 2012,55,10551
‑
10563.
[0522]
sklaroff,r.b.;casper,e.s.;magill,g.b.;young,c.w.phase i study of 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine(don).cancer treat rep 1980,64,1247
‑
1251.
[0523]
stupp,r.;hegi,m.e.;mason,w.p.;van den bent,m.j.;taphoorn,m.j.; janzer,r.c.;
[0524]
ludwin,s.k.;allgeier,a.;fisher,b.;belanger,k.;hau,p.;brandes,a.a.; gijtenbeek,j.;marosi,c.;vecht,c.j.;mokhtari,k.;wesseling,p.;villa,s.; eisenhauer,e.;gorlia,t.;weller,m.;lacombe,d.;cairncross,j.g.;mirimanoff,r. o.effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase iii study: 5
‑
year analysis of the eortc
‑
ncic trial.lancet oncol 2009,10,459
‑
466.
[0525]
stupp,r.;mason,w.p.;van den bent,m.j.;weller,m.;fisher,b.;taphoorn, m.j.;belanger,k.;brandes,a.a.;marosi,c.;bogdahn,u.;curschmann,j.;janzer, r.c.;ludwin,s.k.;gorlia,t.;allgeier,a.;lacombe,d.;cairncross,j.g.; eisenhauer,e.;mirimanoff,r.o.radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma.n engl j med 2005,352,987
‑
996.
[0526]
sullivan,m.p.;beatty,e.c.,jr.;hyman,c.b.;murphy,m.l.;pierce,m.i.;severo,n.c.a comparison of the effectiveness of standard dose 6
‑
mercaptopurine, combination 6
‑
mercaptopurine and don,and high
‑
loading 6
‑
mercaptopurine therapies in treatment of the acute leukemias of childhood:results of a coperative study.cancer chemother rep 1962,18,83
‑
95.
[0527]
sullivan,m.p.;nelson,j.a.;feldman,s.;van nguyen,b.pharmacokinetic and phase i study of intravenous don(6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine)in children. cancer chemother pharmacol 1988,21,78
‑
84.
[0528]
tanaka,k.;sasayama,t.;irino,y.;takata,k.;nagashima,h.;satoh,n.; kyotani,k.;mizowaki,t.;imahori,t.;ejima,y.;masui,k.;gini,b.;yang,h.; hosoda,k.;sasaki,r.;mischel,p.s.;kohmura,e.compensatory glutamine metabolism promotes glioblastoma resistance to mtor inhibitor treatment.j clin invest 2015,125,1591
‑
1602.
[0529]
thangavelu,k.;chong,q.y.;low,b.c.;sivaraman,j.structural basis for the active site inhibition mechanism of human kidney
‑
type glutaminase(kga).sci rep 2014,4,3827.
[0530]
upadhyay,r.k.drug delivery systems,cns protection,and the blood brain barrier.biomed res int 2014,2014,869269.
[0531]
weller,m.;van den bent,m.;hopkins,k.;tonn,j.c.;stupp,r.;falini,a.; cohen
‑
jonathan
‑
moyal,e.;frappaz,d.;henriksson,r.;balana,c.;chinot,o.;ram, z.;reifenberger,g.;soffietti,r.;wick,w.eano guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma.lancet oncol 2014,15,e395
‑
403.
[0532]
willis,r.c.;seegmiller,j.e.the inhibition by 6
‑
diazo
‑5‑
oxo
‑
l
‑
norleucine of glutamine catabolism of the cultured human lymphoblast.j cell physiol 1977,93, 375
‑
382.
[0533]
windmueller,h.g.;spaeth,a.e.uptake and metabolism of plasma glutamine by the small intestine.j biol chem 1974,249,5070
‑
5079.
[0534]
wise,d.r.;thompson,c.b.glutamine addiction:a new therapeutic target in cancer.trends biochem sci 2010,35,427
‑
433.
[0535]
虽然为了清楚理解的目的已经通过举例说明和实例详细描述了前述主题, 但是本领域技术人员将会理解,可以在所附权利要求的范围内实施某些改变和 修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1