本申请涉及生物医药领域,具体地,涉及一种用于扩增造血干细胞(hscs)的小分子化合物,具体为细胞信号通路的小分子抑制剂、其组合物,以及该小分子抑制剂及其组合物在扩增造血干细胞中的用途。
背景技术:
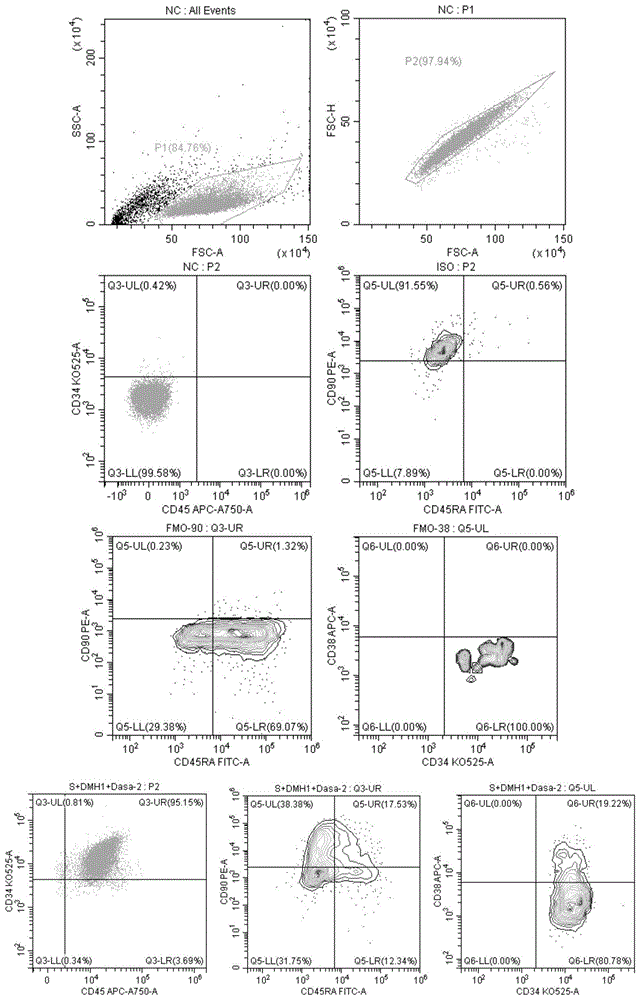
:造血干细胞(hematopoieticstemcells,hscs)是血液系统中一群异质原始造血细胞,具有自我更新和多系分化2个重要特征。机体处于健康状态时,体内hscs长期处于静息状态,当机体发生病变或严重失血状态时,hscs被激活,进入自我更新、多系分化状态,维持血液系统稳定及机体稳态。hscs自我更新特性有利于子代hscs保持干性,而hscs多系分化特性可使其分化成多种成熟血细胞,如髓系细胞(粒细胞、单核细胞、红细胞及血小板),淋系细胞(t细胞和b细胞)。hscs的特性有利于hscs在机体需要时进行分化。hscs的这些特性,使通过造血干细胞移植(hematopoieticstemcelltransplantation,hsct)治疗血液系统疾病成为可能。hscs包含长期造血干细胞(longtermhscs,lt-hscs)和短期造血干细胞(shorttermhscs,st-hscs)。前者具有高度自我更新能力,可在机体整个生命周期进行造血重建;而后者只能在有限时间内保持造血重建功能。1959年,thomas等人利用骨髓造血干细胞进行了人类历史上首次造血干细胞移植,在临床治疗白血病,以恢复病人体内正常造血功能。此后几十年,经过科研工作者的不断努力,造血干细胞移植不仅应用于治疗多种血液系统疾病,还被用于治疗免疫缺陷疾病、神经系统退行性疾病等。目前,hscs主要有三个来源,骨髓(bonemarrow,bm)、动员外周血(mobilizedperipheralblood,mpb)、脐带血(umbilicalcordblood,cb)。采集骨髓造血干细胞,创伤性大,采集量不足,该方法基本被淘汰。人外周血中hscs所占比例很低(小于0.1%),需要用粒细胞集落刺激因子(g-csf)动员造血干细胞从骨髓中迁移至外周血中再进行移植,临床应用中常出现动员效果不佳、所含hscs数量不足,致使多次动员或移植失败。而且这两种方法所采集的hscs均需要进行供者和患者之间白细胞抗原(humanleukocyteantigen,hla)配型。hla配型比较困难,一旦发生错配,则会产生移植物抗宿主反应(graftversushostreaction,gvhd)。发生gvhd的患者会死于免疫系统紊乱。脐带血作为一种新的hscs来源具有多方面优势,首先脐带血hscs对hla配型相合程度要求低,允许hla部分错配,移植后gvhd发病率低,缓解了传统hsct配型困难;其次脐带血采集方便,对供者无伤害且不存在伦理问题,hscs造血能力强。这些优势使脐带血成为未来hscs治疗疾病的优先来源。但由于单份脐带血细胞量少,总体hscs数量较少,因此仅限于儿童或体重较轻的成人移植,不能满足较大体重成人的移植需求。当移植hscs数量不足时,患者中性粒细胞恢复延迟,导致gvhd风险提高。这些都成为制约脐带血临床应用的瓶颈。总之,造血干细胞移植的安全性和有效性取决于移植的hscs含量,若能体外扩增hscs的数量,则可提高造血干细胞移植的成功率。研究者们不断努力,尝试探索不同方法实现造血干细胞的体外扩增。其中一种hscs体外扩增策略是利用靶向hscs的小分子化合物(small-moleculecompounds,smcs)。smcs来源易得,易于批量生产,性质稳定,结构明确,浓度方便调控,已广泛应用于医学研究中。现阶段hscs体外扩增技术中,smcs可显著提高hscs扩增倍数。例如ahr芳烃受体抑制剂stemregenin1(sr1),是筛选出的第一个可体外扩增hscs的smc。嘧啶吲哚衍生物um171也能够体外扩增hscs,但它不是通过ahr细胞信号传导通路发挥作用。转录组分析结果表明,um171没有下调ahr细胞信号传导通路,但抑制了红细胞、巨核细胞分化相关基因。二者组合,对hscs的扩增倍数提高。组蛋白去乙酰酶(histonedeacetylases,hdac)是人们已知的细胞信号传导通路。组蛋白可以通过乙酰化或去乙酰化调节调节特定基因的转录过程、细胞的增殖和分化。已有的研究结果揭示了组蛋白乙酰化在hscs自我更新和增殖方面发挥作用。hdac抑制剂tsa、trapoxin、chlamydocin可体外调节组蛋白乙酰化从而促进hscs的自我更新和增殖。src由src原癌基因编码,是具有酪氨酸蛋白激酶活性的非受体蛋白激酶。它存在于细胞质内,可被多种细胞表面受体激活而参与介导多条细胞信号传导通路,从而调控细胞的增殖、分化等过程,是多条细胞信号传导通路的关键分子。例如src激活后与p52shc协同激活丝裂原活化蛋白激酶(mapk)细胞信号传导通路,参与mapk下游调节细胞生长、分化过程;src也可激活stat细胞信号传导通路,促进相关基因的转录。迄今为止,未有研究报道src抑制剂有助于hscs体外扩增过程中维持干性,而在本发明的研究中我们发现src抑制剂可促进hscs的增殖并能维持hscs的干性。尽管已经发现某些细胞信号通路的小分子抑制剂可以促进hscs的增殖,但本领域需要继续寻找促进hscs增殖作用更强、并且能使增殖后的hscs维持干性的小分子化合物和实现这一目的的综合策略,以满足临床需要。技术实现要素:本申请要解决的问题是,通过研究调控细胞信号传导通路的关键因子来筛选出促进hscs体外扩增同时维持hscs较高比例干性的最佳小分子化合物及其组合物,从而解决现有技术中hscs体外扩增数量仍不足的问题。首先申请人的研究发现,作用于stat细胞信号传导通路的src靶点的多个小分子抑制剂可很好的维持hscs体外培养时的干性,src靶点在stat细胞信号传导通路中对扩增造血干细胞,以及同时维持造血干细胞的干性起到了重要的作用,这是以往研究未被报道过的。进一步地,申请发现在hscs体外培养过程中,hdac抑制剂,例如saha、valproicacid(vpa),与src靶点的小分子抑制剂的组合可很好的维持hscs的干性,其效果远远优于与现有技术中已发现的sr1、um171。因此,本申请一方面发现信号传导及转录激活因子(stat)细胞信号传导通路的小分子抑制剂,例如靶向src靶点的小分子抑制剂可以促进hscs增殖和维持hscs的干性特征。在一些实施方案中,本申请提供了一种促进hscs增殖并维持hscs干性的方法,包括使hscs体外接触含有stat细胞信号传导通路的小分子抑制剂或者其他细胞信号通路小分子抑制剂的培养液。在一些实施方案中,所述stat细胞信号传导通路的小分子抑制剂为src靶点的小分子抑制剂。在一些实施方案中,所述src靶点的小分子抑制剂选自如下的一种或多种:dasatinib、quercetin、um-164、kx2-391和kx1-004。在一些实施方案中,所述src靶点的小分子抑制剂选自如下的一种或多种:dasatinib、um-164和kx1-004。在一些实施方案中,所述src靶点的小分子抑制剂与其他细胞信号通路小分子抑制剂联合使用。在一些实施方案中,所述其它细胞信号通路小分子抑制剂选自以hdac为靶点的小分子抑制剂、以pkc为靶点的小分子抑制剂和以jnk为靶点的小分子抑制剂中的一种或两种以上。在一些实施方案中,所述src靶点的小分子抑制剂与以hdac为靶点的小分子抑制剂、以pkc为靶点的小分子抑制剂或以jnk为靶点的小分子抑制剂联合使用。在一些实施方案中,所述src靶点的小分子抑制剂与以hdac为靶点的小分子抑制剂vpa、以hdac为靶点的小分子抑制剂saha、以pkc为靶点的小分子抑制剂enzastaurin或以jnk为靶点的小分子抑制剂jnk-in-8联合使用。在一些实施方案中,所述src靶点的小分子抑制剂dasatinib与vpa或saha联合使用。在一些实施方案中,所述信号传导及转录激活因子(stat)细胞信号传导通路的小分子抑制剂,例如src靶点的小分子抑制剂,例如dasatinib、um-164或kx1-004维持具有cd34+cd45+cd90+cd45ra-cd38-表型的hscs的细胞占全部细胞中的比例超过8%、10%、15%、20%、25%、30%,例如维持具有cd34+cd45+cd90+cd45ra-cd38-表型的hscs的细胞占全部细胞中的比例为5%-35%、10%-35%、15%-35%、20%-35%、25%-35%、5%-30%、10%-30%、20%-30%、5%-25%、10%-25%、15%-25%、20%-25%、5%-20%、10%-20%、15%-20%;维持cd34+细胞占全部细胞中的比例超过65%、70%、75%、80%、85%。在一些实施方案中,本申请提供了一种用于维持hscs干性的组合物,其包括含有stat细胞信号传导通路的小分子抑制剂。在一些实施方案中,所述含有stat细胞信号传导通路的小分子抑制剂为src靶点的小分子抑制剂。在一些实施方案中,所述src靶点的小分子抑制剂选自如下的一种或多种:dasatinib、quercetin、um-164、kx2-391和kx1-004。在一些实施方案中,所述组合物还包括其它细胞信号通路小分子抑制剂。在一些实施方案中,所述其它细胞信号通路小分子抑制剂包括以hdac为靶点的小分子抑制剂、以pkc为靶点的小分子抑制剂和以jnk为靶点的小分子抑制剂。在一些实施方案中,所述其它细胞信号通路小分子抑制剂包括以hdac为靶点的小分子抑制剂vpa、以hdac为靶点的小分子抑制剂saha、以pkc为靶点的小分子抑制剂enzastaurin和以jnk为靶点的小分子抑制剂jnk-in-8。在一些实施方案中,述组合物还包括sfemii培养基、生长因子flt-3l、生长因子scf、生长因子tpo和生长因子il-6。在一些实施方案中,所述组合物由含有stat细胞信号传导通路的小分子抑制剂和/或其它细胞信号通路小分子抑制剂、sfemii培养基、生长因子flt-3l、生长因子scf、生长因子tpo和生长因子il-6组成。在一些实施方案中,所述组合物维持具有cd34+cd45+cd90+cd45ra-cd38-表型的hscs的细胞占全部细胞中的比例超过8%、10%、15%、20%、25%或30%,例如维持具有cd34+cd45+cd90+cd45ra-cd38-表型的hscs的细胞占全部细胞中的比例为5%-35%、10%-35%、15%-35%、20%-35%、25%-35%、5%-30%、10%-30%、20%-30%、5%-25%、10%-25%、15%-25%、20%-25%、5%-20%、10%-20%、15%-20%。在一些实施方案中,所述组合物维持cd34+细胞占全部细胞中的比例超过65%、70%、75%、80%或85%。在一些实施方案中,所述信号传导及转录激活因子(stat)细胞信号传导通路的小分子抑制剂,例如src靶点的小分子抑制剂,例如dasatinib、um-164或kx1-004与其他细胞信号通路的小分子抑制剂,例如vpa或saha,联合使用维持具有cd34+cd45+cd90+cd45ra-cd38-表型的hscs的细胞占全部细胞中的比例超过8%、10%、15%、20%、25%、30%,例如维持具有cd34+cd45+cd90+cd45ra-cd38-表型的hscs的细胞占全部细胞中的比例为5%-35%、10%-35%、15%-35%、20%-35%、25%-35%、5%-30%、10%-30%、20%-30%、5%-25%、10%-25%、15%-25%、20%-25%、5%-20%、10%-20%、15%-20%;维持cd34+细胞占全部细胞中的比例超过65%、70%、75%、80%、85%。在一些实施方案中,每种抑制剂在培养基中的浓度为:dasatinib:0.1μm-50μm,优选为0.5μm-40μm,进一步优选为0.5μm-30μm,最优选为0.5μm-10μm;saha:10nm-20μm,优选为20nm-15μm,进一步优选为30nm-10μm,最优选为0.1μm-10μm;vpa:10μm-2000μm,优选为10μm-1500μm,进一步优选为10μm-1000μm,最优选为100μm-1000μm;jnk-in-8:0.1μm-20μm,优选为0.5μm-15μm,进一步优选为0.5μm-10μm,最优选为1μm-10μm;epz004777:0.1μm-50μm,优选为0.5μm-40μm,进一步优选为0.5μm-30μm,最优选为0.5μm-10μm;dznep:1nm-500nm,优选为5nm-400nm,进一步优选为10nm-300nm,最优选为10nm-250nm;um-164:0.1μm-1000μm,优选为0.5μm-500μm,进一步优选为1μm-100μm,最优选为1μm-10μm;kx2-391:0.1nm-1000nm,优选为1nm-1000nm,进一步优选为10nm-500nm,最优选为10nm-100nm;kx1-004:0.1μm-1000μm,优选为1μm-1000μm,进一步优选为10μm-500μm,最优选为10μm-100μm。一方面,本申请提供了一种促进hscs增殖并维持hscs干性的方法,包括使hscs体外接触含有如下一种或多种的小分子抑制剂的培养液:1)以hdac为靶点的小分子抑制剂vpa;2)以hdac为靶点的小分子抑制剂saha;3)以pkc为靶点的小分子抑制剂enzastaurin;和4)以jnk为靶点的小分子抑制剂jnk-in-8。一方面,本申请提供了一种用于维持hscs干性的组合物,包含选自如下的任一组合:saha+epz004777、saha+dznep、saha+dasatinib、vpa+dasatinib、saha+jnk-in-8或saha+vpa。在一些实施方案中,所述组合物还包括sfemii培养基、生长因子flt-3l、生长因子scf、生长因子tpo和生长因子il-6。在一些实施方案中,所述组合物由选自的任一组合saha+epz004777、saha+dznep、saha+dasatinib、vpa+dasatinib、saha+jnk-in-8或saha+vpa以及sfemii培养基、生长因子flt-3l、生长因子scf、生长因子tpo和生长因子il-6组成。在一些实施方案中,所述维持hscs干性的组合物还有助于维持cd34+细胞比例。在一些实施方案中,所述组合物维持具有cd34+cd45+cd90+cd45ra-cd38-表型的hscs的细胞占全部细胞中的比例超过8%、10%、15%、20%、25%、30%,例如维持具有cd34+cd45+cd90+cd45ra-cd38-表型的hscs的细胞占全部细胞中的比例为5%-35%、10%-35%、15%-35%、20%-35%、25%-35%、5%-30%、10%-30%、20%-30%、5%-25%、10%-25%、15%-25%、20%-25%、5%-20%、10%-20%、15%-20%;维持cd34+细胞占全部细胞中的比例超过65%、70%、75%、80%、85%。在一些实施方案中,每种抑制剂在培养基中的浓度为:dasatinib:0.1μm-50μm,优选为0.5μm-40μm,进一步优选为0.5μm-30μm,最优选为0.5μm-10μm;saha:10nm-20μm,优选为20nm-15μm,进一步优选为30nm-10μm,最优选为0.1μm-10μm;vpa:10μm-2000μm,优选为10μm-1500μm,进一步优选为10μm-1000μm,最优选为100μm-1000μm;jnk-in-8:0.1μm-20μm,优选为0.5μm-15μm,进一步优选为0.5μm-10μm,最优选为1μm-10μm;epz004777:0.1μm-50μm,优选为0.5μm-40μm,进一步优选为0.5μm-30μm,最优选为0.5μm-10μm;dznep:1nm-500nm,优选为5nm-400nm,进一步优选为10nm-300nm,最优选为10nm-250nm。一方面,本申请提供了一种用于维持hscs干性的组合物,包含选自如下的任一组合:saha+epz004777+dznep或saha+vpa+dasatinib。在一些实施方案中,所述组合物还包括sfemii培养基、生长因子flt-3l、生长因子scf、生长因子tpo和生长因子il-6。在一些实施方案中,所述组合物由saha+epz004777+dznep或saha+vpa+dasatinib以及sfemii培养基、生长因子flt-3l、生长因子scf、生长因子tpo和生长因子il-6组成。在一些实施方案中,所述组合物维持具有cd34+cd45+cd90+cd45ra-cd38-表型的hscs的细胞占全部细胞中的比例超过8%、10%、15%、20%、25%、30%,例如维持具有cd34+cd45+cd90+cd45ra-cd38-表型的hscs的细胞占全部细胞中的比例为5%-35%、10%-35%、15%-35%、20%-35%、25%-35%、5%-30%、10%-30%、20%-30%、5%-25%、10%-25%、15%-25%、20%-25%、5%-20%、10%-20%、15%-20%;维持cd34+细胞占全部细胞中的比例超过65%、70%、75%、80%、85%。在一些实施方案中,每种抑制剂在培养基中的浓度为:dasatinib:0.1μm-50μm,优选为0.5μm-40μm,进一步优选为0.5μm-30μm,最优选为0.5μm-10μm;saha:10nm-20μm,优选为20nm-15μm,进一步优选为30nm-10μm,最优选为0.1μm-10μm;vpa:10μm-2000μm,优选为10μm-1500μm,进一步优选为10μm-1000μm,最优选为100μm-1000μm;epz004777:0.1μm-50μm,优选为0.5μm-40μm,进一步优选为0.5μm-30μm,最优选为0.5μm-10μm;dznep:1nm-500nm,优选为5nm-400nm,进一步优选为10nm-300nm,最优选为10nm-250nm。在一些实施方案中,所述stat细胞信号传导通路的小分子抑制剂为src靶点的小分子抑制剂。在一些实施方案中,所述src靶点的小分子抑制剂选自如下的一种或多种dasatinib、quercetin、um-164、kx2-391和kx1-004。在一些实施方案中,所述src靶点的小分子抑制剂选自如下的一种或多种:dasatinib、um-164和kx1-004。在申请人的研究结果中,上述这些细胞信号传导通路的小分子抑制剂,均可很好维持hscs体外扩增时的干性和cd34+细胞比例,而且这些小分子抑制剂的组合对于hscs的自我更新、干性维持等方面优于与现有技术中已报道的小分子组合的效果。在本申请中,申请人的研究结果发现了src的抑制剂,在hscs体外扩增培养方面,可很好的维持hscs的干性;并且发现了hdac抑制剂,与src抑制剂进行组合,在hscs体外扩增培养方面,效果优于已报道的小分子抑制剂和这些小分子抑制剂单独使用效果。申请人的研究结果可以实现hscs的体外扩增的同时维持hscs较高比例的干性,为实现hscs的临床应用奠定基础。上述造血干细胞的“干性”为造血干细胞特性的简称。造血干细胞(hscs)主要呈现两大方面的细胞生物学特征:自我更新的能力(self-renewalcapacity)和多能分化潜能(pluripotency)。造血干细胞的这些特性简称为“干性”(stemness)。造血干细胞的细胞表面表达的分子表型可以某种程度上体现其是否维持了“干性”。例如,如果造血干细胞的表型为cd34+cd45+cd90+cd45ra-cd38-,说明其为lt-hscs,维持了“干性”。在本申请中,具有cd34+cd45+cd90+cd45ra-cd38-表型的造血干细胞,定义为lt-hscs;造血干细胞具有cd34+cd45+cd90+cd45ra-cd38-表型,定义为其维持或保持了造血干细胞特性,即“干性”。所述全部细胞是指最初的cd34+细胞经过培养之后的所有子代细胞。本发明将造血干细胞体外接触含有stat细胞信号传导通路的小分子抑制剂如src靶点的小分子抑制剂或者其他细胞信号通路小分子抑制剂如以hdac为靶点的小分子抑制剂、以pkc为靶点的小分子抑制剂和以jnk为靶点的小分子抑制剂,能够很好维持hscs体外扩增时的干性和cd34+细胞在全部hscs中的比例,而且这些小分子抑制剂的组合对于hscs的自我更新、干性维持等方面优于与现有技术中已报道的小分子组合的效果,而且,使用上述小分子抑制剂处理后的细胞移植效率明显高于现有技术中已报道的小分子抑制剂处理后的细胞移植效率。附图说明图1显示了目的细胞群cd34+cd45+cd45ra-cd90+cd38-细胞群的逻辑门及门位置的确定。图2显示了在脐带血来源的cd34+细胞上进行小分子抑制剂的最佳浓度以及能够维持hscs干性的第一轮筛选,表4中小分子抑制剂(每种小分子测试4个浓度)诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。图3显示了在脐带血来源的cd34+细胞上进行小分子抑制剂的最佳浓度以及能够维持hscs干性的第二轮筛选,表5中小分子抑制剂诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。图4显示了在脐带血来源的cd34+细胞上进行小分子抑制剂的最佳浓度以及能够维持hscs干性的第三轮筛选,表6中小分子抑制剂(除saha-1μm外,每个抑制剂测试3个浓度)诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。图5显示了在脐带血来源的cd34+细胞上进行小分子抑制剂的最佳浓度以及能够维持hscs干性的第四轮筛选,表7中小分子抑制剂(除saha-1μm外,每个抑制剂测试3个浓度)诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。图6显示了在脐带血来源的cd34+细胞上进行小分子抑制剂的最佳浓度以及能够维持hscs干性的第五轮筛选,表8中小分子抑制剂(除saha-1μm外,每个抑制剂测试3个浓度)诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。图7显示了在脐带血来源的cd34+细胞上进行小分子抑制剂维持hscs干性的最佳双分子组合的第一轮筛选,小分子组合saha+sr1、saha+ve821、saha+pfi3、saha+s-4-a诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。图8显示了在脐带血来源的cd34+细胞上进行小分子抑制剂维持hscs干性的最佳双分子组合的第二轮筛选,小分子组合saha+sr1,saha+um171,saha+pge2,saha+gw9662,saha+flu诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。图9显示了在脐带血来源的cd34+细胞上进行小分子抑制剂维持hscs干性的最佳双分子组合的第三轮筛选,小分子组合saha+butyrate,saha+epz004777,saha+dznep,saha+vitaminc(除saha外,每个抑制剂测试3个浓度)诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。s代表saha(1μm)。图10显示了在脐带血来源的cd34+细胞上进行小分子抑制剂维持hscs干性的最佳双分子组合的第四轮筛选,小分子组合saha+dasatinib,saha+sgc0496,saha+jnk-in-8,saha+enzastaurin(ly317615)(除saha外,每个抑制剂测试3个浓度)诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。s代表saha(1μm)。图11显示了在脐带血来源的cd34+细胞上进行小分子抑制剂维持hscs干性的最佳双分子组合的第五轮筛选,小分子组合saha+vpa、saha+go6983、saha+dca、saha+gsk2606414(除saha外,每个抑制剂测试2-3个浓度)诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。s代表saha(1μm)。图12显示了在脐带血来源的cd34+细胞上进行小分子抑制剂维持hscs干性的最佳三分子组合的第一轮筛选,小分子组合saha+epz004777+dznep诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。每组3个重复,*代表具有显著性差异。图13显示了在脐带血来源的cd34+细胞上进行小分子抑制剂维持hscs干性的最佳三分子组合的第二轮筛选,小分子组合saha+dasatinib+epz004777、saha+jnk-in-8+epz004777、saha+jnk-in-8+dznep、saha+jnk-in-8+dasatinib、saha+jnk-in-8+epz004777+dznep诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的组合名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。每组3个重复,*代表具有显著性差异。图14显示了在脐带血来源的cd34+细胞上进行小分子抑制剂维持hscs干性的最佳三分子组合的第三轮筛选,小分子组合saha+vpa+dasatinib诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的组合名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。每组3个重复,*代表具有显著性差异。图15显示了在脐带血来源的cd34+细胞上进行已筛选小分子抑制剂与文献报道小分子抑制剂sr1、um171的比较。小分子抑制剂诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂组合名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。每组3个重复,*代表具有显著性差异。图16显示了在脐带血来源的cd34+细胞上进行已筛选小分子抑制剂与文献报道小分子抑制剂sr1、um171体外克隆形成能力的分析图。bfu-e、cfu-e、cfu-gm、cfu-gemm代表红系、髓系、淋巴系等血液系统不同谱系的克隆。其中,横坐标代表抑制剂组合名称以及使用浓度,纵坐标coloniesnumber代表总克隆数,coloniesnumberofgemm代表cfu-gemm克隆数量。每组3个重复,*代表具有显著性差异。s代表saha(1μm)。图17显示了在脐带血来源的cd34+细胞上进行小分子抑制剂的最佳浓度以及能够维持hscs干性的筛选,表9中小分子抑制剂(除saha-1μm外,每个抑制剂测试3个浓度)诱导6-7天后流式检测lt-hscs细胞表面标志物(cd34+/cd45+/cd90+/cd45ra-/cd38-)表达分析图,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。图1818a、18c显示了在脐带血来源的cd34+细胞上进行小分子mock(dmso)、sr1(5μm)、um171(350nm)、dasatinib(50nm)处理8天后流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达分析图,其中,横坐标代表抑制剂的名称,纵坐标cd34+cd45+cd90+cd45ra-cd38-(%)代表lt-hscs占所有细胞的比例,cd34+cd45+(%)代表hscs纯度。18b、18d显示了在脐带血来源的cd34+细胞上进行小分子mock(dmso)、sr1(5μm)、um171(350nm)、dasatinib(50nm)处理8天后lt-hscs以及cd34+细胞增殖的绝对数量,其中,横坐标代表抑制剂的名称,纵坐标代表细胞的数量。图19显示了hcd45+以及mcd45+细胞群的逻辑门及门位置的确定。其中,nc代表未加抗体的对照,33代表加入抗体的第33号样本,hcd45代表人源的cd45+细胞,mcd45代表鼠源的cd45+细胞。图20显示了hcd45+、hcd3+、hcd33+、hcd56+、hcd19+以及mcd45+细胞群的逻辑门及门位置的确定。其中,hcd3+代表人源的cd3+细胞,是t淋巴细胞的一种表面标志物。hcd33+代表人源的cd33+细胞,是髓系细胞的一种表面标志物。hcd56+代表人源的cd56+细胞,是自然杀伤细胞(nk细胞)的一种表面标志物。hcd19+代表人源的cd19+细胞,是b淋巴细胞的一种表面标志物。mcd45代表鼠源的cd45+细胞。图21显示了在脐带血来源的cd34+细胞上进行小分子mock(dmso)、sr1(5μm)、dasatinib(50nm)处理7天后,收集所有细胞并移植小鼠体内,在移植后第4周、8周、12周和16周流式检测小鼠外周血中人源的cd45细胞比例,在移植后第16周流式检测小鼠骨髓和脾脏中人源的cd45细胞比例。图21a横坐标代表抑制剂的名称以及移植时间,纵坐标hcd45-pb(%)代表在小鼠外周血中检测到的人源的cd45+细胞的比例。pb代表外周血(peripheralblood),hcd45代表人源的cd45+细胞。图21b横坐标代表抑制剂的名称,纵坐标hcd45-bm(%)代表在小鼠骨髓中检测到的人源的cd45+细胞的比例。bm代表骨髓(bonemarrow),hcd45代表人源的cd45+细胞。图21c横坐标代表抑制剂的名称,纵坐标hcd45-sp(%)代表在小鼠脾脏中检测到的人源的cd45+细胞的比例。sp代表脾脏(spleen),hcd45代表人源的cd45+细胞。图22显示了在脐带血来源的cd34+细胞上进行小分子mock(dmso)、sr1(5μm)、dasatinib(50nm)处理7天后,收集所有细胞并移植小鼠体内,在移植后16周流式检测小鼠外周血、骨髓、脾脏中人源的hcd3+、hcd33+、hcd56+、hcd19+细胞比例,分别代表人源的t淋巴细胞(t)、髓系细胞(my)、自然杀伤细胞(nk)、b淋巴细胞(b)。其中,横坐标代表抑制剂的名称,图22a纵坐标代表在外周血中不同谱系细胞占hcd45+细胞的比例。图22b纵坐标代表在骨髓中不同谱系细胞占hcd45+细胞的比例。图22c纵坐标代表在脾脏中不同谱系细胞占hcd45+细胞的比例。实施例实施例1:脐带血分选cd34+hscs用于后续小分子筛选准备试剂h-lysebuffer(1×)溶液和washbuffer(1×)溶液。取5mlh-lysebuffer10×储存液(r&d,货号:wl1000),加45ml去离子水(edigene,0.22μm滤膜过滤),混匀,配制成h-lysebuffer(1×)溶液。取5mlwashbuffer10×储存液(r&d,货号:wl1000),加45ml去离子水,混匀,配制成washbuffer(1×)溶液。向10ml脐带血(edigene)中加注生理盐水至终体积为30ml。向该稀释血液中加入人淋巴细胞分离液(达科为,货号:dkw-klsh-0100),之后400g离心30min(设置升速3,降速0),吸取白膜层,500g离心10min。将细胞沉淀集中至一个50ml离心管中,加入h-lysebuffer(1×)10ml,常温裂解红细胞10min。然后加入10mlwashbuffer(1×)终止裂解反应,补加生理盐水至终体积为50ml。将上述50ml离心管转移至高速离心机中,500g离心10min,弃上清,用50ml生理盐水(1%hsa)重悬细胞,混匀,取20μl细胞悬液至细胞计数仪(nexcelom,型号:cellometerk2)中计数,将该离心管转移至高速离心机中,500g离心10min。弃上清,根据计数结果加入相应体积的磁珠(100ulfcr/1*10^8cell和100ulcd34microbeads/1*10^8cell),其操作如下:首先加入fcrblockingreagent(miltenyibiotec,货号:130-100-453,试剂用量根据细胞计数结果决定)重悬细胞,再加入预混匀的cd34microbeads(cd34microbeadkitultrapure,human:miltenyibiotec,货号:130-100-453),混匀,4℃冰箱中孵育30min。往离心管中加生理盐水(1%hsa)至终体积为50ml,转移至高速离心机中,500g离心10min。准备磁力分离器(miltenyibiotec,型号:130-042-102)和一个磁力架(miltenyibiotec,型号:130-042-303),将磁力分离器调整至合适高度,放入mscolumn(miltenyibiotec,货号:130-042-201)或lscolumn(miltenyibiotec,货号:130-042-401)(根据细胞量决定选用柱子的类型,具体参考产品相关说明书),下方放置15ml离心管(corning,货号:430791)收集非目标细胞悬液,用1ml(ms柱)或者3ml(ls柱)生理盐水(1%hsa)润洗mscolumn或lscolumn。在上述高速离心机(thermo,型号:st40)中的离心管离心后,弃上清,用1ml(ms柱)或3ml(ls柱)生理盐水(1%hsa)重悬细胞,往每个分选柱(分选柱的用量根据脐血的份数以及细胞量决定)中加入细胞悬液。再用1ml(ms柱)或3ml(ls柱)生理盐水(1%hsa)洗涤离心管,洗涤液加入柱中。用1ml(ms柱)或3ml(ls柱)生理盐水(1%hsa)洗涤mscolumn或lscolumn。重复3次。将分选柱转移至新的15ml离心管上方,加入2ml(ms柱)或3ml(ls柱)生理盐水(1%hsa)洗脱目标细胞,再加入1ml(ms柱)或2ml(ls柱)生理盐水(1%hsa)重复洗脱目标细胞一次。取20μl细胞悬液至细胞计数仪(nexcelom,型号:cellometerk2)中计数,剩余细胞悬液400g离心5min。不完全弃上清,留1ml上清,重悬细胞。取一个新的mscolumn,加入1ml生理盐水(1%hsa)润洗,将上述经重悬的细胞的细胞悬液转移至该mscolumn中,重复上述洗涤和洗脱步骤,获得3ml目标细胞悬液。取20μl细胞悬液至细胞计数仪(nexcelom,型号:cellometerk2)中计数,根据细胞密度和细胞悬液体积,计算总细胞数,剩余细胞悬液400g离心5min,弃上清备用。实施例2:小分子抑制剂浓度测试以及筛选根据小分子抑制剂的说明书标明的溶解度以及所需溶剂(小分子抑制剂货号参见表1),进行小分子抑制剂储存液的配置。接着进行基础培养基的配制:sfemii培养基(stemcell,货号:09655)+50ng/ml生长因子flt-3l(peprotech,货号:300-100ug)+50ng/ml生长因子scf(peprotech,货号:300-07-100ug)+50ng/ml生长因子tpo(peprotech,货号:300-18-100ug)+10ng/ml生长因子il-6(peprotech,货号:200-06-20ug)+1%双抗(hyclone,货号:sv30010)。根据设置的小分子抑制剂浓度梯度,利用储存液和基础培养基,配制含有不同浓度小分子抑制剂的培养基。首先,将准备好的培养基加入到24孔板(corning,货号:3473)中,每孔950μl,放置在二氧化碳培养箱(thermo,型号:3111)中预热;将实施例1中备用的hscs用sfemii+50ng/mlflt-3l+50ng/mlscf+50ng/mltpo+10ng/mlil-6+1%双抗重悬,按照每孔50μl细胞悬液,每孔细胞密度为2*10^5/ml计算所加的培养基体积。例如每孔细胞培养液终体积为1ml,根据每孔细胞密度计算每孔细胞总量为2*10^5个细胞,每孔补加的50μl细胞悬液密度则为4*10^6/ml,将实施例1中备用的hscs密度调整为计算所得的细胞悬液密度,进行添加;从培养箱中拿出预热好的培养基,每孔中加入50μl细胞悬液,混匀后,显微镜(olympus,型号:ckx53)下观察细胞状态,然后放入培养箱中培养。表1:小分子抑制剂实施例3:流式检测hscs干性以及cd34+的维持本实施例中所使用的抗体及其来源参见表2。表2:抗体将上述实施例2中培养至6-7天(d6-d7)的细胞取样20μl计数,根据计数结果取出2*10^5个细胞的悬液至1.5ml离心管中;400g,5min离心,弃上清。取含1%hsa(人血清白蛋白,广东双林,货号:s10970069)的pbs(磷酸缓冲盐溶液,hyclone,货号:sh30256.01)100ul,重悬细胞,涡旋混匀,备用。然后,收集对照细胞样本。细胞数量及收集方法同待测样本细胞操作。对照分别设定为nc组、iso组,细胞选择为本批次实验中待检样本的任一样本或混合细胞,视细胞数量而定。同批次实验中各对照组不设重复检测。组别设置参见表3。表3组别设置按照上表3,向上述待检测细胞样本及对照细胞样本的细胞悬液中,按组别对应加入抗体。涡旋混匀,室温避光孵育15min。15min孵育结束后,在每个实验样本中加入含1%hsa的pbs1ml,混匀,400g,5min室温离心。离心结束后,弃上清,每个实验样本用100μl含1%hsa的pbs重悬细胞。上机检测前样本室温避光保存。使用流式细胞仪检测。检测结果按如下方法分析:1)目的细胞群为cd34+cd45+cd45ra-cd90+cd38-细胞群;2)逻辑门及门位置的确定参见图1所示:首先圈定细胞群,p1门;来源于p1门的细胞群去除粘连细胞,为p2门;来源于p2门的细胞群用nc或iso圈定cd34,cd45,cd45ra阴性细胞群,为q3-ll门(cd34-/cd45-),q5-ul+q5-ll门(cd45ra-);fmo90圈定cd90阴性细胞群,为q5-ll+q5-lr门;fmo38圈定cd38阴性细胞群,为q6-lr门;应用nc,iso,fmo划定的门,确定q3-ur—q5-ul—q6-lr门圈定的细胞为cd34+cd45+cd45ra-cd90+cd38-目的细胞。实施例4:单分子筛选在实施例1中分选出来的脐带血来源的cd34+细胞上,以实施例2相同的方法进行小分子抑制剂的最佳浓度以及能够维持hscs干性的筛选,小分子诱导6-7天后,用与实施例3相同的方法流式细胞仪检测长期造血干细胞(long-termhematopoieticstemcells,lt-hscs)细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达。在本实施例中共进行了五轮筛选,每轮筛选的抑制剂以及测试浓度见表4、表5、表6、表7、表8,其结果分别如图2-图6所示。图2结果表明,在提高lt-hscs比例方面,saha显著优于表4中其他抑制剂,其效果是其他抑制剂的2-20倍。当saha为5μm时,在显微镜下观察细胞状态差,而通过细胞计数比较,增殖较差,故选用1μm的浓度进行后续的筛选。在维持cd34+细胞比例方面,saha(1μm)略好于对照组(mock,0.01%dmso)。图3结果表明,与表5中的已知文献中(faresi,etal.science.2014;evanst.cellstemcell.2009;boitanoae,etal.science.2010;guob,etal.naturemedicine.2018;guob,etal.naturemedicine.2017)报道的小分子抑制剂um171、pge2、sr1、gw9662、flu进行比较,在维持hscs干性方面,saha的效果是已报道小分子的10-20倍,且在维持cd34+细胞比例方面,saha与sr1并无显著性差异,但明显优于um171,pge2、gw9662、flu。图4结果表明,在维持hscs干性方面,saha比表6中其他抑制剂高约2-15倍。同时saha在维持cd34+细胞比例方面要优于其他抑制剂。图5结果表明,在维持hscs干性方面,saha显著优于表7中其他抑制剂,是其他抑制剂的1-12倍,其次是enzastaurin低浓度使用时,lt-hscs比例是其他抑制剂(saha除外)的3-10倍。在维持cd34+细胞比例方面,jnk-in-8能够维持cd34+比例在90%左右。除jnk-in-8外,saha和dasatinib略优于其他抑制剂。图6结果表明,维持lt-hscs干性方面,表8中valproicacid(vpa)显著高于其他小分子约30倍,比saha高约1倍。saha是其他小分子(vpa除外)的15倍。在维持cd34+细胞比例方面,saha和vpa要优于其他小分子。综上所述:在本实施例中,共筛选出能够维持lt-hscs干性和cd34+细胞高比例的小分子共5个,分别是以hdac为靶点的vpa、saha,以src为靶点的dasatinib,以pkc为靶点的enzastaurin,以jnk为靶点的jnk-in-8。表4:第一轮筛选小分子抑制剂名称测试浓度ve8210.1μm,1μm,5μm,10μmaz200.1μm,1μm,5μm,10μmpfi-30.2μm,2μm,5μm,10μmsodium4-aminosalicylate(s-4-a)0.1mm,1mm,5mm,10mmpdtc1nm,5nm,10nm,50nmsaha0.1μm,1μm,5μm,10μmsantacruzamatea(sis3hcl)0.1μm,1μm,5μm,10μmsr10.1μm,1μm,5μm,10μm表5:第二轮筛选表6:第三轮筛选小分子抑制剂名称测试浓度saha1μmvitaminc5μg/ml,25μg/ml,50μg/mlepz0047770.5μm,5μm,10μmforskolin5μm,10μm,20μmcpi-4551μm,5μm,10μmdznep10nm,50nm,250nmchir-990211μm,3μm,10μmbutyrate50μm,250μm,500μm,sb2035801μm,5μm,10μmiwp-21μm,5μm,10μmiwr-1-endo1μm,5μm,10μmjnk-inhibitorix1μm,5μm,10μmdibutyryl-camp1μm,5μm,10μmthiazovivin1μm,5μm,10μmimr-11μm,5μm,10μmsb4315421μm,5μm,10μmquercetin0.5μm,1μm,5μm表7:第四轮筛选小分子抑制剂名称测试浓度saha1μmdasatinib0.5μm5μm10μmsgc04961μm5μm10μmjnk-in-81μm2μm10μmenzastaurin(ly317615)1μm5μm10μm表8:第五轮筛选实施例5:双分子组合筛选在实施例1中分选出来的脐带血来源的cd34+细胞上,以实施例2相同的方法进行小分子抑制剂维持hscs干性的最佳双分子组合筛选,小分子组合诱导6-7天后,用与实施例3相同的方法流式细胞仪检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达。根据上述实施例4筛选的能够显著维持hscs干性的小分子saha,将其与其他抑制剂进行组合,具体组合及其使用浓度见相关附图,其结果分别如图7-图11所示。图7结果表明,在hscs干性维持和cd34+细胞比例方面,saha与表4中4种造血干细胞扩增有关的细胞信号传导通路中作用的抑制剂的组合saha+sr1、saha+ve821、saha+pfi-3、saha+s-4-a对比没有显著优于saha单独使用。图8结果表明,在维持hscs干性方面,前述文献中报道的抑制剂,即表5中的抑制剂sr1,um171,pge2,gw9662,flu单独使用效果远低于saha,与saha组合效果也低于saha单独使用。在维持cd34+细胞比例方面,saha单独使用与这些抑制剂和saha组合使用也没有显著差异。图9结果表明,在维持hscs干性方面,saha与表6中的butyrate组合中,butyrate低浓度使用效果不如saha单独使用,butyrate高浓度使用效果优于saha单独使用,但是高浓度条件下,butyrate对细胞毒性大,而且如实施例4中所得结果表明butyrate单独使用效果不如saha单独使用,且其与saha为相同靶点抑制剂,故后续不对butyrate做进一步研究。saha与表6中的epz004777和dznep分别组合,saha+epz004777和saha+dznep组合优于saha单独使用。在维持cd34+细胞比例方面,这些双分子组合与saha单独使用并无显著差异。因此,筛选出saha+epz004777和saha+dznep组合能够很好的维持hscs干性和cd34+细胞比例。图10结果表明,在维持hscs干性方面,saha与表7中的4种小分子抑制剂分别组合,saha+dasatinib组合和saha+jnk-in-8组合的效果是saha单独使用的3倍,是mock组的30倍。在维持cd34+细胞比例方面,saha+dasatinib组合和saha+jnk-in-8组合与saha单独使用无显著差异,高于mock组5%-10%。在单分子筛选中能够较好维持lt-hscs干性的小分子enzastaurin与saha组合后,其效果远不如saha单独使用,后续未再对enzastaurin与saha的组合做进一步研究。因此,筛选出saha+dasatinib和saha+jnk-in-8组合在维持hscs干性方面,同时维持cd34+细胞比例方面效果较好。图11结果表明,在维持干性方面,saha与表8中的vpa组合,saha+vpa组合的效果高于saha单独使用约2-4倍,高于mock组20倍。在维持cd34+细胞比例方面,saha+vpa组合与saha单独使用无明显差异,比mock组高10%-20%。综上所述,在双分子筛选中,共筛选出能够维持lt-hscs干性和cd34+细胞比例的组合有saha+dasatinib、saha+dznep、saha+epz004777、saha+jnk-in-8、saha+vpa。实施例6:三分子组合筛选在实施例1中分选出来的脐带血来源的cd34+细胞上,以实施例2相同的方法进行小分子抑制剂维持hscs干性的最佳三分子组合筛选,小分子组合诱导6-7天后,用与实施例3相同的方法流式细胞仪检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达。(1)将实施例5中筛选的能够维持hscs干性的组合saha+epz004777,saha+dznep进行三分子组合,其结果如图12所示。图12结果表明,在维持hscs干性方面,saha+epz004777+dznep三分子组合高于mock组约20倍,高于saha单独使用和saha+epz004777双分子组合约2倍,略高于saha+dznep双分子组合。在维持cd34+细胞比例方面,三分子组合以及双分子组合与mock组有显著性差异,cd34+细胞比例均为80%左右。(2)将实施例5中筛选的能够维持hscs干性的组合saha+epz004777,saha+dznep,saha+jnk-in-8,saha+dasatinib进行三分子组合,其结果分别如图13和图14所示。图13结果表明,在维持hscs干性方面,saha+jnk-in8组合效果不如saha+dasatinib,后续不对saha+jnk-in8做进一步研究。saha+dasatinib+epz004777与saha+dasatinib相比无显著性差异,其他三分子组合在维持lt-hscs干性方面效果不如saha+dasatinib。在维持cd34+细胞比例方面,saha+dasatinib维持cd34+细胞比例约80%。图14结果表明,根据实施例5中筛选的能够维持hscs干性的双分子组合saha+dasatinib、saha+vpa进行重新组合。在维持hscs干性方面,saha+vpa+dasatinib三分子组合效果是mock组的50倍,是双分子组合的1.5-2倍。在维持cd34+细胞比例方面,saha+vpa+dasatinib三分子组合高于mock组20%。综上所述,大部分三分子组合在维持lt-hscs干性方面,其效果不如双分子组合saha+dasatinib,三分子组合中效果较好的组合是saha+epz004777+dznep、saha+dasa+vpa。实施例7:已筛抑制剂saha、vpa、dasatinib和文献报道抑制剂um171,sr1单独使用和组合使用的比较在实施例1中分选出来的脐带血来源的cd34+细胞上,以实施例2相同的方法进行已筛抑制剂saha、vpa、dasatinib与文献(faresi,etal.science.2014;boitanoae,etal.science.2010;)报道抑制剂um171,sr1单独使用和组合使用的比较。小分子抑制剂诱导6-7天后,用与实施例3相同的方法流式细胞仪检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达,其结果如图15所示。图15结果表明,在维持hscs干性方面,小分子单独使用时,saha、vpa比sr1、um171高2-5倍。双分子组合中,saha+dasatinib和vpa+dasatinib比saha+sr1,saha+um171高1.5-2倍。三分子组合saha+dznep+epz004777略低于saha+dasatinib和vpa+dasatinib。在维持cd34+细胞比例方面,单分子saha、vpa与双分子组合saha+dasatinib、vpa+dasatinib之间无显著差异,cd34+细胞比例均在80%左右。综上所述,在维持lt-hscs干性方面和cd34+细胞比例方面,双分子组合saha+dasatinib和vpa+dasatinib效果优于小分子单独使用、双分子组合saha+sr1和saha+um171以及三分子组合saha+dznep+epz004777。实施例8:cd34+造血干细胞集落形成培养本实施例通过集落形成单位(colony-formingunit,cfu)检测脐血来源的造血干细胞经过小分子抑制剂诱导后的体外功能进行定性和定量检测,验证其体外分化潜能。首先,分装100ml培养基methoculttmh4034optimum(stemcell,货号:04034),然后在2-8℃过夜解冻。剧烈摇晃1-2min后静置10min,待气泡浮升至液面。将50ml注射器针头紧套在5ml一次性注射器后,吸取培养基至1ml,全部推出注射器以排尽注射器内气体,重新吸取3ml分装至每个15ml离心管(corning,货号:430791)。2-8℃保存1个月,-20℃长期保存,切勿反复冻融。准备3ml培养基methoculttmh4034optimum,然后在室温(15-25℃)或2-8℃过夜解冻。进行细胞接种。取小分子抑制剂诱导后扩增培养7天后的细胞(脐血来源的经小分子抑制剂诱导后的cd34+造血干细胞)悬液细胞计数,根据计数结果吸取100倍接种密度的细胞悬液(例如,接种密度100cells/孔/3ml,应收集10000cells),加入到1ml的2%fbs(gibco,货号:16000-044)-imdm(gibco,货号:12440-053)培养基中,混匀备用。将上述细胞混匀后吸取50μl细胞悬液加入到0.5mlimdm(2%fbs)重悬细胞(相当于将细胞悬液稀释10倍),混匀后,取出100μl细胞悬液(100个细胞)加入到3mlmethoculttmh4034optimum中。涡旋至少4s后静置10min,待气泡浮升至液面。3ccsyringes(stemcell,货号:28240)与blunt-endneedles16gauge(stemcell,货号:28110)配合使用,吸取所得细胞悬液至1ml,全部推出注射器以排尽注射器内气体,重新吸取所得全部细胞悬液,向smsrtdishtm-6(stemcell,货号:27370,6孔板)一个孔注入3ml,缓慢倾斜6孔板使细胞悬液均匀铺满孔底部。按上述接种完所有细胞后,将6孔板各孔间隙内补加无菌pbs3ml,防止培养基干涸。将6孔板盖好盖子后放入二氧化碳培养箱(thermo,型号:3111),37℃,5%co2,95%相对湿度,培养14天。于培养第7,14天进行观察集落,培养14天后用stemgridtm-6计数网格(stemcell,货号:27000)进行克隆计数。集落的判定标准如下(不同分类的集落可反应出hscs集落形成能力,维持干性的能力):cfu-gemm(cfu-g、cfu-e、cfu-mm):粒细胞-红细胞-巨噬细胞-巨核细胞集落形成单位。一个集落内包含红细胞和20个或更多个非红细胞(粒细胞、巨噬细胞和/或巨核细胞),通常集落中心有红细胞,周围有非红细胞,非红细胞也可以集中在红细胞的一侧。cfu-gemm的集落通常比cfu-gm或bfu-e的集落大。在大多数细胞样本中比较少见(通常占集落总数的10%)。cfu-gm:含有超过20个以上粒细胞(cfu-g)和/或巨噬细胞(cfu-m)的集落。不显现红色或棕色,集落内个体细胞通常可以区分,特别是在集落边缘,大的集落可能有一个或多个密集的暗核。该集落生长及分化不需要促红细胞生成素(epo)。bfu-e:爆发红细胞集落形成单位,形成单个或多个细胞簇组成的集落,每个集落包含>200个成熟红细胞。当细胞被血红蛋白化时呈现红色或棕色,难以区分每簇内的单个细胞,bfu-e是更加不成熟的祖细胞,它的生长需要红细胞生成素(epo)和其他细胞因子,尤其是白介素3(il-3)和干细胞因子(scf),以促进其集落的最佳生长。cfu-e:红细胞集落形成单位,可形成1-2个包含有8-200个红细胞的细胞簇,当细胞被血红蛋白化时呈现红色或棕色,在集落内难区分单个细胞。cfu-e是成熟的红细胞系的祖细胞,需要促红细胞生成素(epo)促进其分化。实施例9:已筛抑制剂saha、vpa、dasatinib和文献报道抑制剂um171,sr1单独使用和组合使用的体外克隆形成能力的比较在实施例1中分选出来的脐带血来源的cd34+细胞上进行已筛抑制剂saha、vpa、dasatinib与文献报道抑制剂um171,sr1单独使用和组合使用的体外克隆形成能力的比较。小分子抑制剂处理细胞,7天后,以实施例8相同的方法进行体外克隆(cfu)形成检测,接种细胞14天后统计克隆数目,并对cfu-gemm进行分析,其结果如图16所示,其中,bfu-e、cfu-e、cfu-gm、cfu-gemm代表红系、髓系、淋巴系等血液系统不同谱系的克隆。图16结果表明,在总克隆数量方面,vpa+dasatinib组合效果明显优于其他组合。在由lt-hscs分化形成的gemm克隆数目方面,vpa+dasatinib组合显著优于已知文献(faresi,etal.science.2014;boitanoae,etal.science.2010;)中报道的小分子抑制剂单独和与saha组合使用(优于sr1、um171、saha+sr1、saha+um171)。vpa+dasatinib与saha+dasatinib相比,前者效果更好。saha+dznep+epz004777在总克隆和gemm克隆数量上远不如vpa+dasatinib和saha+dasatinib。综上所述,在体外克隆形成能力方面,vpa+dasatinib和saha+dasatinib组合优于已知文献报道的小分子sr1,um171单独和与saha的组合使用。实施例10:src通路抑制剂效果验证在实施例1中分选出来的脐带血来源的cd34+细胞上,以实施例2相同的方法进行src靶点的其他小分子抑制剂的筛选,小分子组合诱导6-7天后,用与实施例3相同的方法上机流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达,其结果如图17所示,其中,本轮筛选的小分子抑制剂及浓度见表9。表9:src通路抑制剂及选用浓度小分子抑制剂名称测试浓度saha1μmum-1641μm5μm10μmkx2-39110nm50nm100nmkx1-00410μm50μm100μm图17结果表明,在维持lt-hscs干性方面,src靶点的抑制剂um-164的效果是saha的5倍,src靶点的其他抑制剂kx1-004效果与saha无明显差异。在维持cd34+细胞比例方面,um164和saha无明显差异,cd34+比例维持在80%左右。以上结果说明src作为一个新的靶点在维持hscs干性方面起到了很重要的作用。与hdac靶点的抑制剂组合,src靶点抑制剂在维持hscs干性以及促进hscs扩增方面的作用进一步加强。实施例11:已筛抑制剂dasatinib和文献报道抑制剂um171,sr1对造血干细胞体外扩增以及干性维持能力的比较在实施例1中分选出来的脐带血来源的cd34+细胞上进行已筛抑制剂dasatinib与文献报道抑制剂um171,sr1体外扩增以及干性维持能力的比较。小分子抑制剂诱导6-8天后,用与实施例3相同的方法流式细胞仪检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达,分别在培养2天、4天、6天、8天时取20μl细胞悬液至细胞计数仪(nexcelom,型号:cellometerk2)中计数,并计算第8天最终的cd34+细胞以及lt细胞的绝对数量(细胞绝对数量=细胞比例*总细胞数量),其结果如图18所示。图18的结果表明,在维持干性方面,dasatinib显著好于sr1和um171,其效果是sr1的1.2倍左右,um171的2.8倍左右。lt细胞的绝对数量dasatinib组没有明显好于sr1组,与um171组差不多。在维持cd34+细胞比例方面,dasatinib在处理细胞8天后cd34+细胞比例维持在40%左右,而sr1维持在65%左右,um171维持在40%左右,dasatinib组cd34+细胞的绝对数量并没有显著好于sr1和um171。实施例12:已筛抑制剂dasatinib和文献报道抑制剂sr1对造血干细胞体内移植效果验证在实施例1中分选出来的脐带血来源的cd34+细胞上,进行已筛选小分子抑制剂dasatinib,以及文献报道抑制剂sr1单独使用的体内造血系统重建能力的比较。本实施例中所使用的小分子抑制剂浓度及分组见表10。表10小分子抑制剂浓度组别小分子抑制剂使用浓度mock——sr15μmdasatinib50nm配制细胞培养基:sfemii培养基+50ng/ml生长因子flt-3l+50ng/ml生长因子scf+50ng/ml生长因子tpo+10ng/ml生长因子il-6+1%双抗,所用培养基、生长因子、双抗等货号与实施例2中所述一致,根据表10中设置的组别,加入不同的小分子抑制剂。将配制好的细胞培养基加入到24孔板中,每孔950μl,放置在二氧化碳培养箱中预热;将实施例1中备用的hscs用sfemii+50ng/mlflt-3l+50ng/mlscf+50ng/mltpo+10ng/mlil-6+1%双抗重悬,按照每孔50ul细胞悬液,每孔细胞密度为1*10^5/ml计算所加的培养基体积;从培养箱中拿出预热好的培养基,每孔中加入50μl细胞悬液,混匀后,显微镜下观察细胞状态,然后放入培养箱中培养。每只小鼠移植的起始培养细胞量为1*10^5/只,则24孔板中每个孔所扩增的细胞可移植一只小鼠。细胞培养过程中隔天计数,技术方法及细胞计数仪与实施例1一致,保证细胞密度不超过8*10^5/ml,如细胞过密,则及时分孔,并添加新鲜培养基。小分子抑制剂处理细胞7天后,用与实施例3相同的方法上机流式检测lt-hscs细胞表面标志物(cd34+cd45+cd90+cd45ra-cd38-)表达。准备小鼠,每个组别设置8只小鼠。小鼠购自北京维通达生物技术有限公司,品系为npg(nod-prkdcscidll2rgnull/vst),6周龄,雌鼠,小鼠之间体重克差控制在3g内。小鼠进行细胞移植之前经过半致死剂量辐照,辐照剂量为1.6gy。收集培养的细胞悬液(起始培养细胞量为1*10^5/ml),400g离心5min,弃上清,用100μl生理盐水(1%hsa)重悬,尾静脉注射一只经辐照的npg小鼠,不同组别小鼠做好标记。细胞移植小鼠后,分别在第4周、第8周、第12周采集小鼠外周血,进行流式检测humancd45比例;第16周处死小鼠,采集小鼠外周血、骨髓细胞和脾脏细胞,进行流式检测humancd45、humancd19、humancd3、humancd33和humancd56比例。本实施例中所用抗体、7-aad染料及来源参见表11。表11:抗体及7-aad抗体名称厂家货号fitcanti-mousecd45biolegend103108apc/cy7anti-humancd45biolegend304014brilliantviolet510tmanti-humancd3biolegend300448peanti-humancd19biolegend363004brilliantviolet421tmanti-humancd33biolegend303416apcanti-humancd56biolegend3046107-aadviabilitystainingsolutionbiolegend420404流式检测小鼠外周血humancd45比例,设置的细胞检测组别参见表12。表12:准备1x红细胞裂解液:取5mlrbclysis/fixationsolution10×储存液(biolegend,货号:422401),加45ml去离子水(edigene,0.22μm滤膜过滤),混匀,配制成1x红细胞裂解液。采集小鼠外周血(约100μl),按照表12设置的组别加入抗体。涡旋混匀,室温避光孵育15min。孵育结束后,在nc和每个样本中加入1x红细胞裂解液1.2ml,涡旋混匀,室温避光裂解15min,期间每隔3min上下颠倒一次样本离心管。裂解结束后,400g,室温离心5min。离心结束后,弃上清,在每个实验样本中加入1ml含1%hsa的pbs,混匀,400g,室温离心5min。离心结束后,弃上清,在每个实验样本中加入100μl含1%hsa的pbs和5μl7-aad染料,涡旋混匀,室温避光孵育5min。孵育结束后,在nc和每个样本中加入1ml含1%hsa的pbs,混匀,400g,室温离心5min。离心结束后,弃上清,在每个实验样本中加入100ul含1%hsa的pbs重悬细胞,上机检测前样本室温避光保存。使用流式细胞仪检测。检测结果按如下方法分析:1)目的细胞群为humancd45+细胞群;2)逻辑门及门位置的确定参见图19所示:首先圈定细胞群,为p1门;来源于p1门的细胞群去除粘连细胞,为p2门;来源于p2门的细胞群用7-aad圈定活细胞群,为p3门;来源于p3门的细胞群用nc圈定mousecd45-和humancd45-细胞群(q2-ll门);应用nc划定的门,确定q2-ul门圈定的细胞为humancd45+目的细胞。人造血干细胞移植效率用humancd45细胞比例表示,计算方法为humancd45%/(humancd45%+mousecd45%)。流式检测小鼠外周血、骨髓细胞和脾脏细胞humancd45、humancd19、humancd3、humancd33和humancd56比例,设置的细胞检测组别参见表13。表13:采集小鼠外周血(约100μl),按照表13设置的组别加入抗体。后续血样处理与前述检测小鼠外周血humancd45比例操作一致。操作结束后使用流式细胞仪进行检测。断颈处死小鼠,取小鼠一侧后腿的胫骨和股骨。用眼科剪和眼科镊操作,分别剪断胫骨和股骨两端,露出骨髓腔。用1ml注射器吸取预冷的含1%hsa的pbs,将针头刺入骨髓腔的一端,用力推注pbs,将骨髓细胞从骨髓腔另一端冲出。胫骨和股骨骨髓腔分别用2mlpbs冲洗。反复吹吸骨髓细胞悬液,用40um细胞筛网(bd,货号:352340)过滤,400g,室温离心5min。离心结束后,弃上清,骨髓细胞备用。断颈处死小鼠,取小鼠脾脏,置于预冷的含1%hsa的pbs中。用眼科剪剪碎脾脏,用移液器反复吹吸脾脏组织悬液,用40μm细胞筛网过滤,400g,室温离心5min。离心结束后,弃上清,脾脏细胞备用。在备用的骨髓细胞和脾脏细胞中加入1x红细胞裂解液1ml,涡旋混匀,室温裂解15min,期间每隔3min上下颠倒一次样本离心管。裂解结束后,在每个样本中加入4ml含1%hsa的pbs,400g,室温离心5min。离心结束后,弃上清,在每个样本中加入1ml含1%hsa的pbs,涡旋混匀。每个样本中各取100μl细胞悬液,按照表13的组别加入抗体,涡旋混匀,室温避光孵育15min。孵育结束后,在每个实验样本中加入5μl7-aad染料,涡旋混匀,室温避光孵育5min。孵育结束后,在nc和每个样本中加入1ml含1%hsa的pbs,混匀,400g,室温离心5min。离心结束后,弃上清,在每个实验样本中加入100μl含1%hsa的pbs重悬细胞,上机检测前样本室温避光保存,使用流式细胞仪检测。检测结果按如下方法分析:1)目的细胞群为humancd45+细胞群,humancd19+细胞群,humancd3+细胞群,humancd33+细胞群,以及humancd56+细胞群;2)逻辑门及门位置的确定参见图20所示:首先圈定细胞群,p1门;来源于p1门的细胞群去除粘连细胞,为p2门;来源于p2门的细胞群用7-aad圈定活细胞群,为p3门;来源于p3门的细胞群用nc圈定mousecd45+(p4门)和humancd45+细胞群(p5门);来源于p5门的细胞群用nc圈定humancd33+(p6门)和humancd56+细胞群(p7门);来源于p5门的细胞群用nc圈定humancd19+(p8门)和humancd3+细胞群(p9门)。人造血干细胞移植效率用humancd45细胞比例表示,计算方法为humancd45%/(humancd45%+mousecd45%)。人造血干细胞在小鼠体内分化为各谱系血细胞的效率用humancd19%(代表b细胞),humancd3%(代表t细胞),humancd33%(代表髓系细胞),humancd56%(代表nk细胞)表示。图21结果表明,小鼠移植的起始培养细胞量一致的情况下,dasatinib处理的细胞在第8周、第12周、第16周外周血检测中,移植效率显著高于mock组和sr1组。在第16周的骨髓和脾脏检测中,dasatinib处理的细胞组移植效率显著高于sr1组。证明dasatinib可提高造血干细胞的移植能力,效果优于文献报道的小分子sr1。图22结果表明,小鼠移植后第16周外周血、骨髓、脾脏中,可以检测到人源的t细胞、b细胞、髓系细胞和nk细胞,各谱系细胞在每组中的比例差别不明显,证明人源造血干细胞不仅成功移植,还能分化生成各谱系细胞,具有正常的分化功能。当前第1页12
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:方日国;杨卉慧;史忠玉;袁鹏飞;于玲玲
- 技术所有人:广州辑因医疗科技有限公司
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....