一种检测受体样品中供体的存在或比例的方法和试剂盒
1.本技术涉及分子诊断领域。具体而言,本技术涉及一种检测供体来源的样品与受体来源的样品的snp位点的方法。进一步的,本技术还涉及一种检测受体样品中供体的存在或其比例的方法,以及用于实施所述方法的试剂盒。
背景技术:
2.异源dna是指个体自身体内存在来自一个或多个个体的非自身dna,相对于个体自身dna而言,来自一个或多个个体的非自身dna可定义为异源dna。最常见的例子是同种异体移植时受体体内存在供体来源的dna,目前对异源dna的检测方法可应用于骨髓移植和实质性器官移植两大方面。
3.在骨髓移植中,同种异源基因造血干细胞移植(allo-hsct)是许多恶性血液病和一些非恶性疾病的主要治疗手段。针对移植后造血干细胞嵌合状态的检测方法主要根据例如红细胞抗原、人类白细胞抗原分型、短串联重复序列分析(str-pcr)等人群中所具有的多态性遗传标记。目前国际骨髓移植登记组已将str-pcr分析技术列为hsct术后用于定量监测供体细胞嵌合状态的金标准,但其缺陷是竞争性扩增产生的非特异性干扰、基因漏扩现象所产生的影子(stutter)条带。有研究发现当供体和受体细胞比例在5%-10%以下时,敏感度会明显降低(bone marrow transplant,2001,28(5):511-8)。其它类型特异性标记的嵌合体检测方法被报道(j mol diagn,2009,11(1):66-74),但仍存在样本通量低、耗材成本高、检测灵敏度差、实验操作复杂等缺点。
4.目前实体器官移植术后移植物的监测常采用抽血进行肾、肝功能检查,或穿刺针采集组织进行病理学检查。对于常规抽血功能检查,其各项指标如肌酐、alt、ast、胆红素等等灵敏度和特异性均不高,无法准确地反映移植物的状况。根据对于目前金标准的组织活检,其虽可直接地反映移植物的状况,但存在侵入式检测引起的感染或损伤;检出异常时损伤比治疗滞后;穿刺病灶部位的取样可能定位不准确等问题。stephen r.quake等人研究表明(proc natl acad sci u s a.2011;108(15):6229-6234.),受体血浆中异源的供体游离dna(donor-derived cell free dna,dd-cfdna)比例可一定程度上反应移植物的状态。
5.目前,对dd-cfdna含量检测大多是基于人类遗传多态性信息(sci transl med.2014;6(241):241ra77.),或基于表观遗传学修饰变化(gut.2018;67(12):2204-2212.)。beck j等人研究报道(clin chem,2013,59(12):1732-41.),在对肝脏、肾脏和心脏移植患者术后的早期研究中,通过qpcr技术分析供体异源的单核苷酸多态性信息,用dpcr技术对移植后受体血浆中dd-cfdna比例进行测定。grskovic等使用二代测序技术(next-generation sequencing,ngs)平台上进一步开发和改进为对大量snp位点进行同步检测,并在大量心脏移植术后患者的dd-cfdna比例实时监测中得到了可靠的验证(j mol diagn,2016,18(6):890-902.)。中国发明专利中公开了一种确定受体cfdna样本中供体来源cfdna的比例的方法(cn106544407a),通过ngs对目标区域捕获测序,从而获得受体样本的大量snp基因分型信息;同时对移植后受体的血浆cfdna样本进行目标区域的捕获和测序,用以
分析dd-cfdna占总cfdna的比例。然而上述方法在应用于检测异源基因组dna或异源游离dna时还存在如下问题:ngs技术方案实验操作繁琐,检测周期长(3-7个工作日),且检测费用高,不适合用于移植后定期监测;而其它常规技术对遗传多态性信息检测时存在通量低、操作步骤多、检测灵敏度偏低、开盖易污染等缺点。
技术实现要素:
6.在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
7.如本文中所使用的,术语“供体”是指已经或拟向其他个体(受体)提供用以移植的器官、组织或细胞的个体。在某些实施方案中,所述供体已经或拟向其他个体(受体)提供用以移植的器官(例如,肾脏,心脏,肺脏,肝脏,胰脏或其任何组合)。在某些实施方案中,所述供体已经或拟向其他个体(受体)提供用以移植的造血干细胞(例如骨髓造血干细胞,外周血造血干细胞,脐血造血干细胞)或含有造血干细胞的组织或器官(例如骨髓)。
8.如本文中所使用的,术语“受体”是指已经或拟接受或移植其他个体(供体)提供的用以移植的器官、组织或细胞的个体。在某些实施方案中,所述受体已经或拟接受或移植其他个体(供体)提供的器官(例如,肾脏,心脏,肺脏,肝脏,胰脏或其任何组合)。在某些实施方案中,所述受体已经或拟接受或移植其他个体(供体)提供的造血干细胞(例如骨髓造血干细胞,外周血造血干细胞,脐血造血干细胞)或含有造血干细胞的组织或器官(例如骨髓)。
9.如本文中所使用的,术语“个体”是指任何生物个体。在某些实施方案中,所述个体是动物个体,例如哺乳动物(例如,人、鼠、兔、马、羊等)个体。
10.如本文中所使用的,术语“供体嵌合率”或“供体细胞嵌合率”是指受体在接受异体或异种移植物后,供、受体细胞相互移行、相互存在的现象,可用于评估异基因造血干细胞移植疗效的医疗检测指标,其结果对移植后复发有警示作用,能够提示临床提早进行干预。
11.如本文中所使用的,术语“供体游离dna比例”或“dd-cfdna比例”是一种潜在的,可用于评估器官移植术后排异反应的检测指标,来源于移植物细胞凋亡和坏死过程中释放至血浆的游离dna,其结果对移植物损伤程度有指示作用,能够指导临床提早进行干预。
12.如本文中所使用的,术语“聚类分析”是指将物理或抽象对象的集合分组为由类似的对象组成的多个类的分析过程。聚类分析的目标就是在相似的基础上收集数据来分类。聚类源于很多领域,包括数学,计算机科学,统计学,生物学和经济学。在不同的应用领域,这些技术方法被用作描述数据,衡量不同数据源间的相似性,以及把数据源分类到不同的簇中。
13.如本文中所使用的,术语“snp(单核苷酸多态性)”是指在基因组水平上由单个核苷酸的变异所引起的核酸序列多态性。术语“snp位点”为基因组中具有单核苷酸多态性的位点。在本文中,snp位点包括,具有单核苷酸多态性的单个位点以及具有1个或多个(例如,1个,2个,3个,4个,5个,6个,或更多个)核苷酸的插入或缺失的位点。在本文中,snp位点通过其参考号(例如rs id)命名。可以利用rs id在公共数据库中查询snp位点及其型别,例如,通过ncbi的dbsnp数据库,chinamap数据库,jsnp数据库等。在本技术中,所选择或使用的snp位点优选地为二等位多态性的snp位点。
14.如本文中所使用的,当提及snp位点的“基因型别”时,其是指某一生物个体所有同源染色体(通常是两条同源染色体)中该snp位点上的基因组合的总称。在本文中,snp位点的“基因型别”指来自供体或受体的一对同源染色体中该snp位点上的基因组合。例如,“某个体rs5858210位点的基因型别为ag/
‑”
表示,该个体的一对同源染色体在rs5858210位点上分别具有核苷酸序列“ag”和
“‑”
(
“‑”
表示缺失)。“某个体rs5858210位点的基因型别为ag/ag”表示,该个体的一对同源染色体在rs5858210位点上均具有核苷酸序列“ag”。相应地,单条染色体上含有该snp位点的一段基因(即,核苷酸区段)即被称为含有该snp位点的“等位基因”。如本文中所使用的,对于某个snp位点而言,除了该snp位点上的核苷酸差异之外,不同的等位基因通常具有完全相同的核苷酸序列。当某个体的一对同源染色体在某snp位点上具有相同的核苷酸序列(即,具有相同的等位基因)时,该个体在该snp位点上的基因型别是纯合的。当某个体的一对同源染色体在某snp位点上具有不同的核苷酸序列(即,具有不同的等位基因)时,该个体在该snp位点上的基因型别是杂合的。
15.如本文中所使用的,术语“fst”是指群体固定系数,其能够反映群体等位基因杂合性水平,用于衡量种群分化程度。fst取值在0到1之间,当fst为1时,表明等位基因在各地方群体中固定,完全分化;当fst为0时,表明不同地方群体遗传结构完全一致,群体间没有分化。在本技术中,选取的snp位点优选在不同人种之间fst<0.01。这些位点在不同人种之间分化程度很小,基因杂合性水平接近。
16.如本文中所使用的,术语“互补”意指,两条核酸序列能够根据碱基配对原则(waston-crick原则)在彼此之间形成氢键,并由此形成双链体。在本技术中,术语“互补”包括“实质上互补”和“完全互补”。如本文中所使用的,术语“完全互补”意指,一条核酸序列中的每一个碱基都能够与另一条核酸链中的碱基配对,而不存在错配或缺口。如本文中所使用的,术语“实质上互补”意指,一条核酸序列中的大部分碱基都能够与另一条核酸链中的碱基配对,其允许存在错配或缺口(例如,一个或数个核苷酸的错配或缺口)。通常,在允许核酸杂交、退火或扩增的条件下,“互补”(例如实质上互补或完全互补)的两条核酸序列将选择性地/特异性地发生杂交或退火,并形成双链体。相应地,术语“不互补”意指,两条核酸序列在允许核酸杂交、退火或扩增的条件下不能发生杂交或退火,无法形成双链体。如本文中所使用的,术语“不能完全互补”意指,一条核酸序列中的碱基不能够与另一条核酸链中的碱基完全配对,至少存在一个错配或缺口。
17.如本文中所使用的,术语“杂交”和“退火”意指,互补的单链核酸分子形成双链核酸的过程。在本技术中,“杂交”和“退火”具有相同的含义,并且可互换使用。通常,完全互补或实质上互补的两条核酸序列可发生杂交或退火。两条核酸序列发生杂交或退火所需要的互补性取决于所使用的杂交条件,特别是温度。
18.如本文中所使用的,术语“pcr反应”具有本领域技术人员通常理解的含义,其是指使用核酸聚合酶和引物来扩增靶核酸的反应(聚合酶链式反应)。如本文中所使用的,术语“多重扩增”是指,在同一个反应体系中对多个靶核酸进行扩增。如本文中所使用的,术语“不对称扩增”是指,对靶核酸进行扩增所获得的扩增产物中,两条互补的核酸链的量不相同,一条核酸链的量大于另一条核酸链。
19.如本文中所使用的,并且如本领域技术人员通常理解的,术语“正向”和“反向”仅仅是为了便于描述和区分一个引物对中的两条引物;它们是相对而言的,并不具有特别的
含义。
20.如本文中所使用的,术语“熔解曲线分析”具有本领域技术人员通常理解的含义,其是指,通过测定双链核酸分子的熔解曲线来分析双链核酸分子存在或其身份(identity)的方法,其通常用于评估双链核酸分子在加热过程中的解离特征。用于进行熔解曲线分析的方法是本领域技术人员熟知的(参见例如the journal of molecular diagnostics2009,11(2):93-101)。在本技术中,术语“熔解曲线分析”和“熔解分析”具有相同的含义,并且可互换使用。
21.在本技术的某些优选实施方案中,可通过使用标记有报告基团和淬灭基团的检测探针来进行熔解曲线分析。简言之,在环境温度下,检测探针能够通过碱基配对作用与其互补序列形成双链体。在此情况下,检测探针上的报告基团(例如荧光基团)和淬灭基团彼此分离,淬灭基团无法吸收报告基团发出的信号(例如荧光信号),此时,能够检测到最强的信号(例如荧光信号)。随着温度的升高,双链体的两条链开始解离(即,检测探针逐渐从其互补序列上解离),并且解离下的检测探针呈单链自由卷曲状态。在此情况下,解离下的检测探针上的报告基团(例如荧光基团)和淬灭基团互相靠近,由此报告基团(例如荧光基团)发出的信号(例如荧光信号)被淬灭基团所吸收。因此,随着温度的升高,所检测到信号(例如荧光信号)逐渐变弱。当双链体的两条链完全解离时,所有的检测探针均呈单链自由卷曲状态。在此情况下,所有的检测探针上的报告基团(例如荧光基团)发出的信号(例如荧光信号)都被淬灭基团所吸收。因此,基本上无法检测到报告基团(例如荧光基团)发出的信号(例如荧光信号)。因此,对包含检测探针的双链体在升温或降温过程中发出的信号(例如荧光信号)进行检测,就能观察到检测探针与其互补序列的杂交和解离过程,形成信号强度随着温度变化而变化的曲线。进一步,对所获得的曲线进行求导分析,可获得以信号强度变化速率为纵坐标,温度为横坐标的曲线(即,该双链体的熔解曲线)。该熔解曲线中的峰即为熔解峰,其所对应的温度即为所述双链体的熔点(tm)。通常而言,检测探针与互补序列的匹配程度越高(例如,错配的碱基越少,配对的碱基越多),那么双链体的tm就越高。因此,通过检测双链体的tm,可确定双链体中与检测探针互补的序列的存在和身份。在本文中,术语“熔解峰”、“熔点”和“t
m”具有相同的含义,并且可互换使用。
22.本技术的发明人通过深入的研究,利用多重不对称pcr扩增和多色探针熔解曲线分析,建立了一种检测供体来源的样品与受体来源的样品的snp位点的方法。在此基础上,结合数字pcr系统,本技术开发了一种检测受体样本中供体的存在和比例方法,以及用于实施所述方法的试剂盒。
23.因此,在一个方面,本技术提供了一种检测供体与受体具有不同基因型别的snp位点的方法,其包括以下步骤:
24.(a)提供含有来源于所述供体的一种或多种靶核酸的第一样品,以及含有来源于所述受体的一种或多种靶核酸的第二样品,所述靶核酸包含一种或多种候选snp位点,并且,
25.提供第一通用引物和第二通用引物,并且,针对每一种候选snp位点,提供至少一个靶特异性引物对;其中,
26.所述第一通用引物包含第一通用序列;
27.所述第二通用引物包含第二通用序列,所述第二通用序列包含第一通用序列且在
第一通用序列的3'端额外包含至少一个核苷酸;
28.所述靶特异性引物对能够以所述靶核酸为模板进行扩增,产生含有所述候选snp位点的核酸产物,并且所述靶特异性引物对包含一个正向引物和一个反向引物,其中,所述正向引物包含第一通用序列和特异于所述靶核酸的正向核苷酸序列,且所述正向核苷酸序列位于第一通用序列的3'端;所述反向引物包含第二通用序列和特异于所述靶核酸的反向核苷酸序列,且所述反向核苷酸序列位于第二通用序列的3'端;并且,第二通用序列不能与所述正向引物的互补序列完全互补;和
29.(b)在允许核酸扩增的条件下,使用所述第一通用引物和第二通用引物以及所述靶特异性引物对,分别扩增第一样品和第二样品中的靶核酸,从而获得分别与第一样品和第二样品对应的扩增产物;
30.(c)对步骤(b)获得的与第一样品和第二样品对应的扩增产物分别进行熔解曲线分析;
31.(d)根据步骤(c)的熔解曲线分析结果,确定这样的snp位点:在该位点上第一样品和第二样品具有不同基因型别。
32.在本技术的方法中,正向引物和反向引物分别包含特异于所述靶核酸的正向核苷酸序列和反向核苷酸序列,由此,在pcr反应过程中,靶特异性引物对(正向引物和反向引物)将退火至靶核酸,并启动pcr扩增,产生初始扩增产物,其包含分别与正向引物和反向引物互补的两条核酸链(核酸链a和核酸链b)。进一步,由于正向引物和第一通用引物均包含第一通用序列,因此,与正向引物互补的核酸链a也能够与第一通用引物互补。类似地,与反向引物互补的核酸链b也能够与第二通用引物互补。
33.因此,随着pcr反应的进行,第一通用引物和第二通用引物将分别退火至初始扩增产物的核酸链a和核酸链b,并进一步启动pcr扩增。在该过程中,由于反向引物/第二通用引物包含第一通用序列,因此,第一通用引物不仅能够退火至核酸链a(与正向引物/第一通用引物互补的核酸链)并合成其互补链,而且能够退火至核酸链b(与反向引物/第二通用引物互补的核酸链)并合成其互补链。也即,第一通用引物可以同时扩增初始扩增产物的核酸链a和核酸链b。与此同时,第二通用引物在第一通用序列的3'端包含额外的核苷酸,因此,虽然第二通用引物也可能退火至核酸链a(与正向引物/第一通用引物互补的核酸链,其具有与正向引物互补的序列),但是其与核酸链a在3'端是不匹配的(即,在3'端不能完全互补)。由此,在扩增过程中,第二通用引物将优先退火至核酸链b(与反向引物/第二通用引物互补的核酸链)并合成其互补链,而基本上不能延伸合成核酸链a(与第一正向引物/第一通用引物互补的核酸链)的互补链。
34.因此,随着pcr扩增的进行,核酸链a的互补链(核酸链b)的合成效率将显著低于核酸链b的互补链(核酸链a),导致核酸链b的互补链(核酸链a)被大量合成和扩增,而核酸链a的互补链(核酸链b)的合成和扩增受到抑制,从而产生大量单链产物(核酸链a,其含有与正向引物/第一通用引物互补的序列以及反向引物/第二通用引物的序列),实现了对含有一种或多种snp位点的靶核酸的不对称扩增。因此,在本技术方法的步骤(a)和(b)中,实现了不对称扩增样品中的一种或多种靶核酸。
35.另外,由于正向引物和反向引物均含有第一通用序列,因此,在pcr反应过程中,因正向引物和反向引物的非特异性扩增而形成的引物二聚体在变性后将产生其5'端和3'端
包含彼此互补的反向序列的单链核酸,该单链核酸在退火阶段容易自身退火,形成稳定的锅柄结构,阻止第一通用引物和第二通用引物对该单链核酸的退火和延伸,从而抑制引物二聚体的进一步扩增。因此,在本发明的方法中,引物二聚体的非特异性扩增能够被有效抑制。
36.在某些实施方案中,在所述方法的步骤(d)中,根据熔解曲线分析结果确定第一样品和第二样品的各个候选snp位点的型别,从而检测供体与受体具有不同基因型别的snp位点。
37.在某些实施方案中,所述受体已经或拟接受或移植来自供体的器官、组织或细胞。
38.在某些实施方案中,所述受体已经或拟接受或移植来自供体的器官(例如,肾脏,心脏,肺脏,肝脏,胰脏或其任何组合)。
39.在某些实施方案中,所述受体已经或拟接受或移植来自供体的造血干细胞(例如骨髓造血干细胞,外周血造血干细胞,脐血造血干细胞或其任何组合)或含有造血干细胞的组织或器官(例如骨髓)。
40.在某些实施方案中,第二样品基本上不含有来自供体的核酸。在此类实施方案中,“基本上不含有来自供体的核酸“是指不含有来自供体的核酸,或者,来自供体的核酸在第二样品中的总核酸不超过10%(例如不超过5%,不超过3%,不超过1%,或更低)。
41.在某些实施方案中,第一样品来自所述供体;例如,所述第一样品包含来自所述供体的细胞或组织;例如,所述第一样品选自来自所述供体的皮肤,唾液,尿液,血液,毛发,指甲,或其任何组合。
42.在某些实施方案中,第二样品来自所述受体(例如,经历或未经历移植手术的受体);例如,所述第二样品包含来自所述受体的细胞或组织;例如,所述第二样品选自来自所述受体的皮肤,唾液,尿液,血液,毛发,指甲,或其任何组合。
43.在某些实施方案中,对于未经历移植手术的受体,第二样品可以是任何细胞或组织(例如,皮肤,唾液,尿液,血液等)。对于经历了移植手术的受体,第二样品基本上不含有来自供体的核酸。
44.在某些优选的实施方案中,经历了造血干细胞移植的受体,第二样品可以选自皮肤,唾液,尿液,毛发,指甲,或者组织等,但无法选自血液,因为经历了造血干细胞移植的受体的血液样本中可能会含有大量供体核酸。在某些优选的实施方案中,经历了肾脏移植的受体,第二样品可以选自皮肤,唾液,毛发,指甲,或者组织等,但无法选自血液和尿液,因为经历了肾脏移植的受体的血液、尿液样本中可能会含有大量供体核酸。在某些优选的实施方案中,经历了肝脏移植的受体,第二样品可以选自皮肤,唾液,毛发,指甲,尿液,或者组织等,但无法选自血液,因为经历了肾脏移植的受体的血液样本中可能会含有大量供体核酸。
45.在某些实施方案中,在步骤(a)中,针对每一种候选snp位点,还提供一个检测探针,所述检测探针包含特异于所述靶核酸的核苷酸序列并且能够与所述靶核酸中含有所述候选snp位点的区域退火或杂交,并且,所述检测探针标记有报告基团和淬灭基团,其中,所述报告基团能够发出信号,并且,所述淬灭基团能够吸收或淬灭所述报告基团发出的信号;并且,所述检测探针在与其互补序列杂交的情况下发出的信号不同于在未与其互补序列杂交的情况下发出的信号;
46.并且,在步骤(c)中,使用所述检测探针对步骤(b)获得的与第一样品和第二样品
对应的扩增产物分别进行熔解曲线分析。
47.在某些实施方案中,所述第一样品包含dna(例如基因组dna)。
48.在某些实施方案中,所述第二样品包含dna(例如基因组dna)。
49.在第二方面,本技术提供了一种检测经历移植手术后的受体的样品中供体的核酸的存在或其比例的方法,其中,所述方法包含以下步骤:
50.(1)提供来自受体的含有核酸的待检样品,所述受体已经移植了供体的细胞、组织或器官;
51.(2)鉴定一个或多个目标snp位点,其中,在所述目标snp位点上,受体具有包含第一等位基因的第一基因型别,且,供体具有包含第二等位基因的第二基因型别,其中,第一基因型别不同于第二基因型别,且第一等位基因不同于第二等位基因;
52.(3)对所述待检样品中各个目标snp位点的第一等位基因和第二等位基因分别进行定量检测;然后,根据第一等位基因和第二等位基因定量检测的结果,确定所述待检样品中供体的核酸的存在或其比例。
53.在某些实施方案中,在步骤(2)中,可通过选自下列的机制来区分某个snp位点上的不同等位基因,从而鉴定目标snp位点:探针杂交、引物延伸、杂交连接和特异酶切。在某些实施方案中,在步骤(2)中,可通过选自下列的方法来鉴定目标snp位点:测序法(例如,一代测序法、焦磷酸测序法、二代测序法)、芯片法(例如,使用能够检测snp的固相芯片、液相芯片)、基于qpcr的检测法(例如,taqman探针法)、质谱法(如基于massarray的iplex
tm gold)、色谱法(如变性高效液相色谱法dhplc)、电泳法(如snpshot法)、基于熔解曲线分析的检测法。在某些实施方案中,在步骤(2)中,通过基于多重pcr结合熔解曲线分析的检测法鉴定所述目标snp位点。
54.在某些实施方案中,通过如前所描述的方法鉴定所述目标snp位点。
55.在某些实施方案中,在步骤(3)中,通过数字pcr对所述样品中各个目标snp位点的第一等位基因和第二等位基因分别进行定量检测。
56.在某些实施方案中,通过下述方案进行步骤(3):
57.(i)从步骤(2)中选取至少1个(例如,1个,2个,3个,或更多个)目标snp位点,并且,针对每一个选取的目标snp位点,提供一个扩增引物组和一个探针组,其中,
58.(i-1)所述扩增引物组至少包含一条扩增引物(例如一对扩增引物或更多的扩增引物),其在允许核酸杂交或退火的条件下,能够特异性扩增含有所述目标snp位点的核酸分子;
59.(i-2)所述探针组包含第一探针和第二探针;其中,
60.(i)第一探针和第二探针各自独立地标记有报告基团和淬灭基团,其中,所述报告基团能够发出信号,并且,所述淬灭基团能够吸收或淬灭所述报告基团发出的信号;并且,第一探针和第二探针分别标记不同的报告基团(例如荧光基团);并且
61.(ii)第一探针能够与含有所述目标snp位点的第一等位基因的核酸分子杂交或退火(优选完全互补),第二探针能够与含有所述目标snp位点的第二等位基因的核酸分子杂交或退火(优选完全互补);并且,所述第一探针和第二探针特异于不同的等位基因;
62.(ii)使用所述扩增引物组和探针组对所述受体样品进行数字pcr,对具有第一等位基因的核酸分子和具有第二等位基因的核酸分子进行定量检测;
63.(iii)根据步骤(ii)的定量检测结果,确定所述待检样品中供体核酸的存在或其比例。
64.在某些实施方案中,所述第一探针在数字pcr反应过程中与具有第一等位基因的核酸分子特异性退火或杂交;和,所述第二探针在数字pcr反应过程中与具有第二等位基因的核酸分子特异性退火或杂交。
65.在某些实施方案中,所述第一探针在数字pcr反应过程中不与具有第二等位基因的核酸分子退火或杂交;和/或,所述第二探针在数字pcr反应过程中不与具有第一等位基因的核酸分子退火或杂交。
66.在某些实施方案中,在步骤(3)之前,对所述来自受体的待检样品进行预处理。
67.在某些实施方案中,所述预处理包括对样品进行核酸提取和/或对样品中的核酸进行富集(例如,通过浓缩和/或扩增)。
68.在某些实施方案中,所述受体已经接受或移植了供体的造血干细胞(例如骨髓造血干细胞,外周血造血干细胞,脐血造血干细胞或其任何组合)或含有造血干细胞的组织或器官(例如骨髓)。
69.在某些实施方案中,待检样品包含来自移植后受体的血液(例如,外周血)或其组分(例如,血细胞,血浆,单核细胞,粒细胞,t细胞,或其任何组合)。
70.在某些实施方案中,所述目标snp位点是这样的snp位点,在所述snp位点上,受体具有包含纯合的第一等位基因的第一基因型别,且,供体具有包含纯合的第二等位基因的第二基因型别;或者,受体具有包含杂合的第一等位基因和第二等位基因的第一基因型别,且,供体具有包含纯合的第二等位基因的第二基因型别。
71.在某些实施方案中,所述目标snp位点是这样的snp位点,在所述snp位点上,受体具有包含纯合的第一等位基因的第一基因型别,且,供体具有包含纯合的第二等位基因的第二基因型别。
72.在某些实施方案中,通过以下的一种或多种方法计算所述受体样品中供体的比例:
73.(1)当目标snp位点是受体具有包含纯合的第一等位基因的第一基因型别(例如,bb),且,供体具有包含纯合的第二等位基因的第二基因型别(例如,aa)的snp位点时,所述受体样品中供体的比例为:
74.其中,nb为等位基因b的拷贝数(其可通过数字pcr确定),na为等位基因a的拷贝数(其可通过数字pcr确定);
75.(2)当目标snp位点是受体具有包含杂合的第一等位基因和第二等位基因的第一基因型别(例如,ab),且,供体具有包含纯合的第二等位基因的第二基因型别(例如,aa)的snp位点时,所述受体样品中供体的比例为:
76.其中,nb为等位基因b的拷贝数(其可通过数字pcr确定),na为等位基因a的拷贝数(其可通过数字pcr确定)。
77.在某些实施方案中,其中,所述受体已经接受或移植来自供体的器官(例如,肾脏,心脏,肺脏,肝脏,胰脏或其任何组合)。
78.在某些实施方案中,所述受体已经接受或移植来自供体的肾脏。
79.在某些实施方案中,待检样品包含来自移植后受体的血液(例如,外周血)或尿液(特别是在肾脏移植的情况下)。
80.在某些实施方案中,所述目标snp位点是这样的snp位点,在所述snp位点上,供体具有包含纯合的第一等位基因的第一基因型别,且,受体具有包含纯合的第二等位基因的第二基因型别;或者,供体具有包含杂合的第一等位基因和第二等位基因的第一基因型别,且,受体具有包含纯合的第二等位基因的第二基因型别。
81.在某些实施方案中,所述目标snp位点是这样的snp位点,在所述snp位点上,供体具有包含纯合的第一等位基因的第一基因型别,且,受体具有包含纯合的第二等位基因的第二基因型别。
82.在某些实施方案中,通过以下的一种或多种方法计算所述供体样品中受体的比例:
83.(1)当目标snp位点是供体具有包含纯合的第一等位基因的第一基因型别(例如,bb),且,受体具有包含纯合的第二等位基因的第二基因型别(例如,aa)的snp位点时,所述受体样品中供体的比例为:
84.其中,nb为等位基因b的拷贝数(其可通过数字pcr确定),na为等位基因a的拷贝数(其可通过数字pcr确定);
85.(2)当目标snp位点是供体具有包含杂合的第一等位基因和第二等位基因的第一基因型别(例如,ab),且,受体具有包含纯合的第二等位基因的第二基因型别(例如,aa)的snp位点时,所述供体样品中受体的比例为:
86.其中,nb为等位基因b的拷贝数(其可通过数字pcr确定),na为等位基因a的拷贝数(其可通过数字pcr确定)。
87.在某些实施方案中,其中,所述方法的步骤(a)-(b)通过包含下述步骤(i)-(vi)的方案来进行:
88.(i)提供所述第一样品,所述第二样品,所述第一通用引物和第二通用引物,以及,所述靶特异性引物对;以及任选地,所述检测探针;
89.(ii)将所述样品与所述第一通用引物和第二通用引物和靶特异性引物对,核酸聚合酶,以及任选地,检测探针混合;
90.(iii)在允许核酸变性的条件下,温育前一步骤的产物;
91.(iv)在允许核酸退火或杂交的条件下,温育前一步骤的产物;
92.(v)在允许核酸延伸的条件下,温育前一步骤的产物;和
93.(vi)任选地,重复步骤(iii)-(v)一次或多次。
94.在某些实施方案中,在步骤(iii)中,在80-105℃的温度下温育步骤(ii)的产物,从而使核酸变性。
95.在某些实施方案中,在步骤(iii)中,温育步骤(ii)的产物10-20s,20-40s,40-60s,1-2min,或2-5min。
96.在某些实施方案中,在步骤(iv)中,在35-40℃,40-45℃,45-50℃,50-55℃,55-60
fluor red 590,rox,cal fluor red 610,texas red,cal fluor red 635,quasar 670,cy3,cy5,cy5.5,quasar 705);并且,淬灭基团为能够吸收/淬灭所述荧光的分子或基团(例如dabcyl、bhq(例如bhq-1或者bhq-2)、eclipse、和/或tamra)。
110.在某些实施方案中,所述第一探针和第二探针各自独立地是线性的,或者具有发夹结构。
111.在某些实施方案中,所述第一探针和第二探针具有不同的报告基团。在某些实施方案中,所述第一探针和第二探针是可被核酸聚合酶(例如dna聚合酶)降解的。
112.在某些实施方案中,所述探针组包括具有选自下列的核苷酸序列的探针或其任何组合(例如,任意5个,10个,20个,40个,60个的组合):seq id no:73,74,78,79,82,83,86,87,90,91,94,95,98,99,102,103,106,107,110,111,114,115,118,119,122,123,126,127,130,131,134,135,138,139,142,143,146,147,150,151,154,155,158,159,162,163。
113.在第三方面,本技术提供了一种鉴定受体具有包含纯合的第一等位基因的第一基因型别的snp位点的方法,其包括以下步骤:
114.(a)提供来自所述受体的第五样品,其中,所述第五样品含有来源于所述受体的一种或多种靶核酸,且基本上不含有来源于供体的核酸;所述靶核酸包含一种或多种候选snp位点,并且,
115.提供第一通用引物和第二通用引物,并且,针对每一种候选snp位点,提供至少一个靶特异性引物对;其中,
116.所述第一通用引物包含第一通用序列;
117.所述第二通用引物包含第二通用序列,所述第二通用序列包含第一通用序列且在第一通用序列的3'端额外包含至少一个核苷酸;
118.所述靶特异性引物对能够以所述靶核酸为模板进行扩增,产生含有所述候选snp位点的核酸产物,并且所述靶特异性引物对包含一个正向引物和一个反向引物,其中,所述正向引物包含第一通用序列和特异于所述靶核酸的正向核苷酸序列,且所述正向核苷酸序列位于第一通用序列的3'端;所述反向引物包含第二通用序列和特异于所述靶核酸的反向核苷酸序列,且所述反向核苷酸序列位于第二通用序列的3'端;并且,第二通用序列不能与所述正向引物的互补序列完全互补;和
119.(b)在允许核酸扩增的条件下,使用所述第一通用引物和第二通用引物以及所述靶特异性引物对,分别扩增第五样品中的靶核酸,从而获得与第五样品对应的扩增产物;
120.(c)对步骤(b)获得的与第五样品对应的扩增产物进行熔解曲线分析;
121.(d)根据步骤(c)的熔解曲线分析结果,鉴定这样的snp位点:在该位点上,受体具有包含纯合的第一等位基因的第一基因型别。
122.在本技术的方法中,正向引物和反向引物分别包含特异于所述靶核酸的正向核苷酸序列和反向核苷酸序列,由此,在pcr反应过程中,靶特异性引物对(正向引物和反向引物)将退火至靶核酸,并启动pcr扩增,产生初始扩增产物,其包含分别与正向引物和反向引物互补的两条核酸链(核酸链a和核酸链b)。进一步,由于正向引物和第一通用引物均包含第一通用序列,因此,与正向引物互补的核酸链a也能够与第一通用引物互补。类似地,与反向引物互补的核酸链b也能够与第二通用引物互补。
123.因此,随着pcr反应的进行,第一通用引物和第二通用引物将分别退火至初始扩增
产物的核酸链a和核酸链b,并进一步启动pcr扩增。在该过程中,由于反向引物/第二通用引物包含第一通用序列,因此,第一通用引物不仅能够退火至核酸链a(与正向引物/第一通用引物互补的核酸链)并合成其互补链,而且能够退火至核酸链b(与反向引物/第二通用引物互补的核酸链)并合成其互补链。也即,第一通用引物可以同时扩增初始扩增产物的核酸链a和核酸链b。与此同时,第二通用引物在第一通用序列的3'端包含额外的核苷酸,因此,虽然第二通用引物也可能退火至核酸链a(与正向引物/第一通用引物互补的核酸链,其具有与正向引物互补的序列),但是其与核酸链a在3'端是不匹配的(即,在3'端不能完全互补)。由此,在扩增过程中,第二通用引物将优先退火至核酸链b(与反向引物/第二通用引物互补的核酸链)并合成其互补链,而基本上不能延伸合成核酸链a(与第一正向引物/第一通用引物互补的核酸链)的互补链。
124.因此,随着pcr扩增的进行,核酸链a的互补链(核酸链b)的合成效率将显著低于核酸链b的互补链(核酸链a),导致核酸链b的互补链(核酸链a)被大量合成和扩增,而核酸链a的互补链(核酸链b)的合成和扩增受到抑制,从而产生大量单链产物(核酸链a,其含有与正向引物/第一通用引物互补的序列以及反向引物/第二通用引物的序列),实现了对含有一种或多种snp位点的靶核酸的不对称扩增。因此,在本技术方法的步骤(a)和(b)中,实现了不对称扩增样品中的一种或多种靶核酸。
125.另外,由于正向引物和反向引物均含有第一通用序列,因此,在pcr反应过程中,因正向引物和反向引物的非特异性扩增而形成的引物二聚体在变性后将产生其5'端和3'端包含彼此互补的反向序列的单链核酸,该单链核酸在退火阶段容易自身退火,形成稳定的锅柄结构,阻止第一通用引物和第二通用引物对该单链核酸的退火和延伸,从而抑制引物二聚体的进一步扩增。因此,在本发明的方法中,引物二聚体的非特异性扩增能够被有效抑制。
126.在某些实施方案中,“基本上不含有来自供体的核酸“是指不含有来自供体的核酸,或者,来自供体的核酸在第五样品中的总核酸不超过10%(例如不超过5%,不超过3%,不超过1%,或更低)。
127.在某些实施方案中,第五样品来自所述受体(例如,经历或未经历移植手术的受体);例如,所述第五样品包含来自所述受体的细胞或组织;例如,所述第五样品选自来自所述受体的皮肤,唾液,尿液,血液,毛发,指甲,或其任何组合。
128.在某些实施方案中,在步骤(a)中,针对每一种候选snp位点,还提供一个检测探针,所述检测探针包含特异于所述靶核酸的核苷酸序列并且能够与所述靶核酸中含有所述候选snp位点的区域退火或杂交,并且,所述检测探针标记有报告基团和淬灭基团,其中,所述报告基团能够发出信号,并且,所述淬灭基团能够吸收或淬灭所述报告基团发出的信号;并且,所述检测探针在与其互补序列杂交的情况下发出的信号不同于在未与其互补序列杂交的情况下发出的信号;
129.并且,在步骤(c)中,使用所述检测探针对步骤(b)获得的与第五样品对应的扩增产物分别进行熔解曲线分析。
130.在某些实施方案中,所述第五样品包含dna(例如基因组dna)。
131.在第四方面,本技术提供了一种检测经历了移植手术后的受体样品中供体的核酸的存在或其比例的方法,其中,所述方法包含以下步骤:
132.(1)提供来自受体的含有核酸的待检样品,所述受体已经移植了供体的细胞、组织或器官;
133.(2)鉴定多个(例如至少5个,至少6个,至少7个,至少8个,至少9个,至少10个或更多个)这样的候选snp位点,所述候选snp位点在所述受体所属的物种中至少显示第一等位基因和第二等位基因,并且,在所述候选snp位点上,受体具有包含纯合的第一等位基因的第一基因型别;
134.(3)对待检样品的各个候选snp位点的各等位基因分别进行定量检测;
135.(4)根据步骤(3)的定量检测结果,从所述候选snp位点中挑选这样的目标snp位点:所述待检样品在该位点上显示出了第一等位基因的信号,以及第二等位基因的信号;
136.(5)根据所述目标snp位点的第一等位基因和第二等位基因定量检测的结果,确定所述待检受体样品中供体的核酸的存在或其比例。
137.在某些实施方案中,在步骤(2)中,可通过选自下列的机制来区分某个snp位点上的不同等位基因,从而鉴定候选snp位点:探针杂交、引物延伸、杂交连接和特异酶切。在某些实施方案中,在步骤(2)中,可通过选自下列的方法来鉴定候选snp位点:测序法(例如,一代测序法、焦磷酸测序法、二代测序法)、芯片法(例如,使用能够检测snp的固相芯片、液相芯片)、基于qpcr的检测法(例如,taqman探针法)、质谱法(如基于massarray的iplex
tm gold)、色谱法(如变性高效液相色谱法dhplc)、电泳法(如snpshot法)、基于熔解曲线分析的检测法。在某些实施方案中,在步骤(2)中,通过基于多重pcr结合熔解曲线分析的检测法鉴定所述候选snp位点。
138.在某些实施方案中,通过如前所描述的方法鉴定所述候选snp位点。
139.在某些实施方案中,在步骤(3)中,通过数字pcr对各个候选snp位点的各等位基因分别进行定量检测。
140.在某些实施方案中,通过下述方案进行步骤(3):
141.(i)从步骤(2)中选取多个(例如至少5个,至少6个,至少7个,至少8个,至少9个,至少10个或更多个)候选snp位点,并且,针对每一个选取的候选snp位点,提供一个扩增引物组和一个探针组,其中,
142.(i-1)所述扩增引物组至少包含一条扩增引物(例如一对扩增引物或更多的扩增引物),其在允许核酸杂交或退火的条件下,能够特异性扩增含有所述候选snp位点的核酸分子;
143.(i-2)所述探针组包含第一探针和第二探针;其中,
144.(i)第一探针和第二探针各自独立地标记有报告基团和淬灭基团,其中,所述报告基团能够发出信号,并且,所述淬灭基团能够吸收或淬灭所述报告基团发出的信号;并且,第一探针和第二探针分别标记不同的报告基团(例如荧光基团);并且
145.(ii)第一探针能够与含有所述候选snp位点的第一等位基因的核酸分子杂交或退火(优选完全互补),第二探针能够与含有所述候选snp位点的第二等位基因的核酸分子杂交或退火(优选完全互补);并且,所述第一探针和第二探针特异于不同的等位基因;
146.(ii)使用所述扩增引物组和探针组对所述来自受体的待检样品进行数字pcr,对具有第一等位基因的核酸分子和具有第二等位基因的核酸分子进行定量检测;
147.在某些实施方案中,所述第一探针在数字pcr反应过程中与具有第一等位基因的
核酸分子特异性退火或杂交;和,所述第二探针在数字pcr反应过程中与具有第二等位基因的核酸分子特异性退火或杂交;
148.在某些实施方案中,所述第一探针在数字pcr反应过程中不与具有第二等位基因的核酸分子退火或杂交;和/或,所述第二探针在数字pcr反应过程中不与具有第一等位基因的核酸分子退火或杂交;
149.在本技术的方法中,以所述探针组中的第一探针为例,其能够与具有第一等位基因的核酸分子杂交或退火(优选完全互补)。因此,在进行数字pcr反应时,在退火或延伸过程中,所述第一探针将与所述核酸分子形成双链体,并在扩增期间被核酸聚合酶(例如dna聚合酶)所降解,释放报告基团(例如荧光基团)。由此,在数字pcr扩增反应结束后,通过微滴检测仪对各微滴的终点荧光进行检测,根据游离的第一报告基团(例如第一荧光基团)的信号(例如第一荧光信号)强度,即可确定阳性微滴和阴性微滴数,从而确定样品中具有第一等位基因的核酸分子的量。类似地,在数字pcr扩增反应结束后,通过微滴检测仪对各微滴的终点荧光进行检测,根据游离的第二报告基团(例如第二荧光基团)的信号(例如第二荧光信号)强度,即可确定阳性微滴和阴性微滴数,即可确定样品中具有第二等位基因的核酸分子的量。由于供体/受体基因型别不同,对应于第一/第二等位基因含量即不同,因此,通过比较和分析含有第一/第二等位基因的核酸分子的量,即可判断受体样品中是否存在供体,并且任选地,确定供体的比例。
150.在本技术的方法中,在某些实施方案中,所述第一探针在数字pcr反应过程中不与具有第二等位基因的核酸分子退火或杂交;和/或,所述第二探针在数字pcr反应过程中不与具有第一等位基因的核酸分子退火或杂交。易于理解,所述第一/第二探针的杂交特异性是特别有利的,其能够有助于准确测定第一等位基因/第二等位基因的含量,从而有助于计算供体样品和受体样品各自的比例。在某些实施方案中,可通过控制数字pcr反应的退火温度和/或延伸温度,从而获得所述第一/第二探针的杂交特异性。例如,可设置退火温度和/或延伸温度低于第一探针与具有第一等位基因的核酸分子形成的双链体的熔点,但高于第一探针与具有第二等位基因的核酸分子形成的双链体的熔点,从而使得第一探针在数字pcr反应过程中与具有第一等位基因的核酸分子杂交,但不与具有第二等位基因的核酸分子杂交。类似地,可设置退火温度和/或延伸温度低于第二探针与具有第二等位基因的核酸分子形成的双链体的熔点,但高于第二探针与具有第一等位基因的核酸分子形成的双链体的熔点,从而使得第二探针在数字pcr反应过程中与具有第二等位基因的核酸分子杂交,但不与具有第一等位基因的核酸分子杂交。
151.在本技术的方法中,等位基因的拷贝数量可根据泊松分布原理,由数字pcr平台检测并通过软件直接输出,其相关原理及计算方法可参见例如,milbury ca,zhong q,lin j,et al.determining lower limits of detection of digital pcr assays for cancer-related gene mutations.biomol detect quantif.2014;1(1):8-22.published 2014aug 20.doi:10.1016/j.bdq.2014.08.001。
152.在某些实施方案中,在步骤(5)中,对多个(例如至少5个,至少6个,至少7个,至少8个,至少9个,至少10个或更多个)目标snp位点的第二等位基因的定量检测结果进行聚类分析;然后,根据聚类分析结果,确定供体在各个目标snp位点上的基因型别;然后,根据所述受体和供体在各个目标snp位点上的基因型别,以及所述待检样品中第一等位基因和第二
60s,1-2min,或2-5min。
170.在某些实施方案中,在步骤(iv)中,在35-40℃,40-45℃,45-50℃,50-55℃,55-60℃,60-65℃,或65-70℃的温度下温育步骤(iii)的产物,从而允许核酸退火或杂交。
171.在某些实施方案中,在步骤(iv)中,温育步骤(iii)的产物10-20s,20-40s,40-60s,1-2min,或2-5min。
172.在某些实施方案中,在步骤(v)中,在35-40℃,40-45℃,45-50℃,50-55℃,55-60℃,60-65℃,65-70℃,70-75℃,75-80℃,80-85℃的温度下温育步骤(iv)的产物,从而允许核酸延伸。
173.在某些实施方案中,在步骤(v)中,温育步骤(iv)的产物10-20s,20-40s,40-60s,1-2min,2-5min,5-10min,10-20min或20-30min。
174.在某些实施方案中,在相同或不同的温度下进行步骤(iv)和(v)。
175.在某些实施方案中,重复步骤(iii)-(v)至少一次,例如至少2次,至少5次,至少10次,至少20次,至少30次,至少40次,或至少50次。在某些实施方案中,当重复步骤(iii)-(v)一次或多次时,每一个循环的步骤(iii)-(v)所使用的条件各自独立地是相同的或不同的。
176.在某些实施方案中,扩增引物组的引物的长度各自独立地为15-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt,80-90nt,90-100nt,100-110nt,110-120nt,120-130nt,130-140nt,140-150nt。
177.在某些实施方案中,所述扩增引物组的引物或其任何组成成分各自独立地包含或者由天然存在的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸),经修饰的核苷酸,非天然的核苷酸,或其任何组合组成。
178.在某些实施方案中,所述扩增引物组各自独立地包括具有选自下列的核苷酸序列的引物对或其任何组合(例如,任意5对,10对,15对,20对,23对的组合):seq id no:72和73;77和76;80和81;84和85;88和89;92和93;96和97;100和101;104和105;108和109;112和113;116和117;120和121;124和125;128和129;132和133;136和137;140和141;144和145;148和149;152和153;156和157;160和161。
179.在某些实施方案中,所述第一探针和第二探针各自独立地包含或者由天然存在的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸),经修饰的核苷酸,非天然的核苷酸(例如肽核酸(pna)或锁核酸),或其任何组合组成。
180.在某些实施方案中,所述第一探针和第二探针的长度各自独立地为15-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt,80-90nt,90-100nt,100-200nt,200-300nt,300-400nt,400-500nt,500-600nt,600-700nt,700-800nt,800-900nt,900-1000nt。
181.在某些实施方案中,所述第一探针和第二探针各自独立地具有3'-oh末端;或者,所述探针的3'-末端是封闭的;例如,通过在探针的最后一个核苷酸的3'-oh上添加化学部分(例如,生物素或烷基),通过将探针的最后一个核苷酸的3'-oh去除,或者将所述最后一个核苷酸替换为双脱氧核苷酸,从而封闭检测探针的3'-末端。
182.在某些实施方案中,所述第一探针和第二探针各自独立地为自淬灭探针;例如,所述探针在其5'末端或上游标记有报告基团且在其3'末端或下游标记有淬灭基团,或者在其3'末端或下游标记报告基团且在5'末端或上游标记淬灭基团。在某些实施方案中,所述报告基团和淬灭基团相距10-80nt或更长的距离。
183.在某些实施方案中,所述探针中的报告基团各自独立地为荧光基团(例如,alex-350,fam,vic,tet,cal fluor gold 540,joe,hex,cal fluor orange 560,tamra,cal fluor red 590,rox,cal fluor red 610,texas red,cal fluor red 635,quasar 670,cy3,cy5,cy5.5,quasar 705);并且,淬灭基团为能够吸收/淬灭所述荧光的分子或基团(例如dabcyl、bhq(例如bhq-1或者bhq-2)、eclipse、和/或tamra)。
184.在某些实施方案中,所述第一探针和第二探针各自独立地是线性的,或者具有发夹结构。
185.在某些实施方案中,所述第一探针和第二探针具有不同的报告基团。在某些实施方案中,所述第一探针和第二探针是可被核酸聚合酶(例如dna聚合酶)降解的。
186.在某些实施方案中,所述探针组包括具有选自下列的核苷酸序列的探针或其任何组合(例如,任意5个,10个,20个,40个,60个的组合):seq id no:73,74,78,79,82,83,86,87,90,91,94,95,98,99,102,103,106,107,110,111,114,115,118,119,122,123,126,127,130,131,134,135,138,139,142,143,146,147,150,151,154,155,158,159,162,163。
187.在第五方面,本技术提供了一种检测供体与受体具有不同基因型别的snp位点的方法,其包括以下步骤:
188.(a)提供来自所述受体的第三样品和来自经历移植手术后的受体的第四样品,其中,所述第三样品含有来源于所述受体的一种或多种靶核酸,且基本上不含有来源于供体的核酸;所述第四样品含有来源于所述供体的一种或多种靶核酸,并且,所述靶核酸包含一种或多种候选snp位点,并且,
189.提供第一通用引物和第二通用引物,并且,针对每一种候选snp位点,提供至少一个靶特异性引物对;其中,
190.所述第一通用引物包含第一通用序列;
191.所述第二通用引物包含第二通用序列,所述第二通用序列包含第一通用序列且在第一通用序列的3'端额外包含至少一个核苷酸;
192.所述靶特异性引物对能够以所述靶核酸为模板进行扩增,产生含有所述候选snp位点的核酸产物,并且所述靶特异性引物对包含一个正向引物和一个反向引物,其中,所述正向引物包含第一通用序列和特异于所述靶核酸的正向核苷酸序列,且所述正向核苷酸序列位于第一通用序列的3'端;所述反向引物包含第二通用序列和特异于所述靶核酸的反向核苷酸序列,且所述反向核苷酸序列位于第二通用序列的3'端;并且,第二通用序列不能与所述正向引物的互补序列完全互补;和
193.(b)在允许核酸扩增的条件下,使用所述第一通用引物和第二通用引物以及所述靶特异性引物对,分别扩增第三样品和第四样品中的靶核酸,从而获得分别与第三样品和第四样品对应的扩增产物;
194.(c)对步骤(b)获得的与第三样品和第四样品对应的扩增产物分别进行熔解曲线分析;
195.(d)根据步骤(c)的熔解曲线分析结果,确定这样的snp位点:在该位点上第三样品仅显示第一等位基因,且第四样品至少显示第二等位基因(例如,显示第一和第二等位基因);所述snp位点为供体与受体具有不同基因型别的snp位点;
196.在本技术的方法中,正向引物和反向引物分别包含特异于所述靶核酸的正向核苷
酸序列和反向核苷酸序列,由此,在pcr反应过程中,靶特异性引物对(正向引物和反向引物)将退火至靶核酸,并启动pcr扩增,产生初始扩增产物,其包含分别与正向引物和反向引物互补的两条核酸链(核酸链a和核酸链b)。进一步,由于正向引物和第一通用引物均包含第一通用序列,因此,与正向引物互补的核酸链a也能够与第一通用引物互补。类似地,与反向引物互补的核酸链b也能够与第二通用引物互补。
197.因此,随着pcr反应的进行,第一通用引物和第二通用引物将分别退火至初始扩增产物的核酸链a和核酸链b,并进一步启动pcr扩增。在该过程中,由于反向引物/第二通用引物包含第一通用序列,因此,第一通用引物不仅能够退火至核酸链a(与正向引物/第一通用引物互补的核酸链)并合成其互补链,而且能够退火至核酸链b(与反向引物/第二通用引物互补的核酸链)并合成其互补链。也即,第一通用引物可以同时扩增初始扩增产物的核酸链a和核酸链b。与此同时,第二通用引物在第一通用序列的3'端包含额外的核苷酸,因此,虽然第二通用引物也可能退火至核酸链a(与正向引物/第一通用引物互补的核酸链,其具有与正向引物互补的序列),但是其与核酸链a在3'端是不匹配的(即,在3'端不能完全互补)。由此,在扩增过程中,第二通用引物将优先退火至核酸链b(与反向引物/第二通用引物互补的核酸链)并合成其互补链,而基本上不能延伸合成核酸链a(与第一正向引物/第一通用引物互补的核酸链)的互补链。
198.因此,随着pcr扩增的进行,核酸链a的互补链(核酸链b)的合成效率将显著低于核酸链b的互补链(核酸链a),导致核酸链b的互补链(核酸链a)被大量合成和扩增,而核酸链a的互补链(核酸链b)的合成和扩增受到抑制,从而产生大量单链产物(核酸链a,其含有与正向引物/第一通用引物互补的序列以及反向引物/第二通用引物的序列),实现了对含有一种或多种snp位点的靶核酸的不对称扩增。因此,在本技术方法的步骤(a)和(b)中,实现了不对称扩增样品中的一种或多种靶核酸。
199.另外,由于正向引物和反向引物均含有第一通用序列,因此,在pcr反应过程中,因正向引物和反向引物的非特异性扩增而形成的引物二聚体在变性后将产生其5'端和3'端包含彼此互补的反向序列的单链核酸,该单链核酸在退火阶段容易自身退火,形成稳定的锅柄结构,阻止第一通用引物和第二通用引物对该单链核酸的退火和延伸,从而抑制引物二聚体的进一步扩增。因此,在本发明的方法中,引物二聚体的非特异性扩增能够被有效抑制。
200.在某些实施方案中,在所述方法的步骤(d)中,根据熔解曲线分析结果确定第三样品和第四样品的各个候选snp位点的型别,从而确定这样的snp位点:在该位点上第三样品仅显示第一等位基因,且第四样品显示第一和第二等位基因;
201.在某些实施方案中,“基本上不含有来自供体的核酸“是指不含有来自供体的核酸,或者,来自供体的核酸在第二样品中的总核酸不超过10%(例如不超过5%,不超过3%,不超过1%,或更低)。
202.在某些实施方案中,第三样品来自所述受体(例如,经历或未经历移植手术的受体);例如,所述第三样品包含来自所述受体的细胞或组织;例如,所述第三样品选自来自所述受体的皮肤,唾液,尿液,血液,毛发,指甲,或其任何组合;
203.在某些实施方案中,对于未经历移植手术的受体,第三样品可以是任何细胞或组织(例如,皮肤,唾液,尿液,血液等)。对于经历了移植手术的受体,第三样品基本上不含有
来自供体的核酸。
204.在某些优选的实施方案中,经历了造血干细胞移植的受体,第三样品可以选自皮肤,唾液,尿液,毛发,指甲,或者组织等,但无法选自血液,因为经历了造血干细胞移植的受体的血液样本中可能会含有大量供体核酸。在某些优选的实施方案中,经历了肾脏移植的受体,第三样品可以选自皮肤,唾液,毛发,指甲,或者组织等,但无法选自血液和尿液,因为经历了肾脏移植的受体的血液、尿液样本中可能会含有大量供体核酸。在某些优选的实施方案中,经历了肝脏移植的受体,第三样品可以选自皮肤,唾液,毛发,指甲,尿液,或者组织等,但无法选自血液,因为经历了肾脏移植的受体的血液样本中可能会含有大量供体核酸。
205.在某些实施方案中,在第四样品中,来自供体的核酸的量占第四样品中的总核酸的量的至少20%,例如至少25%,至少30%,至少35%,至少40%,至少50%,或者更高;
206.在某些实施方案中,所述受体已经接受或移植来自供体的器官、组织或细胞;
207.例如,所述受体已经接受或移植来自供体的器官(例如,肾脏,心脏,肺脏,肝脏,胰脏或其任何组合);在某些实施方案中,所述第四样品包含来自经历移植手术后的受体血液(例如,外周血)或尿液(特别是在肾脏移植的情况下);在某些实施方案中,所述第四样品包含来自经历移植手术后不超过5天(例如不超过3天,2天或1天)的受体血液(例如,外周血)或尿液(特别是在肾脏移植的情况下);
208.例如,所述受体已经接受或移植来自供体的造血干细胞(例如骨髓造血干细胞,外周血造血干细胞,脐血造血干细胞)或含有造血干细胞的组织或器官(例如骨髓);在某些实施方案中,所述第四样品包含来自经历移植手术后的受体的血液(例如外周血)或其组分(例如血细胞);在某些实施方案中,所述第四样品包含来自经历移植手术后至少5天(例如至少10天,至少15天,至少20天,至少30天)的受体的血液(例如外周血)或其组分(例如血细胞);
209.在某些实施方案中,在步骤(a)中,针对每一种候选snp位点,还提供一个检测探针,所述检测探针包含特异于所述靶核酸的核苷酸序列并且能够与所述靶核酸中含有所述候选snp位点的区域退火或杂交,并且,所述检测探针标记有报告基团和淬灭基团,其中,所述报告基团能够发出信号,并且,所述淬灭基团能够吸收或淬灭所述报告基团发出的信号;并且,所述检测探针在与其互补序列杂交的情况下发出的信号不同于在未与其互补序列杂交的情况下发出的信号;
210.并且,在步骤(c)中,使用所述检测探针对步骤(b)获得的与第三样品和第四样品对应的扩增产物分别进行熔解曲线分析;
211.在某些实施方案中,所述第三样品包含dna(例如基因组dna)。
212.在某些实施方案中,所述第四样品包含dna(例如基因组dna)。
213.在第六方面,本技术提供了一种检测经历移植手术后的受体的样品中供体的核酸的存在或其比例的方法,其中,所述方法包含以下步骤:
214.(1)提供来自受体的包含核酸的待检样品,所述受体已经移植了供体的细胞、组织或器官;
215.(2)鉴定多个(例如至少5个,至少6个,至少7个,至少8个,至少9个,至少10个或更多个)目标snp位点,其中,在所述目标snp位点上,受体具有包含纯合的第一等位基因的第一基因型别,且,供体具有包含第二等位基因的第二基因型别,其中,第一基因型别不同于
第二基因型别,且第一等位基因不同于第二等位基因;
216.(3)对所述待检样品中各个目标snp位点的第一等位基因和第二等位基因分别进行定量检测;
217.(4)根据所述目标snp位点的第一等位基因和第二等位基因定量检测的结果,确定所述待检受体样品中供体的核酸的存在或其比例;
218.在某些实施方案中,在步骤(2)中,可通过选自下列的机制来区分某个snp位点上的不同等位基因,从而鉴定目标snp位点:探针杂交、引物延伸、杂交连接和特异酶切。在某些实施方案中,在步骤(2)中,可通过选自下列的方法来鉴定目标snp位点:测序法(例如,一代测序法、焦磷酸测序法、二代测序法)、芯片法(例如,使用能够检测snp的固相芯片、液相芯片)、基于qpcr的检测法(例如,taqman探针法)、质谱法(如基于massarray的iplex
tm gold)、色谱法(如变性高效液相色谱法dhplc)、电泳法(如snpshot法)、基于熔解曲线分析的检测法。在某些实施方案中,在步骤(2)中,通过基于多重pcr结合熔解曲线分析的检测法鉴定所述目标snp位点。
219.在某些实施方案中,通过如前所描述的方法鉴定所述目标snp位点。
220.在某些实施方案中,在步骤(3)中,通过数字pcr对所述样品中各个目标snp位点的第一等位基因和第二等位基因分别进行定量检测。
221.在某些实施方案中,通过下述方案进行步骤(3):
222.(i)针对每一个目标snp位点,提供一个扩增引物组和一个探针组,其中,
223.(i-1)所述扩增引物组至少包含一条扩增引物(例如一对扩增引物或更多的扩增引物),其在允许核酸杂交或退火的条件下,能够特异性扩增含有所述目标snp位点的核酸分子;
224.(i-2)所述探针组包含第一探针和第二探针;其中,
225.(i)第一探针和第二探针各自独立地标记有报告基团和淬灭基团,其中,所述报告基团能够发出信号,并且,所述淬灭基团能够吸收或淬灭所述报告基团发出的信号;并且,第一探针和第二探针分别标记不同的报告基团(例如荧光基团);并且
226.(ii)第一探针能够与含有所述目标snp位点的第一等位基因的核酸分子杂交或退火(优选完全互补),第二探针能够与含有所述目标snp位点的第二等位基因的核酸分子杂交或退火(优选完全互补);并且,所述第一探针和第二探针特异于不同的等位基因;
227.(ii)使用所述扩增引物组和探针组对所述待检样品进行数字pcr,对具有第一等位基因的核酸分子和具有第二等位基因的核酸分子进行定量检测。
228.在某些实施方案中,所述第一探针在数字pcr反应过程中与具有第一等位基因的核酸分子特异性退火或杂交;和,所述第二探针在数字pcr反应过程中与具有第二等位基因的核酸分子特异性退火或杂交。
229.在某些实施方案中,所述第一探针在数字pcr反应过程中不与具有第二等位基因的核酸分子退火或杂交;和/或,所述第二探针在数字pcr反应过程中不与具有第一等位基因的核酸分子退火或杂交。
230.在本技术的方法中,以所述探针组中的第一探针为例,其能够与具有第一等位基因的核酸分子杂交或退火(优选完全互补)。因此,在进行数字pcr反应时,在退火或延伸过程中,所述第一探针将与所述核酸分子形成双链体,并在扩增期间被核酸聚合酶(例如dna
聚合酶)所降解,释放报告基团(例如荧光基团)。由此,在数字pcr扩增反应结束后,通过微滴检测仪对各微滴的终点荧光进行检测,根据游离的第一报告基团(例如第一荧光基团)的信号(例如第一荧光信号)强度,即可确定阳性微滴和阴性微滴数,从而确定样品中具有第一等位基因的核酸分子的量。类似地,在数字pcr扩增反应结束后,通过微滴检测仪对各微滴的终点荧光进行检测,根据游离的第二报告基团(例如第二荧光基团)的信号(例如第二荧光信号)强度,即可确定阳性微滴和阴性微滴数,即可确定样品中具有第二等位基因的核酸分子的量。由于供体/受体基因型别不同,对应于第一/第二等位基因含量即不同,因此,通过比较和分析含有第一/第二等位基因的核酸分子的量,即可判断受体样品中是否存在供体,并且任选地,确定供体的比例。
231.在本技术的方法中,在某些实施方案中,所述第一探针在数字pcr反应过程中不与具有第二等位基因的核酸分子退火或杂交;和/或,所述第二探针在数字pcr反应过程中不与具有第一等位基因的核酸分子退火或杂交。易于理解,所述第一/第二探针的杂交特异性是特别有利的,其能够有助于准确测定第一等位基因/第二等位基因的含量,从而有助于计算供体样品和受体样品各自的比例。在某些实施方案中,可通过控制数字pcr反应的退火温度和/或延伸温度,从而获得所述第一/第二探针的杂交特异性。例如,可设置退火温度和/或延伸温度低于第一探针与具有第一等位基因的核酸分子形成的双链体的熔点,但高于第一探针与具有第二等位基因的核酸分子形成的双链体的熔点,从而使得第一探针在数字pcr反应过程中与具有第一等位基因的核酸分子杂交,但不与具有第二等位基因的核酸分子杂交。类似地,可设置退火温度和/或延伸温度低于第二探针与具有第二等位基因的核酸分子形成的双链体的熔点,但高于第二探针与具有第一等位基因的核酸分子形成的双链体的熔点,从而使得第二探针在数字pcr反应过程中与具有第二等位基因的核酸分子杂交,但不与具有第一等位基因的核酸分子杂交。
232.在本技术的方法中,等位基因的拷贝数量可根据泊松分布原理,由数字pcr平台检测并通过软件直接输出,其相关原理及计算方法可参见例如,milbury ca,zhong q,lin j,et al.determining lower limits of detection of digital pcr assays for cancer-related gene mutations.biomol detect quantif.2014;1(1):8-22.published 2014aug 20.doi:10.1016/j.bdq.2014.08.001。
233.在某些实施方案中,在步骤(4)中,对多个(例如至少5个,至少6个,至少7个,至少8个,至少9个,至少10个或更多个)目标snp位点的第二等位基因的定量检测结果进行聚类分析;然后,根据聚类分析结果,确定供体在各个目标snp位点上的基因型别;然后,根据所述受体和供体在各个目标snp位点上的基因型别,以及所述待检样品中第一等位基因和第二等位基因的定量检测结果,确定所述待检受体样品中供体的核酸的存在或其比例。
234.由于受体在目标snp位点上包含纯合的第一等位基因,因此,待检样品中所检测到的第二等位基因信号必然来源于供体。换言之,供体在该目标snp位点上的基因型别可能为,纯合的第二等位基因或者,杂合的第一和第二等位基因。理论上,对于同一个样品来说,在数字pcr定量检测过程中,纯合型snp位点的第二等位基因所显示的检测结果(对应于绝对拷贝数)将是杂合型snp位点的第二等位基因所显示的检测结果的两倍。因此,通过对多个目标snp位点的第二等位基因的检测结果进行聚类分析,可以确定,供体具有纯合的第二等位基因的目标snp位点,以及,供体具有杂合的第一和第二等位基因的目标snp位点;其
中,前者的检测结果(对应于绝对拷贝数)将是后者的两倍。换言之,通过对第二等位基因的检测信号进行聚类分析,可以确定供体在各个目标snp位点上的基因型别。在此基础上,根据所述受体和供体在各个目标snp位点上的基因型别,以及所述待检样品中第一等位基因和第二等位基因的定量检测结果,可以容易地确定所述待检受体样品中供体的核酸的存在或其比例。
235.在某些实施方案中,在步骤(3)之前,对所述来自受体的待检样品进行预处理。
236.在某些实施方案中,所述预处理包括对样品进行核酸提取和/或对样品中的核酸进行富集(例如,通过浓缩和/或扩增)。
237.在某些实施方案中,其中,所述受体已经接受或移植了供体的造血干细胞(例如骨髓造血干细胞,外周血造血干细胞,脐血造血干细胞或其任何组合)或含有造血干细胞的组织或器官(例如脊髓);
238.在某些实施方案中,所述待检样品包含来自移植后受体的血液(例如,外周血)或其组分(例如,血细胞,血浆,单核细胞,粒细胞,t细胞,或其任何组合)。
239.在某些实施方案中,其中,所述受体已经接受或移植来自供体的器官(例如,肾脏,心脏,肺脏,肝脏,胰脏或其任何组合)。
240.在某些实施方案中,所述受体已经接受或移植来自供体的肾脏。
241.在某些实施方案中,待检样品包含来自移植后受体的血液(例如,外周血)或尿液(特别是在肾脏移植的情况下)。
242.在某些实施方案中,其中,所述方法的步骤(a)-(b)通过包含下述步骤(i)-(vi)的方案来进行:
243.(i)提供所述第三样品和第四样品,所述第一通用引物和第二通用引物,以及,所述靶特异性引物对;以及任选地,所述检测探针;
244.(ii)将所述样品与所述第一通用引物和第二通用引物和靶特异性引物对,核酸聚合酶,以及任选地,检测探针混合;
245.(iii)在允许核酸变性的条件下,温育前一步骤的产物;
246.(iv)在允许核酸退火或杂交的条件下,温育前一步骤的产物;
247.(v)在允许核酸延伸的条件下,温育前一步骤的产物;和
248.(vi)任选地,重复步骤(iii)-(v)一次或多次。
249.在某些实施方案中,在步骤(iii)中,在80-105℃的温度下温育步骤(ii)的产物,从而使核酸变性。
250.在某些实施方案中,在步骤(iii)中,温育步骤(ii)的产物10-20s,20-40s,40-60s,1-2min,或2-5min。
251.在某些实施方案中,在步骤(iv)中,在35-40℃,40-45℃,45-50℃,50-55℃,55-60℃,60-65℃,或65-70℃的温度下温育步骤(iii)的产物,从而允许核酸退火或杂交。
252.在某些实施方案中,在步骤(iv)中,温育步骤(iii)的产物10-20s,20-40s,40-60s,1-2min,或2-5min。
253.在某些实施方案中,在步骤(v)中,在35-40℃,40-45℃,45-50℃,50-55℃,55-60℃,60-65℃,65-70℃,70-75℃,75-80℃,80-85℃的温度下温育步骤(iv)的产物,从而允许核酸延伸。
254.在某些实施方案中,在步骤(v)中,温育步骤(iv)的产物10-20s,20-40s,40-60s,1-2min,2-5min,5-10min,10-20min或20-30min。
255.在某些实施方案中,在相同或不同的温度下进行步骤(iv)和(v)。
256.在某些实施方案中,重复步骤(iii)-(v)至少一次,例如至少2次,至少5次,至少10次,至少20次,至少30次,至少40次,或至少50次。在某些实施方案中,当重复步骤(iii)-(v)一次或多次时,每一个循环的步骤(iii)-(v)所使用的条件各自独立地是相同的或不同的。
257.在某些实施方案中,扩增引物组的引物的长度各自独立地为15-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt,80-90nt,90-100nt,100-110nt,110-120nt,120-130nt,130-140nt,140-150nt。
258.在某些实施方案中,所述扩增引物组的引物或其任何组成成分各自独立地包含或者由天然存在的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸),经修饰的核苷酸,非天然的核苷酸,或其任何组合组成。
259.在某些实施方案中,所述扩增引物组各自独立地包括具有选自下列的核苷酸序列的引物对或其任何组合(例如,任意5对,10对,15对,20对,23对的组合):seq id no:72和73;77和76;80和81;84和85;88和89;92和93;96和97;100和101;104和105;108和109;112和113;116和117;120和121;124和125;128和129;132和133;136和137;140和141;144和145;148和149;152和153;156和157;160和161。
260.在某些实施方案中,所述第一探针和第二探针各自独立地包含或者由天然存在的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸),经修饰的核苷酸,非天然的核苷酸(例如肽核酸(pna)或锁核酸),或其任何组合组成。
261.在某些实施方案中,所述第一探针和第二探针的长度各自独立地为15-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt,80-90nt,90-100nt,100-200nt,200-300nt,300-400nt,400-500nt,500-600nt,600-700nt,700-800nt,800-900nt,900-1000nt。
262.在某些实施方案中,所述第一探针和第二探针各自独立地具有3'-oh末端;或者,所述探针的3'-末端是封闭的;例如,通过在探针的最后一个核苷酸的3'-oh上添加化学部分(例如,生物素或烷基),通过将探针的最后一个核苷酸的3'-oh去除,或者将所述最后一个核苷酸替换为双脱氧核苷酸,从而封闭检测探针的3'-末端。
263.在某些实施方案中,所述第一探针和第二探针各自独立地为自淬灭探针;例如,所述探针在其5'末端或上游标记有报告基团且在其3'末端或下游标记有淬灭基团,或者在其3'末端或下游标记报告基团且在5'末端或上游标记淬灭基团。在某些实施方案中,所述报告基团和淬灭基团相距10-80nt或更长的距离。
264.在某些实施方案中,所述探针中的报告基团各自独立地为荧光基团(例如,alex-350,fam,vic,tet,cal fluor gold 540,joe,hex,cal fluor orange 560,tamra,cal fluor red 590,rox,cal fluor red 610,texas red,cal fluor red 635,quasar 670,cy3,cy5,cy5.5,quasar 705);并且,淬灭基团为能够吸收/淬灭所述荧光的分子或基团(例如dabcyl、bhq(例如bhq-1或者bhq-2)、eclipse、和/或tamra)。
265.在某些实施方案中,所述第一探针和第二探针各自独立地是线性的,或者具有发夹结构。
266.在某些实施方案中,所述第一探针和第二探针具有不同的报告基团。在某些实施
方案中,所述第一探针和第二探针是可被核酸聚合酶(例如dna聚合酶)降解的。
267.在某些实施方案中,所述探针组包括具有选自下列的核苷酸序列的探针或其任何组合(例如,任意5个,10个,20个,40个,60个的组合):seq id no:73,74,78,79,82,83,86,87,90,91,94,95,98,99,102,103,106,107,110,111,114,115,118,119,122,123,126,127,130,131,134,135,138,139,142,143,146,147,150,151,154,155,158,159,162,163。
268.在某些实施方案中,所述候选snp位点具有选自以下的1个或多个特征:
269.(1)所述候选snp位点在不同人种之间的fst小于0.3(例如,小于0.2,小于0.1,小于0.05,小于0.01);
270.(2)所述候选snp位点位于不同染色体;
271.(3)所述候选snp位点的等位基因频率在0.2至0.8之间(例如,0.3至0.7之间,0.4至0.6之间)。
272.在某些实施方案中,所述候选snp位点具有选自以下的1个或多个特征:
273.(1)所述候选snp位点在不同人种之间的fst小于0.01;
274.(2)所述候选snp位点位于不同染色体;
275.(3)所述候选snp位点的等位基因频率在0.3至0.7之间。
276.在某些实施方案中,所述候选snp位点为具有二等位多态性的snp位点。
277.在某些实施方案中,所述候选snp位点为人基因组中的snp位点;例如所述靶核酸包含选自下列的人基因组snp位点:rs16363,rs1610937,rs5789826,rs1611048,rs2307533,rs112552066,rs5858210,rs2307839,rs149809066,rs66960151,rs34765837,rs68076527,rs10779650,rs4971514,rs6424243,rs12990278,rs2122080,rs98506667,rs774763,rs711725,rs2053911,rs9613776,rs7160304,以及前述snp位点的任意组合(例如,前述snp位点中任意5个,10个,15个,20个,23个的组合)。
278.在某些实施方案中,所述样品中的靶核酸包含下列人基因组snp位点:rs16363,rs1610937,rs5789826,rs1611048,rs2307533,rs112552066,rs5858210,rs2307839,rs149809066,rs66960151,rs34765837,rs68076527,rs10779650,rs4971514,rs6424243,rs12990278,rs2122080,rs98506667,rs774763,rs711725,rs2053911,rs9613776和rs7160304。
279.在某些实施方案中,在步骤(b)中,将所述样品与所述第一通用引物、所述第二通用引物和所述靶特异性引物对,以及核酸聚合酶混合,并进行核酸扩增(例如pcr反应),然后,将检测探针加入到步骤(b)的产物中,并进行熔解曲线分析;或者,在步骤(b)中,将所述样品与所述第一通用引物、所述第二通用引物、所述靶特异性引物对和所述检测探针,以及核酸聚合酶混合,并进行核酸扩增(例如pcr反应),然后,在pcr反应结束后,进行熔解曲线分析。
280.在某些实施方案中,所述检测探针包含或者由天然存在的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸),经修饰的核苷酸,非天然的核苷酸(例如肽核酸(pna)或锁核酸),或其任何组合组成。在某些优选的实施方案中,检测探针包含经修饰的核苷酸,例如经修饰的脱氧核糖核苷酸或核糖核苷酸,例如5-甲基胞嘧啶或5-羟甲基胞嘧啶。在某些优选的实施方案中,检测探针包含非天然的核苷酸,例如脱氧次黄嘌呤,肌苷,1-(2'-脱氧-β-d-呋喃核糖基)-3-硝基吡咯,5-硝基吲哚或锁核酸(lna)。
281.在某些实施方案中,所述检测探针的长度为15-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt,80-90nt,90-100nt,100-200nt,200-300nt,300-400nt,400-500nt,500-600nt,600-700nt,700-800nt,800-900nt,900-1000nt。
282.在某些实施方案中,所述检测探针具有3'-oh末端;或者,所述检测探针的3'-末端是封闭的;例如,通过在检测探针的最后一个核苷酸的3'-oh上添加化学部分(例如,生物素或烷基),通过将检测探针的最后一个核苷酸的3'-oh去除,或者将所述最后一个核苷酸替换为双脱氧核苷酸,从而封闭检测探针的3'-末端。
283.在某些实施方案中,所述检测探针为自淬灭探针;例如,所述检测探针在其5'末端或上游标记有报告基团且在其3'末端或下游标记有淬灭基团,或者在其3'末端或下游标记报告基团且在5'末端或上游标记淬灭基团。在此类实施方案中,当检测探针未与其他序列杂交时,淬灭基团位于能够吸收或淬灭报告基团的信号的位置(例如,淬灭基团位于报告基团的邻近),从而吸收或淬灭报告基团发出的信号。在这种情况下,所述检测探针不发出信号。进一步,当所述检测探针与其互补序列杂交时,淬灭基团位于不能吸收或淬灭报告基团的信号的位置(例如,淬灭基团位于远离报告基团的位置),从而无法吸收或淬灭报告基团发出的信号。在这种情况下,所述检测探针发出信号。
284.此类自淬灭检测探针的设计在本领域技术人员的能力范围之内。例如,可在所述检测探针的5'末端标记报告基团而在3'末端标记淬灭基团,或可在所述检测探针的3'末端标记报告基团而在5'末端标记淬灭基团。由此,当所述检测探针单独存在时,所述报告基团与所述淬灭基团彼此接近并相互作用,使得所述报告基团发出的信号被所述淬灭基团吸收,从而使得所述检测探针不发出信号;而当所述检测探针与其互补序列杂交时,所述报告基团与所述淬灭基团相互分离,使得所述报告基团发出的信号不能被所述淬灭基团吸收,从而使得所述检测探针发出信号。
285.然而,应当理解的是,报告基团和淬灭基团并非必须标记在检测探针的末端。报告基团和/或淬灭基团也可以标记在检测探针的内部,只要所述检测探针在与其互补序列杂交的情况下发出的信号不同于在未与其互补序列杂交的情况下发出的信号。例如,可将报告基团标记在检测探针的上游(或下游),而将淬灭基团标记在检测探针的下游(或上游),并且二者相距足够的距离(例如相距10-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt,或更长的距离)。由此,当所述检测探针单独存在时,由于探针分子的自由卷曲或者探针的二级结构(例如发夹结构)的形成,所述报告基团与所述淬灭基团彼此接近并相互作用,使得所述报告基团发出的信号被所述淬灭基团吸收,从而使得所述检测探针不发出信号;并且,当所述检测探针与其互补序列杂交时,所述报告基团与所述淬灭基团相互分离足够的距离,使得所述报告基团发出的信号不能被所述淬灭基团吸收,从而使得所述检测探针发出信号。在某些优选的实施方案中,报告基团和淬灭基团相距10-80nt或更长的距离,例如10-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt。在某些优选的实施方案中,报告基团和淬灭基团相距不超过80nt,不超过70nt,不超过60nt,不超过50nt,不超过40nt,不超过30nt,或不超过20nt。在某些优选的实施方案中,报告基团和淬灭基团相距至少5nt,至少10nt,至少15nt,或至少20nt。
286.因此,可在检测探针的任何合适的位置标记报告基团和淬灭基团,只要所述检测探针在与其互补序列杂交的情况下发出的信号不同于在未与其互补序列杂交的情况下发
出的信号即可。然而,在某些优选的实施方案中,报告基团和淬灭基团中的至少一种位于检测探针的末端(例如5'或3'末端)。在某些优选的实施方案中,报告基团和淬灭基团中的一种位于检测探针的5'末端或者距离5'末端1-10nt的位置,并且报告基团和淬灭基团相距合适的距离,使得在检测探针与其互补序列杂交之前,淬灭基团能够吸收或淬灭报告基团的信号。在某些优选的实施方案中,报告基团和淬灭基团中的一种位于检测探针的3'末端或者距离3'末端1-10nt的位置,并且报告基团和淬灭基团相距合适的距离,使得在检测探针与其互补序列杂交之前,淬灭基团能够吸收或淬灭报告基团的信号。在某些优选的实施方案中,报告基团和淬灭基团可相距如上文所定义的距离(例如10-80nt或更长的距离)。在某些优选的实施方案中,报告基团和淬灭基团中的一种位于检测探针的5'末端,并且另一种位于3'末端。
287.在某些实施方案中,所述检测探针中的报告基团为荧光基团(例如,alex-350,fam,vic,tet,cal fluor gold 540,joe,hex,cal fluor orange 560,tamra,cal fluor red 590,rox,cal fluor red 610,texas red,cal fluor red 635,quasar 670,cy3,cy5,cy5.5,quasar 705);并且,淬灭基团为能够吸收/淬灭所述荧光的分子或基团(例如dabcyl、bhq(例如bhq-1或者bhq-2)、eclipse、和/或tamra)。
288.在某些实施方案中,所述检测探针具有抵抗核酸酶活性(例如5'核酸酶活性,例如5'至3'核酸外切酶活性)的抗性;例如,所述检测探针的主链包含抵抗核酸酶活性的修饰,例如硫代磷酸酯键,烷基磷酸三酯键,芳基磷酸三酯键,烷基膦酸酯键,芳基膦酸酯键,氢化磷酸酯键,烷基氨基磷酸酯键,芳基氨基磷酸酯键,2'-o-氨基丙基修饰,2'-o-烷基修饰,2'-o-烯丙基修饰,2'-o-丁基修饰,和1-(4'-硫代-pd-呋喃核糖基)修饰。
289.在某些实施方案中,所述检测探针是线性的,或者具有发夹结构。
290.在某些实施方案中,所述检测探针各自独立地具有相同或不同的报告基团。在某些实施方案中,所述检测探针具有相同的报告基团,并且,对步骤(b)的产物进行熔解曲线分析,然后根据熔解曲线中的熔解峰来确定靶核酸的存在;或,所述检测探针具有不同的报告基团,并且,对步骤(b)的产物进行熔解曲线分析,然后根据报告基团的信号种类及熔解曲线中的熔解峰来确定靶核酸的存在。
291.在某些实施方案中,在步骤(c)中,对步骤(b)的产物进行逐渐的升温或降温并实时监测每一种检测探针上的报告基团发出的信号,从而获得每一种报告基团的信号强度随着温度变化而变化的曲线。例如,可将步骤(2)的产物从45℃或更低的温度(例如,不超过45℃,不超过40℃,不超过35℃,不超过30℃,不超过25℃)逐渐升温至75℃或更高的温度(例如,至少75℃,至少80℃,至少85℃,至少90℃,至少95℃),并实时监测检测探针上的报告基团发出的信号,从而获得所述报告基团的信号强度随着温度变化而变化的曲线。升温的速率可以由本领域技术人员常规地确定。例如,升温的速率可以为:每步骤升温0.01-1℃(例如0.01-0.05℃、0.05-0.1℃、0.1-0.5℃、0.5-1℃、0.04-0.4℃,例如0.01℃、0.02℃、0.03℃、0.04℃、0.05℃、0.06℃、0.07℃、0.08℃、0.09℃、0.1℃、0.2℃、0.3℃、0.4℃、0.5℃、0.6℃、0.7℃、0.8℃、0.9℃或1.0℃),并且每步骤维持0.5-15s(例如0.5-1s,1-2s,2-3s,3-4s,4-5s,5-10s,10-15s);或者每秒升温0.01-1℃(例如0.01-0.05℃、0.05-0.1℃、0.1-0.5℃、0.5-1℃、0.04-0.4℃,例如0.01℃、0.02℃、0.03℃、0.04℃、0.05℃、0.06℃、0.07℃、0.08℃、0.09℃、0.1℃、0.2℃、0.3℃、0.4℃、0.5℃、0.6℃、0.7℃、0.8℃、0.9℃或1.0℃)。
292.然后,对所述曲线进行求导,从而获得步骤(b)的产物的熔解曲线。
293.在某些实施方案中,根据熔解曲线中的熔解峰(熔点),确定各个snp位点的型别。
294.在某些实施方案中,所述检测探针包括具有选自下列的核苷酸序列的检测探针或其任何组合(例如,任意5个,10个,15个,20个,23个的组合):seq id no:3,6,9,12,15,18,21,24,27,30,33,36,39,42,45,48,51,54,57,60,63,66和69。
295.在某些实施方案中,在所述方法的步骤(a)中,提供1-5个,5-10个,10-15个,15-20个或更多个靶特异性引物对。
296.在某些实施方案中,在所述方法的步骤(b)中,所述第一通用引物和第二通用引物的工作浓度高于所述正向引物和反向引物的工作浓度;例如,所述第一通用引物和第二通用引物的工作浓度比所述正向引物和反向引物的工作浓度高1-5倍,5-10倍,10-15倍,15-20倍,20-50倍或更多倍。
297.在某些实施方案中,在所述方法的步骤(b)中,所述第一通用引物和第二通用引物的工作浓度是相同的;或者,所述第一通用引物的工作浓度低于第二通用引物。
298.在某些实施方案中,在所述方法的步骤(b)中,所述正向引物和反向引物的工作浓度是相同的或者不同的。
299.在某些实施方案中,所述样品或靶核酸包含mrna,且在进行所述方法的步骤(b)之前,对所述样品进行逆转录反应。
300.在某些实施方案中,在所述方法的步骤(b)中,使用核酸聚合酶(特别是模板依赖性核酸聚合酶)来进行pcr反应。在某些实施方案中,所述核酸聚合酶为dna聚合酶,例如热稳定的dna聚合酶。在某些实施方案中,所述热稳定的dna聚合酶获自,thermus aquaticus(taq),thermus thermophiles(tth),thermus filiformis,thermis flavus,thermococcus literalis,thermus antranildanii,thermus caldophllus,thermus chliarophilus,thermus flavus,thermus igniterrae,thermus lacteus,thermus oshimai,thermus ruber,thermus rubens,thermus scotoductus,thermus silvanus,thermus thermophllus,thermotoga maritima,thermotoga neapolitana,thermosipho africanus,thermococcus litoralis,thermococcus barossi,thermococcus gorgonarius,thermotoga maritima,thermotoga neapolitana,thermosiphoafricanus,pyrococcus woesei,pyrococcus horikoshii,pyrococcus abyssi,pyrodictium occultum,aquifexpyrophilus和aquifex aeolieus。在某些实施方案中,所述dna聚合酶为taq聚合酶。
301.在某些实施方案中,所述第一通用引物由第一通用序列组成,或者,包含第一通用序列和额外的序列,所述额外的序列位于第一通用序列的5'端。在某些实施方案中,所述额外的序列包含1-5个,5-10个,10-15个,15-20个或更多个核苷酸。
302.在某些实施方案中,所述第一通用序列位于或构成所述第一通用引物的3'部分。
303.在本技术的实施方案中,所述第一通用引物可以是任意的长度,只要其能够进行pcr反应即可。在某些实施方案中,所述第一通用引物的长度为5-15nt,15-20nt,20-30nt,30-40nt,或40-50nt。
304.在某些实施方案中,所述第一通用引物或其任何组成成分包含或者由天然存在的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸),经修饰的核苷酸,非天然的核苷酸,或其任何
组合组成。在某些优选的实施方案中,第一通用引物(或其任何组成成分)包含或者由天然的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸)组成。在某些优选的实施方案中,第一通用引物(或其任何组成成分)包含经修饰的核苷酸,例如经修饰的脱氧核糖核苷酸或核糖核苷酸,例如5-甲基胞嘧啶或5-羟甲基胞嘧啶。在某些优选的实施方案中,第一通用引物(或其任何组成成分)包含非天然的核苷酸,例如脱氧次黄嘌呤,肌苷,1-(2'-脱氧-β-d-呋喃核糖基)-3-硝基吡咯,5-硝基吲哚或锁核酸(lna)。
305.在某些实施方案中,所述第二通用引物由第二通用序列组成,或者,包含第二通用序列和额外的序列,所述额外的序列位于第二通用序列的5'端。在某些实施方案中,所述额外的序列包含1-5个,5-10个,10-15个,15-20个或更多个核苷酸。
306.在某些实施方案中,所述第二通用序列位于或构成所述第二通用引物的3'部分。
307.在某些实施方案中,所述第二通用序列包含第一通用序列且在第一通用序列的3'端额外包含1-5个,5-10个,10-15个,15-20个或更多个核苷酸。
308.在本技术的实施方案中,所述第二通用引物可以是任意的长度,只要其能够进行pcr反应即可。在某些实施方案中,所述第二通用引物的长度为8-15nt,15-20nt,20-30nt,30-40nt,或40-50nt。
309.在某些实施方案中,所述第二通用引物或其任何组成成分包含或者由天然存在的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸),经修饰的核苷酸,非天然的核苷酸,或其任何组合组成。在某些优选的实施方案中,第二通用引物(或其任何组成成分)包含或者由天然的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸)组成。在某些优选的实施方案中,第二通用引物(或其任何组成成分)包含经修饰的核苷酸,例如经修饰的脱氧核糖核苷酸或核糖核苷酸,例如5-甲基胞嘧啶或5-羟甲基胞嘧啶。在某些优选的实施方案中,第二通用引物(或其任何组成成分)包含非天然的核苷酸,例如脱氧次黄嘌呤,肌苷,1-(2'-脱氧-β-d-呋喃核糖基)-3-硝基吡咯,5-硝基吲哚或锁核酸(lna)。
310.在某些实施方案中,在所述正向引物中,所述正向核苷酸序列直接连接至第一通用序列的3'端,或者,通过核苷酸连接体连接至第一通用序列的3'端。在某些实施方案中,所述核苷酸连接体包含1-5个,5-10个,10-15个,15-20个或更多个核苷酸。
311.在某些实施方案中,所述正向引物还包含额外的序列,其位于第一通用序列的5'端。在某些实施方案中,所述额外的序列包含1-5个,5-10个,10-15个,15-20个或更多个核苷酸。
312.在某些实施方案中,所述正向引物从5'至3'包含或由第一通用序列和正向核苷酸序列组成;或者,从5'至3'包含或由第一通用序列、核苷酸连接体和正向核苷酸序列组成;或者,从5'至3'包含或由额外的序列、第一通用序列和正向核苷酸序列组成;或者,从5'至3'包含或由额外的序列、第一通用序列、核苷酸连接体和正向核苷酸序列组成。
313.在某些实施方案中,所述正向核苷酸序列位于或构成所述正向引物的3'部分。
314.在某些实施方案中,所述正向核苷酸序列的长度为10-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt,80-90nt,90-100nt。
315.在某些实施方案中,所述正向引物的长度为15-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt,80-90nt,90-100nt,100-110nt,110-120nt,120-130nt,130-140nt,140-150nt。
316.在某些实施方案中,所述正向引物或其任何组成成分包含或者由天然存在的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸),经修饰的核苷酸,非天然的核苷酸,或其任何组合组成。在某些优选的实施方案中,正向引物(或其任何组成成分)包含或者由天然的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸)组成。在某些优选的实施方案中,正向引物(或其任何组成成分)包含经修饰的核苷酸,例如经修饰的脱氧核糖核苷酸或核糖核苷酸,例如5-甲基胞嘧啶或5-羟甲基胞嘧啶。在某些优选的实施方案中,正向引物(或其任何组成成分)包含非天然的核苷酸,例如脱氧次黄嘌呤,肌苷,1-(2'-脱氧-β-d-呋喃核糖基)-3-硝基吡咯,5-硝基吲哚或锁核酸(lna)。
317.在某些实施方案中,在所述反向引物中,所述反向核苷酸序列直接连接至第二通用序列的3'端,或者,所述反向核苷酸序列通过核苷酸连接体连接至第二通用序列的3'端。在某些实施方案中,所述核苷酸连接体包含1-5个,5-10个,10-15个,15-20个或更多个核苷酸。
318.在某些实施方案中,所述反向引物还包含额外的序列,其位于第二通用序列的5'端。在某些实施方案中,所述额外的序列包含1-5个,5-10个,10-15个,15-20个或更多个核苷酸。
319.在某些实施方案中,所述反向引物从5'至3'包含或由第二通用序列和反向核苷酸序列组成;或者,从5'至3'包含或由第二通用序列、核苷酸连接体和反向核苷酸序列组成;或者,从5'至3'包含或由额外的序列、第二通用序列和反向核苷酸序列组成;或者,从5'至3'包含或由额外的序列、第二通用序列、核苷酸连接体和反向核苷酸序列组成。
320.在某些实施方案中,所述反向核苷酸序列位于或构成所述反向引物的3'部分。
321.在某些实施方案中,所述反向核苷酸序列的长度为10-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt,80-90nt,90-100nt。
322.在某些实施方案中,所述反向引物的长度为15-20nt,20-30nt,30-40nt,40-50nt,50-60nt,60-70nt,70-80nt,80-90nt,90-100nt,100-110nt,110-120nt,120-130nt,130-140nt,140-150nt。
323.在某些实施方案中,所述反向引物或其任何组成成分包含或者由天然存在的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸),经修饰的核苷酸,非天然的核苷酸,或其任何组合组成。在某些优选的实施方案中,反向引物(或其任何组成成分)包含或者由天然的核苷酸(例如脱氧核糖核苷酸或核糖核苷酸)组成。在某些优选的实施方案中,反向引物(或其任何组成成分)包含经修饰的核苷酸,例如经修饰的脱氧核糖核苷酸或核糖核苷酸,例如5-甲基胞嘧啶或5-羟甲基胞嘧啶。在某些优选的实施方案中,反向引物(或其任何组成成分)包含非天然的核苷酸,例如脱氧次黄嘌呤,肌苷,1-(2'-脱氧-β-d-呋喃核糖基)-3-硝基吡咯,5-硝基吲哚或锁核酸(lna)。
324.在某些实施方案中,所述第二通用序列不能与所述正向引物的互补序列完全互补;例如,所述第二通用序列中位于3'末端的至少一个核苷酸,例如1-5个,5-10个,10-15个,15-20个或更多个核苷酸,不能与所述正向引物的互补序列互补。
325.在某些实施方案中,所述第一通用引物的序列如seq id no:71所示。
326.在某些实施方案中,所述第二通用引物的序列如seq id no:70所示。
327.在某些实施方案中,所述靶特异性引物对包括具有选自下列的核苷酸序列的引物
对或其任何组合(例如,任意5对,10对,15对,20对,23对的组合):seq id no:1和2;4和5;7和8;10和11;13和14;16和17;19和20;22和23;25和26;28和29;31和32;34和35;37和38;40和41;43和44;46和47;49和50;52和53;55和56;58和59;61和62;64和65;67和68。
328.在某些实施方案中,所述目标snp位点各自独立地选自:
329.(1)供体基因型为第一纯合、受体基因型为第二纯合的snp位点;
330.(2)供体基因型为纯合、受体基因型为杂合的snp位点。
331.在某些优选的实施方案中,通过方案(1)来计算所述受体样品中供体的比例。
332.在某些实施方案中,通过以下的一种或多种方法计算所述供体样品中受体的比例:
333.(1)当目标snp位点是供体基因型为第一纯合(例如,aa),受体基因型为第二纯合(例如,bb)的snp位点时,所述受体样品中供体的比例为:
334.其中,nb为等位基因b的拷贝数(其可通过数字pcr确定),na为等位基因a的拷贝数(其可通过数字pcr确定);
335.(2)当目标snp位点是供体基因型为纯合(例如,aa),受体基因型为杂合(例如,ab)的snp位点时,所述受体样品中供体的比例为:
336.其中,nb为等位基因b的拷贝数(其可通过数字pcr确定),na为等位基因a的拷贝数(其可通过数字pcr确定)。
337.在某些实施方案中,所述移植为器官移植。
338.在某些实施方案中,所述器官移植选自肾脏,心脏,肺脏,肝脏,胰脏,或其任何组合。
339.在某些实施方案中,受体样品选自来自移植后受体的血液(例如,外周血),尿液,及其任何组合。
340.在某些实施方案中,所述目标snp位点各自独立地选自:
341.(1)供体基因型为第一纯合、受体基因型为第二纯合的snp位点;
342.(2)供体基因型为杂合、受体基因型为纯合的snp位点。
343.在某些优选的实施方案中,通过方案(1)来计算所述受体样品中供体的比例。
344.在某些实施方案中,通过以下的一种或多种方法计算所述供体样品中受体的比例:
345.(1)当目标snp位点是供体基因型为第一纯合(例如,bb),受体基因型为第二纯合(例如,aa)的snp位点时,所述受体样品中供体的比例为:
346.其中,nb为等位基因b的拷贝数(其可通过数字pcr确定),na为等位基因a的拷贝数(其可通过数字pcr确定);
347.(2)当目标snp位点是供体基因型为杂合(例如,ab),受体基因型为纯合(例如,aa)的snp位点时,所述供体样品中受体的比例为:
348.其中,nb为等位基因b的拷贝数(其可通过数字pcr确
定),na为等位基因a的拷贝数(其可通过数字pcr确定)。
349.在本技术的方法中,以所述探针组中的第一探针为例,其能够与具有第一等位基因的核酸分子杂交或退火(优选完全互补)。因此,在进行数字pcr反应时,在退火或延伸过程中,所述第一探针将与所述核酸分子形成双链体,并在扩增期间被核酸聚合酶(例如dna聚合酶)所降解,释放报告基团(例如荧光基团)。由此,在数字pcr扩增反应结束后,通过微滴检测仪对各微滴的终点荧光进行检测,根据游离的第一报告基团(例如第一荧光基团)的信号(例如第一荧光信号)强度,即可确定阳性微滴和阴性微滴数,从而确定样品中具有第一等位基因的核酸分子的量。类似地,在数字pcr扩增反应结束后,通过微滴检测仪对各微滴的终点荧光进行检测,根据游离的第二报告基团(例如第二荧光基团)的信号(例如第二荧光信号)强度,即可确定阳性微滴和阴性微滴数,即可确定样品中具有第二等位基因的核酸分子的量。由于供体/受体基因型别不同,对应于第一/第二等位基因含量即不同,因此,通过比较和分析含有第一/第二等位基因的核酸分子的量,即可判断受体样品中是否存在供体,并且任选地,确定供体的比例。
350.在本技术的方法中,在某些实施方案中,所述第一探针在数字pcr反应过程中不与具有第二等位基因的核酸分子退火或杂交;和/或,所述第二探针在数字pcr反应过程中不与具有第一等位基因的核酸分子退火或杂交。易于理解,所述第一/第二探针的杂交特异性是特别有利的,其能够有助于准确测定第一等位基因/第二等位基因的含量,从而有助于计算供体样品和受体样品各自的比例。在某些实施方案中,可通过控制数字pcr反应的退火温度和/或延伸温度,从而获得所述第一/第二探针的杂交特异性。例如,可设置退火温度和/或延伸温度低于第一探针与具有第一等位基因的核酸分子形成的双链体的熔点,但高于第一探针与具有第二等位基因的核酸分子形成的双链体的熔点,从而使得第一探针在数字pcr反应过程中与具有第一等位基因的核酸分子杂交,但不与具有第二等位基因的核酸分子杂交。类似地,可设置退火温度和/或延伸温度低于第二探针与具有第二等位基因的核酸分子形成的双链体的熔点,但高于第二探针与具有第一等位基因的核酸分子形成的双链体的熔点,从而使得第二探针在数字pcr反应过程中与具有第二等位基因的核酸分子杂交,但不与具有第一等位基因的核酸分子杂交。
351.在本技术的方法中,等位基因的拷贝数量可根据泊松分布原理,由数字pcr平台检测并通过软件直接输出,其相关原理及计算方法可参见例如,milbury ca,zhong q,lin j,et al.determining lower limits of detection of digital pcr assays for cancer-related gene mutations.biomol detect quantif.2014;1(1):8-22.published 2014aug 20.doi:10.1016/j.bdq.2014.08.001。
352.在第七方面,本技术提供了一种试剂盒,所述试剂盒包括,能够不对称扩增含有候选snp位点的靶核酸的鉴定引物组。
353.在某些实施方案中,所述鉴定引物组包含:第一通用引物和第二通用引物,以及,针对每一种候选snp位点,提供至少一个靶特异性引物对,其中,
354.所述第一通用引物包含第一通用序列;
355.所述第二通用引物包含第二通用序列,所述第二通用序列包含第一通用序列且在第一通用序列的3'端额外包含至少一个核苷酸;
356.所述靶特异性引物对能够以所述靶核酸为模板进行扩增,产生含有所述候选snp
位点的核酸产物,并且所述靶特异性引物对包含一个正向引物和一个反向引物,其中,所述正向引物包含第一通用序列和特异于所述靶核酸的正向核苷酸序列,且所述正向核苷酸序列位于第一通用序列的3'端;所述反向引物包含第二通用序列和特异于所述靶核酸的反向核苷酸序列,且所述反向核苷酸序列位于第二通用序列的3'端;并且,第二通用序列不能与所述正向引物的互补序列完全互补。
357.在某些实施方案中,所述试剂盒还包括一种或多种能够检测所述候选snp位点的检测探针,所述检测探针包含特异于所述靶核酸的核苷酸序列并且能够与所述靶核酸中含有所述候选snp位点的区域退火或杂交,并且标记有报告基团和淬灭基团,其中,所述报告基团能够发出信号,并且,所述淬灭基团能够吸收或淬灭所述报告基团发出的信号;并且,所述检测探针在与其互补序列杂交的情况下发出的信号不同于在未与其互补序列杂交的情况下发出的信号。
358.在某些实施方案中,所述候选snp位点具有选自以下的1个或多个特征:
359.(1)所述候选snp位点在不同人种之间的fst小于0.3(例如,小于0.2,小于0.1,小于0.05,小于0.01);
360.(2)所述候选snp位点位于不同染色体;
361.(3)所述候选snp位点的等位基因频率在0.2至0.8之间(例如,0.3至0.7之间,0.4至0.6之间)。
362.在某些实施方案中,所述候选snp位点具有选自以下的1个或多个特征:
363.(1)所述候选snp位点在不同人种之间的fst小于0.01;
364.(2)所述候选snp位点位于不同染色体;
365.(3)所述候选snp位点的等位基因频率在0.3至0.7之间。
366.在某些实施方案中,所述候选snp位点为具有二等位多态性的snp位点。
367.在某些实施方案中,所述候选snp位点为人基因组中的snp位点;例如所述靶核酸包含选自下列的人基因组snp位点:rs16363,rs1610937,rs5789826,rs1611048,rs2307533,rs112552066,rs5858210,rs2307839,rs149809066,rs66960151,rs34765837,rs68076527,rs10779650,rs4971514,rs6424243,rs12990278,rs2122080,rs98506667,rs774763,rs711725,rs2053911,rs9613776,rs7160304,以及前述snp位点的任意组合(例如,前述snp位点中任意5个,10个,15个,20个,23个的组合)。
368.在某些实施方案中,所述靶核酸包含下列人基因组snp位点:rs16363,rs1610937,rs5789826,rs1611048,rs2307533,rs112552066,rs5858210,rs2307839,rs149809066,rs66960151,rs34765837,rs68076527,rs10779650,rs4971514,rs6424243,rs12990278,rs2122080,rs98506667,rs774763,rs711725,rs2053911,rs9613776和rs7160304。
369.在某些实施方案中,所述检测探针包括具有选自下列的核苷酸序列的检测探针或其任何组合(例如,任意5个,10个,15个,20个,23个的组合):seq id no:3,6,9,12,15,18,21,24,27,30,33,36,39,42,45,48,51,54,57,60,63,66和69。
370.在某些实施方案中,所述第一通用引物的序列如seq id no:71所示。
371.在某些实施方案中,所述第二通用引物的序列如seq id no:70所示。
372.在某些实施方案中,所述靶特异性引物对包括具有选自下列的核苷酸序列的引物对或其任何组合(例如,任意5对,10对,15对,20对,23对的组合):seq id no:1和2;4和5;7
和8;10和11;13和14;16和17;19和20;22和23;25和26;28和29;31和32;34和35;37和38;40和41;43和44;46和47;49和50;52和53;55和56;58和59;61和62;64和65;67和68。
373.易于理解,本技术试剂盒中的第一通用引物、第二通用引物、靶特异性引物对和检测探针用于实施如上所述的方法。因此,上文中对于第一通用引物、第二通用引物、靶特异性引物对和检测探针所进行的详细描述(包括各种优选特征和示例性特征的描述)同样也适用于此处。
374.在某些实施方案中,所述试剂盒还包括选自下列的一种或多种组分:扩增引物组,探针组,用于进行数字pcr的试剂。
375.在某些实施方案中,所述扩增引物组至少包含一条扩增引物(例如一对扩增引物或更多的扩增引物),其在允许核酸杂交或退火的条件下,能够特异性扩增含有所述snp位点的核酸分子。
376.在某些实施方案中,所述探针组包含第一探针和第二探针;其中,
377.(i)第一探针和第二探针各自独立地标记有报告基团和淬灭基团,其中,所述报告基团能够发出信号,并且,所述淬灭基团能够吸收或淬灭所述报告基团发出的信号;并且,第一探针和第二探针分别标记不同的报告基团(例如荧光基团);并且
378.(ii)第一探针能够与含有所述目标snp位点的第一等位基因的核酸分子杂交或退火(优选完全互补),第二探针能够与含有所述目标snp位点的第二等位基因的核酸分子杂交或退火(优选完全互补);并且,所述第一探针和第二探针特异于不同的等位基因。
379.在某些实施方案中,所述探针组包括具有选自下列的核苷酸序列的探针或其任何组合(例如,任意5个,10个,20个,40个,60个的组合):seq id no:73,74,78,79,82,83,86,87,90,91,94,95,98,99,102,103,106,107,110,111,114,115,118,119,122,123,126,127,130,131,134,135,138,139,142,143,146,147,150,151,154,155,158,159,162,163。
380.在某些实施方案中,所述扩增引物组包括具有选自下列的核苷酸序列的引物对或其任何组合(例如,任意5对,10对,15对,20对,23对的组合):seq id no:72和73;77和76;80和81;84和85;88和89;92和93;96和97;100和101;104和105;108和109;112和113;116和117;120和121;124和125;128和129;132和133;136和137;140和141;144和145;148和149;152和153;156和157;160和161。
381.在某些实施方案中,所述进行数字pcr的试剂选自包括选自下列的一种或多种组分:用于制备微液滴样本的试剂,用于进行核酸扩增的试剂,核酸聚合酶,用于检测微液滴样本的试剂,或其任何组合。
382.在某些实施方案中,所述试剂盒还包括选自下列的一种或多种组分:核酸聚合酶,用于进行核酸扩增的试剂,用于进行熔解曲线分析的试剂,或其任何组合。
383.易于理解,本技术试剂盒中的扩增引物组和探针组(第一探针和第二探针)用于实施如上所述的方法。因此,上文中对于扩增引物组和探针组(第一探针和第二探针)所进行的详细描述(包括各种优选特征和示例性特征的描述)同样也适用于此处。
384.在某些实施方案中,所述核酸聚合酶是模板依赖性核酸聚合酶,例如dna聚合酶,特别是热稳定的dna聚合酶;在某些实施方案中,所述核酸聚合酶如前述所定义。
385.在某些实施方案中,所述用于进行核酸扩增的试剂包括,酶(例如核酸聚合酶)的工作缓冲液、dntps(标记或未标记的)、水、包含离子(例如mg
2+
)的溶液、单链dna结合蛋白、
或其任何组合。
386.在某些实施方案中,所述试剂盒用于判断受体样品中是否含有供体,或者,计算受体样品中供体的比例。
387.在某些实施方案中,所述数字pcr选自微滴式数字pcr和芯片式数字pcr。
388.在某些实施方案中,本技术提供了如前所述的鉴定引物组用于制备试剂盒的用途,所述试剂盒用于不对称扩增靶核酸分子,或用于检测靶核酸分子中候选snp位点的基因型别;或用于鉴定供体与受体具有不同基因型别的snp位点;或用于鉴定受体具有纯合的等位基因的snp位点。
389.在某些实施方案中,所述试剂盒还包含如前述所定义的检测探针。
390.在某些实施方案中,所述试剂盒用于实施如前述所描述的方法。
391.在某些实施方案中,本技术提供了如前所述的扩增引物组和探针组用于制备试剂盒的用途,所述试剂盒用于检测经历了移植手术后的受体样品中供体的核酸的存在或其比例。
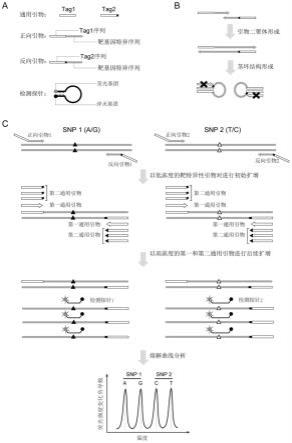
392.在某些实施方案中,所述试剂盒还包含用于确定受体或供体的基因组中一个或多个snp位点的基因型别的试剂。
393.在某些实施方案中,所述试剂盒还包含如前述所定义的鉴定引物组和检测探针。
394.在某些实施方案中,所述试剂盒用于实施如前述所描述的方法。
395.发明的有益效果
396.与现有技术相比,本技术的优势在于:(1)自动化检测,人工操作步骤少,且检测周期短。本技术独特的snp分型系统可同时实现对多个snp的分型,自动化程度高。整个流程从核酸提取到获得结果可以在1天内完成,能够及时对完成骨髓移植患者供体嵌合率测定,评估造血干细胞嵌合状态,能够完成器官移植患者dd-cfdna比例测定,反映出移植物的健康状况;(2)准确、灵敏度高。能绝对定量异源dna拷贝数,准确计算出供体嵌合率或dd-cfdna比例,异源dna的检测灵敏度低至0.1%。(3)无创、通用的检测流程:不依赖供体样本的定量分析,具有较低成本、直观的数字化定量结果,使得本方法应用广泛。
397.下面将结合附图和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
398.图1示意性地描述了本发明方法通过snp分型检测受体样品中供体的存在或比例的示例性实施方案,以阐释本发明方法的基本原理。
399.图1a示意性地描述了该实施方案中所涉及的引物组和自淬灭荧光检测探针,其中,引物组包括:第一通用引物和第二通用引物,以及,包含正向引物和反向引物的靶特异性引物对;其中,
400.第一通用引物包含第一通用序列(tag1);
401.第二通用引物包含第二通用序列(tag2),所述第二通用序列包含第一通用序列且在第一通用序列的3'端额外包含至少一个核苷酸(例如1-5个,5-10个,10-15个,15-20个或
更多个核苷酸);
402.正向引物包含第一通用序列和特异于含有snp位点的靶核酸的正向核苷酸序列,且正向核苷酸序列位于第一通用序列的3'端;
403.反向引物包含第二通用序列和特异于含有snp位点的靶核酸的反向核苷酸序列,且反向核苷酸序列位于第二通用序列的3'端;并且,
404.正向引物和反向引物能够特异性扩增相应的含有snp位点的靶核酸;并且,
405.第二通用序列不能与正向引物的互补序列完全互补。
406.图1b示意性地描述了使用图1a的引物组进行扩增时,引物二聚体的非特异性扩增被抑制的原理,其中,因正向引物和反向引物的非特异性扩增而形成的引物二聚体在变性后将产生其5'端和3'端包含彼此互补的反向序列的单链核酸,该单链核酸自身在退火阶段将形成锅柄结构,阻止第一通用引物和第二通用引物对该单链核酸的退火和延伸,从而抑制引物二聚体的进一步扩增。
407.图1c示意性地描述了使用图1a的引物组和检测探针对含有snp位点的多个靶核酸同时检测的原理。在该实施方案中,针对每个含有snp位点的靶核酸分别设计一对正向引物和反向引物以及一条自淬灭荧光检测探针,具体检测流程如下:
408.首先,由浓度低的靶特异性引物对启动pcr扩增,产生初始扩增产物,其包含分别与正向引物/第一通用引物和反向引物/第二通用引物互补的两条核酸链(核酸链a和核酸链b);随后,由浓度高的第一通用引物和第二通用引物对所述初始扩增产物进行后续的pcr扩增。
409.由于反向引物/第二通用引物包含第一通用序列,因此,第一通用引物不仅能够退火至核酸链a(与正向引物/第一通用引物互补的核酸链)并合成其互补链,而且能够退火至核酸链b(与反向引物/第二通用引物互补的核酸链)并合成其互补链。也即,第一通用引物可以同时扩增核酸链a和核酸链b。
410.第二通用引物在第一通用序列的3'端包含额外的核苷酸,因此,其与核酸链a(与正向引物/第一通用引物互补的核酸链)在3'端是不匹配的(即,在3'端不能完全互补)。由此,在扩增过程中,第二通用引物将优先退火至核酸链b(与反向引物/第二通用引物互补的核酸链)并合成其互补链,而基本上不能延伸合成核酸链a(与正向引物/第一通用引物互补的核酸链)的互补链。
411.因此,随着pcr扩增的进行,核酸链a的互补链(核酸链b)的合成效率将显著低于核酸链b的互补链(核酸链a),导致核酸链b的互补链(核酸链a)被大量合成和扩增,而核酸链a的互补链(核酸链b)的合成和扩增受到抑制,从而产生大量目标单链产物(核酸链a,其含有与正向引物/第一通用引物互补的序列以及反向引物/第二通用引物的序列),实现不对称扩增。此外,为进一步增强扩增的不对称性,还可以调整第一通用引物和第二通用引物的比例,使得第一通用引物的浓度低于第二通用引物,以更好地富集目标单链产物。在同一反应体系内同时使用多对正向引物和反向引物对,就可以同时不对称扩增多个含有snp位点的靶核酸,产生大量的含有snp位点的靶核酸单链。
412.pcr扩增完之后,预先加入的多条自淬灭荧光检测探针与对应的含有snp位点的靶核酸单链分别结合,形成检测探针与靶核酸单链的双链杂交体,因所形成双链杂交体稳定性的不同,经熔解曲线分析后,即能获得不同的熔解峰,再根据熔点(tm)的高低及探针所标
记的荧光基团类型即可判定各靶核酸单链中snp的基因型。
413.图2显示了本发明方法用于骨髓移植的供体嵌合率测定的流程图。
414.图3显示了本发明方法用于器官移植的dd-cfdna比例测定的流程图。
415.图4显示了实施例2中使用本发明体系对骨髓移植病例1样本组和病例2样本组的供体及受体的基因组dna(10ng/μl)进行扩增后熔解曲线分析的结果。其中,黑色实线代表骨髓移植病例1样本组中供体基因组dna的检测结果;黑色虚线代表病例1样本组中受体基因组dna的检测结果;灰色实线代表骨髓移植病例2样本组中供体基因组dna的检测结果;灰色虚线代表病例2样本组中受体基因组dna的检测结果。
416.图5显示了实施例3中使用本发明体系对器官移植病例3样本组的供体及受体的基因组dna(10ng/μl)进行扩增后熔解曲线分析的结果,其中,黑色实线代表器官移植病例3样本组中供体基因组dna的检测结果;黑色虚线代表病例3样本组中受体基因组dna的检测结果;以及,灰色实线代表实施例4中使用本发明体系对器官移植病例3样本组的术后第3天尿液游离dna(1ng/μl)进行扩增后熔解曲线分析的结果。
417.图6显示了实施例5中使用本发明体系对器官移植病例4样本组的术后尿液游离dna(1ng/μl)及受体的基因组dna(10ng/μl)进行扩增后熔解曲线分析的结果,其中,黑色实线代表器官移植病例4样本组中术后尿液游离dna的检测结果;黑色虚线代表病例4样本组中受体基因组dna的检测结果;以及,使用本发明体系对器官移植病例5(无供体样本)受体的基因组dna(10ng/μl)进行扩增后熔解曲线分析的结果,其中,灰色虚线代表病例5的受体基因组dna检测结果。
具体实施方式
418.现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。应当理解的是,这些实施例只是用于说明本发明的原理和技术效果,而并不是表示本发明的所有可能性。本发明并不局限于这些实施例中提到的材料、反应条件或参数。本领域技术人员可以根据本发明的原理,利用其它类似的材料或反应条件来实施其他技术方案。此类技术方案没有脱离本发明描述的基本原理和概念,并且涵盖在本发明的范围内。
419.实施例1.候选snp位点的选取
420.本发明所覆盖的snp位点从美国国立生物技术信息中心(ncbi)的单核苷酸多态性位点库(dbsnp)中选取,本发明的snp位点优选的具备以下条件:(1)不同人种之间fst(群体固定系数)<0.01,即这些位点在不同人种的人群中分化程度很小,基因杂合性水平接近;(2)等位基因频率为0.3至0.7之间;(3)在亚洲人群中的分布遵循哈迪温伯格平衡;(4)每两个snp之间的距离都》1mb;(5)为了避免不同位点之间连锁,尽量选择位于不同染色体上的位点。按以上标准进行snp位点的筛选,本实施例选用了优选的23个snp位点,具体如表1所示,snp位点信息及序列从美国国家生物技术信息中心(ncbi)的dbsnp数据库查询和下载,等位基因频率参考千人基因组数据库来源的亚洲人群频率,这些位点均匀分布在基因组各条染色体上。
421.表1.实施例1选取的snp位点信息
[0422][0423][0424]
实施例2.骨髓移植供体嵌合率的测定
[0425]
本实例的检测流程如图2所示,以2例骨髓移植样本组为例,采集以下两部分样本:1、对骨髓移植患者移植前的供体样本、受体样本分别进行收集和提取,用于snp分型,snp分型原理如图1所示。2、对移植后受体监测期各时间点的外周血进行收集,提取基因组dna,用于目标snp位点定量,检测骨髓移植后供体嵌合率,评估异基因造血干细胞移植后的嵌合状态。
[0426]
以上检测流程的具体操作步骤如下:
[0427]
1.收集2例骨髓移植样本组(每组均包括移植前供体样本、受体样本和移植后各时间点的受体样本),其中血液样本采用edta抗凝管(浙江拱东医疗器械股份有限公司,台州)采集,4℃保存;唾液样本采用唾液采集器(厦门致善生物科技股份有限公司,厦门)按其说明书要求采集后,室温保存。
[0428]
2.使用lab-aid 824核酸提取仪以及配套的血液、唾液基因组dna提取试剂(厦门致善生物科技股份有限公司,厦门)提取上述各血液、唾液样本的基因组dna,使用nanodrop-2000微量紫外可见分光光度计(thermo fisher scientific,usa)测定基因组dna浓度和纯度。
[0429]
3.snp分型:按所选取的snp位点,设计相应的引物和探针,利用本发明的多重不对称pcr系统(原理如图1所示),在2个pcr反应体系中同时对23个snp进行分型,所使用的引物和探针序列及使用浓度如表2所示。
[0430]
表2.实施例2所使用的引物、探针序列及使用浓度
[0431]
[0432]
[0433][0434]
snp分型体系具体配置如下:25μl的pcr反应体系含有:1
×
pcr buffer(takara,北京),5.0mm mgcl2,0.2mm dntps,1u taq dna聚合酶(takara,北京),引物和探针及用量如表2所示,5μl人类基因组dna或阴性对照(水)。pcr扩增程序为:95℃预变性5min;10个循环的95℃变性15s,65℃-56℃退火15s(每个循环下降1℃),76℃延伸20s;95℃变性15s,55℃退火15s,76℃延伸20s,50个循环;随后进行熔解曲线分析,程序为:95℃变性1min,37℃维持3min;随后按0.04℃/s的升温速率从40℃递增至85℃进行熔解曲线分析,并采集fam、hex、rox、cy5、quasar705通道的荧光信号。本实验采用的仪器为slan 96实时荧光pcr仪(上海宏石医疗科技有限公司)。本实施例中骨髓移植病例供体、受体样本的snp分型典型结果如图4所示。
[0435]
4.目标snp位点的筛选:对比供体dna样本和受体dna样本相应的snp位点的基因型,获取目标snp位点,即供体dna样本和受体的dna样本中的同一个snp位点,供体样本的snp位点基因型为纯合型aa(或bb),受体样本的snp位点基因型为另一纯合型bb(或aa);或者供体样本的snp位点基因型为纯合型aa(或bb),受体样本的snp位点基因型为杂合型ab。在本实施例中,以骨髓移植病例1样本组和病例2样本组为例,供体dna样本和受体dna样本的各snp分型结果见表3和图4。其中,病例1样本组的目标snp位点为6个(即rs2307839、rs16363、rs12990278、rs4971514、rs9613376、rs7160304),选取其中2个优选的目标snp位点(即rs12990278、rs4971514)采用数字pcr体系对其等位基因拷贝数进行定量分析,测定供体嵌合率;病例2样本组的目标snp位点为10个(即rs2307839、rs66960151、rs68076527、rs5789826、rs1611048、rs149809066、rs12990278、rs2122080、rs774763、rs9613776),选取其中优选的2个目标snp位点(即rs5789826、rs2122080)采用数字pcr体系对其等位基因拷贝数进行定量分析,测定供体嵌合率。
[0436]
表3:骨髓移植病例1样本组和病例2样本组的snp分型结果
[0437][0438][0439]
5.基因组dna样本的定量检测:按所选取的目标snp位点分别建立数字pcr定量分析体系,每个体系均包含有一对引物和分别针对snp不同等位基因特异的两条荧光探针,各snp位点定量体系所使用的引物和探针以及使用量如表4所示。对于选定的目标snp位点,采用数字pcr体系中对应的引物组和探针组进行目标snp位点各等位基因比例的测定。
[0440]
数字pcr体系配置、pcr扩增程序、操作流程以及数据分析如下:微滴式数字pcr包括drop marker样本制备仪、chip reader生物芯片阅读仪(新羿生物,北京)和朗基a300型扩增仪(朗基科学仪器有限公司,杭州)组成完整的数字pcr系统。微液滴样本制备通用试剂盒、微液滴样本检测通用试剂盒(新羿生物,北京),30μl pcr反应液中含有ddpcr通用扩增试剂(新羿生物,北京),人工合成序列(上海生物工程,上海)。可选的对上述游离dna样本预
富集后,采用数字pcr体系中对应的目标snp位点的引物组和探针组,上、下游引物浓度0.8μmol/l,荧光探针浓度0.25μmol/l,进行snp等位基因拷贝数的测定,将基因组dna样本加入至pcr预混液后,使用drop marker样本制备仪制备成体积纳升级别的液滴,pcr扩增程序为95℃预变性10min,40个循环的94℃变性30s,58℃退火60s,扩增结束后12℃保温,整体变温速率为1.5℃/s。在pcr反应结束后,使用chip reader生物芯片阅读仪对微液滴进行定量检测,阅读系统导出excel格式的样本检测数据,包括fam、hex荧光通道的阴、阳性微滴数、拷贝数等。
[0441]
6.供体嵌合率计算:根据snp分子标记二等位特性和遗传平衡的哈迪-温伯格平衡定律推导供体嵌合率的定量分析模型。
[0442]
1)若选择目标snp位点为供体的snp基因型为aa,受体的snp基因型为bb,而数字pcr测定受体b等位基因的个数为nb,测定供体a等位基因的个数为比例为na,则供体基因组dna占受体总基因组dna的百分比为供体嵌合率:
[0443][0444]
2)若选择目标snp位点为供体的snp基因型为bb,受体的snp基因型为aa,而数字pcr测定受体a等位基因的个数为na,测定供体b等位基因的个数为比例为nb,则供体基因组dna占受体总基因组dna的百分比为供体嵌合率:
[0445][0446]
3)若选择目标snp位点为供体的snp基因型为aa,受体的snp基因型为ab,而数字pcr测定受体b等位基因的个数为nb,测定供体a等位基因的个数为比例为na,则供体基因组dna占受体总基因组dna的百分比为供体嵌合率:
[0447][0448]
4)若选择目标snp位点为供体的snp基因型为bb,受体的snp基因型为ab,而数字pcr测定受体a等位基因的个数为na,测定供体b等位基因的个数为比例为nb,则供体基因组dna占受体总基因组dna的百分比为供体嵌合率:
[0449][0450]
对于有检测多个目标snp位点,先基于各目标snp位点所检测的供体嵌合率,再求其平均值作为分析报告中的供体嵌合率。
[0451]
表4.数字pcr定量分析体系所使用的引物和探针
[0452]
[0453]
[0454][0455]
7.检测结果
[0456]
利用本发明方法对2例骨髓移植病例的术后供体嵌合率进行测定,在移植后4个时间点采集血液,各样受体不同时间点的供体嵌合率检测结果如表5所示。从表中结果可以看出,病例1和病例2的经移植后处于恢复状态,各时间点的受体嵌合率均大于95%。
[0457]
表5:2例骨髓移植病例的术后供体嵌合率测定结果
[0458][0459]
实施例3.器官移植(有供体信息)供体游离dna比例的测定
[0460]
本实施例以1例肾移植术后的血浆、尿液样本中供体cfdna比例测定为例,监测肾移植病例3的器官损伤,考察本发明方法用于器官移植测定dd-cfdna比例的可行性及检测性能。
[0461]
本实例病例的检测流程如图3所示,以1例肾移植样本组为例,需采集以下两部分样本:(1)对肾移植患者移植前的供体样本、受体样本进行收集和提取,用于snp分型,snp分型原理如图1所示;或收集移植后受体血细胞沉淀,唾液,移植器官之外的组织,皮肤等充当移植前受体样本。(2)对移植后受体监测期各时间点的外周血、尿液进行收集,分离血浆、尿液上清后提取cfdna,用于目标snp定量,检测器官移植后dd-cfdna比例,评估术后器官损伤
的程度。
[0462]
以上检测流程的具体操作步骤如下:
[0463]
1.肾移植样本组收集
[0464]
病例3样本组包括移植前供体外周血样本、受体外周血样本和移植后各时间点的受体样本(血浆和尿液)。血液样本使用edta抗凝管(浙江拱东医疗器械股份有限公司,台州)采集,在采集后2小时之内按标准分离流程(1600g,离心10min,16000g,离心10min)进行血浆分离,血浆样本置于-80℃冷冻保存;尿液样本使用尿液采集杯(浙江拱东医疗器械股份有限公司,台州)采集,在采集后6小时内按标准分离流程(5000g,离心20min)取上清液,尿液上清液样本置于-80℃冷冻保存。
[0465]
2.基因组dna和游离dna的提取
[0466]
使用lab-aid 824核酸提取仪以及配套的血液基因组dna提取试剂(厦门致善生物科技股份有限公司,厦门)提取上述各血液样本的基因组dna,使用nanodrop-2000微量紫外可见分光光度计(thermo fisher scientific,usa)测定基因组dna浓度和纯度。使用apostle minimax
tm
高效游离dna富集分离试剂盒提取血浆、尿液样本中的游离dna(apostle,usa),使用qubit 3.0fluorometer(thermo fisher scientific,usa)测定游离dna浓度。
[0467]
3.snp分型
[0468]
按所选取的snp位点,设计相应的引物和探针,利用多重不对称pcr分型系统(原理如图1所示),在2个pcr反应体系中同时对23个snp进行分型,所使用的引物和探针序列及使用浓度如表2所示。snp分型体系具体配置与实例2一致。本案例中肾移植病例供体、受体样本的snp分型典型结果如图5和表6所示。
[0469]
表6.器官移植病例3样本组的snp分型结果
[0470][0471]
4.目标snp位点的筛选
[0472]
对比病例3样本组中供体基因组dna和受体基因组dna相应的snp位点的基因型,获取目标snp位点,即供体dna样本和受体的dna样本中的同一个snp位点,供体样本的snp位点基因型为纯合型aa(或bb),受体样本的snp位点基因型为另一纯合型bb(或aa),或者供体样本的snp位点基因型为杂合型ab,受体样本的snp位点基因型为纯合型aa(或bb)。在本实施例中,病例3样本组的目标snp位点有3个(即rs2122080、rs10779650、rs7160304),对这3个目标snp位点采用数字pcr体系对其等位基因拷贝数进行定量分析,测定供体游离dna的比例。
[0473]
5.游离dna样本的预富集
[0474]
按实例1中所选取的snp位点,设计预富集引物,各snp富集引物对与数字pcr中snp
定量体系所使用的引物对一致,具体见实例1中表4。预富集体系为50μl的pcr反应体系,具体配置如下:1
×
pcr buffer(takara,北京),5.0mm mgcl2,0.2mm dntps,2u taq dna聚合酶(takara,北京),各引物用量见表4,加入1-10ng游离dna,超纯水补足至50μl。pcr扩增程序为:95℃预变性5min;10个循环的95℃变性20s,58℃退火4min,72℃延伸2min。本实验采用的仪器为a300型扩增仪(朗基科学仪器有限公司,杭州)。
[0475]
6.游离dna样本的定量检测
[0476]
按实例1中所选取的snp位点,分别建立数字pcr定量分析体系,每个体系均包含有一对引物和分别针对snp等位基因特异的两条探针,各snp位点定量体系所使用的引物和探针以及使用量如表4所示。对于选定的目标snp位点,采用数字pcr体系中对应的引物组和探针组进行目标snp位点各等位基因比例的测定,游离dna样本的定量检测体系具体配置与实例1基因组dna样本的定量检测所描述一致。
[0477]
7.供体游离dna比例计算
[0478]
病例3的计算方法如下:
[0479]
根据snp分子标记二等位特性和遗传平衡的哈迪-温伯格平衡定律可推导出dd-cfdna的定量分析模型。
[0480]
1)若选择目标snp位点为供体的snp基因型为aa,受体的snp基因型为bb,而数字pcr测定供体a等位基因的个数为比例为na,测定受体b等位基因的个数为nb,则供体cfdna占受体总cfdna的比例为:
[0481][0482]
2)若选择目标snp位点为供体的snp基因型为bb,受体的snp基因型为aa,而数字pcr测定供体b等位基因的个数为比例为nb,测定受体a等位基因的个数为na,则供体cfdna占受体总cfdna的比例为:
[0483][0484]
3)若选择目标snp位点为供体的snp基因型为ab,受体的snp基因型为aa,而数字pcr测定供体b等位基因的个数为比例为nb,测定受体a等位基因的个数为na,则供体cfdna占受体总cfdna的比例为:
[0485][0486]
4)若选择目标snp位点为供体的snp基因型为ab,受体的snp基因型为bb,而数字pcr测定供体a等位基因的个数为比例为na,测定受体b等位基因的个数为nb,则供体cfdna占受体总cfdna的比例为:
[0487][0488]
以上对于有检测多个目标snp位点,先基于各目标snp位点所检测的dd-cfdna比例,再求其平均值作为分析报告中的dd-cfdna比例。
[0489]
8.检测结果分析
[0490]
利用本发明方法对肾移植病例的术后dd-cfdna比例进行测定,在移植后7个时间
点采集血液、尿液,经检测,各受体不同时间点采集样本dd-cfdna比例如表7所示。
[0491]
表7:病例3肾移植术后dd-cfdna比例测定结果
[0492][0493][0494]
实施例4.肾移植后尿液游离dna用于筛选目标snp位点
[0495]
器官移植监测中可能会出现无法采集到供体样本的情况,本实例以实例3的受体样本为例,模拟在无法获取供体样本时,以肾移植后受体尿液游离dna为snp分型模板,考察本技术方法用于筛选目标snp位点的可行性。基于实施例3尿液dd-cfdna比例和文献报道,尿液dd-cfdna比例在5%至80%的波动范围。
[0496]
按实施例1中所选取的snp位点,设计相应的引物和探针,利用多重不对称pcr分型系统(原理如图1所示),在2个pcr反应体系中同时对23个snp进行分型,所使用的引物和探针序列及使用浓度如表2所示。snp分型体系具体配置与实例2一致。本案例中肾移植病例术后受体尿液游离dna样本、供体和受体基因组dna样本的snp分型典型结果如图5和表7所示。
[0497]
表7:器官移植病例3样本组的snp分型结果
[0498]
[0499][0500]
通过对比病例3样本组中受体术后第3天尿液游离dna和受体基因组dna相应的snp位点的基因型,筛选目标snp位点,即筛选同一snp位点中,受体术后第3天尿液游离dna样本与受体基因组dna样本具有不同等位基因的snp位点。在本实施例中,可筛选出3个目标snp位点(即rs2122080、rs10779650、rs7160304),该筛选结果与实例3中采用供体基因组dna样本和受体基因组dna样本所筛选出来的目标snp位点的结果一致,说明肾移植后尿液游离dna可以作为无法获得供体样本时,用于目标snp位点的筛选。
[0501]
由实例4的考察结果表明,器官移植术后采集的血液、尿液样本提取的游离dna中(如移植后第1天的外周血中cfdna或肾移植后尿液cfdna),含有部分供体来源的游离dna,当供体游离dna达到一定的比例(例如,达20%及以上比例)时,可通过采用snp分型体系直接对cfdna进行基因分型,对比受体自身基因组dna的snp分型结果,即可筛选到目标snp位点。
[0502]
实施例5.器官移植(无供体信息)供体游离dna比例的测定
[0503]
本实施例以肾移植病例4、病例5样本组为例,考察本发明方法用于无法获取供体样本的器官移植后测定dd-cfdna比例的可行性及检测性能。
[0504]
具体操作步骤如下:
[0505]
1.收集2例肾移植样本组
[0506]
采集病例4样本组的移植前受体样本(血液)和移植后各时间点的受体样本(血液、尿液)和病例5样本组的移植前受体样本(血液)和移植后各时间点的受体样本(血液)。其中,血液样本使用edta抗凝管(浙江拱东医疗器械股份有限公司,台州)采集,在采集后2小时之内按标准分离流程(1600g,离心10min,16000g,离心10min)进行血浆分离,血浆样本置于-80℃冷冻保存;尿液样本使用尿液采集杯(浙江拱东医疗器械股份有限公司,台州)采集,在采集后6小时内按标准分离流程(5000g,离心20min)取上清液,尿液上清液样本置于-80℃冷冻保存。
[0507]
2.基因组dna和游离dna的提取
[0508]
使用lab-aid 824核酸提取仪以及配套的血液提取试剂(厦门致善生物科技股份
有限公司,厦门)提取上述各血液的基因组dna,使用nanodrop-2000微量紫外可见分光光度计(thermo fisher scientific,usa)测定基因组dna浓度和纯度。使用apostle minimax
tm
高效游离dna富集分离试剂盒提取血液、尿液游离dna(apostle,usa),使用qubit 3.0fluorometer(thermo fisher scientific,usa)测定游离dna浓度。
[0509]
3.snp分型
[0510]
按所选取的snp位点,设计相应的引物和探针,利用多重不对称pcr分型系统(原理如图1所示),在2个pcr反应体系中同时对23个snp进行分型,所使用的引物和探针序列及使用浓度如表2所示。snp分型体系具体配置与实例2一致。本案例中肾移植病例术后尿液样本、受体样本的snp分型典型结果如图6和表8所示。
[0511]
表8:器官移植病例4、病例5样本组的snp分型结果
[0512][0513]
4.目标snp位点的筛选
[0514]
对比病例4样本组中尿液cfdna和受体基因组dna相应的snp位点的基因型,获取目标snp位点,即受体的snp基因型为纯合型aa(或bb),并且移植后受体尿液cfdna样本出现与受体基因组dna样本不同等位基因的snp位点。在本实施例中,病例4筛选到的目标snp位点
为6个(即rs5858210、rs5789826、rs34765837、rs16363、rs1610937、rs149809066)选取其中3个目标snp位点(即rs5858210、rs149809066、rs1610937)采用数字pcr体系对其等位基因拷贝数进行定量分析,测定供体游离dna的比例。
[0515]
针对无供体样本的病例5,选取受体样本基因型为纯合型的snp位点(例如,aa或bb),病例5中,受体样本为纯合的snp位点为11个(即rs2307839、rs112552066、rs5858210、rs66960151、rs68076527、rs34765837、rs1610937、rs2307533、rs98506667、rs10779650、rs9613776),选取其中8个snp位点,采用数字pcr体系对病例5术后血液cfdna样本的8个snp位点的等位基因拷贝数进行定量分析,以用于之后的供体游离dna的比例的测定。
[0516]
5.游离dna样本的预富集
[0517]
按实例1中所选取的snp位点,设计预富集引物,各snp富集引物对与数字pcr中snp定量体系所使用的引物对一致,具体见实例1中表4。预富集体系为50μl的pcr反应体系,具体配置如下:1
×
pcr buffer(takara,北京),5.0mm mgcl2,0.2mm dntps,2u taq dna聚合酶(takara,北京),各引物用量见表4,加入1-10ng游离dna,超纯水补足至50μl。pcr扩增程序为:95℃预变性5min;10个循环的95℃变性20s,58℃退火4min,72℃延伸2min。本实验采用的仪器为a300型扩增仪(朗基科学仪器有限公司,杭州)。
[0518]
6.游离dna样本的定量检测
[0519]
按实例1中所选取的snp位点,分别建立数字pcr定量分析体系,每个体系均包含有一对引物和分别针对snp等位基因特异的两条探针,各snp位点定量体系所使用的引物和探针以及使用量如表4所示。对于选定的目标snp位点,采用数字pcr体系中对应的引物组和探针组进行目标snp位点各等位基因比例的测定,游离dna样本的定量检测体系具体配置与实例1基因组dna样本的定量检测所描述一致。
[0520]
7.供体游离dna比例计算
[0521]
7.1病例4的计算方法
[0522]
在读取目标snp位点数字pcr结果后,可获取不同等位基因的绝对拷贝数,可通过聚类分析(k-means)将供体特异等位基因的拷贝数比例分成两类,这两类值存在两倍关系,即杂合型和纯合型的两倍拷贝数关系。使用聚类分析后的两类数据进行卡方检验,判断两倍关系是否存在显著性差异。以病例4术后第1天血液cfdna样本为例,3个目标snp位点数字pcr体系的定量分析测定特异等位基因比例如表9所示。将3个目标snp位点(rs5858210、rs149809066、rs1610937)经校正后的均值作为分析报告中的dd-cfdna比例,即36.41%。
[0523]
表9:器官移植病例4的术后血液cfdna样本分析
[0524][0525]
7.2病例5的计算方法:
[0526]
已知病例5受体的snp基因型为纯合型aa或bb,故病例5术后血液cfdna样本与病例5受体基因组dna不同的等位基因可认为大部分是来自供体,极小一部分是由于数字pcr空白检测限以下的信号干扰。而供体的snp基因型可能为杂合型或纯合型,具体基因型未知。在读取数字pcr结果后,可获取不同等位基因的绝对拷贝数,可通过聚类分析(k-means)将供体特异等位基因的拷贝数比例分成两类,这两类值存在两倍关系,即杂合型和纯合型的两倍拷贝数关系。使用聚类分析后的两类数据进行卡方检验,判断两倍关系是否存在显著性差异。以病例5术后第2天血液cfdna样本为例,选取受体样本基因型为纯合型的8个snp位点进行数字pcr体系的定量分析,测定特异等位基因比例如表10所示。将4个目标snp位点(rs2307839、rs66960151、rs10779650、rs9613776)经校正后的均值作为分析报告中的dd-cfdna比例,即3.76%。
[0527]
表10:器官移植病例5受体纯合位点的术后血液cfdna样本分析
[0528][0529]
8.检测结果分析
[0530]
利用本发明方法对2例器官移植病例的术后dd-cfdna比例进行测定,在移植后4个时间点采集血液,经检测,各受体不同时间点采集样本dd-cfdna比例如表11所示。
[0531]
表11:2例器官移植病例的术后dd-cfdna比例测定结果
[0532][0533]
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公开的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1