一种蛋白质与多级孔道金属有机骨架复合物及其制备方法与应用
1.本发明属于生物材料制备技术领域,具体涉及一种蛋白质与多级孔道金属有机骨架复合物及其制备方法与应用。
背景技术:
2.蛋白质是由氨基酸残基构成的生物大分子,在生物体内行使催化、免疫等功能,并能在体外发挥作用。其中酶作为自然界的高效催化剂,因其在生物医药、食品加工、环境工程等领域的广泛用途备受青睐。然而天然酶分子存在稳定性差、不可回收、难从产物中分离等缺点,极大限制了其在工业应用中的范围并提高了应用成本。免疫蛋白主要包括免疫球蛋白和抗体等,可广泛应用于预防、治疗、诊断相应传染病或其他有关疾病。但其存在稳定性差,易降解、聚集等缺点,容易性能下降甚至产生副作用。金属有机骨架是以过渡金属离子为顶点,通过有机配体的配位作用形成的微孔网状骨架结构,其比表面积大、机械性能好、可设计性强,是一类良好的固定化蛋白载体材料。将金属有机骨架复合物与蛋白质进行结合,构建蛋白质金属有机骨架复合物受到研究者的广泛关注,在生物催化、医学检测和治疗等方面具有重要的应用前景。
3.目前以mofs材料作为载体的固定蛋白技术主要有先合成mofs再吸附蛋白分子进行固定化的吸附法和将在mofs合成过程中引入蛋白分子的原位包埋法。吸附法通过合成与蛋白分子尺寸相匹配的介孔金属有机骨架,通过水溶液吸附法将蛋白分子吸附到介孔中,实现对蛋白分子的固定化。由于蛋白分子尺寸通常在3
‑
5nm左右,因此吸附法所需的介孔金属有机骨架需要有较大空间位阻的长臂配体,而长臂配体的合成通常需要多步有机合成反应,过程复杂繁琐,收率低,耗能高。而原位包埋法反应条件温和,通过蛋白、金属离子与有机配体在溶液条件下进行一步反应,对蛋白的分子尺寸没有限制,具有一定普适性。然而目前,原位包埋法主要采用微孔型的沸石咪唑骨架材料,材料主要含1
‑
2nm的微孔结构,一方面不利于蛋白在催化过程中的构象翻转,另一方面也限制了酶催化反应过程中的底物和产物传递。目前所报道的酶
‑
金属有机骨架复合物的表观催化活性通常低于10%。与此同时,沸石咪唑骨架材料在水溶液尤其是酸性溶液中的稳定性较差,致使酶和抗体等蛋白质的应用范围受到限制。因此,探索一种温和简便高效且能保留较高蛋白活性的原位包埋法用于构建结构稳定的蛋白质
‑
金属有机骨架复合物具有重要的研究意义。
技术实现要素:
4.本发明的目的在于提供一种蛋白质与多级孔道金属有机骨架复合物的制备方法。该方法通过调控反应时间和反应物浓度完成,具有操作简便、反应条件温和、稳定性好、所得复合物催化、免疫活性好等特点。
5.本发明的另一个目的是提供一种通过上述制备方法制备得到的蛋白质与多级孔道金属有机骨架复合物。
6.本发明的再一个目的是提供上述蛋白质与多级孔道金属有机骨架复合物的应用。
7.本发明目的通过以下技术方案实现:
8.一种蛋白质与多级孔道金属有机骨架复合物的制备方法,包括如下制备步骤:
9.(1)将核苷酸来源的化合物和蛋白质加入到溶剂中混合均匀,得到含核苷酸来源的化合物和蛋白质的混合液;
10.(2)向步骤(1)的含核苷酸来源的化合物和蛋白质的混合液中加入锌盐溶液,搅拌反应,获得含有沉淀的反应液;
11.(3)将步骤(2)的含有沉淀的反应液离心,取沉淀,洗涤,加入分散剂分散,得到分散液;
12.(4)向步骤(3)中得到的分散液中加入有机配体溶液,搅拌反应,获得含有沉淀颗粒的反应溶液;
13.(5)将步骤(4)的含有沉淀颗粒的反应溶液取出,离心取沉淀颗粒物,洗涤,干燥,所得粉末即为蛋白质与多级孔道金属有机骨架复合物。
14.步骤(1)中所述的核苷酸来源的化合物优选包括但不限于核苷酸和核苷酸盐中的至少一种;
15.所述的核苷酸优选包括但不限于单磷酸腺苷(amp)、单磷酸鸟苷(gmp)、单磷酸胞苷(cmp)、单磷酸尿苷(ump)、二磷酸腺苷(adp)、三磷酸腺苷(atp)、二磷酸胞苷(cdp)、三磷酸鸟苷(gtp)、单磷酸脱氧腺苷(damp)、单磷酸脱氧鸟苷(dgmp)、二磷酸脱氧腺苷(dadp)和单磷酸脱氧胞苷(dcmp)中的至少一种;
16.所述的核苷酸盐优选包括但不限于单磷酸腺苷二钠盐(amp
·
na2)、单磷酸鸟苷二钠盐(gmp
·
na2)、单磷酸胞苷二钠盐(cmp
·
na2)、单磷酸尿苷二钠盐(ump
·
na2)、二磷酸腺苷二钠盐(adp
·
na2)、单磷酸脱氧腺苷二钠盐(damp
·
na2)、单磷酸脱氧鸟苷二钠盐(dgmp
·
na2)、单磷酸脱氧胞苷二钠盐(dcmp
·
na2)、单磷酸腺苷单钠盐(amp
·
na)、单磷酸鸟苷单钠盐(gmp
·
na2)、单磷酸腺苷二钾盐(amp
·
k2)、单磷酸脱氧腺苷二钾盐(damp
·
k2)和单磷酸鸟苷二钾盐(gmp
·
k2)中的至少一种。
17.所述的核苷酸来源的化合物更优选为单磷酸腺苷(amp)、单磷酸腺苷二钠盐(amp
·
na2)、单磷酸鸟苷二钠盐(gmp)、二磷酸脱氧腺苷(dadp)、单磷酸脱氧腺苷二钾盐(damp
·
k2)和单磷酸胞苷二钠盐(cmp)中的至少一种。
18.步骤(1)中所述的蛋白质优选包括但不限于酶、绿色荧光蛋白、免疫球蛋白和抗体中的至少一种。
19.所述的酶优选包括但不限于细胞色素c、细胞色素p450、辣根过氧化物酶、乙醇脱氢酶、脂肪酶、乙酰胆碱酯酶、漆酶、酪氨酸酶、葡萄糖脱氢酶、葡萄糖氧化酶、胰蛋白酶、枯草杆菌蛋白酶、碳酸酐酶、醛酮还原酶、淀粉酶、蔗糖酶、超氧化物歧化酶、脲酶和过氧化氢酶中的至少一种。
20.所述的脂肪酶优选为猪胰脂肪酶和南极假丝酵母脂肪酶b中的至少一种。
21.所述的免疫球蛋白优选为血清免疫球蛋白g。
22.所述的蛋白质更优选为葡萄糖氧化酶、辣根过氧化物酶、蔗糖酶、猪胰脂肪酶、酪氨酸酶、南极假丝酵母脂肪酶b、细胞色素c和血清免疫球蛋白g中的至少一种。
23.步骤(1)中所述的蛋白质的分子量优选为5~1000kda;进一步优选为10~300kda;
更优选为13~150kda。
24.步骤(1)中所述的核苷酸来源的化合物与蛋白质优选按摩尔比1~100000:1~10000计算。
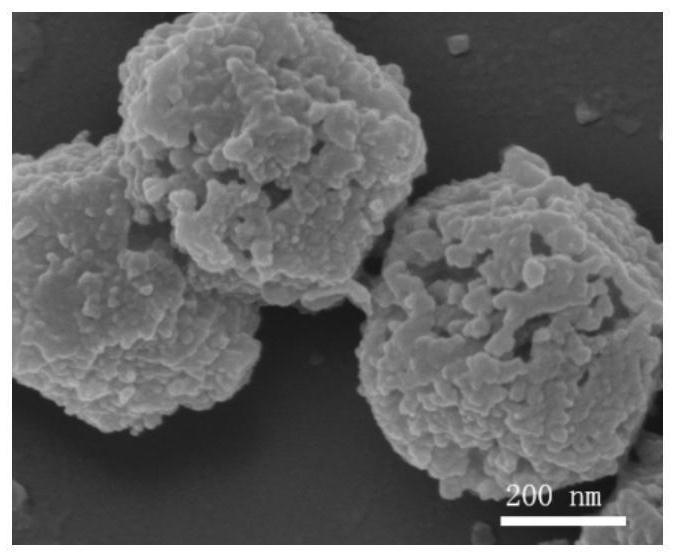
25.步骤(1)中所述的溶剂优选为水、缓冲液、二甲基亚砜、叔丁醇、叔戊醇、乙腈、丙酮、甲醇、乙醇和正己烷中的至少一种;更优选为水、二甲基亚砜、乙腈和叔丁醇中的至少一种。
26.步骤(2)中所述的锌盐优选为可溶性锌盐;所述的可溶性锌盐优选包括但不限于乙酸锌、氯化锌、硫酸锌和水合硝酸锌中的至少一种。
27.步骤(2)中所述的锌盐溶液的溶剂优选为水、缓冲液、二甲基亚砜、叔丁醇、叔戊醇、乙腈、丙酮、甲醇、乙醇和正己烷中的至少一种;更优选为水、二甲基亚砜、乙腈和叔丁醇中的至少一种。
28.所述的缓冲液优选为磷酸盐缓冲液和醋酸盐缓冲液中的至少一种。
29.所述的缓冲液的优选浓度为10~50mm、ph为6.0~7.0。
30.步骤(2)中所述的锌盐溶液中的锌离子浓度优选为1~1000mm;进一步优选为1~800mm;更优选为80~300mm。
31.步骤(2)中所述的蛋白质与锌盐溶液中的锌离子的质量比优选按0.00001~4:1计算;进一步优选按0.015~4:1计算;更优选按0.015:1、0.025:1、0.06:1、0.1:1、0.2:1、0.5:1、1:1、2:1或4:1计算。
32.步骤(2)中所述的搅拌优选为磁力搅拌;所述的磁力搅拌的转速优选为400rpm。
33.步骤(2)中所述的反应的温度优选为0~50℃,时间为0.01~24h;更优选为20~25℃、10~20min。
34.步骤(3)中所述的离心的条件优选为:8000~13000rpm条件下离心0.5~5min;更优选为10000~12000rpm条件下离心1~5min。
35.步骤(3)中所述的洗涤的试剂优选为水、缓冲液、二甲基亚砜、叔丁醇、叔戊醇、乙腈、丙酮、甲醇、乙醇和正己烷中的至少一种;更优选为水、二甲基亚砜、乙腈和叔丁醇中的至少一种。
36.所述的水优选为去离子水。
37.所述的缓冲液优选为磷酸盐缓冲液和醋酸盐缓冲液中的至少一种。
38.所述的缓冲液的优选浓度为10~50mm、ph为6.0~7.0。
39.步骤(3)中所述的洗涤的次数优选为至少2次;更优选为2次。
40.步骤(3)中所述的分散剂优选包括但不限于水、缓冲液、二甲基亚砜、叔丁醇、叔戊醇、乙腈、丙酮、甲醇、乙醇和正己烷中的至少一种;更优选为水、二甲基亚砜、乙腈和叔丁醇中的至少一种。
41.步骤(4)中所述的有机配体优选包括但不限于2
‑
甲基咪唑、4
‑
甲基咪唑、1
‑
甲基咪唑、苯并咪唑和咪唑中的至少一种。
42.步骤(4)中所述的有机配体溶液中的有机配体的浓度优选为1~10m;更优选为1.5~4.6m。
43.步骤(4)中所述的有机配体溶液的溶剂优选为水、缓冲液、二甲基亚砜、叔丁醇、叔戊醇、乙腈、丙酮、甲醇、乙醇和正己烷中的至少一种;更优选为水、二甲基亚砜、乙腈和叔丁
醇中的至少一种。
44.所述的缓冲液优选为磷酸盐缓冲液和醋酸盐缓冲液中的至少一种。
45.所述的缓冲液的优选浓度为10~50mm、ph为6.0~7.0。
46.步骤(4)中所述的核苷酸来源的化合物与有机配体优选按摩尔比1:4~320计算;进一步优选为1:40~160;更优选按1:80或1:100计算。
47.步骤(4)中所述的搅拌优选为磁力搅拌;所述的磁力搅拌的转速优选为400rpm。
48.步骤(4)中所述的反应的温度优选为0~50℃、时间为0.01~24h;进一步优选温度为4~35℃、时间为0.01~4h;更优选温度为25℃、时间为15~40min。
49.步骤(5)中所述的离心的条件优选为:8000~13000rpm条件下离心0.5~5min;更优选为10000~12000rpm条件下离心1~5min。
50.步骤(5)中所述的洗涤的试剂优选为水、缓冲液、二甲基亚砜、叔丁醇、叔戊醇、乙腈、丙酮、甲醇、乙醇和正己烷中的至少一种。
51.所述的水优选为去离子水。
52.所述的缓冲液优选为磷酸盐缓冲液和醋酸盐缓冲液中的至少一种。
53.所述的缓冲液的优选浓度为10~50mm、ph为6.0~7.0。
54.步骤(5)中所述的洗涤的次数优选为至少2次;更优选为2次。
55.步骤(5)中所述的干燥优选为冷冻干燥;所述的冷冻干燥的时间优选为6~48h;进一步优选为8~36h;更进一步优选为8~24h;最优选为8h、10h、12h或24h。
56.一种蛋白质与多级孔道金属有机骨架复合物,通过上述制备方法制备得到。
57.所述的蛋白质与多级孔道金属有机骨架复合物含有微孔介孔多级孔道结构;所述的蛋白质与多级孔道金属有机骨架复合物的介孔孔径一般为20~50nm;介孔孔径为2~10nm时性能更佳。
58.所述的蛋白质与多级孔道金属有机骨架复合物在生物催化剂的构建、催化,以及免疫领域中的应用。所述的免疫领域优选为免疫球蛋白和抗体复合物的构建领域。
59.本发明具有如下优点及有益效果:
60.1、本发明所提供的蛋白质与多级孔道金属有机骨架复合物的制备方法操作简便,反应条件温和,稳定性好,蛋白的生物活性得到较大程度保留。
61.2、本发明的原理为:蛋白质、锌离子、核苷酸来源的化合物在溶液条件下自组装形成无定型的蛋白质
‑
金属核苷酸复合物。将上述得到的物质分散到有机配体溶液中,有机配体可不断取代原有核苷酸的位置,形成杂化配位结构,获得多级孔道金属有机骨架复合物。在锌离子与核苷酸原位自组装过程中引入蛋白质,进行上述操作,即可得到蛋白质与多级孔道金属有机骨架复合物。
62.3、本发明蛋白质与多级孔道金属有机骨架复合物的制备方法及其所得到的产物具有如下优点及有益效果:
63.(1)本发明通过竞争取代的方法制备具有微孔介孔的多级孔道金属有机骨架复合物及蛋白质
‑
多级孔道金属有机骨架复合物,方法简便高效。
64.(2)本发明所制备的蛋白质与多级孔道金属有机骨架复合物,显著提高了酶的催化活性,提升了其在工业催化条件下的稳定性。
65.(3)本发明所制备的蛋白质
‑
多级孔道金属有机骨架复合物在酸性条件下具有良
好稳定性,拓宽了其应用范围。
附图说明
66.图1为实施例1中所得多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物的扫描电镜图。
67.图2为实施例1中所得多级孔道金属有机骨架
‑
葡萄糖氧化酶(mnf@gox)与多级孔道金属有机骨架复合物(mnf)的xrd图谱。
68.图3为实施例1中所得多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物(mnf@gox)、微孔金属有机框架材料
‑
葡萄糖氧化酶复合物(zif
‑
8@gox)和游离葡萄糖氧化酶(gox)的活性对比图。
69.图4为实施例1中多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物(mnf@gox)和游离葡萄糖氧化酶(gox)在有机溶剂条件下处理后的活性保留对比图。
70.图5为实施例2中所得多级孔道金属有机骨架
‑
蔗糖酶复合物(mnf@inv)、微孔金属有机框架材料
‑
蔗糖酶复合物(zif
‑
8@inv)和游离蔗糖酶(inv)的活性对比图。
71.图6为实施例2中多级孔道金属有机骨架
‑
蔗糖酶复合物(mnf@inv)和游离蔗糖酶(inv)在高温条件下处理后的活性保留对比图。
72.图7为实施例3中所得多级孔道金属有机骨架
‑
猪胰脂肪酶复合物(mnf@ppl)、微孔金属有机框架材料
‑
猪胰脂肪酶复合物(zif
‑
8@ppl)和游离猪胰脂肪酶(ppl)的活性对比图。
73.图8为实施例3中多级孔道金属有机骨架
‑
猪胰脂肪酶复合物(mnf@ppl)和游离猪胰脂肪酶(ppl)在蛋白变性剂(尿素)条件下处理后的活性保留对比图。
74.图9为实施例4中所得多级孔道金属有机骨架
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物
75.(mnf@gox
‑
hrp)、微孔金属有机框架材料
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物(zif
‑
8@gox
‑
hrp)和游离葡萄糖氧化酶
‑
辣根过氧化物酶混合溶液(gox
‑
hrp)的活性对比图。
76.图10为实施例4中多级孔道金属有机骨架
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物(mnf@gox
‑
hrp)和游离葡萄糖氧化酶
‑
辣根过氧化物酶混合溶液(gox
‑
hrp)在蛋白酶条件下处理后的活性保留对比图。
77.图11为实施例5中蛋白质与多级孔道金属有机骨架复合物经ph5.0酸性溶液处理不同时间的扫描电镜图;其中,图a为多级孔道金属有机骨架
‑
血清免疫球蛋白复合物(mnf@igg)经ph5.0酸性溶液处理后的扫描电镜图;图b为微孔金属有机框架材料
‑
血清免疫球蛋白复合物(zif
‑
8@igg)经ph5.0酸性溶液处理后的扫描电镜图。
78.图12为实施例6中利用gmp所得多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物的扫描电镜图。
79.图13为实施例6中利用gmp所得多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物(mnf@gox)、微孔金属有机框架材料
‑
葡萄糖氧化酶复合物(zif
‑
8@gox)和游离葡萄糖氧化酶(gox)的活性对比图。
80.图14为实施例7中利用cmp所得多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物的扫
描电镜图。
81.图15为实施例7中利用cmp所得多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物(mnf@gox)、微孔金属有机框架材料
‑
葡萄糖氧化酶复合物(zif
‑
8@gox)和游离葡萄糖氧化酶(gox)的活性对比图。
具体实施方式
82.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
83.实施例中所用的有机溶剂若非特殊说明,均为分析纯级有机溶剂。若无特别说明,实施例中所用的试剂或原料均可通过市购得到。
84.所述的葡萄糖氧化酶的分子量为150kda,购于sigma
‑
aldrich公司;蔗糖酶的分子量为56kda,购于sigma
‑
aldrich有限公司;猪胰脂肪酶的分子量为30kda,购于sigma
‑
aldrich公司;辣根过氧化物酶的分子量为40kda,购于sigma
‑
aldrich公司;血清免疫球蛋白g(igg)的分子量为150kda,购于sigma
‑
aldrich公司;酪氨酸酶的分子量为75kda,购于sigma
‑
aldrich公司;南极假丝酵母脂肪酶b的分子量为33kda,购于sigma
‑
aldrich公司;细胞色素c的分子量为13kda,购于sigma
‑
aldrich公司。
85.实施例1
86.(1)分别以水为溶剂配制浓度为160mm的乙酸锌溶液,32mm的单磷酸腺苷二钠盐(amp
·
na2)溶液、2.3m的2
‑
甲基咪唑溶液、1mg/ml葡萄糖氧化酶溶液;
87.(2)取步骤(1)中amp
·
na2溶液0.5ml,加入葡萄糖氧化酶溶液0.05ml、去离子水0.325ml混合均匀,得到含amp
·
na2和葡萄糖氧化酶的混合液;
88.(3)往步骤(2)中所得含amp
·
na2和葡萄糖氧化酶的混合液中加入0.125ml乙酸锌溶液,然后400rpm磁力搅拌,25℃反应10min,获得含有白色半透明凝胶状沉淀的反应液;
89.(4)将步骤(3)的含有白色半透明凝胶状沉淀的反应液取出,12000rpm离心1min,取凝胶状沉淀,去离子水洗涤2次,加入去离子水分散成0.75ml分散液,使分散均匀,得到分散液;
90.(5)往步骤(4)中所得分散液中加入2
‑
甲基咪唑溶液0.25ml,然后400rpm磁力搅拌,25℃反应15min,获得含有白色沉淀颗粒的反应溶液;
91.(6)将步骤(5)的含有白色沉淀颗粒的反应溶液取出,12000rpm离心1min,取沉淀颗粒物,去离子水洗涤2次,冷冻干燥12h,所得粉末即为多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物。
92.本实施例所得多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物的扫描电镜图如图1所示,为粒径500
‑
700nm的十二面体结构,可以看出酶蛋白没有明显影响最终所形成的多级孔道金属有机骨架
‑
酶复合物的形貌。多级孔道金属有机骨架复合物(mnf)的制备方法与上述多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物(mnf@gox)的制备方法基本相同,不同之处在于,多级孔道金属有机骨架复合物(mnf)制备过程中不加入葡萄糖氧化酶溶液。所得到的多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物(mnf@gox)与多级孔道金属有机骨架复合物(mnf)的xrd图如图2所示,可以看出,酶蛋白的掺杂不影响多级孔道金属有机骨架
‑
酶复合物本身的晶体结构。
93.对本实施例所制备的多级孔道金属有机骨架
‑
酶复合物的活性进行测定。具体操作步骤如下:分别向50μl多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物(mnf@gox)、等量微孔金属有机框架材料
‑
葡萄糖氧化酶复合物(zif
‑
8@gox)(制备方法:以水为溶剂,配制0.5ml含20mm乙酸锌和100μg/ml葡萄糖氧化酶的混合液,加入0.5ml 2.3m的2
‑
甲基咪唑溶液,400rpm磁力搅拌30min,12000rpm离心1min收集沉淀,去离子水清洗2次,最终沉淀用1ml去离子水分散,获得zif
‑
8@gox的分散液)和等量游离葡萄糖氧化酶(gox)溶液(50μg/ml)中加入含100μl 2.8mg/ml abts、50μl 1mg/ml辣根过氧化物酶和800μl 100mm葡萄糖的pbs缓冲液(50mm、ph 7.4)快速混匀,用紫外分光光度计测定检测1min内415nm吸光值的动态变化。实验结果如图3所示。
94.由图3可知,多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物活性显著高于等量的微孔金属有机框架材料
‑
葡萄糖氧化酶复合物的活性,活性提高了30倍以上。
95.将本实施例所制得的多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物和等量游离葡萄糖氧化酶分散到250μl的水溶液中,加入250μl有机溶剂(分别为二甲基亚砜、丙酮、甲醇和乙醇)混合均匀,50℃水浴加热30min。分别取50μl有机溶剂处理后的多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物分散液和等量处理后的游离葡萄糖氧化酶溶液加入含100μl2.8mg/ml abts、50μl 1mg/ml辣根过氧化物酶和800μl 100mm葡萄糖的pbs缓冲液(50mm、ph=7.4)快速混匀,用紫外分光光度计测定检测1min内415nm吸光值的动态变化。多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物(mnf@gox)与游离葡萄糖氧化酶(gox)经有机溶剂处理后,活性保留如图4所示。
96.结果可见,游离葡萄糖氧化酶分别经二甲基亚砜、丙酮、甲醇、乙醇处理后,因蛋白结构变性,活性中心结构破坏,均有70%以上的表观活力损失(甲醇、乙醇中游离葡萄糖氧化酶完全失活),而多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物活力经有机溶剂处理后仍然能保持60%~80%的表观活力。表明多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物的有机溶剂耐受性较游离葡萄糖氧化酶明显提高。
97.实施例2
98.(1)分别以水为溶剂配制浓度为160mm的乙酸锌溶液,32mm的单磷酸腺苷二钠盐(amp
·
na2)溶液、2.3m的2
‑
甲基咪唑溶液、1mg/ml蔗糖酶溶液;
99.(2)取步骤(1)中amp
·
na2溶液0.5ml,加入蔗糖酶溶液0.05ml、去离子水0.325ml混合均匀,得到含amp
·
na2和蔗糖酶的混合液;
100.(3)往步骤(2)中所得amp
·
na2和蔗糖酶的混合液中加入0.125ml乙酸锌溶液,然后400rpm磁力搅拌,25℃反应10min,获得含有白色半透明凝胶状沉淀的反应液;
101.(4)将步骤(3)的含有白色半透明凝胶状沉淀的反应液取出,12000rpm离心1min,取凝胶状沉淀,去离子水洗涤2次,加入去离子水分散成0.75ml分散液,使分散均匀,得到分散液;
102.(5)往步骤(4)中所得分散液中加入2
‑
甲基咪唑溶液0.25ml,然后400rpm磁力搅拌,25℃反应15min,获得含有白色沉淀颗粒的反应溶液;
103.(6)将步骤(5)的含有白色沉淀颗粒的反应溶液取出,12000rpm离心1min,取沉淀颗粒物,去离子水洗涤2次,冷冻干燥12h,所得粉末即为多级孔道金属有机骨架
‑
蔗糖酶复合物。
104.对本实施例所制备的多级孔道金属有机骨架
‑
蔗糖酶复合物的活性进行测定。具体操作步骤如下:分别向100μl多级孔道金属有机骨架
‑
蔗糖酶复合物(mnf@inv)、等量微孔金属有机框架材料
‑
蔗糖酶复合物(zif
‑
8@inv)(制备方法:以水为溶剂,配制0.5ml含20mm乙酸锌和100μg/ml蔗糖酶的混合液,加入0.5ml 2.3m的2
‑
甲基咪唑溶液,400rpm磁力搅拌30min,12000rpm离心1min收集沉淀,去离子水清洗2次,最终沉淀用1ml去离子水分散,获得zif
‑
8@inv的分散液)和等量游离蔗糖酶(inv)溶液(50μg/ml)中加入含900μl100mm蔗糖的pbs缓冲液(50mm,ph=7.4)快速混匀,常温静置反应5min,而后沸水浴1min将酶灭活停止反应,得反应液;取0.5ml反应液和1ml 0.1m 3,5
‑
二硝基水杨酸溶液混合均匀,沸水浴5min后加入去离子水稀释到5ml,用紫外分光光度计测定检测5min内540nm吸光值的变化。
105.实验结果如图5所示。由图5可知,多级孔道金属有机骨架
‑
蔗糖酶复合物活性显著高于等量的微孔金属有机框架材料
‑
蔗糖酶复合物,活性提高了40倍以上。多级孔道金属有机骨架
‑
蔗糖酶复合物活性的提高,与多级孔道金属有机骨架复合物具有更多的腔体结构,传质阻力小,使包埋在其中的酶分子更容易与底物分子接触有关。
106.将本实施例所制得的多级孔道金属有机骨架
‑
蔗糖酶复合物和等量游离蔗糖酶(inv)分散到500μl的水溶液中,65℃水浴加热30min。分别取100μl高温处理后的多级孔道金属有机骨架
‑
蔗糖酶复合物分散液和等量处理后的游离蔗糖酶溶液加入含900μl 100mm蔗糖的pbs(50mm、ph=7.4)缓冲液快速混匀,常温静置反应5min,而后沸水浴1min将酶灭活停止反应,得反应液。取0.5ml反应液和1ml、0.1m 3,5
‑
二硝基水杨酸溶液混合均匀,沸水浴5min后加入去离子水稀释到5ml,用紫外分光光度计测定检测5min内540nm吸光值的变化。通过吸光值与时间的斜率比较酶活。
107.多级孔道金属有机骨架
‑
蔗糖酶复合物(mnf@inv)与游离蔗糖酶(inv)经高温处理后,活性保留如图6所示。结果可见游离蔗糖酶经高温处理因蛋白结构变性,活性中心结构破坏,80%以上的表观活力损失,而多级孔道金属有机骨架
‑
蔗糖酶复合物活力经高温处理后仍然能保持50%的表观活力,表明多级孔道金属有机骨架
‑
蔗糖酶复合物的热稳定性较游离蔗糖酶明显提高。
108.实施例3
109.(1)分别以水为溶剂配制浓度为160mm的乙酸锌溶液,32mm的单磷酸腺苷二钠盐(amp
·
na2)溶液、2.3m的2
‑
甲基咪唑溶液、2mg/ml猪胰脂肪酶溶液;
110.(2)取步骤(1)中amp
·
na2溶液0.5ml,加入猪胰脂肪酶溶液0.05ml、去离子水0.325ml混合均匀,得到含amp
·
na2和猪胰脂肪酶的混合液;
111.(3)往步骤(2)中所得含amp
·
na2和猪胰脂肪酶的混合液中加入0.125ml乙酸锌溶液,然后400rpm磁力搅拌,25℃反应10min,获得白色半透明凝胶状沉淀的反应液;
112.(4)将步骤(3)的含有白色半透明凝胶状沉淀反应液取出,12000rpm离心1min,取凝胶状沉淀,去离子水洗涤2次,加入去离子水分散成0.75ml分散液,使分散均匀,得到分散液;
113.(5)往步骤(4)中所得分散液中加入2
‑
甲基咪唑溶液0.25ml,然后400rpm磁力搅拌,25℃反应15min,获得含有白色沉淀颗粒的反应溶液;
114.(6)将步骤(5)的含有白色沉淀颗粒的反应溶液取出,12000rpm离心1min,取沉淀颗粒物,去离子水洗涤2次,冷冻干燥24h,所得粉末即为多级孔道金属有机骨架
‑
猪胰脂肪
酶复合物。
115.对本实施例所制备的多级孔道金属有机骨架
‑
猪胰脂肪酶复合物的活性进行测定。具体操作步骤如下:将3.5μl对硝基苯酚丁酸酯溶入0.1ml乙腈中,取上述溶液均匀分散到9.9ml含0.125g triton x
‑
100的磷酸缓冲液(25mm,ph 7.0)中,配制成底物溶液。分别向100μl多级孔道金属有机骨架
‑
猪胰脂肪酶复合物(mnf@ppl)、等量微孔金属有机框架材料
‑
猪胰脂肪酶复合物(zif
‑
8@ppl)(制备方法:配制0.5ml含20mm乙酸锌和200μg/ml猪胰脂肪酶的混合液,加入0.5ml 2.3m的2
‑
甲基咪唑溶液,400rpm磁力搅拌30min,12000rpm离心1min收集沉淀,去离子水清洗2次,最终沉淀用1ml去离子水分散,获得zif
‑
8@ppl的分散液)和等量游离猪胰脂肪酶(ppl)溶液(100μg/ml)中加入900μl含0.035μl对硝基苯酚丁酸酯的水溶液中快速混匀,常温静置反应20min,用紫外分光光度计测定检测20min内348nm吸光值的变化。
116.实验结果如图7所示。由图7可知,多级孔道金属有机骨架
‑
猪胰脂肪酶复合物活性显著高于等量的微孔金属有机框架材料
‑
猪胰脂肪酶复合物,活性提高了5倍以上。
117.将本实施例所制得的多级孔道金属有机骨架
‑
猪胰脂肪酶复合物和等量游离猪胰脂肪酶分散到1ml的尿素溶液(2m)中,50℃水浴加热30min。将35μl对硝基苯酚丁酸酯溶入1ml乙腈中,取上述溶液0.1ml均匀分散到9.9ml含0.125g triton x
‑
100的磷酸缓冲液(25mm,ph=7.0)中,配制成底物溶液。分别取100μl尿素处理后的多级孔道金属有机骨架
‑
猪胰脂肪酶复合物分散液和等量处理后的游离猪胰脂肪酶溶液加入900μl含0.035μl对硝基苯酚丁酸酯的水溶液中快速混匀,常温静置反应20min,用紫外分光光度计测定检测20min内348nm吸光值的变化。
118.多级孔道金属有机骨架
‑
猪胰脂肪酶复合物(mnf@ppl)与游离猪胰脂肪酶(ppl)经蛋白变性剂(尿素)处理后,活性保留如图8所示。结果可见游离猪胰脂肪酶经尿素处理后损失65%以上的表观活力,而多级孔道金属有机骨架
‑
猪胰脂肪酶复合物活力经有机溶剂处理后仍然能保持85%以上的表观活力。
119.实施例4
120.(1)分别以水为溶剂配制浓度为160mm的乙酸锌溶液、32mm的单磷酸腺苷二钠盐(amp
·
na2)溶液、2.3m的2
‑
甲基咪唑溶液、1mg/ml葡萄糖氧化酶溶液、1mg/ml辣根过氧化物酶溶液;
121.(2)取步骤(1)中amp
·
na2溶液0.5ml,加入葡萄糖氧化酶溶液0.05ml、辣根过氧化物酶溶液0.2ml、去离子水0.125ml混合均匀,得到含amp
·
na2、葡萄糖氧化酶和辣根过氧化物酶的混合液;
122.(3)往步骤(2)中所得amp
·
na2、葡萄糖氧化酶和辣根过氧化物酶的混合液中加入0.125ml乙酸锌溶液,然后400rpm磁力搅拌,25℃反应10min,获得含有白色半透明凝胶状沉淀的反应液;
123.(4)将步骤(3)的反应液取出,12000rpm离心1min,取凝胶状沉淀,去离子水洗涤2次,加入去离子水分散成0.75ml分散液,使分散均匀,得到分散液;
124.(5)往步骤(4)中所得分散液中加入2
‑
甲基咪唑溶液0.25ml,然后400rpm磁力搅拌,25℃反应15min,获得含有白色沉淀颗粒的反应溶液。
125.(6)将步骤(5)的反应溶液取出,12000rpm离心1min,取沉淀颗粒物,去离子水洗涤
2次,冷冻干燥10h,所得粉末即为多级孔道金属有机骨架
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物。
126.对本实施例所制备的多级孔道金属有机骨架
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物的活性进行测定。具体操作步骤如下:分别将50μl多级孔道金属有机骨架
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物(mnf@gox
‑
hrp)、等量微孔金属有机框架材料
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物(zif
‑
8@gox
‑
hrp)(制备方法:配制0.5ml含20mm乙酸锌和100μg/ml葡萄糖氧化酶、100μg/ml辣根过氧化物酶的混合液,加入0.5ml 2.3m的2
‑
甲基咪唑溶液,400rpm磁力搅拌30min,12000rpm离心1min,收集沉淀,去离子水清洗2次,最终沉淀用1ml去离子水分散,获得zif
‑
8@gox
‑
hrp的分散液)和等量游离葡萄糖氧化酶
‑
辣根过氧化物酶混合溶液(gox
‑
hrp)(两种酶的浓度均为50μg/ml)加入含100μl 2.8mg/ml abts和850μl 100mm葡萄糖的pbs缓冲液(50mm,ph=7.4)快速混匀,用紫外分光光度计测定检测1min内415nm吸光值的动态变化。
127.实验结果如图9所示。由图9可知,多级孔道金属有机骨架
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物活性显著高于等量的微孔金属有机框架材料
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物的活性,活性提高了7倍以上。本实施例表明多级孔道金属有机骨架复合物也可用于双酶至多酶的固定化,进一步拓展了其应用范围。
128.将本实施例所制得的多级孔道金属有机骨架
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物和等量游离葡萄糖氧化酶
‑
辣根过氧化物酶混合物分散到1ml 1mg/ml的木瓜蛋白酶溶液中混合均匀,50℃水浴加热30min。分别取50μl木瓜蛋白酶处理后的多级孔道金属有机骨架
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物分散液和等量木瓜蛋白酶处理后的游离葡萄糖氧化酶
‑
辣根过氧化物酶混合溶液(两种酶的浓度均为50μg/ml)加入含100μl 2.8mg/ml abts和850μl100mm葡萄糖的pbs缓冲液(50mm,ph=7.4)快速混匀,用紫外分光光度计测定检测1min内415nm吸光值的动态变化。
129.多级孔道金属有机骨架
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物(mnf@gox
‑
hrp)与游离葡萄糖氧化酶
‑
辣根过氧化物酶混合溶液(gox
‑
hrp)经木瓜蛋白酶处理后,活性保留如图10所示。结果可见游离葡萄糖氧化酶
‑
辣根过氧化物酶经木瓜蛋白酶处理因蛋白结构被水解,损失90%以上的表观活力,而多级孔道金属有机骨架
‑
葡萄糖氧化酶
‑
辣根过氧化物酶复合物活力经蛋白酶处理后仍然能保持70%以上的表观活力。
130.实施例5
131.(1)分别以水为溶剂配制浓度为160mm的乙酸锌溶液,32mm的单磷酸腺苷二钠盐(amp
·
na2)溶液、2.3m的2
‑
甲基咪唑溶液、1mg/ml血清免疫球蛋白g(igg)溶液。
132.(2)取步骤(1)中amp
·
na2溶液0.5ml,加入血清免疫球蛋白溶液0.05ml、去离子水0.325ml混合均匀,得到含amp
·
na2和血清免疫球蛋白的混合液;
133.(3)往步骤(2)中所得含amp
·
na2和血清免疫球蛋白的混合液中加入0.125ml乙酸锌溶液,然后400rpm磁力搅拌反应,25℃反应10min,获得含有白色半透明凝胶状沉淀的反应液;
134.(4)将步骤(3)的含有白色半透明凝胶状沉淀的反应液取出,12000rpm离心1min,取凝胶状沉淀,去离子水洗涤2次,加入去离子水分散成0.75ml分散液,使分散均匀,得到分散液;
135.(5)往步骤(4)中所得分散液中加入2
‑
甲基咪唑溶液0.25ml,然后400rpm磁力搅拌反应,25℃反应15min,获得含有白色沉淀颗粒的反应溶液;
136.(6)将步骤(5)的含有白色沉淀颗粒的反应溶液取出,12000rpm离心1min,取沉淀颗粒物,去离子水洗涤2次,冷冻干燥12h,所得粉末即为多级孔道金属有机骨架
‑
血清免疫球蛋白复合物。
137.本实施例所得多级孔道金属有机骨架
‑
血清免疫球蛋白复合物(mnf@igg)和微孔金属有机框架材料
‑
血清免疫球蛋白复合物(zif
‑
8@igg)分别经ph 5.0的酸性溶液(50mm醋酸盐缓冲液)处理后的扫描电镜图如图11所示。可以看出,多级孔道金属有机骨架
‑
血清免疫球蛋白复合物经酸性条件处理120min后仍能较完整的保持缺陷型十二面体晶体的结构(图11a),而微孔金属有机框架材料
‑
血清免疫球蛋白复合物经酸性条件处理30min后十二面体晶体结构完全破坏(图11b)。因此多级孔道金属有机骨架
‑
蛋白复合物较传统金属有机框架材料
‑
蛋白复合物的耐酸性条件的稳定性有明显提高,能在酸性条件下实现对蛋白分子的保护。
138.实施例6
139.(1)分别以水为溶剂配制浓度为80mm的乙酸锌溶液,32mm的单磷酸鸟苷二钠盐(gmp
·
na2)溶液、1.5m的2
‑
甲基咪唑溶液、1mg/ml葡萄糖氧化酶溶液;
140.(2)取步骤(1)中gmp
·
na2溶液0.5ml,加入葡萄糖氧化酶溶液0.05ml、去离子水0.325ml混合均匀,得到含gmp
·
na2和葡萄糖氧化酶的混合液;
141.(3)往步骤(2)中所得含gmp
·
na2和葡萄糖氧化酶的混合液中加入0.125ml乙酸锌溶液,然后400rpm磁力搅拌,25℃反应20min,获得含有白色松散颗粒状沉淀的反应液;
142.(4)将步骤(3)的含有白色松散颗粒状沉淀的反应液取出,12000rpm离心1min取凝胶状沉淀,去离子水洗涤2次,加入去离子水分散成0.75ml分散液,使分散均匀,得到分散液;
143.(5)往步骤(4)中所得分散液中加入2
‑
甲基咪唑溶液0.25ml,然后400rpm磁力搅拌,25℃反应20min,获得含有白色沉淀颗粒的反应溶液;
144.(6)将步骤(5)的含有白色沉淀颗粒的反应溶液取出,12000rpm离心1min,取沉淀颗粒物,去离子水洗涤2次,冷冻干燥12h,所得粉末即为多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物。
145.本实施例所得多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物的扫描电镜图如图12所示,为粒径500
‑
700nm的十二面体结构,可以看出酶蛋白没有明显影响最终所形成的多级孔道金属有机骨架
‑
酶复合物的形貌。
146.对本实施例所制备的多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物的活性进行测定。具体操作步骤如下:分别向50μl多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物(mnf@gox)、等量微孔金属有机框架材料
‑
葡萄糖氧化酶复合物(zif
‑
8@gox)(制备方法:配制0.5ml含20mm乙酸锌和100μg/ml葡萄糖氧化酶的混合液,加入0.5ml 2.3m的2
‑
甲基咪唑溶液,400rpm磁力搅拌30min,12000rpm离心1min收集沉淀,去离子水清洗2次,最终沉淀用1ml去离子水分散,获得zif
‑
8@gox的分散液)和等量游离葡萄糖氧化酶(gox)溶液(50μg/ml)中加入含100μl 2.8mg/ml abts、50μl 1mg/ml辣根过氧化物酶和800μl、100mm葡萄糖的pbs缓冲液(50mm、ph 7.4)快速混匀,用紫外分光光度计测定检测1min内415nm吸光值的动态变
化。实验结果如图13所示。
147.由图13可知,多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物活性显著高于等量的微孔金属有机框架材料
‑
葡萄糖氧化酶复合物的活性,活性提高了25倍以上。
148.实施例7
149.(1)分别以水为溶剂配制浓度为300mm的乙酸锌溶液、64mm的单磷酸胞苷二钠盐(cmp
·
na2)溶液、4.6m的2
‑
甲基咪唑溶液、2mg/ml葡萄糖氧化酶溶液;
150.(2)取步骤(1)中cmp
·
na2溶液0.5ml、加入葡萄糖氧化酶溶液0.05ml、去离子水0.325ml混合均匀,得到含cmp
·
na2和葡萄糖氧化酶的混合液;
151.(3)往步骤(2)中所得含cmp
·
na2和葡萄糖氧化酶的混合液中加入0.125ml乙酸锌溶液,然后400rpm磁力搅拌,25℃反应10min,获得含有白色松散颗粒状沉淀的反应液;
152.(4)将步骤(3)的含有白色松散颗粒状沉淀的反应液取出,12000rpm离心1min,取凝胶状沉淀,去离子水洗涤2次,加入去离子水分散成0.75ml分散液,使分散均匀,得到分散液;
153.(5)往步骤(4)中所得分散液中加入2
‑
甲基咪唑溶液0.25ml,然后400rpm磁力搅拌,25℃反应40min,获得含有白色沉淀颗粒的反应溶液;
154.(6)将步骤(5)的含有白色沉淀颗粒的反应溶液取出,12000rpm离心1min,取沉淀颗粒物,去离子水洗涤2次,冷冻干燥12h,所得粉末即为多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物。
155.本实施例所得多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物的扫描电镜图如图14所示,为粒径500
‑
700nm的十二面体结构,可以看出酶蛋白没有明显影响最终所形成的多级孔道金属有机骨架
‑
酶复合物的形貌。
156.对本实施例所制备的多级孔道金属有机骨架
‑
酶复合物的活性进行测定。具体操作步骤如下:分别将50μl多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物(mnf@gox)、等量微孔金属有机框架材料
‑
葡萄糖氧化酶复合物(zif
‑
8@gox)(制备方法:配制0.5ml含20mm乙酸锌和100μg/ml葡萄糖氧化酶的混合液,加入0.5ml 2.3m的2
‑
甲基咪唑溶液,400rpm磁力搅拌30min,12000rpm离心1min收集沉淀,去离子水清洗2次,最终沉淀用1ml去离子水分散,获得zif
‑
8@gox的分散液)和等量游离葡萄糖氧化酶(gox)溶液(50μg/ml)加入含100μl、2.8mg/ml abts、50μl 1mg/ml辣根过氧化物酶和800μl、100mm葡萄糖的pbs缓冲液(50mm、ph7.4)快速混匀,用紫外分光光度计测定检测1min内415nm吸光值的动态变化。实验结果如图15所示。
157.由图15可知,多级孔道金属有机骨架
‑
葡萄糖氧化酶复合物活性显著高于等量的微孔金属有机框架材料
‑
葡萄糖氧化酶复合物,活性提高了40倍以上。
158.实施例8
159.(1)分别以叔丁醇为溶剂配制浓度为160mm的硝酸锌溶液,32mm的单磷酸腺苷(amp)溶液、2.3m的2
‑
甲基咪唑溶液、5mg/ml酪氨酸酶溶液;
160.(2)取步骤(1)中amp溶液0.5ml,加入酪氨酸酶溶液0.05ml、叔丁醇0.325ml混合均匀,得到含amp和酪氨酸酶的混合液;
161.(3)往步骤(2)中所得含amp和酪氨酸酶的混合液中加入0.125ml硝酸锌溶液,然后400rpm磁力搅拌,20℃反应15min,获得含有浅棕色沉淀的反应液;
162.(4)将步骤(3)的含有浅棕色沉淀的反应液取出,10000rpm离心2min,取浅棕色沉淀,叔丁醇洗涤2次,加入叔丁醇分散成0.75ml分散液,使分散均匀,得到沉淀分散液;
163.(5)往步骤(4)中所得沉淀分散液中加入2
‑
甲基咪唑溶液0.25ml,然后400rpm磁力搅拌,25℃反应20min,获得含有浅棕色沉淀颗粒的反应溶液;
164.(6)将步骤(5)的含有浅棕色沉淀颗粒的反应溶液取出,10000rpm离心2min,取沉淀颗粒物,去离子水洗涤2次,冷冻干燥10h,所得粉末即为多级孔道金属有机骨架
‑
酪氨酸酶复合物。
165.经检测,所得多级孔道金属有机骨架
‑
酪氨酸酶复合物具有良好的活性性能和有机溶剂、温度、蛋白酶耐受性。
166.实施例9
167.(1)分别以乙腈为溶剂配制浓度为200mm的硫酸锌溶液,40mm的二磷酸脱氧腺苷(dadp)溶液、4m的2
‑
甲基咪唑溶液、2mg/ml南极假丝酵母脂肪酶b溶液;
168.(2)取步骤(1)中dadp溶液0.5ml,加入南极假丝酵母脂肪酶b溶液0.05ml、乙腈0.325ml混合均匀,得到含dadp和南极假丝酵母脂肪酶b的混合液;
169.(3)往步骤(2)中所得含dadp和南极假丝酵母脂肪酶b的混合液中加入0.125ml硫酸锌溶液,然后400rpm磁力搅拌,20℃反应15min,获得含有浅黄色沉淀的反应液;
170.(4)将步骤(3)的含有浅黄色沉淀的反应液取出,10000rpm离心2min,取浅黄色沉淀,乙腈洗涤2次,加入乙腈分散成0.75ml分散液,使分散均匀,得到沉淀分散液;
171.(5)往步骤(4)中所得沉淀分散液中加入2
‑
甲基咪唑溶液0.25ml,然后400rpm磁力搅拌,25℃反应20min,获得含有白色沉淀颗粒的反应溶液;
172.(6)将步骤(5)的含有白色沉淀颗粒的反应溶液取出,10000rpm离心2min,取沉淀颗粒物,去离子水洗涤2次,冷冻干燥8h,所得粉末即为多级孔道金属有机骨架
‑
南极假丝酵母脂肪酶b复合物。
173.经检测,所得多级孔道金属有机骨架
‑
南极假丝酵母脂肪酶b复合物具有良好的活性性能和有机溶剂、温度、蛋白酶耐受性。
174.实施例10
175.(1)分别以二甲基亚砜为溶剂配制浓度为160mm的硝酸锌溶液,32mm的单磷酸腺苷二钾盐(amp
·
k2)溶液、32mm的单磷酸脱氧腺苷二钾盐(damp
·
k2)溶液、2m的2
‑
甲基咪唑溶液、4mg/ml细胞色素c溶液;
176.(2)取步骤(1)中amp
·
k2溶液0.25ml,加入damp
·
k2溶液0.25ml、细胞色素c溶液0.05ml、二甲基亚砜0.325ml混合均匀,得到含amp
·
k2、damp
·
k2和细胞色素c的混合液;
177.(3)往步骤(2)中所得含amp
·
k2、damp
·
k2和细胞色素c的混合液中加入0.125ml硝酸锌溶液,然后400rpm磁力搅拌,20℃反应15min,获得含有浅红色沉淀的反应液;
178.(4)将步骤(3)的含有浅红色沉淀的反应液取出,10000rpm离心5min,取浅红色沉淀,二甲基亚砜洗涤2次,加入二甲基亚砜分散成0.75ml分散液,使分散均匀,得到沉淀分散液;
179.(5)往步骤(4)中所得沉淀分散液中加入2
‑
甲基咪唑溶液0.25ml,然后400rpm磁力搅拌,25℃反应20min,获得含有浅红色沉淀颗粒的反应溶液;
180.(6)将步骤(5)的含有浅红色沉淀颗粒的反应溶液取出,10000rpm离心5min,取沉
淀颗粒物,去离子水洗涤2次,冷冻干燥10h,所得粉末即为多级孔道金属有机骨架
‑
细胞色素c复合物。
181.经检测,所得多级孔道金属有机骨架
‑
细胞色素c复合物具有良好的活性性能和有机溶剂、温度、蛋白酶耐受性。
182.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1