一种体外耳蜗微器官功能单元及其三维构建方法和应用
本发明属于干/前体细胞三维培养领域,具体涉及一种体外耳蜗微器官功能单元的三维构建方法。
背景技术:
根据世界卫生组织2019年的统计数据,目前全球约有4.66亿听力障碍患者,占全部人口的5%以上,而这一数字仍在以每年几十万甚至上百万的速度增长着。在我国,耳聋是仅次于肢体残疾的第二大致残疾病,在影响患者生活质量的同时也给家庭和社会带来了沉重的负担。目前的研究表明,耳蜗毛细胞和螺旋神经节神经元不可逆性的损伤和缺失是导致感音神经性耳聋的主要原因,因此探索内耳损伤机制和干预措施有望为感音神经性耳聋建立新的生物学治疗方法。
但是,哺乳动物耳蜗结构位于侧颅底深部骨性结构内,难以接近,在体研究困难重重;组织和细胞高度特化,生物学样本获取困难。因此建立可靠的体外研究模型对于感音神经性耳聋发病机制和干预措施的研究极为重要。
2003年李华伟教授了首次从成年鼠前庭感觉上皮中分离出了内耳干细胞(li,h.,liu,h.&heller,s.pluripotentstemcellsfromtheadultmouseinnerear.natmed9,1293-1299.),为体外构建内耳微器官奠定了基础。但是传统悬浮培养将内耳前体细胞培养在悬浮培养皿中,缺乏细胞外基质的作用,导致内耳前体细胞生存期短、增殖能力差、分化结构单一不规则的缺点(xia,m.,chen,y.,he,y.,li,h.&li,w.activationoftherhoa-yap-beta-cateninsignalingaxispromotestheexpansionofinnerearprogenitorcellsin3dculture.stemcells.)。近年来随着三维培养技术的进步,多种组织,如肝、胰腺、小肠和胃等的前体/干细胞被陆续培养为相应的类器官。利用胚胎/诱导多能干细胞所培育的耳蜗类器官,经鉴定其所含毛细胞为前庭感觉器属性(koehler,k.r.etal.generationofinnerearorganoidscontainingfunctionalhaircellsfromhumanpluripotentstemcells.natbiotechnol35,583-589.)。尽管有研究通过分离新生鼠的耳蜗感觉上皮前体细胞通过三维培养的方式建立的内耳感觉上皮的类器官(mclean,w.j.etal.clonalexpansionoflgr5-positivecellsfrommammaliancochleaandhigh-puritygenerationofsensoryhaircells.cellrep18,1917-1929.),形成了具备相关耳蜗毛细胞标志物阳性的类似耳蜗感觉上皮的结构。
目前面临着一些未解决的问题:体内耳蜗的毛细胞是与螺旋神经元形成突触连接,以此完成声信号的编码和传递,但耳蜗前体细胞只能诱导分化为耳蜗感觉上皮成分,通过耳蜗前体细胞培养的耳蜗类器官只具备单一的类似耳蜗感觉上皮的毛细胞和支持细胞。目前耳蜗类器官中毛细胞形态和功能特性未知,并且缺乏在体接受反馈毛细胞编码声信息的螺旋神经元,不能应用于毛细胞与螺旋神经元之间的突触连接相关研究,以及难以应用于毛细胞再生后听觉功能重建等问题的研究。类似于克服体内再生毛细胞策略实现听觉功能重建的难点:即体内促进毛细胞再生及成熟,并且与螺旋神经元形成有效的突触传递,重建听觉通路。构建具备神经支配的耳蜗微器官的需克服的技术难点在于缺乏共培养体系促进耳蜗类器官细胞定向分化成熟为毛细胞,同时促进螺旋神经元生长并与毛细胞形成突触联系。因此构建听觉微器官,将能为体内毛细胞再生策略实现听觉功能重建提供新思路和为听觉相关研究提供良好的体外研究模型。
技术实现要素:
本发明的目的是提供一种体外耳蜗微器官功能单元的三维构建方法。本发明建立的新的三维培养体系,构建包含感觉上皮中毛细胞和支持细胞成分,同时能够与螺旋神经节神经元建立突触连接——具有神经支配的内耳感觉上皮功能单元,从细胞组成到功能建立模拟内耳感觉上皮,利用该技术,使用促进耳蜗类器官分化和螺旋神经元生长的共性因子,构建具备神经支配的耳蜗微器官结构。研究再生的毛细胞与螺旋神经元形成功能性突触的调控机制,更好的研究内耳发育机制、毛细胞和螺旋神经节神经元损伤机制和干预措施、毛细胞再生调控与听功能重建等一系列的难题。
为实现上述目的,本发明采用如下技术方案:
本发明提供了一种体外耳蜗微器官功能单元的三维构建方法,包括以下步骤:(1)将分离的lgr5阳性耳蜗前体细胞三维培养进行诱导增殖成球,得到耳蜗类器官;(2)三维共培养耳蜗类器官与螺旋神经元,在培养体系因子作用下,形成毛细胞与螺旋神经元连接的结构即为耳蜗微器官单元。
本发明提供的体外耳蜗微器官功能单元的三维构建方法的步骤(1)中,耳蜗类器官为利用三维培养技术诱导lgr5阳性的内耳前体细胞克隆性增殖来源。本发明是用lgr5-egfp-ires-creert2转基因c57bl/6j小鼠进行解剖,取耳蜗感觉上皮,消化为单细胞,采用流式细胞术分选lgr5阳性的耳蜗前体细胞。
本发明提供的体外耳蜗微器官功能单元的三维构建方法的步骤(1)中,将分离的lgr5阳性耳蜗前体细胞与含5vol%的matrigel增殖培养基混悬形成三维培养7-8天,得到耳蜗类器官;其中,每1ml增殖培养基成分为dmem/f-12glutamax培养基配置含有1.25mm的nac、1x的n2、1x的b27、50ng/ml的egf、50ng/ml的bfgf、50ng/ml的igf、3μm的chir99021、10μm的y-27632,待培养到第2天后,将10μmy-27632换为2.5μmlpa,继续培养5-6天。该增殖培养基中采用的nac有抗氧化的作用,有利于长时程培养。y-27632可以促进单细胞的成球,chir99021和lpa可促进内耳前体细胞的增殖成球和长时程培养。其中egf、bfgf和igf为经典培养耳蜗前体细胞体系促进细胞增殖所用的成分。
本发明提供的体外耳蜗微器官功能单元的三维构建方法的步骤(2)中,是用matrigel基质胶包裹耳蜗类器官和螺旋神经元,进行三维共培养。三维共培养时,调整耳蜗类器官和螺旋神经元的位置,使螺旋神经元类似体内环形辐射神经纤维端指向耳蜗类器官,并且显微镜下维持两者环形距离200-300μm。三维共培养的时间优选为30天。
本发明提供的体外耳蜗微器官功能单元的三维构建方法的步骤(2)中,培养体系因子为每1ml的共培养培养基,其成分为dmem/f-12glutamax培养基配置含有1.25mm的nac、1x的n2、1x的b27、10ng/ml的bfgf、0.5μm的a83-01、100ng/ml的shh、1μm的ra以及5μm的ly411575,待培养到第5天后,撤掉ly411575,继续培养。该共培养培养基中采用的bfgf可以维持耳蜗类器官和螺旋神经元的生长活性,ra能够分别促进毛细胞分化和神经生长,shh和a83-01能够促进螺旋神经元的轴突生长,ly411575则促进耳蜗类器官的毛细胞定向分化。考虑到ly411575对螺旋神经元轴突生长的抑制作用,作用短时程即保证类器官毛细胞的分化又不损坏螺旋神经元的生长。
本发明提供了一种体外耳蜗微器官功能单元的三维构建方法构建的耳蜗微器官单元,是将具有感受编码声信号功能的耳蜗类器官毛细胞与接受声信息转化的电信号的螺旋神经元组合在一起,并且具备两种细胞之间的突触连接,形成类似耳蜗的功能组织。
本发明提供的体外耳蜗微器官功能单元的三维构建方法构建的耳蜗微器官单元可以应用在毛细胞再生相关研究、毛细胞损伤保护相关研究、内耳发育相关研究、听觉相关疾病发病机制相关研究、遗传性耳聋基因治疗载体的筛选及相关研究或听觉突触重建相关研究中。
本发明的整体思路如下:一、优化小鼠耳蜗前体细胞来源的耳蜗类器官定向诱导分化为毛细胞的三维培养体系和小鼠螺旋神经元三维培养体系;二、在共性因子作用下,三维共培养耳蜗类器官和螺旋神经元得到耳蜗微器官。其中步骤一通过如下方法实现:(1)解剖分离小鼠耳蜗前体细胞:用lgr5-egfp-ires-creert2转基因c57bl/6j小鼠进行解剖,取耳蜗感觉上皮,消化为单细胞,采用流式细胞术分选lgr5阳性的耳蜗前体细胞。(2)三维培养耳蜗前体细胞形成耳蜗类器官:将分离得到的耳蜗前体细胞与含5vol%的基质胶(matrigel)增殖培养基混悬形成三维培养7-8天,得到耳蜗类器官。(3)促进耳蜗类器官定向分化和成熟体系:将耳蜗类器官进行贴壁三维培养,筛选最佳利于向毛细胞分化和成熟的因子组合。(4)促进螺旋神经元生长和成熟体系:解剖c57bl/6j小鼠,获得螺旋神经元组织,贴壁三维培养,筛选最佳利于螺旋神经元生长和成熟的因子组合。步骤二可以通过如下方法实现:(1)耳蜗类器官分化和成熟体系与螺旋神经元生长和成熟共性体系的确定:将得到的有利于两者生长、分化和成熟的体系进行对比,确立最佳作用的因子的组合方案;(2)共培养耳蜗类器官和螺旋神经元获得耳蜗微器官:取耳蜗类器官与螺旋神经元进行贴壁共培养,基质胶(matrigel)包裹形成三维支架,在培养体系因子作用下,形成毛细胞与螺旋神经元连接的结构即为耳蜗微器官单元。
有益效果:本发明首次利用三维培养技术构建耳蜗微器官,其具备毛细胞与螺旋神经元,其中毛细胞为内耳前体细胞诱导分化而来,耳蜗微器官与体内耳蜗感觉器的组织成分具有高度同源性,并且体外生存时间长。培养方案做到了同时最大化定向诱导耳蜗前体细胞分化为毛细胞和最大化促进螺旋神经元的生长,分化的毛细胞能够分泌神经营养因子,一定程度吸引螺旋神经元的神经纤维的定向生长,成功建立起耳蜗微器官毛细胞与螺旋神经元之间的突触联系。该发明将会应用于体外的内耳发育研究、内耳损伤保护和再生药物及基因筛选、听觉障碍相关疾病模型等应用,有力的推动耳神经疾病的听觉功能的重建研究。成果构建出的耳蜗微器官填补了体外构建整体耳蜗感觉器的空白,使研究水平达到国际领先。
本发明构建的耳蜗微器官,具备突触连接,能够长时程培养;具备良好的三维形态;具备类似体内的毛细胞;具备神经支配。
附图说明
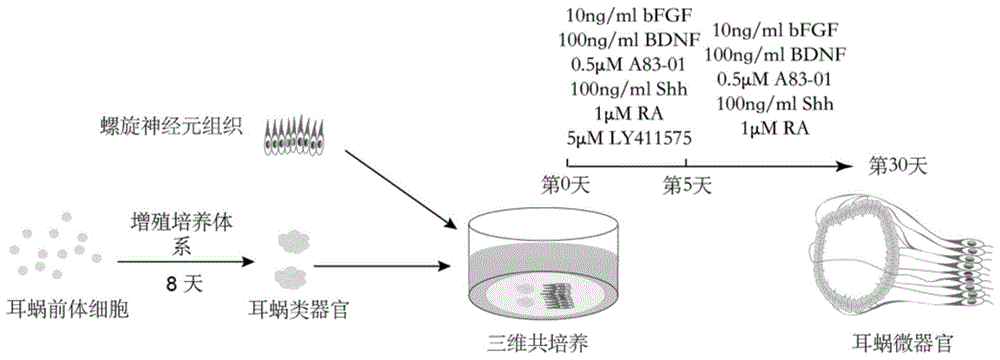
图1:构建微器官的示意流程图,通过三维培养耳蜗前体细胞增殖成耳蜗类器官,与螺旋神经元共培养,通过分布诱导策略构建耳蜗微器官。
图2:各个因子对耳蜗类器官定向分化为毛细胞的作用,具体为添加bfgf和ly411575作用14天,对毛细胞分化和分化过程中凋亡的作用,bfgf可减轻类器官分化过程中的凋亡。myosin7a标记毛细胞,casp3标记凋亡的细胞,e-cadherin标记上皮细胞。比例尺50μm。
图3:各个因子对耳蜗类器官定向分化为毛细胞的作用结果所对应的统计图,即为图2的所对应的统计图。
图4:不同因子对耳蜗类器官向毛细胞分化的荧光图,其中bmp4、ra和ly411575可促进类器官的毛细胞定向转化,myosin7a标记毛细胞,f-actin标记细胞骨架。比例尺50μm。
图5:不同因子对耳蜗类器官向毛细胞分化的荧光图所对应的统计图,即为图4所对应的统计图。
图6:不同因子对耳蜗类器官向毛细胞分化的荧光图所对应的统计图,即为图4所对应的统计图。
图7:各个因子对螺旋神经元组织轴突生长的作用。a图为添加不同因子作用7天,对螺旋神经元轴突生长的作用,其中shh、ra和a83-01可一定程度促进螺旋神经元轴突生长。tuj1标记神经元及纤维。比例尺,300μm。
图8:各个因子对螺旋神经元组织轴突生长的作用结果统计图,即为图7所对应的统计图。
图9:三维共培养耳蜗类器官和螺旋神经元组织的第0天的光镜图。左下侧标注的为螺旋神经元,右侧为耳蜗类器官。比例尺,100μm。
图10:图为培养第16天,耳蜗微器官中标记的毛细胞与标记的螺旋神经元免疫荧光图。a图为整体tuj1阳性神经元与atoh1阳性的毛细胞免疫荧光图。比例尺,100μm。b图为atoh1阳性的耳蜗类器官被神经纤维丝缠绕。比例尺,100μm。c图为atoh1阳性细胞之间有神经丝的渗入。比例尺,25μm。
图11:培养第30天,耳蜗微器官的突触分布情况。a图为atoh1阳性的类器官表面有突触前蛋白ctbp2的分布,并且被神经纤维包绕。比例尺,50μm。b图为a图中的放大图,显示atoh1阳性细胞表面有ctbp2突触前蛋白的分布,并且与tuj1阳性的神经纤维末端接触。
图12:培养第30天,耳蜗微器官的突触分布情况。图a为毛细胞标志物myosin7a阳性细胞表面同时分布毛细胞突触前蛋白ctbp2和神经纤维突触后蛋白psd95。比例尺,25μm。图b和c代表a图中两个区域的放大图,直观显示微器官细胞表面有ctbp2和psd95形成的突触对,代表突触的联系形成。
图13:培养第30天,未共培养的耳蜗类器官和构建的微器官毛细胞表面的突触前蛋白数量统计图。耳蜗微器官的毛细胞突触前蛋白ctbp2数量明显多于未共培养的耳蜗类器官突触前蛋白的数量。
具体实施方式
下面结合具体实施方式,进一步阐述本发明。
下面针对具体实施例对本发明所用到的试剂和实验方法作出更清楚的描述,下述的实施例中所用的实验材料、试剂等,若无特殊说明,均可从商业渠道获取,所有的实验均设置重复三次以上。
1.实验细胞
实验所用动物为c57bl/6j小鼠,lgr5-egfp-ires-creert2转基因小鼠(编号008875)从杰克逊实验室所购买,饲养于复旦大学动物实验中心,从内耳中分离、培养获取内耳前体细胞和螺旋神经元。
2.本发明中的培养体系所用到试剂
dmem/f-12glutamax培养基(thermofisher,10565018),青/链霉素(thermofisher,15140122),n2补充剂(thermofisher,a1370701),b27补充剂(thermofisher,107504044),pbs缓冲液(hyclone,sh30256.01b),胰酶(thermofisher,25200072),胰酶中和剂(thermofisherr002100),戊二醛溶液(sigma,g5882),多聚甲醛(sigma,p6148),表皮生长因子(egf)(peprotech,450-33),碱性成纤维细胞生长因子(bfgf)(peprotech,315-09),胰岛素样生长因子(igf)(peprotech,250-19),shh(peprotech,315-22),chir99021(sigma,s2924),油酰基-l-α-溶血磷脂酸钠盐(lpa)(sigma,7260),维a酸(ra)(sigma,r2625),ly411575(selleck,s2714),y-27632(selleck,s1049),n-乙酰基-l-半胱氨酸(nac)(sigma,a7250),脑源性神经营养因子(bdnf)(peprotech,450-02),a83-01(sigma,sml0788),shh(peprotech,315-22),iwp2(sigma,i0536),bmp4(peprotech,315-27),noggin(peprotech,250-38),cyclopamine(sigma,c4116),tgfβ1(peprotech,100-21),基质胶(matrigel)(corning,354230),小鼠抗β
具体操作技术包括如下步骤(如图1所示)。
1.小鼠耳蜗前体细胞的分离培养
选取lgr5-egfp的出生1-2天的c57乳鼠,在无菌条件下断头,剪开大脑,取出含内耳的颞骨置于冰的pbs缓冲液中,解剖显微镜下分离出耳蜗的基底膜,去除螺旋韧带和上皮附近的间质组织。将分离的耳蜗上皮转移至预热的0.125%的胰酶中消化10min,加入胰酶中和剂终止消化,采用机械法吹打组织,滤过40μm的滤网,得到单细胞。以1000rpm离心6min去除上清,加入培养基,流式细胞术分选lgr5阳性的耳蜗前体细胞。1000rpm离心6min,将得到的细胞与含有5vol%的matrigel的培养基混悬移入悬浮培养板中,以1*105个细胞/600μl的matrigel增殖培养基混合液种植每孔,于恒温培养箱中进行三维培养。
前2天增殖培养基成分为dmem/f-12glutamax培养基配置含有1x的n2、1x的b27、1.25mm的nac、50ng/ml的egf、50ng/ml的bfgf、50ng/ml的igf、3μm的chir99021、10μm的y-27632,后将y-27632改为2.5μm的lpa,继续培养5-6天后,得到耳蜗类器官。
当观察到细胞形成克隆球,第7-8天进行染色鉴定或传代。或用于后续的耳蜗类器官分化实验。
2.筛选耳蜗类器官定向分化为毛细胞类器官方案
为了进一步调控内耳前体细胞向毛细胞分化和成熟,将上述步骤中培养的细胞类器官转移至预冷的pbs中,缓缓吹打清洗细胞克隆球所附着的matrigel,400rpm离心3min。接种于1vol%matrigel包被的培养皿,2min后,吸尽培养基,培养皿冰上放置约1-2min,滴加约100μl的100vol%matrigel充分覆盖细胞形成贴壁的三维环境。
将培养皿放恒温培养箱中约20min,使matrigel充分凝固,加上1ml的基础培养基,其成分为dmem/f-12glutamax培养基配置含有1.25mm的nac、1x的n2、1x的b27,添加下列不同因子:10ng/ml的bfgf、5μm的ly411575、1μm的chir99021、2μm的iwp2、20ng/ml的bmp4、100ng/ml的noggin、100ng/ml的shh、5μm的cyclopamine、10ng/ml的tgfβ1、0.5μm的a83-01、1μm的ra,培养14天左右,期间换液如matrigel降解,滴加100vol%matrigel放培养箱中成胶后,继续补培养液。
用免疫荧光技术检测微器官中分化的毛细胞情况,如图2和图3所示,bfgf可以减轻毛细胞分化过程中凋亡,其中casp3标记凋亡细胞,myosin7a标记毛细胞。如图4、5和6所示,筛选到bmp4、ra和ly411575能够促进耳蜗类器官细胞向毛细胞的定向转化。
3.螺旋神经元三维培养
取新生2-3天的c57乳鼠,剪头后,取出颞骨,置于冰的pbs缓冲液中。在解剖显微镜下挑开蜗壳,取出耳蜗内的蜗轴和基底膜等组织,撕去螺旋韧带和基底膜上皮,保持蜗轴区域的完整性。
利用显微刀片垂直切取蜗轴的中顶圈区域,继而分离螺旋神经元组织,切取环状的螺旋神经元为5-6个小片状,继而贴壁于预先matrigel包被好的玻底的圆形皿,吸去培养基,保持一定的湿润度,放在冰上贴壁1-2min后,加上100μl预冷好的100vol%matrigel,放置恒温培养箱中,待胶充分凝固后,加入1ml的基础培养基,添加下列不同因子:10ng/ml的bfgf、100ng/ml的bdnf、1μm的chir99021、2μm的iwp2、20ng/ml的bmp4、100ng/ml的noggin、100ng/ml的shh、5μm的cyclopamine、10ng/ml的tgfβ1、0.5μm的a83-01、1μm的ra、5μm的ly411575,培养7天左右,期间换液如matrigel降解,滴加100vol%matrigel放培养箱中成胶后,继续补培养液。
通过免疫染色检测螺旋神经元生长状态,如图7和8所示,在bfgf和bdnf一定程度维持螺旋神经元生长的基础上,发现添加shh、a83-01和ra可以促进螺旋神经元的生长,而强有力促进耳蜗类器官向毛细胞分化的ly411575明显抑制了螺旋神经元的生长,且bmp4也抑制其轴突的生长。
4.三维共培养耳蜗类器官与螺旋神经元构建内耳微器官(图9和10)
取步骤1所获得的lgr5-egfp小鼠的培养所得的内耳前体细胞来源类器官,洗去表面的胶之后置于预冷的培养基中,另外同步骤3解剖出螺旋神经元组织片,放置于预冷的培养基中。
如图9所示,取matrigel包被的玻璃底培养皿,将耳蜗类器官与螺旋神经元组织转移至培养皿中,留取一定的培养基保持湿润状态,摆好耳蜗类器官和螺旋神经元的位置,使螺旋神经元类似体内环形辐射神经纤维端指向耳蜗类器官,并且显微镜下维持两者环形距离约200-300μm,吸尽培养基后,充分冰浴贴壁2min后,加上100μl的matrigel,培养箱中成胶约20min形成三维培养环境。
结合步骤2和3的结果,我们采取如下共培养方案,每皿加入1ml的共培养培养基,其成分为dmem/f-12glutamax培养基配置含有1.25mm的nac、1x的n2、1x的b27、10ng/ml的bfgf、0.5μm的a83-01、100ng/ml的shh、1μm的ra以及5μm的ly411575,待培养到第5天后,撤掉ly411575。继续培养20天左右,期间换液如matrigel降解,滴加100vol%matrigel放培养箱中成胶后,继续补培养液。此步骤中,诱导耳蜗类器官中的细胞定向分化并成熟为毛细胞,耳蜗微器官的毛细胞为耳蜗前体细胞定向诱导而来;三维培养螺旋神经元,将螺旋神经元包裹在基质胶中,在共培养体系作用下,促进其生长成熟。
三维共培养耳蜗类器官和螺旋神经元组织的第0天的光镜图如图9所示,显示两者并无任何连接。三维共培养培养第16天后染色鉴定,如图10所示,tuj1标记的螺旋神经元与类器官接触,并且发出的神经纤维包绕耳蜗类器官的atoh1阳性毛细胞。
5.内耳微器官的形态分析(图11和12)
用免疫荧光技术检测微器官中分化的毛细胞与螺旋神经元是否具备突触连接,如图11和12所示,培养30天时,可见tuj1标记的螺旋神经元的纤维接触的atoh1-egfp阳性毛细胞有突触前蛋白ctbp2表达,并且myosin7a标记的毛细胞底端具备突触前蛋白ctbp2和突触后蛋白psd95分布形成的突触对。图13为培养第30天,未共培养的耳蜗类器官和构建的微器官毛细胞表面的突触前蛋白数量统计图。图中显示耳蜗微器官的毛细胞突触前蛋白ctbp2数量明显多于未共培养的耳蜗类器官突触前蛋白的数量。
以上仅是本发明的优选实施方式,应当指出的是,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的发明内容。
- 还没有人留言评论。精彩留言会获得点赞!