提高N-乙酰氨基葡萄糖产量的RamAM转录因子突变体
提高n
‑
乙酰氨基葡萄糖产量的ramam转录因子突变体
技术领域
1.本发明属于代谢工程技术领域,尤其涉及一种提高n
‑
乙酰氨基葡萄糖产量的ramam转录因子突变体。
背景技术:
2.n
‑
乙酰氨基葡萄糖(glcnac)是氨基葡萄糖的一种衍生物,具有还原性,也是合成双岐因子和透明质酸的重要前体物质,又称2
‑
(乙酰氨基)
‑2‑
脱氧
‑
葡萄糖及n
‑
乙酰葡萄糖胺,是生物体内多种多糖的基本组成单位,在生物体内具有重要的生理功能。谷氨酸棒杆菌是放线菌门中高gc含量的革兰氏阳性土壤细菌,已被用于氨基酸的工业生产,并被设计用于生产各种化合物,包括聚合物结构单元和生物燃料。自其基因组序列首次发表以来,其多功能代谢途径及其遗传成分和调控机制已得到广泛研究。为了提高生物技术生产的效率,基于基因组序列信息开发了遗传工具和基于组学的分析方法,包括转录组学,蛋白质组学,代谢组学和流变学,并广泛用于了解代谢途径及其在转录后的调控。
3.现如今国内外研究生产glcnac的基因工程菌主要为大肠杆菌(escherichia coli)、谷氨酸棒杆菌(corynebacterium glutamicum)和枯草芽孢杆菌(bacillus subtilis,b.subtilis)。然而,由于大肠杆菌不是食品安全级菌株,未能达到氨基葡萄糖生产的食品级要求;因此,适合于工业规模发酵生产的食品安全级生产菌株是微生物发酵法生产glcnac的理想菌株。许多通常被认为安全的微生物菌株己被鉴定,而且已经利用这些菌株实现了许多重要营养制品的生产。而相比枯草芽孢杆菌,谷氨酸棒杆菌具有高安全性,低致病性,高抗逆性,在放大生产时可以免于噬菌体的侵染,生长快速、无孢子产生、发酵过程无明显异味产生等优点;谷氨酸棒杆菌相比枯草芽孢杆菌具有更高的谷氨酸生产能力,大量的谷氨酸积累生成谷氨酰胺可作为glcnac生产的氨基供体,并供细胞生长以及氮代谢需要;另外,谷氨酸棒杆菌种子及发酵培养基以玉米粉(浆)作为主要培养基,不需要土豆汁或麦芽汁、蛋白胨、牛肉膏、酵母粉等常用培养基成分,从而节约了成本。
4.在过去的研究中,为了提高谷氨酸棒杆菌中目标基因的表达量,学者们往往采用基因组改造、启动子以及rbs序列的优化、利用定点突变技术以及改造转运系统等方式。要想实现真正意义上的工程菌株的定性改造和细胞工程的理性设计,必须从细胞整体和系统全局出发,综合考虑基因表达、转录调控以及代谢反应之间的相互作用关系。发明人前期提供了一种促进n
‑
乙酰氨基葡萄糖生产的rama转录因子突变体,使得谷氨酸棒杆菌中的碳代谢流更多地流向n
‑
乙酰氨基葡萄糖生产,从而提高了谷氨酸棒杆菌生产n
‑
乙酰氨基葡萄糖的能力,但是n
‑
乙酰氨基葡萄糖在胞外的积累量还有待进一步提高,以适应工业化生产应用。
技术实现要素:
5.为解决上述技术问题,本发明对全局调控转录因子ramam进行定点随机突变文库,从中筛选出有n
‑
乙酰氨基葡萄糖积累量提高的突变菌株,进一步提供一种提高n
‑
乙酰氨基
葡萄糖产量的ramam转录因子突变体,使得谷氨酸棒杆菌中的碳代谢流更多地流向n
‑
乙酰氨基葡萄糖生产。
6.本发明的第一个目的是提供一种提高n
‑
乙酰氨基葡萄糖产量的ramam转录因子突变体,所述的ramam转录因子突变体的氨基酸序列如seq id no.4所示。
7.进一步地,编码所述的ramam转录因子突变体的基因的核苷酸序列如seq id no.3所示。
8.本发明的第二个目的是提供一种提高n
‑
乙酰氨基葡萄糖产量的基因工程菌,所述基因工程菌是以谷氨酸棒杆菌为宿主菌,过表达所述的ramam转录因子突变体。
9.进一步地,所述的宿主菌为谷氨酸棒杆菌s9114δnaga
‑
δgama
‑
δldh。
10.进一步地,所述的基因工程菌是以ptyw
‑4‑
cen
‑
c.glglms为表达载体。
11.本发明的第三个目的是提供所述的基因工程菌的构建方法,包括如下步骤:
12.(1)将ramam转录因子突变体的编码基因连接到表达载体ptyw
‑4‑
cen
‑
c.glglms上,构建ptyw
‑4‑
cen
‑
c.glglms
‑
rama载体;
13.(2)将步骤(1)构建的载体转入宿主菌谷氨酸棒杆菌s9114δnaga
‑
δgama
‑
δldh,得到所述的基因工程菌。
14.本发明的第四个目的是提供所述的ramam转录因子突变体在n
‑
乙酰氨基葡萄糖生产中的应用。
15.本发明的第五个目的是提供所述的基因工程菌在n
‑
乙酰氨基葡萄糖生产中的应用。
16.进一步地,所述的应用是将所述的基因工程菌接种至发酵培养基中,28~30℃条件下通气发酵72~100小时。
17.进一步地,所述的发酵培养基为:葡萄糖90
‑
110g/l,玉米浆8
‑
12g/l,kh2po
4 0.8
‑
1.2g/l,(nh4)2so
4 18
‑
22g/l,mgso
4 0.4
‑
0.6g/l,caco
3 18
‑
22g/l,feso
4 0.16
‑
0.20g/l。
18.借由上述方案,本发明至少具有以下优点:
19.本发明提供了一种提高n
‑
乙酰氨基葡萄糖产量的ramam转录因子突变体,并提供了过表达ramam转录因子突变体的基因工程菌株,提高了n
‑
乙酰氨基葡萄糖在胞外的积累量,其浓度最高可达37.9g/l,为进一步代谢工程改造谷氨酸棒杆菌生产氨基葡萄糖奠定了基础。本发明提供的重组谷氨酸棒杆菌构建方法简单,便于使用,具有很好的应用前景。
20.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细说明如后。
附图说明
21.图1为ptyw
‑4‑
cen
‑
c.glglms质粒图谱。
22.图2为构建重组ptyw
‑4‑
cen
‑
c.glglms
‑
rama质粒图谱。
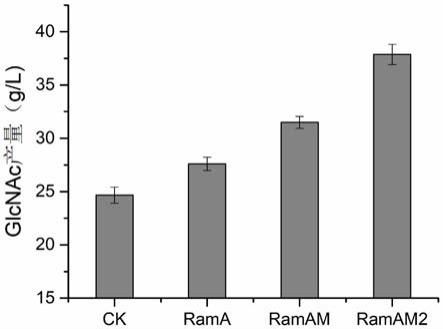
23.图3为不同菌株摇瓶发酵上清液中glcnac的产量图。
具体实施方式
24.涉及的检测方法:
25.n
‑
乙酰氨基葡萄糖的测定方法:
synthesis.synthetic and systems biotechnology,2019.4:120
‑
129.
49.使用引物vectorrama.for和vectorrama.rev,以提取的质粒ptyw
‑4‑
cen
‑
c.glglms为模板,pcr条件为:95℃预变性3min;98℃变性1min;55℃退火1min;72℃延伸5min,反应30个循环;最后72℃延伸l0min。pcr产物用dna纯化试剂盒回收,获得线性化的质粒ptyw
‑4‑
cen
‑
c.glglms。
50.(2)采用诺唯赞生物科技有限公司的clonexpress ii one step cloning kit快速克隆试剂盒进行连接,pcr得到的线性化载体以及带有载体同源性末端的目的基因片段胶回收后以3:1的摩尔比混合,同时加入5
×
ce ii buffer 4μl,exnase ii 2μl,然后加入ddh 2
o使得连接体系总体积达到20μl,37℃反应30min,降低至4℃保温。然后取10μl连接体系转化e.coli.bl21(de3)感受态细胞(感受态制备方法详见takara大肠杆菌感受态试剂盒说明书)。挑选菌落pcr正确的转化子,然后送往苏州金唯智生物科技有限公司进行测序验证,得到重组表达载体ptyw
‑4‑
cen
‑
c.glglms
‑
rama。
51.将质粒ptyw
‑4‑
cen
‑
c.glglms
‑
rama通过电击转化法转化到谷氨酸棒杆菌s9114δnaga
‑
δgama
‑
δldh菌株中。
52.谷氨酸棒杆菌电转感受态的制备:
53.(1)c.glutamicum接种于lbg培养基(需要新鲜培养的斜面上进行挑选,否则会影响菌体的生长),置于巡回式摇床(200rpm)上,30℃培养16h,od
562
达到3.0。
54.(2)10%转接入感受态培养基中od
562
达到0.3,置于巡回式摇床(200rpm)上,30℃培养至od
562
达到0.9(培养约3
‑
5h,处于对数生长期即可,一般如果菌浓的持续较低约0.6左右也可以继续后续操作)。需要保证菌体浓度尽量要浓,一般浓缩倍数为100倍(50ml感受态培养基浓缩至0.5ml制备5管感受态细胞)。
55.(3)菌液冰水浴15min,4,000rpm,4℃离心10min,小心的弃去上清。
56.(4)用30ml预冷10%甘油充分悬浮菌体,4,000rpm,4℃离心10min,小心的弃去上清,重复洗涤四次。
57.(5)用500μl预冷10%甘油重悬细胞(浓缩100倍),1.5ml无菌离心管分装,每管100μl。
58.(6)
‑
80℃保存待用,为保证感受态的转化效率最好现用现做,不能放置超过1周,否则由于感受态细胞裂解细胞内容物释放,在后续电击转化过程中造成电转杯的击穿,同时影响转化效率。
59.谷氨酸棒杆菌的电击转化:
60.(1)
‑
80℃保存的谷氨酸棒状杆菌感受态,冰浴中融化。
61.(2)加入1
‑
5.0μl质粒混匀(dna总量约为1.0μg),冰浴5
‑
10min。
62.(3)加入于预冷的0.1cm电击杯中,1.8kv电压5ms电击2次。
63.(4)迅速加入预热的恢复用培养基(lbws)1.0ml混匀并转移到新的1.5ml无菌离心管中,46℃水浴6min,后放入冰浴中。
64.(5)将菌体置于巡回式摇床(100rpm)上,30℃后培养2h。
65.(6)6,000rpm,常温离心1min,涂布到加入对应抗性的转化子检出平板中,于30℃恒温培养箱,培养2
‑
3天。
66.(7)感受态效率验证:加入5.0μl无菌ddh2o作为阴性对照,无菌落,阳性对照加入
1
‑
5μl质粒pxmjl9(dna总量约为1.0μg),长出大量菌落。
67.实施例2:重组谷氨酸棒杆菌中rama基因突变文库的构建
68.rama基因突变文库的构建方法:
69.以重组质粒ptyw
‑4‑
cen
‑
c.glglms
‑
rama为模板,所采用的引物为:
70.上游引物ramam.for(seq id no.9):
[0071]5’
——nnngatnnngcgattcaggatgagggc——3’[0072]
下游引物ramam.rev(seq id no.10):
[0073]5’
——ctcatgtgaaatgacatttgccctggtgtaatcac——3’[0074]
上述引物采用磷酸化试剂盒进行5'
‑
phosphate磷酸化处理,然后使用5'
‑
phosphate磷酸化过的引物,pcr条件为:95℃预变性3min;98℃变性1min;55℃退火1min;72℃延伸5min,反应30个循环;最后72℃延伸l0min。pcr产物用dna纯化试剂盒回收,获得一系列包含突变位点的线性化的质粒ptyw
‑4‑
cen
‑
c.glglms
‑
rama
m
。
[0075]
纯化得到的pcr产物,并用dpni核酸内切酶消化质粒模板2h,取15μl消化产物,16℃下采用t4连接酶连接1h或过夜,反应体系为:线性化质粒pcr产物15μl,t4 dna ligase buffer(10x)*2ul,t4 dna ligase 1ul,ddh2o 2ul。然后采用胶回收试剂盒回收连接产物,然后直接转化宿主菌谷氨酸棒杆菌s9114δnaga
‑
δgama
‑
δldh,得到含rama基因突变体文库的谷氨酸棒杆菌,所得到的rama基因突变体均携带两个突变位点,分别为90k和92s,两处氨基酸随机突变为任意氨基酸组合。
[0076]
ramam基因突变文库的构建方法:
[0077]
以得到的k90n/s92k双突变菌株中的质粒ptyw
‑4‑
cen
‑
c.glglms
‑
rama
m
为模板,所采用的引物为:
[0078]
上游引物ramam2.for(seq id no.11):
[0079]5’
——cgtgctggcttgtgtcnnnctcggtcacacc——3’[0080]
下游引物ramam2.rev(seq id no.12):
[0081]5’
——tccaactcacgcgcnnncagcttggtggtctg——3’[0082]
后续构建方法同rama基因突变文库的构建方法,将线性化突变质粒直接转化宿主菌谷氨酸棒杆菌s9114δnaga
‑
δgama
‑
δldh,得到含ramam基因突变体文库的谷氨酸棒杆菌,所得到的ramam2基因突变体均携带两个突变位点,分别为221s和232a,两处氨基酸随机突变为任意氨基酸组合。
[0083]
实施例3:重组谷氨酸棒杆菌中过量表达rama基因以及rama
m
基因对n
‑
乙酰氨基葡萄糖产量的影响
[0084]
突变文库高通量筛选方法:
[0085]
首先将诱变后涂布平板上长出的菌落接种于48浅孔板中作为种子液(接种6块板,每块接种46株突变菌株,2株对照菌株,共计276株突变菌株,12株对照菌株),37℃培养10h后,取2μl转接至48深孔板诱变筛选培养基中,发酵培养48h。发酵结束后,离心取2μl上清液于96pcr板中,加入43μl超纯水以及1μl四硼酸钾溶液(1.5g四硼酸钾溶解于25ml超纯水)后于96℃金属浴加热5min,结束反应。取10μl反应液于96浅孔板,向其中添加125μl pdaba溶液(1g对二甲基苯甲醛溶解于100ml含1.25%盐酸的冰醋酸中),于37℃96孔板摇床反应10min,利用酶标仪测定a585处吸光值,吸光值与glcnac的含量成正相关。根据酶标仪测定
的数据,在96浅孔板中找出最高产量对应的突变株,并将其作为下一轮出发菌株进行诱变处理。经过多轮诱变后,将最终初筛获得的高产菌株进行摇瓶验证。
[0086]
将经过孔板高通量筛选得到的初筛菌株接种至摇瓶中进行复筛发酵验证。
[0087]
在本发明的一种实施方式中,所述发酵是将28~30℃,220rpm下培养16h的种子以使得发酵培养基的初始od
562
为1.6的接种量转入发酵培养基,于28~30℃,220rpm条件下培养72~100h,采用hplc测量glcnac生成量。
[0088]
以含有质粒ptyw
‑4‑
cen
‑
c.glglms的重组菌为对照,在相同条件下培养、发酵,72h后glcnac产量为24.7g/l,过量表达rama基因的质粒ptyw
‑4‑
cen
‑
c.glglms
‑
rama的菌株72h后glcnac产量为27.6g/l,过量表达ramam基因的质粒ptyw
‑4‑
cen
‑
c.glglms
‑
ramam的菌株72h后glcnac产量为31.5g/l。在此基础上进一步构建的突变文库b中的菌株经过孔板初筛以及摇瓶复筛,最终得到一株glcnac产量相对最高的菌株,2h后glcnac产量为37.9g/l(图3),将该突变菌株所携带质粒命名为ptyw
‑4‑
cen
‑
c.glglms
‑
ramam2,设计引物扩增该质粒的突变部分核苷酸,送往苏州金唯智生物科技有限公司进行测序。该突变基因rama
m
携带两个突变位点,分别是s221l,a232l。
[0089]
以上仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1