利用好氧菌和厌氧菌共培养发酵生产丁醇的方法及装置
1.本发明属于微生物发酵领域,具体涉及一种利用好氧菌和厌氧菌共培养发酵生产丁醇的方法及装置。
背景技术:
2.与燃料乙醇相比,燃料丁醇具有能量密度高、挥发性低的特点,能提高燃油效率和更长的行驶里程;发动机燃烧时不产生sox或nox,与汽油混合宽容度大,无需对车辆进行改造;腐蚀性较小,适用于现有燃料供应和分销系统。
3.工业微生物生产丁醇的工艺是以淀粉、木薯等农副产品,或者糖蜜、甘蔗、甜菜等糖类产品为原料,经过预处理得到含糖水溶液,接入产丁醇菌种(多数为厌氧梭菌,例如拜氏梭菌、丙酮丁醇梭菌),进行丙酮丁醇(abe)发酵,发酵液精馏后得正丁醇。上述工艺设备与燃料乙醇生产相似,原料价廉、来源广泛、投资较小,发酵时条件温和、不需贵重金属催化剂。
4.传统生物丁醇发酵工艺普遍存在(1)丁醇产量和产率低;(2)溶剂终浓度低,常规精馏方法能耗高;(3)丁醇在发酵总溶剂中的占比低,丁醇分离的成本高;(4)普遍采用玉米、糖蜜等粮食原料进行生产,原材料的成本较高,存在“与人争粮”。
5.因此,为降低原料成本,拓展了发酵原料品种,例如利用价廉易得的一些农业废弃物,如玉米秸秆、甘蔗渣、稻草、果园残次果等。
6.在玉米秸秆和甘蔗渣等木质纤维素的预处理方法中,通常会使用稀酸、稀碱、氨爆、汽爆等预处理工艺,木质纤维类原料会产生一定浓度的可溶性木质素,对随后的微生物发酵产生毒害作用,而开发化学和生物方法脱毒水解物,研究脱毒机理,对加快发酵效率,降低工艺成本具有重要意义。
7.许多生物质降解的研究已证明:木质素聚合物降解途径的第一步是解聚成木质素单体。木质素单体主要有三种,分别是香草醛,对香豆酸和丁香酸。其中香草醛和丁香酸的中间代谢产物是愈创木酚和邻苯二酚-二羟基苯;对香豆酸和丁香酸的中间代谢产物是对羟基苯甲酸,都是带有苯环的化学物质。某些微生物可以将上述的中间代谢产物进一步开环裂解,产生低分子量的酸(丁酸、丙戊酸、草酸和丙酸)和醇(乙醇和乙二醇)。
8.cn 107760753a公开了一种利用热解糖高温厌氧菌和丙酮丁醇梭菌共培养发酵生产丁醇的方法。将活化的热解糖高温厌氧菌接种到含有木聚糖的发酵培养基中进行发酵,得到发酵液,将活化的丙酮丁醇梭菌接种到前述发酵液中发酵生产丁醇。但该发明未涉及到复杂原料(如玉米秸秆)中木质素的降解和转化。
9.在现有工业微生物发酵制备丁醇技术途径中,主要采用丙酮丁醇梭菌和拜氏梭菌,为降低原料成本,玉米秸秆和甘蔗渣等木质纤维素原料被广泛采用,但预处理过程中容易产生可溶性木质素,对后续发酵的菌株具有毒害作用,而通过水洗浸泡等工艺,不仅增加了操作步骤,而且会大量浪费水。
技术实现要素:
10.本发明目的在于提供一种利用好氧菌和厌氧菌共培养发酵生产丁醇的方法及装置。以克服生物丁醇的工业微生物发酵工艺中,针对玉米秸秆和玉米渣等农林业废弃物,在稀酸、稀碱、氨爆、汽爆等预处理方法中,所产生的可溶性木质素对后续微生物发酵的毒害作用。
11.本发明通过在化学(和/或物理)预处理秸秆或甘蔗渣的酶解糖化水解液中,在发酵反应体系的上层区域添加一种或多种好氧木质素降解菌株。发酵一段时间后,在下层区域添加厌氧的产丁醇梭菌。这种分层式共培养的发酵方式可原位地降低木质素含量,同时代谢转化产生的低分子量有机酸可以通过梭菌的酸醇转化机制,进一步产生丙酮或丁醇等有机溶剂,从而降低原料的用量和成本,简化工艺过程,有机溶剂产率和产量得到了一定程度的提高。
12.本发明提供一种利用好氧菌和厌氧菌共培养发酵生产丁醇的方法,包括以下步骤:(1)在含有酶解玉米秸秆或甘蔗渣的培养液中设置筛孔塔板,通过筛孔塔板将培养液划分为上层区域以及下层区域;(2)将活化的好氧木质素降解菌接种到步骤(1)中所述的上层区域进行发酵,得到发酵液体系;(3)将活化的拜氏梭菌接种到步骤(1)中所述的下层区域,继续发酵生产丁醇。
13.步骤(1)所述的筛孔塔板的孔直径在300毫米-1000毫米之间,孔的个数在40-100个/平方米;所述筛孔塔板在发酵液中设置的位置在其垂直高度的1/3-2/3处。
14.步骤(1)中所述的下层区域内设置有搅拌桨。步骤(1)中所述的上层区域和下层区域分别指:在整个发酵液体系中,以筛孔塔板为分界线,塔板以上的区域为上层区域,塔板以下的区域为下层区域。所述上层区域与下层区域间的液体可以透过筛孔上下通过,因此发酵体系是均匀的,但通过塔板的物理阻挡,可以抵消下层搅拌桨的旋转力,避免发酵体系上层好氧菌和下层的厌氧菌的重复混合。
15.步骤(2)所述的好氧木质素降解菌为以下细菌中的一种或多种:假单胞菌(pseudomonas putida mt-2),其保藏登记号为:dsmz, dsm-6125、保藏日期:1990年7月,公开在journal of bacteriology 115 (1): 262-267;链霉菌(streptomyces viridosporus t7a),其保藏登记号为:atcc 39115、保藏日期:1981年5月,公开在appl. environ. microbiol. 42: 378-380;微杆菌(microbacterium sp),其保藏登记号为:cgmcc: 1.15785、保藏日期:2001年9月,公开在biochemical engineering journal. 121(15), 2017, 131-138;红球菌(rhodococcus jostii rha1),其保藏登记号为:dsm 44719,保藏日期: 2003公开在int.j.syst.evol.microbiol. 52 : 409-413;伯克霍尔德氏(burkholderia cepacia),其保藏登记号为:dsm 50180,保藏日期:1990,公开在enzyme and microbial technology 14 (11): 938-943;和芽孢杆菌(alkalihalobacillus ligniniphilus l1、其保藏登记号为:dsm 26145,保藏日期:2011,公开在int j syst evol microbiol 64 (pt5): 1712-7。步骤(3)所述拜氏梭菌分类命名为拜氏梭菌(clostridium beijerinckii y-3),其保藏登记号为:cgmcc 5805,保藏日期:2012年,公开在cn102719371a。
16.优选地,步骤(2)所述发酵的条件为:发酵温度20-40℃,发酵时间12-50 h,发酵初始ph值5.0-7.5,转速50-170 rpm。
17.优选地,步骤(1)所述培养液中玉米秸秆或甘蔗渣浓度为150-300 g/l。优选地,培养液中还包含:1-3 g/l的乙酸钠,0.5-3 g/l的乙酸,1.0-5.0 g/l酵母粉,0.2-1.0 g/l mgcl2·
6h2o,0.1-0.6 g/l nh4cl,0.01-0.05 g/l cacl2·
2h2o,0.5-2.0 g/l fecl2·
4h2o,0.1-0.5 g/l kcl。调节ph至4.5-6.5。
18.步骤(2)所述活化的好氧木质素降解菌的接种方式如下:将活化的好氧木质素降解菌培养液离心,将离心得到的沉淀接种到步骤(1)得到的发酵液体系的上层区域中。
19.优选地,步骤(3)中拜氏梭菌接种时机为:当步骤(2)所述发酵液中可溶解木质素浓度降低到《0.6 g/l时,将活化的拜氏梭菌接种到步骤(1)得到的发酵液下层区域中,发酵生产丁醇。当木质素浓度低于《0.6 g/l,发酵液上层区域富集好氧木质素降解菌,可实现发酵液的空气隔离,从而在下层进行拜氏梭菌的发酵。
20.优选地,步骤(1)中所述发酵在发酵罐内进行。步骤(2)中好氧木质素降解菌与步骤(3)中拜氏梭菌种子的加入比例,按体积比计,为1:1-1:3之间。
21.优选地,步骤(1)所述活化的好氧木质素降解菌的接种量为发酵体系总体积的1%-20%。
22.优选地,步骤(2)所述活化的厌氧拜氏梭菌的接种量为发酵体系总体积的1%-20%。
23.步骤(3)所述发酵条件为:发酵温度35-40℃,发酵时间60-168 h,发酵ph值4.5-7.0,转速100-200 rpm。
24.为实现上述发明目的,本发明第二方面在于提供一种利用好氧菌和厌氧菌共培养发酵生产丁醇的装置,包括:发酵罐以及设置在发酵罐内的筛孔塔板,通过筛孔塔板将发酵罐分为上层区域以及下层区域。
25.所述的筛孔塔板的孔直径在300毫米-1000毫米之间,孔的个数在40-100个/平方米;所述筛孔塔板在发酵液中设置的位置在其垂直高度的1/3-2/3处。
26.所述的下层区域内设置有搅拌桨。步骤(1)中所述的上层区域和下层区域分别指:在整个发酵罐中,以筛孔塔板为分界线,塔板以上的区域为上层区域,塔板以下的区域为下层区域。所述上层区域与下层区域间的液体可以透过筛孔上下通过,因此发酵罐内发酵体系是均匀的,但通过塔板的物理阻挡,可以抵消下层搅拌桨的旋转力,避免发酵体系上层好氧菌和下层的厌氧菌的重复混合。
27.有益效果:与现有技术相比,本发明的技术优势如下:(1)本发明是将木质素降解和丁醇发酵在同体系中进行,工艺简化,同时利用了木质素原料,提高了丁醇的产量,对丁醇的微生物工业应用具有重要意义。
28.(2)本发明通过先培养可以利用木质素的好氧的木质素降解菌,在发酵体系塔板上层区域将玉米秸秆或甘蔗渣酶解糖化液中的可溶性木质素降解转化为低分子量的酸(丁酸、丙戊酸、草酸、丙酸)和醇(乙醇和乙二醇),进而在发酵体系下层的拜氏梭菌发酵过程中通过酸醇转化机制,转化为丁醇、丙酮等有机溶剂,从而提高丁醇的产量;(3)当好氧木质素降解菌与拜氏梭菌种子按照体积比例1:2进行培养,丁醇产量最高,达到12.92 g/l,溶剂产量达到22.43 g/l,这是目前将玉米秸秆成分进行全利用,共培
养得到的最高丁醇产量。好氧木质素降解菌与厌氧微生物共培养48 h时,发酵液中木质素浓度低于《0.6 g/l,并得到5 g/l的有机酸;此后,在共培养体系中,富集的好氧木质素降解菌能够有效阻断发酵液下层的氧气含量,筛孔塔板能够有效隔离好氧与厌氧菌的生长区域,从而使拜氏梭菌能够持续生长在厌氧环境中;(4)该方法有效降低了工业生产丁醇的成本,同时解决了稀酸蒸汽爆破秸秆或甘蔗渣中木质素难以利用的问题,具有重要的应用价值。
附图说明
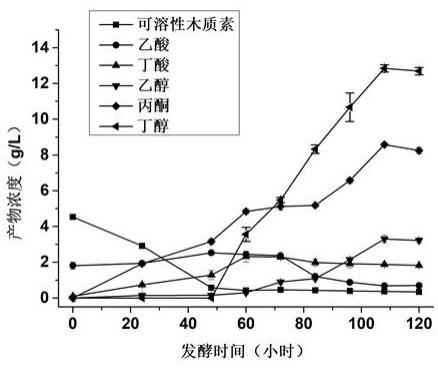
29.图1为本发明采用好氧菌与厌氧菌共培养发酵体系示意图;其中1为发酵液体系,2为好氧菌,3为厌氧菌;图2为实施例1中以玉米秸秆酶解液为底物,发酵产物以及底物随时间变化的浓度;图3为实施例5中不同预处理玉米秸秆酶解液浓度条件下,发酵液丁醇产物和总溶剂浓度;图4为实施例6中上下层不同体积比例的发酵体系中,发酵所产生的丁醇和总溶剂的浓度。
具体实施方式
30.图1给出了本发明采用好氧菌与厌氧菌共培养发酵体系示意图,发酵液体系1通过筛孔塔板(未示出)分隔成上部区域(上层有氧区域)和下部区域(下层厌氧区域)。发酵过程中,好氧菌2接种到上层区域,厌氧菌3接种到下层区域。在发酵体系内设置有搅拌桨。筛孔塔板的孔直径在300毫米-1000毫米之间,孔的个数在40-100个/平方米;所述筛孔塔板在发酵液中设置的位置在其垂直高度的1/3-2/3处。
31.实施例1以稀酸蒸汽爆破预处理的玉米秸秆酶解液作为碳源,利用伯克霍尔德氏(burkholderia cepacia)和拜氏梭菌(clostridium beijerinckii y-3)进行共培养发酵产丁醇(图1)。
32.从平板上挑取菌株伯克霍尔德氏(burkholderia cepacia)单菌落接种到20 ml含有酶解玉米秸秆的发酵培养基中,37℃、100 rpm培养36 h。然后以接种量10% v/v(以发酵液体系为基准)接种到发酵体系的上层区域,37℃、100 rpm,发酵初始ph值为5.5搅拌培养发酵,得到木质素移除和发酵体系下层区域厌氧的脱毒发酵液体系。
33.从平板上挑取菌株拜氏梭菌(clostridium beijerinckii y-3)单菌落接种到20 ml发酵培养基中,37℃、100 rpm培养36 h。当发酵液中可溶解木质素浓度降低到《0.6 g/l时(发酵时间为36h),将拜氏梭菌以接种量10 %v/v(以发酵液体系为基准)接种到发酵液的下层,37℃、100 rpm搅拌培养72h,发酵ph为4.5。每24小时在反应器中取样,用gc测其各种产物的浓度,最终丁醇产量为12.92 g/l,有机溶剂产量22.43 g/l(图2)。
34.上述发酵培养基配方为1.7 g/l的乙酸钠,0.9 g/l的乙酸,4.5 g/l酵母粉,0.2 g/l mgcl2·
6h2o,0.15 g/l nh4cl,0.02 g/l cacl2·
2h2o,0.5 g/l fecl2·
4h2o,0.23 g/l kcl,玉米秸秆250g/l。调节ph至5.5,121℃ 灭菌15 min。
35.实施例2以稀酸蒸汽爆破预处理的玉米秸秆酶解液作为碳源,利用假单胞菌(pseudomonas putida mt-2)和拜氏梭菌(clostridium beijerinckii y-3)发酵产丁醇。
36.从平板上挑取菌株假单胞菌(pseudomonas putida mt-2)单菌落接种到10 ml发酵培养基中,25℃、150 rpm培养24 h。然后以接种量5% v/v接种到发酵反应体系的上层区域,25℃、150 rpm,发酵初始ph值为6.5搅拌培养发酵,得到木质素移除和发酵体系下层区域厌氧的脱毒发酵液体系。
37.从平板上挑取菌株拜氏梭菌(clostridium beijerinckii y-3)单菌落接种到10 ml发酵培养基中,35℃、150 rpm培养24 h。当发酵液中可溶解木质素浓度降低到《0.6 g/l时(发酵时间为48h),将拜氏梭菌以接种量10 %v/v接种到发酵反应体系的下层,35℃、150 rpm搅拌培养150h,发酵ph为5.0。每24小时在反应器中取样,用gc测其各种产物的浓度,最终丁醇产量为10.97 g/l,有机溶剂产量20.68 g/l。
38.上述发酵培养基配方为1.5 g/l的乙酸钠, 0.8 g/l的乙酸,4.0 g/l酵母粉,0.30 g/l mgcl2·
6h2o,0.1 g/l nh4cl,0.015 g/l cacl2·
2h2o,0.6 g/l fecl2·
4h2o,0.18 g/l kcl,玉米秸秆250g/l。调节ph至6.5,121 ℃灭菌15 min。
39.实施例3以稀酸蒸汽爆破预处理的玉米秸秆酶解液作为碳源,利用芽孢杆菌(bacillus ligniniphilus l1)和拜氏梭菌(clostridium beijerinckii y-3)发酵产丁醇。
40.从平板上挑取菌株芽孢杆菌(bacillus ligniniphilus l1)的单菌落接种到20 ml发酵培养基中,40℃、50 rpm培养45h。然后以接种量5% v/v接种到发酵反应体系的上层,40℃、50 rpm,发酵初始ph值为7.5搅拌培养发酵,得到木质素移除和发酵体系下层区域厌氧的脱毒发酵液体系。
41.从平板上挑取菌株拜氏梭菌(clostridium beijerinckii y-3)单菌落接种到20 ml发酵培养基中,40℃、100 rpm培养36 h。当发酵液中可溶解木质素浓度降低到《0.6 g/l时(发酵时间为25h),将拜氏梭菌以接种量10 %v/v接种到发酵反应体系的下层,40℃、100 rpm搅拌培养100h,发酵ph为6.5。每24小时在反应器中取样,用gc测其各种产物的浓度,最终丁醇产量为11.76 g/l,有机溶剂产量21.32 g/l。
42.上述发酵培养基配方为1.7 g/l的乙酸钠,0.9 g/l的乙酸,4.5 g/l酵母粉,0.2 g/l mgcl2·
6h2o,0.15 g/l nh4cl,0.02 g/l cacl2·
2h2o,0.5 g/l fecl2·
4h2o,0.23 g/l kcl,玉米秸秆200 g/l,调节ph至7.5,121℃ 灭菌15 min。
43.实施例4以稀酸蒸汽爆破预处理的玉米秸秆酶解液作为碳源,利用红球菌(rhodococcus jostii rha1)和拜氏梭菌(clostridium beijerinckii y-3)发酵产丁醇。
44.从平板上挑取菌株红球菌(rhodococcus jostii rha1)的单菌落接种到20 ml发酵培养基中,35℃、120 rpm培养15h,然后以接种量5% v/v接种到发酵反应体系的上层,35℃、120 rpm,发酵初始ph值为6.0搅拌培养发酵,得到木质素移除和发酵体系下层区域厌氧的脱毒发酵液体系。
45.从平板上挑取菌株拜氏梭菌(clostridium beijerinckii y-3)单菌落接种到20 ml发酵培养基中,37℃、100 rpm培养36 h。当发酵液中可溶解木质素浓度降低到《0.6 g/l
时(发酵时间为36h),将拜氏梭菌以接种量10 %v/v接种到发酵反应体系的下层,37℃、200 rpm搅拌培养72h,,发酵ph为5.5。每24小时在反应器中取样,用gc测其各种产物的浓度,最终丁醇产量为11.63g/l,有机溶剂产量20.97 g/l。
46.上述发酵培养基配方为1.7 g/l的乙酸钠,0.9 g/l的乙酸,4.5 g/l酵母粉,0.2 g/l mgcl2·
6h2o,0.15 g/l nh4cl,0.02 g/l cacl2·
2h2o,0.5 g/l fecl2·
4h2o,0.23 g/l kcl,玉米秸秆275 g/l,调节ph至6.0,121℃ 灭菌15 min。
47.实施例5不同玉米秸秆酶解液浓度对最终丁醇产量的影响(1)将好氧木质素降解微生物伯克霍尔德氏(burkholderia cepacia)以接种量5%v/v接种到稀酸蒸汽爆破预处理的玉米秸秆酶解液体系的上层,37℃、120 rpm活化培养;(2)将活化的拜氏梭菌(clostridium beijerinckii y-3)以接种量5%v/v接种到玉米秸秆酶解液体系的下层区域,37℃、120rpm发酵96 h,得到发酵液,每隔24h取样检测;发酵培养基配方为:1.7 g/l的乙酸钠,0.9 g/l的乙酸,4.5 g/l酵母粉,0.2 g/l mgcl2·
6h2o,0.15 g/l nh4cl,0.02 g/l cacl2·
2h2o,0.5 g/l fecl2·
4h2o,0.23 g/l kcl。设置四组发酵培养基,其中预处理的玉米秸秆浓度分别为150 g/l,200 g/l,250 g/l,300 g/l,调节ph至5.5,121℃ 灭菌15 min。
48.发酵过程中,每隔24h取样测定其丁醇产量。当预处理的玉米秸秆浓度为250 g/l时,共培养得到的丁醇浓度最高,丁醇产量达到了12.92 g/l,有机溶剂产量22.43 g/l;当预处理的玉米秸秆浓度为150 g/l时,共培养得到的丁醇浓度仅有8.53g/l;当预处理的玉米秸秆浓度为300 g/l时,共培养得到的丁醇浓度有11.37g/l,略低于250 g/l玉米秸秆酶解液时共培养得到的丁醇浓度(图3)。
49.实施例6好氧微生物与厌氧微生物种子的不同比例对丁醇产量的影响。
50.方法同实施例1,不同之处在于:发酵培养体系中好氧微生物与厌氧微生物(好氧木质素降解菌伯克霍尔德氏菌和厌氧拜氏梭菌)种子加入的比例,体积比按照(2:1、1:1、1:2、1:3)进行调整,预处理的玉米秸秆浓度均为250 g/l。
51.步骤(2)活化好的好氧木质素降解菌培养液放入4℃离心机离心,转速为6000 rpm、10 min,然后将上清倒掉,将菌泥加入步骤(2)的发酵液上层中,其中活化好的好氧木质素降解菌培养液的体积与发酵液体积的关系比例为1:10,好氧菌培养液的od
600
值达到5;然后37℃继续培养,转速100 rpm;步骤(3)活化好的拜氏梭菌培养液放入4℃离心机离心,转速为6000 rpm、10 min,然后将上清倒掉,将菌泥加入步骤(3)的发酵液下层中,其中活化好的拜氏梭菌培养液的体积与发酵液体积的比例为2:10,厌氧拜氏梭菌培养液的od
600
值达到5;然后37℃继续培养,转速100 rpm,ph为5.5,发酵96h;丁醇发酵过程中,每隔24h取样并测定其丁醇产量。当好氧与厌氧微生物种子液的比例为1:2时,丁醇产量9.84 g/l,有机溶剂产量19.68 g/l(图4)。
52.对比例1以稀酸蒸汽爆破预处理的玉米秸秆酶解液作为碳源,利用伯克霍尔德氏
(burkholderia cepacia)和拜氏梭菌(clostridium beijerinckii y-3)进行共培养发酵产丁醇。
53.从平板上挑取菌株伯克霍尔德氏(burkholderia cepacia)单菌落接种到20 ml含有酶解玉米秸秆的发酵培养基中,37℃、100 rpm培养36 h,然后以接种量10% v/v(以发酵液体系为基准)接种到发酵体系中(该发酵体系中没有筛孔塔板),37℃、100 rpm搅拌培养发酵,得到木质素移除的脱毒发酵液体系。
54.从平板上挑取菌株拜氏梭菌(clostridium beijerinckii y-3)单菌落接种到20 ml发酵培养基中,37℃、100 rpm培养36 h,然后以接种量10 %v/v(以发酵液体系为基准)接种到发酵液的下层,37℃、100 rpm搅拌培养72h,每24小时在反应器中取样,用gc测其各种产物的浓度,最终丁醇产量未检出,有机溶剂产量未检测,因为在好氧搅拌的环境下拜氏梭菌无法生长。
55.上述发酵培养基配方为1.7 g/l的乙酸钠,0.9 g/l的乙酸,4.5 g/l酵母粉,0.2 g/l mgcl2·
6h2o,0.15 g/l nh4cl,0.02 g/l cacl2·
2h2o,0.5 g/l fecl2·
4h2o,0.23 g/l kcl,玉米秸秆250g/l。调节ph至5.5,121℃ 灭菌15 min。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1