一种聚多巴胺聚乙烯亚胺纳米颗粒、其制备和应用
1.本发明涉及的是一种药物技术领域的药物输送技术,更具体涉及一种聚多巴胺聚乙烯亚胺纳米颗粒、其制备和应用。
背景技术:
2.青光眼是世界上不可逆性失明的首要原因。眼压(iop)的管理是限制青光眼进展的最有效方法。目前,青光眼的治疗策略是恢复房水(ah)产生和引流之间的平衡。在原发性开角型青光眼(poag)中,传统流出途径是ah引流的主要阻力部位。然而,现有技术中仅设计了几种抗青光眼药物来靶向常规的流出途径。
3.随着技术的进步,通过外源性基因导入来治疗疾病的成为可能。病毒载体往往具有较高的基因转移能力,但可能受到其内在免疫原性相关并发症的阻碍。基因传递的非病毒方法,包括聚合物、脂基和无机纳米颗粒以及物理传递技术,也得到了广泛的研究。
4.眼基因治疗已进入高速发展时代,然而,除非核酸(na,nucleic acid)与其他化学分子复合或采用物理方法迫使其进入细胞并导入核,否则裸露核酸分子的诱导细胞的能力通常是无效的。尽管病毒载体目前是替换和/或校正基因的最佳选择,目前在治疗眼底遗传性疾病中已有较多研究,但将仍有待改进,以提高转导效率并降低医源性风险。病毒载体相比非病毒载体(裸质粒dna、寡核苷酸和rna)具有更好的安全性(免疫原性低、插入突变的风险低)、更大的载药能力、重复给药的潜力,且更容易大规模生产。
5.目前已有的核酸的载体或转染方法有病毒类载体、其他非病毒载体(如脂质体、阳离子聚合物)、脂质体;局部电穿孔转染。其中,病毒载体作为基因传递的工具被广泛地采纳,但仍存在着局限性,即病毒性载体均可诱导机体产生某种程度的免疫反应,存在着插入突变等致瘤及致毒的风险。非病毒类载体:基因转移和表达效率较低,靶向性也较低,导入基因表达效果短暂,疗效也降低。电穿孔特性受到多种因素的影响,如电压、电穿孔次数和时间、温度、dna的状态和浓度等,参数设定不佳将对组织产生一定的损害。电穿孔引起的不良反应主要是局部细胞损害和炎性反应。电压过高,会造成细胞的死亡或组织失去功能,电穿孔次数过多会对局部细胞组织造成不可逆的损害。
6.microrna(mirna)是复杂生物学过程中的重要调节一环,mir
‑
21
‑
5p有改变传统流出途径阻力的功能。但作为核酸,其转入离体眼部细胞与在体眼内的研究与未来临床转化,也面临着转染这个重要问题。
7.由于眼部与全身免疫系统有屏障隔离,并且眼部血流与代谢保持一个较高的水平,眼内药物扩散方式更加复杂,有着更多的未知性;除此之外,眼睛是全身最精细的结构之一,一旦受损,易引起不可逆性盲,将极大的影响患者生活质量。因此基因治疗的载体选择需要更加谨慎。因此有必要开发更加安全而有效的核酸药物眼部递送系统。
技术实现要素:
8.本发明提供了一种能够在眼内转染治疗中应用的高分子多聚物纳米颗粒,该高分
子多聚物纳米颗粒能够长时间稳定的分散在溶液里,不需要借助表面承载,储存方便,该高分子多聚物纳米颗粒能够简便有效的负载核酸,所得到的聚多巴胺聚乙烯亚胺纳米颗粒核酸复合物可以在4℃较长稳定保存,有效的递送到眼部,实现细胞靶向的缓控释给药,并且该递送系统几乎没有免疫反应。
9.更具体的,本发明要解决的第一个技术问题是:提供一种聚多巴胺聚乙烯亚胺纳米颗粒(pda/pei nps)的制备方法。
10.为解决上述技术问题,本发明的提供的技术方案是:一种聚多巴胺聚乙烯亚胺纳米颗粒的制备方法,包括以下步骤:
11.(1)聚多巴胺(pda)溶液的制备:将多巴胺溶于水中,加热;加入碱的水溶液,发生自聚合反应形成聚多巴胺溶液;
12.(2)聚多巴胺聚乙烯亚胺纳米颗粒(pda/pei nps)的合成;将聚乙烯亚胺添加到步骤(1)得到的聚多巴胺溶液中,发生希夫碱反应与迈克尔加成反应,然后通过纯化获得聚多巴胺聚乙烯亚胺纳米颗粒;
13.步骤(1)中,所述加热的温度为40
‑
60℃;所述碱为naoh,其在水中的摩尔浓度为5
‑
8mmol/l;所述多巴胺和碱的投料质量比为5
‑
10:1;所述自聚合反应的时间为1
‑
6小时;所述自聚合反应的温度为20
‑
70℃;
14.步骤(2)中,所述聚乙烯亚胺为支化聚乙烯亚胺,所述聚乙烯亚胺的分子量为5
‑
30kda,所述聚多巴胺和聚乙烯亚胺质量比为10:1
‑
1:10。
15.本发明的一个优选的实施方案中:
16.步骤(1)中,所述多巴胺和碱的投料质量比为7.4:1;所述碱在水中的摩尔浓度6.8mmol/l;所述自聚合反应的温度为45
‑
55℃;
17.步骤(2)中,所述聚乙烯亚胺的分子量为25kda,所述聚多巴胺和聚乙烯亚胺质量比为2:1
‑
1:2。
18.本发明要解决的第二个技术问题是,提供一种聚多巴胺聚乙烯亚胺纳米颗粒。
19.为解决上述技术问题,本发明的提供的技术方案是:本发明方法制备得到的聚多巴胺聚乙烯亚胺纳米颗粒。
20.本发明要解决的第三个技术问题是,提供一种聚多巴胺聚乙烯亚胺纳米颗粒在制备治疗眼部疾病的药物中的用途。
21.为解决上述技术问题,本发明的提供的技术方案是:本发明聚多巴胺聚乙烯亚胺纳米颗粒在制备治疗眼部疾病的药物中的用途。所述眼部疾病为以降低眼压为唯一治疗手段的各种类型开角型青光眼、闭角型青光眼、高眼压症、正常眼压青光眼、头痛、视神经萎缩以及视神经退行性病变。
22.本发明要解决的第四个技术问题是,提供一种聚多巴胺聚乙烯亚胺纳米颗粒核酸复合物(pda/peinps/na)。
23.为解决上述技术问题,本发明的提供的技术方案是:一种聚多巴胺聚乙烯亚胺纳米颗粒核酸复合物(pda/peinps/na)的制备方法,包括以下步骤:
24.(1)聚多巴胺溶液的制备:将多巴胺溶于水中,加热;加入碱的水溶液,发生自聚合反应形成聚多巴胺溶液;
25.(2)聚多巴胺聚乙烯亚胺纳米颗粒的合成;将聚乙烯亚胺添加到步骤(1)得到的聚
多巴胺溶液中发生希夫碱反应与迈克尔加成反应,然后通过纯化获得聚多巴胺聚乙烯亚胺纳米颗粒;
26.(3)pda/pei nps/na的合成:将步骤(2)中得到的聚多巴胺乙烯亚胺纳米颗粒溶解于灭菌水,加入核酸,混合均匀,即可;
27.步骤(1)中,所述加热的温度为40
‑
60℃;优选为50℃;所述碱为naoh,其在水中的摩尔浓度为5
‑
8mmol/l;所述多巴胺和碱的投料质量比为5
‑
10:1;所述自聚合反应的时间为1
‑
6小时;所述自聚合反应的温度为20
‑
70℃;
28.步骤(2)中,所述聚乙烯亚胺为支化聚乙烯亚胺,所述聚乙烯亚胺的分子量为5
‑
30kda,所述聚多巴胺和聚乙烯亚胺质量比为10:1
‑
1:10;
29.步骤(3)中,所述聚多巴胺乙烯亚胺纳米颗粒与核酸的质量比为1:1
‑
100:1;所述聚多巴胺乙烯亚胺纳米颗粒在灭菌水中的浓度为0.1
‑
1000mg/ml。
30.在本发明一个优选的实施方案中,步骤(1)中,所述多巴胺和碱的投料质量比为7.4:1;所述碱在水中的摩尔浓度6.8mmol/l;所述自聚合反应的温度为45
‑
55℃;
31.步骤(2)中,所述聚乙烯亚胺的分子量为25kda,所述聚多巴胺和聚乙烯亚胺质量比为2:1
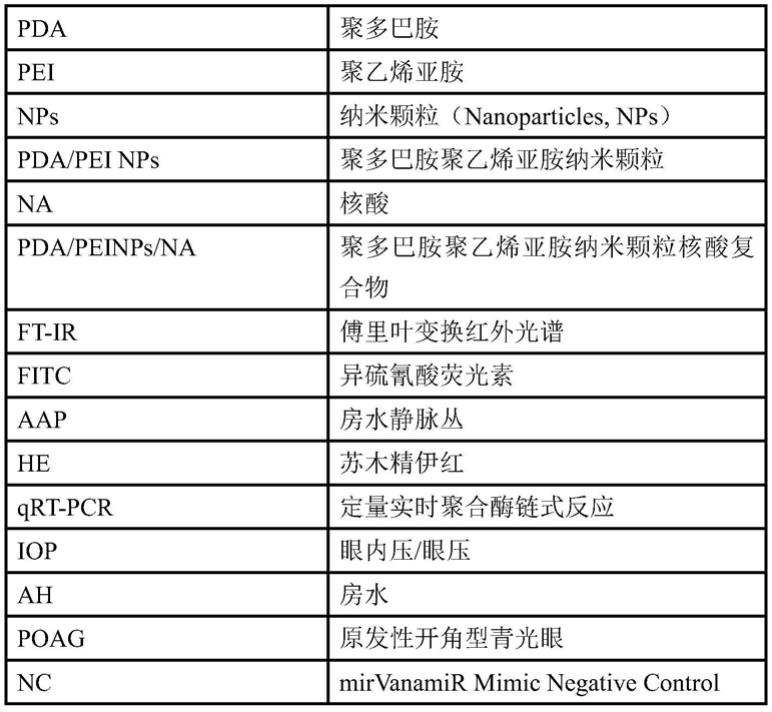
‑
1:2;
32.步骤(3)中,所述聚多巴胺乙烯亚胺纳米颗粒与核酸的质量比为5:1
‑
20:1;所述聚多巴胺乙烯亚胺纳米颗粒在灭菌水中的浓度为1
‑
10mg/ml。
33.本发明所述核酸可以选自dna、sirna、microrna或shrna。
34.在本发明的一些实施例中,所述microrna为mir
‑
21
‑
5p。
35.本发明要解决的第五个技术问题是提供一种聚多巴胺聚乙烯亚胺纳米颗粒核酸复合物。
36.为解决上述技术问题,本发明的提供的技术方案是:本发明方法制备得到的聚多巴胺聚乙烯亚胺纳米颗粒核酸复合物。
37.在本发明的一些实施例中制备得到的pda/pei nps/na为pda/pei nps/mir
‑
21
‑
5p,pda/pei nps/nc,pda/pei nps/pgl
‑
3。
38.本发明要解决的第六个技术问题是提供一种聚多巴胺聚乙烯亚胺纳米颗粒核酸复合物在制备治疗眼部疾病的药物中的用途。
39.为解决上述技术问题,本发明的提供的技术方案是:本发明聚多巴胺聚乙烯亚胺纳米颗粒核酸复合物在制备治疗眼部疾病的药物中的用途。所述眼部疾病为因眼压高引起的各种类型开角型青光眼、闭角型青光眼、高眼压症、正常眼压青光眼、头痛、视神经萎缩以及视神经退行性病变。
40.本发明首次公开pda/pei nps作为用于眼内转染的mirna传递纳米颗粒。pda/pei nps不仅增强了目标遗传材料的稳定性,而且具有与商用载体相当的转染能力;与脂质体(lipofectamin)转染相同量的核酸,转染效率无明显统计学差异。更重要的是,它显示出相当低的细胞毒性,与转染相同量的核酸市售脂质体和pei相比,细胞活性分别增加1和2倍,是原代细胞转染的不错选择。
41.本发明的pda/pei nps易于保存,在冷藏(4℃)的情况下可至少保存一年。而目前常用的体内转染脂质体试剂稳定性远低于本发明制备得到的pda/pei nps。例如,市售体内转染脂质体试剂invivofectamin必须冷冻保存(
‑
20℃),并且解冻次数超过4次即会影响活
性。眼内转染更常用的慢病毒则需要超低温(
‑
80℃)保存,并且同样每融化一次活性降低至前一次70%。
42.本发明pda/pei nps载核酸形成复合物的方法相对简单,对于核酸片段,只需将pda/pei nps载体与核酸混匀并静置1小时左右,无论是离体细胞还是在体组织均可立即使用。而市售脂质体需要在额外无血清介质中孵育,病毒类载体则要提前构建与病毒匹配的质粒载体。目前常用的市售试剂invivofectamin通常需要在50摄氏度孵育30分钟。
43.本发明所述核酸可以选自dna、sirna、microrna或shrna。
44.在本发明的一些实施例中,所述核酸为mir
‑
21
‑
5p、无功能序列长度相同的对照核酸nc与常用的质粒载体pgl
‑
3。
45.在猪房水静脉从内皮细胞(aap)中,pda/pei nps/mir
‑
21
‑
5p的转染显示单层通透性降低,并伴随着细胞骨架的重新分布。体内研究表明,前房内注射pda/pei nps/nc的小鼠具有良好的生物相容性,没有明显的毒性或炎症反应证据。组织分布研究显示流出组织和角膜积聚。通过促进传统流出途径,mir
‑
21
‑
5p在流出组织中的过表达可以显著降低iop。
46.在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
47.小rna(microrna,mirna)是一种小分子高度保守的核酸片段(19
‑
23bp),广泛存在于生物体中,在细胞增殖、分化、代谢、功能等方面发挥重要的调节作用。一种mirna可与多种mrna相互结合起作用,导致对应的mrna降解或者沉默表达,进而引起内源性蛋白水平改变而调节生物学功能,实现多靶点调控不同通路的目的,同时减少外源性给药造成的副作用。目前,使用病毒或者纳米材料,均能使mirna在一定时间内稳定上调或者下调,能够在较长时间内起到一定的生物学调节功能。因此,能够解决传统青光眼药物因有效时间较短而反复多次用药带来的副作用。
48.小干扰rna(small interfering rna;sirna)有时称为短干扰rna(short interfering rna)或沉默rna(silencing rna),是一个长20到25个核苷酸的双股rna,在生物学上有许多不同的用途。目前已知sirna主要参与rna干扰(rnai)现象,以带有专一性的方式调节基因的表达。此外,也参与一些与rnai相关的反应途径,例如抗病毒机制或是染色质结构的改变。不过这些复杂机制的反应途径目前尚未明了。
49.短发夹rna,(short hairpin rna,shrna是的缩写)。shrna包括两个短反向重复序列,中间由一茎环(loop)序列分隔的,组成发夹结构,由polⅲ启动子控制。随后在连上5
‑
6个t作为rna聚合酶ⅲ的转录终止子。
50.本发明中,pda/pei nps/核酸复合物,pda/pei nps/na,聚多巴胺聚乙烯亚胺核酸纳米复合物和聚多巴胺聚乙烯亚胺纳米颗粒核酸复合物含义相同。
51.pgl
‑
3为包含荧光素酶报告基因的dna质粒,是常用的载体质粒,用于携带目的基因。
52.nc是确定无功能的和mir
‑
21
‑
5p长度相同,仅序列不同的rna。
53.invivofectamin是市售在体转染脂质体试剂,实施例中所用为invivofectamin3.0。
54.lipofectamin是市售细胞转染脂质体试剂,实施例中所用为lipofectamin2000,
是实验室常用的细胞转染试剂。
55.有益效果:
56.1、本发明首次将pda/pei nps作为独立核酸载体用于在眼内治疗。
57.2、本发明方法制备得到的pda/pei nps能够稳定的分散在溶液里,不需要借助表面承载,因此不需要眼内植入外来物。本发明方法制备得到的pda/pei nps能够更稳定的形成球状多聚体,吸附载上更多核酸。
58.3、本发明pda/pei nps/核酸复合物的制备简单,将pda/pei nps和核酸两部分混匀后即可使用;本发明制备得到的pda/pei nps/核酸复合物可以在4℃较长稳定保存的,稳定性高;毒性低,生物可降解,几乎没有免疫反应。
附图说明
59.图1本发明合成反应图。
60.图2实施例1扫描电镜,其中图2a为实施例1或2步骤(2)制备得到的pda/pei nps,图2b为实施例1步骤(3)pda/pei nps/pgl
‑
3复合物;图2c为实施例2步骤(3)制备得到的pda/pei nps/nc复合物;电镜观察下,载体pda/pei nps与载满核酸的载体pda/pei nps/pgl
‑
3、pda/pei nps/nc复合物呈现圆形分散分布。
61.图3实施例4中不同浓度pda/pei nps/nc复合物转染细胞后细胞活性比较
62.图4实施例4中不同转染试剂转染相同量的nc对细胞活性的影响
63.图5实施例5中pda/pei nps/pgl
‑
3与与常用的细胞转染试剂lipofectamin2000的转染能力
64.图6实施例6中pda/pei nps/pgl
‑
3与pda/pei nps/nc在七天内粒子直径
65.图7实施例6中pda/pei nps/pgl
‑
3储存2、4、6天后转染能力与0天对比
66.图8实施例6中pda/pei nps/pgl
‑
3储存0、2、4、6天后转染能力与lipofectamin储存相同时间后转染能力对比
67.图9实施例7中转染aap细胞之后,带有荧光的粒子在细胞胞质内分布图
68.图10实施例7中不同转染浓度对应胞内过表达倍数
69.图11实施例7中转染pda/pei nps/mir
‑
21
‑
5p之后,跨膜电阻值图。
70.图12实施例8中眼内转染1天后,无炎症细胞浸润图。
71.图13实施例8中眼内转染1天后,无炎症因子荧光表达图。
72.图14实施例8中眼内转染1天后,无炎症因子mrna表达图。
73.图15实施例9中在体实验,图15a显示在前房内pda/pei nps分布聚集于角膜与流出组织,图15b显示体内显著过表达mir
‑
21
‑
5p。
74.图16实施例9中眼内转染中的mirna载体后iop测量。图16a显示pda/pei nps/mir
‑
21
‑
5p有显著降眼压的作用,图16b、图16c显示这种作用是通过增加传统途径流出发挥的。
75.图17 pda/pei nps/mirna溶液的稳定性测试。
具体实施方式
76.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条
件进行。
77.本发明实施例中所用的原料或试剂除特别说明之外,均市售可得。主要采购自以下公司:
78.试剂原料供应商多巴胺sigma
‑
aldrich聚乙烯亚胺sigma
‑
aldrichmirvana mirna mimicsthermolipofectamine 2000thermopgl
‑
3金斯瑞
79.本发明中使用的缩写具有本领域常规含义,例如以下缩写的含义如下:
[0080][0081]
实施例1:pda/pei nps/pgl
‑
3的制备
[0082]
(1)聚多巴胺(pda)溶液的制备。
[0083]
将多巴胺(100.6mg)溶于50ml水中,并在搅拌的同时加热至50℃。在碱还是性ph环境下,多巴胺会自聚合成聚多巴胺,加入0.34ml naoh(1mol/l),反应3.5小时。
[0084]
(2)聚多巴胺聚乙烯亚胺纳米颗粒(pda/pei nps)的合成
[0085]
将pei(100mg,分子质量25000)添加到步骤(1)得到的溶液中,反应持续2小时。原材料多巴胺:pei质量比为1:1。然后用超滤管(50k)以4500rpm的超滤作用获得pda/pei nps,并洗涤几次。冻干pda/pei nps,然后进一步观察鉴定。
[0086]
如图2a所示,在扫描电镜下,获得的pda/pei nps为球形形态,并且分散良好(图
2a)。pda/pei np的平均大小确定为209nm。由于pei的修饰,这些纳米粒子带正电,表面电位约为26mv。同时,通过元素分析测得碳:氮的质量分数为2.2。由此可以计算出pda/pei nps中pda和pei的实际质量比为1:2.5。基于ft
‑
ir光谱结构分析显示,pda/pei nps中归因于pda与pei中氨基之间的反应形成的c=n键(1660cm
‑
1处产生波峰),表明pda/pei nps成功合成。
[0087]
(3)pda/pei nps/pgl
‑
3质粒(dna)的合成
[0088]
将步骤(2)中得到的聚多巴胺乙烯亚胺纳米颗粒,配置成5mg/ml浓度的母液,将pda/pei nps与核酸pgl
‑
3质粒(dna)以质量比10:1混合,超声混匀30分钟,再静置2小时,用灭菌pbs稀释到合适浓度使用。
[0089]
pda/pei nps/pgl
‑
3质粒的表征
[0090]
由于pda/pei nps带正电,因此可以通过静电力使带负电的核酸凝聚。同样pda/pei nps/pgl
‑
3质粒为球形形态分散良好(图2b)。使用dls研究了那些pda/pei nps/核酸复合物的大小和表面电荷。
[0091]
pda/pei nps/pgl
‑
3质粒的尺寸约为240nm,具有窄的尺寸分布,略大于pda/pei nps的尺寸,这表明核酸已装载在这些复合物中。同样,该结果表明,获得的复合物在加载核酸后保持分散,并且在复合物形成过程中它们不会聚集,tem观察也证实了这一点。此外,这些复合物的电势低于pda/pei nps,前者接近21mv。这些复合物的正表面电荷可以帮助它们与带负电荷的细胞膜相互作用,促进细胞内在化和基因转染。
[0092]
实施例2:pda/pei nps/nc的制备
[0093]
(1)聚多巴胺(pda)溶液的制备。
[0094]
将多巴胺(100.6mg)溶于50ml水中,并在搅拌的同时加热至50℃。在碱性ph环境下,多巴胺会自聚合成聚多巴胺,加入0.34ml naoh(1mol/l),反应6小时。
[0095]
(2)聚多巴胺聚乙烯亚胺纳米颗粒(pda/pei nps)的合成
[0096]
将pei(100mg,分子质量25000)添加到步骤(1)得到的溶液中,反应持续2小时。原材料多巴胺:pei质量比为1:1。然后用超滤管(50k)以4500rpm的超滤作用获得pda/pei nps,并洗涤几次。冻干pda/pei nps,然后进一步观察鉴定。
[0097]
(3)pda/pei nps/nc的合成
[0098]
将步骤(2)中得到的聚多巴胺乙烯亚胺纳米颗粒,配置成5mg/ml浓度的母液,将pda/pei nps与nc以质量比10:1混合,超声混匀30分钟,再静置2小时,用灭菌pbs稀释到合适浓度使用。
[0099]
同样pda/pei nps/nc为球形形态分散良好(图2c),约为240nm,具有更窄的尺寸分布,略大于pda/pei nps,与pda/pei nps/pgl
‑
3质粒大小相同。同样,该结果表明,装载rna类核酸后获得的复合物仍保持分散,不会聚集,tem观察也证实了这一点。此外,与pda/pei nps/pgl
‑
3质粒相同pda/pei nps/nc的电势低于pda/pei np。
[0100]
实施例3:pda/pei nps/mir
‑
21
‑
5p的制备
[0101]
(1)聚多巴胺(pda)溶液的制备。
[0102]
将多巴胺(100.6mg)溶于50ml水中,并在搅拌的同时加热至50℃。在碱性ph环境下,多巴胺会自聚合成聚多巴胺,加入0.34ml naoh(1mol/l),反应6小时。
[0103]
(2)聚多巴胺聚乙烯亚胺纳米颗粒(pda/pei nps)的合成
nps/mir
‑
21
‑
5p来研究mirna过表达的功效(图10)。转染后24小时,将2、4和8μg/ml pda/pei nps/mir
‑
21
‑
5p显着提高细胞内mir
‑
21
‑
5p水平14.92、20.24和32.58倍(n=3,p<0.001,t检验)。通常很难将核酸转入原代细胞。然而,在这项研究中,pda/pei np在原代aap细胞中表现出出色的转染性能。
[0117]
我们进一步研究了转染pda/pei nps/mir
‑
21
‑
5p后重排的细胞骨架是否最终会导致aap细胞通透性的改变。测量了跨内皮电阻(teer),这是一个反映内皮屏障通透性的物理概念。内皮细胞的单层可以在完整的电路中充当电阻。因此,电阻值可以反应内皮细胞的通透性。teer越低表示细胞通透性越高。图11中,mir
‑
21
‑
5p转染24小时后,teer从25.20
±
0.62ω
·
cm2显着降低至17.50
±
0.27ω
·
cm2(n=5,p<0.001,t检验)。这表明通过mir
‑
21
‑
5p过表达,aap细胞的通透性显着增加。
[0118]
实施例8:体内生物毒性检测
[0119]
我们进一步研究了前房内注射后体内pda/pei nps的生物相容性。通过裂隙灯,苏木精伊红(he)染色,免疫荧光和定量实时聚合酶链(qrt
‑
pcr)评估pda/pei nps/nc处理的眼睛的反应。通过将未处理的对侧眼作为对照,裂隙灯下没有观察到明显的眼内炎症。具体而言,角膜局部雾度显示穿刺点附近出现短暂性水肿,并在72小时内消失。扩张的血管在24小时出现在角膜缘附近,并在48小时恢复到正常外观。在观察期间,前房,瞳孔和晶状体未受影响。如图12he染色所示,在前房组织中未发现总体结构异常或炎性细胞浸润。
[0120]
为了进一步研究nc加载的pda/pei nps溶液的生物相容性,通过免疫荧光和qrt
‑
pcr检测了前节葡萄膜炎的炎症标志物。s100a8和s100a9是活性眼内炎症生物标志物。其中一种s100a8在前节组织中被证明可促进炎症细胞迁移和浸润,表明急性炎症。与阳性对照(小鼠皮肤)相比,炎症标记s100a8/a9的前节染色为阴性(图13)。同时,pcr结果显示,与对照组相比,s100a8的mrna在角膜,虹膜和前房角组织中无统计学意义(图14,n=3,p>0.05,配对t检验)。两者合计,我们的结果表明pda/pei nps对小鼠眼内使用相对安全。
[0121]
实施例9:在体转染与生物学功能
[0122]
由于体外研究证实了pda/pei nps的安全性和转染能力,因此通过前房内注射递送负载的pda/pei nps颗粒来研究体内转染能力和功能。首先,pda/pei nps颗粒的眼内分布特征显示,fitc标记的pda/pei nps注射后24小时,在前房角,角膜和睫状体中观察到荧光信号,表明纳米颗粒在体内被细胞成功内吞(图15a)。具体而言,荧光强度在流出组织,角膜内皮和基质中较高,而在虹膜和睫状体中较低。为了量化常规流出组织中mir
‑
21
‑
5p的过表达能力,进行了qrt
‑
pcr。在解剖的流出组织中,转染24小时后,mir
‑
21
‑
5p显着增加了2.08倍(图15b,每只眼睛0.3μgmir
‑
21
‑
5p或nc,n=3,p<0.05,配对t检验)。
[0123]
在验证pda/pei nps是否为眼内转染中的mirna载体后,我们随后测量了iop以探索功能改变。图16a结果显示,对照和对侧pda/pei nps/mir
‑
21
‑
5p注射眼的平均iop在治疗前分别为(14.2
±
0.7)mmhg和(14.2
±
0.9)mmhg(n=10,配对t检验)。注射后6小时,pda/pei nps/mir
‑
21
‑
5p的平均iop显着下降了pda/pei nps/nc眼睛的12.9%。统计学上显着的iop降低至少持续48小时,最大的下降发生在注射后8小时(13.7%)。72小时后,对侧眼睛的眼压恢复至相同水平。我们的数据表明,通过前房内注射pda/pei nps/mir
‑
21
‑
5p可以降低iop。
[0124]
然后,通过摘除眼睛的眼睛灌注研究流出速率。如图16b、c在mir
‑
21
‑
5p过表达的
眼睛中,流速和常规流出显着增加(n=10,配对t检验)。常规流出的数据与小鼠aap细胞通透性的升高和iop的降低相吻合。因此,这些结果支持以下观点:前房内注射pda/pei nps/mir
‑
21
‑
5p可以通过靶向schlemm管内皮细胞通过常规的流出途径成功降低iop。
[0125]
使用存储的溶液(3天和7天)通过iop测量在体内测试pda/pei nps/mirna溶液的稳定性。图17结果显示,储存的溶液还具有降低iop的能力(两组均n=6,配对t检验)。给药后8小时,最大眼压降低为13.77%(3天)和13.08%(7天),与现制的复合物几乎相同。对于两种储存溶液,iop显著降低持续至少24小时,证明pda/pei nps对mir
‑
21
‑
5p具有理想的保存效果。
[0126]
总之,我们成功地设计生产了pda/pei nps,作为用于眼内转染的mirna传递纳米颗粒。pda/pei nps不仅增强了目标遗传材料的稳定性,而且具有与商用载体相当的转染能力。更重要的是,它显示出相当低的细胞毒性,与市售脂质体和pei相比,是原代细胞转染的不错选择。在aap细胞中,pda/pei nps/mir
‑
21
‑
5p的转染显示单层通透性降低,并伴随细胞骨架的重新分布。体内研究表明,前房内注射pda/pei nps/nc的小鼠具有良好的生物相容性,没有明显的毒性或炎症反应证据。组织分布研究显示流出组织和角膜积聚。通过促进传统流出途径,mir
‑
21
‑
5p在流出组织中的过表达表现出较低的iop。因此,pda/pei nps/mir
‑
21
‑
5p可能是成功的增加房水引流的抗青光眼药物。pda/pei nps可能在其他眼内应用中有望成为有希望的核酸纳米载体。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1