肿瘤干细胞标志分子EpCAM的亲和力成熟结合蛋白及其应用的制作方法
本发明属于亲和力成熟结合蛋白领域,特别涉及一种肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白及其应用。
背景技术:
研究表明,肿瘤细胞之间存在异质性,在肿瘤实体中肿瘤细胞可形成一个层次结构,该层次结构中有一群具有起始肿瘤能力的细胞,即为肿瘤干细胞。肿瘤干细胞理论认为肿瘤干细胞与普通肿瘤细胞类似,具有自我更新、无限增殖、多能性和耐药性等特点。目前治疗肿瘤的主要途径包括手术切除,放疗或者化疗,但这些方法均不能有效的杀死肿瘤干细胞。由于肿瘤干细胞具有起始肿瘤能力,利用基因工程技术,设计靶向肿瘤干细胞特异性生物标记分子,成为治疗癌症的另一个有效途径。
上皮细胞黏附分子(epcam)由314个氨基酸组成,包含三个结构域:胞外段结构域(epex),单次跨膜结构域和胞内结构域(epicd)。在一些正常组织和细胞中,如食道鳞状上皮,epcam蛋白表达水平较低,而在某些具有增殖能力的细胞中,如肝再生细胞,epcam的表达水平相对较高,在正常的胃粘膜中无epcam表达,但是在77%的胃癌患者胃粘膜中均发现epcam重新表达。另外,还有相当一部分组织在发生癌变时出现了epcam表达水平较正常组织高的情况,如胰腺、乳腺、卵巢、结肠、膀胱和前列腺等。这些研究表明,epcam可能在组织细胞恶性转化过程中发挥着一定的作用,且可能参与肿瘤发生发展相关的代谢过程。此外,还有研究表明,epcam蛋白胞外段缺失在肿瘤中经常发生,而这种情况与肿瘤的恶性程度相关。epcam蛋白参与肿瘤细胞增殖、形成、侵袭、迁移、诊断、药物抵抗和抗肿瘤治疗等过程,因此,以epcam作为肿瘤治疗的靶点,拥有广阔的应用前景,具有极高的医学价值。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,提供一种肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白。
本发明的另一目的在于提供上述肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白的应用。
本发明的目的通过下述技术方案实现:一种肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白,是aep17d8亲和力成熟结合蛋白;或是aep14e3亲和力成熟结合蛋白、aep18e7亲和力成熟结合蛋白、aep20c10亲和力成熟结合蛋白和aep24d10亲和力成熟结合蛋白中的至少一种与aep17d8亲和力成熟结合蛋白组合形成的结合蛋白;
所述的aep14e3亲和力成熟结合蛋白的氨基酸序列如seqidno:1所示;
所述的aep17d8亲和力成熟结合蛋白的氨基酸序列如seqidno:2所示;
所述的aep18e7亲和力成熟结合蛋白的氨基酸序列如seqidno:3所示;
所述的aep20c10亲和力成熟结合蛋白的氨基酸序列如seqidno:4所示;
所述的aep24d10亲和力成熟结合蛋白的氨基酸序列如seqidno:5所示。
编码上述肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白的核苷酸序列,是编码所述的aep17d8亲和力成熟结合蛋白的核苷酸序列;或是编码所述的aep14e3亲和力成熟结合蛋白的核苷酸序列、编码所述的aep18e7亲和力成熟结合蛋白的核苷酸序列、编码所述的aep20c10亲和力成熟结合蛋白的核苷酸序列和编码所述的aep24d10亲和力成熟结合蛋白的核苷酸序列中的至少一种与编码所述的aep17d8亲和力成熟结合蛋白的核苷酸序列组合形成的核苷酸序列。
编码所述的aep14e3亲和力成熟结合蛋白的核苷酸序列优选如seqidno:9所示。
编码所述的aep17d8亲和力成熟结合蛋白的核苷酸序列优选如seqidno:10所示。
编码所述的aep18e7亲和力成熟结合蛋白的核苷酸序列优选如seqidno:11所示。
编码所述的aep20c10亲和力成熟结合蛋白的核苷酸序列优选如seqidno:12所示。
编码所述的aep24d10亲和力成熟结合蛋白的核苷酸序列优选如seqidno:13所示。
所述的肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白的氨基酸序列如下所示:
aep14e3:maqvqllesggglvqpggslrlscaasgvkfsnhdmtwvrqapgkglewvsainsgggstyyadsvkgrftisrdnskntlylqmnslraedtavyycarlgrqarvphhmrfwgqgtlvtvssaaa;
aep17d8:maqvqllesggglvqpggslrlscvasgvkfsnhdmtwvrqapgkglewvsainsgggstyyadsvkgrftisrdnskntlylqmnslraedtavyycarmgrqarvphhmrfwgqgtlvtvssaaa;
aep18e7:maqvqllesggglvqpggslrlscaasgvkfsnhdmtwvrqapgkglewvsainsgggityyadsvkgrftisrdnskntlylqmnslraedtavyycarmgrqarvphhmrfwgqgtlvtvssaaa;
aep20c10:maqvqllesggglvqpggslrlscaasgvkfrnhdmtwvrqapgkslewvsainsgggstyyadsvkgrftisrdnskntlylqmnslraedtavyycarmgrqarvphhmrfrgqgtlvtvssaaa;
aep24d10:maqvqllesggglvqpggslrlscaasglkfsnhdmtwvrqapgkglewisainsgggstyyadsvkgrftisrdnskntlylqmkslraedtavyycarmgrqarvphhmrfwgqgtlvtvssaaa。
所述的肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白的核苷酸序列如下所示:
aep14e3:atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccggagttaagtttagcaatcacgatatgacctgggtccgccaggctccagggaagggtctagagtgggtatcagccattaatagcggaggcggtagcacatactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacgctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgagattgggtcgtcaggcgcgtgttccgcaccacatgcggttttggggtcagggaaccctggtcaccgtctcgagcgcggccgca;
aep17d8:atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgtagcctccggagttaagtttagcaatcacgatatgacctgggtccgtcaggctccagggaagggtctagagtgggtatcagccattaatagcggaggcggtagcacatactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacgctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgagaatgggtcgtcaggcgcgtgttccgcaccacatgcggttttggggtcagggaaccctggtcaccgtctcgagcgcggccgca;
aep18e7:atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccggagttaagtttagcaatcacgatatgacctgggtccgccaggctccagggaagggtctagagtgggtatcagccattaatagcggaggcggtatcacatactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacgctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgagaatgggtcgtcaggcgcgtgttccgcaccacatgcggttttggggtcagggaaccctggtcaccgtctcgagcgcggccgca;
aep20c10:atggcccaggtgcagctgctggagtctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccggagttaagtttagaaatcacgatatgacctgggtccgccaggctccagggaagagtctagagtgggtatcagccattaatagcggaggcggtagcacatactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacgctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgagaatgggtcgtcaggcgcgtgttccgcaccacatgcggtttaggggtcagggaaccctggtcaccgtctcgagcgcggccgca;
aep24d10:atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccggacttaagtttagcaatcacgatatgacctgggtccgccaggctccagggaagggtctagagtggatatcagccattaatagcggaggcggtagcacatactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacgctgtatctgcaaatgaagagtctgcgtgccgaggacaccgcggtatattattgcgcgagaatgggtcgtcaggcgcgtgttccgcaccacatgcggttttggggtcagggaaccctggtcaccgtctcgagcgcggccgca。
从上可见,编码所述的aep14e3亲和力成熟结合蛋白、aep17d8亲和力成熟结合蛋白、aep18e7亲和力成熟结合蛋白、aep20c10亲和力成熟结合蛋白和aep24d10亲和力成熟结合蛋白的核苷酸序列均由381个碱基组成,对应编码的氨基酸均为127个。这5个亲和力成熟结合蛋白均含有3个cdr(互补决定簇)区:cdr1含有9个氨基酸;cdr2含有6个氨基酸;cdr3含有14个氨基酸。
所述的肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白的制备方法,包括以下步骤:通过基因合成编码上述肿瘤干细胞标志分子epcam亲和力成熟结合蛋白的核苷酸序列,将其克隆至表达载体,再将重组后的表达载体转入宿主细胞进行表达、纯化,得到肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白;或是通过蛋白合成的方法,得到所述的肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白。
上述epcam亲和力成熟结合蛋白在制备用于治疗epcam高表达为特征疾病的抗体药物中的应用。
所述的epcam高表达为特征疾病为癌症。
所述的癌症为epcam高表达肿瘤,包括胰腺癌、乳腺癌、膀胱癌、食管癌、鼻咽癌,头颈癌、胃癌、结直肠癌、前列腺癌、肺癌,卵巢瘤,宫颈癌,子宫癌,肝癌,脾脏癌,肾脏癌和脑肿瘤。
本发明相对于现有技术具有如下的优点及效果:
1.本发明通过以实验室前期筛选得到的野生型epcam结合蛋白为模板,采用易错pcr法构建其亲和力成熟文库,再通过噬菌体展示技术,在噬菌体亲和力成熟结合蛋白文库中筛选与epcam胞外部分相互作用的蛋白,可在无需使用抗原免疫人体的情况下获得人体蛋白的亲和力成熟结合蛋白。
2.本发明提供的亲和力成熟结合蛋白具有结构稳定性高,易于改造等优点。
3.本发明提供的亲和力成熟结合蛋白结合高表达的原核宿主进行蛋白表达,能显著降低亲和力成熟结合蛋白的生产成本,促进亲和力成熟结合蛋白的应用。
附图说明
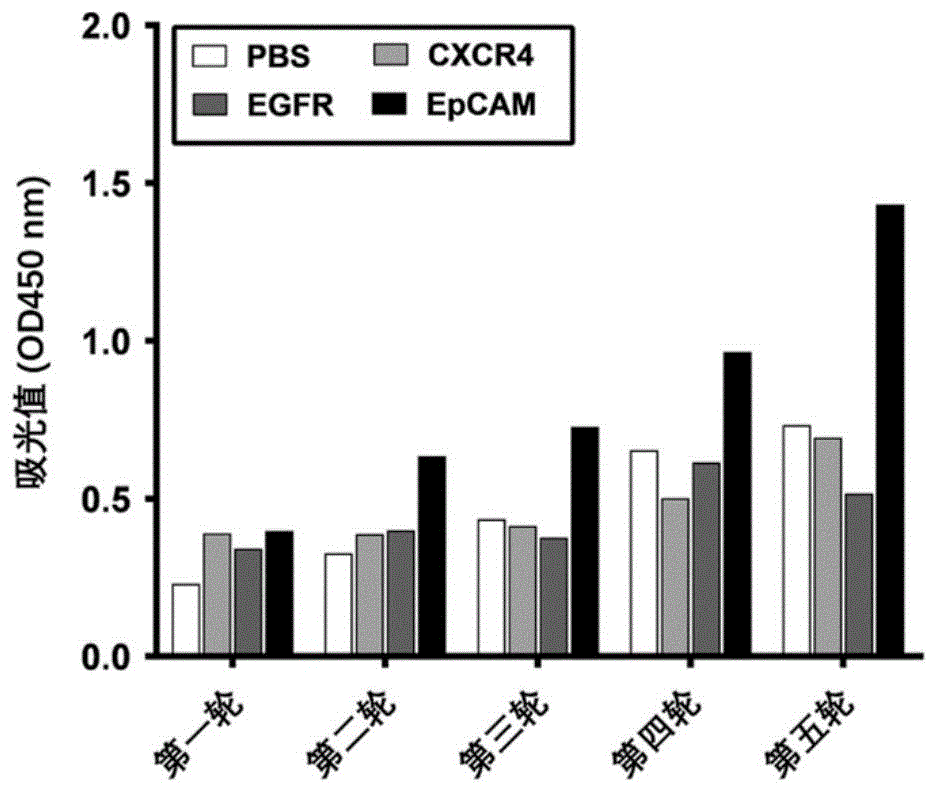
图1为多克隆噬菌体elisa分析亲和力成熟结合蛋白文库的筛选富集结果图;其中,pbs孔为空白对照,cxcr4和egfr为无关抗原对照,epcam孔包被了合成的epcam多肽;一抗为各轮文库筛选后扩增纯化获得的多克隆噬菌体结合蛋白,二抗为hrp标记的抗噬菌体m13的抗体。结果表明:从第1轮至第5轮筛选抗体文库过程中,采用epcam多肽筛选文库得到的od450nm值逐轮升高,说明每轮采用epcam多肽筛选得到的文库中epcam抗体克隆的富集逐渐升高。
图2是单克隆噬菌体elisa筛选与epcam结合的阳性克隆结果图;其中,a为单克隆噬菌体elisa挑选具有比aep3d4野生型结合蛋白较高epcam结合能力的候选阳性单克隆结果图;b是将筛选得到的候选阳性单克隆进行多个无关抗原噬菌体elisa验证其epcam特异性的结果图,包被的抗原包括7个无关抗原、epcam完整胞外段和epcam多肽,(n=3)。图2b结果表明:与野生型结合蛋白aep3d4相比,aep14e3、aep17d8和aep18e7与epcam胞外段和epcam多肽具有较高的结合能力,aep20c10和aep24d10与epcam多肽具有类似的结合能力。
图3是亲和力成熟结合蛋白表达纯化后的sds-page电泳图;其中,a为aep14e3亲和力成熟结合蛋白的电泳图,b为aep17d8亲和力成熟结合蛋白的电泳图,c为aep18e7亲和力成熟结合蛋白的电泳图,d为aep20c10亲和力成熟结合蛋白的电泳图,e为aep24d10亲和力成熟结合蛋白的电泳图;泳道m为蛋白marker,泳道1为未诱导大肠杆菌全蛋白样品,泳道2为诱导后的大肠杆菌全蛋白,泳道3为破碎上清,泳道4为破碎沉淀,泳道5为过柱液,泳道6为洗杂液,泳道7-11为目的蛋白洗脱液1-5。
图4为采用elisa方法检测纯化的epcam亲和力成熟结合蛋白与epcam的结合的结果图;其中,**p<0.01相对于pbs,##p<0.01相对于aep3d4(n=3)。结果表明:与野生型结合蛋白aep3d4相比,aep17d8和aep18e7与epcam胞外段和epcam多肽具有较高的结合能力,aep20c10和aep24d10具有类似的结合能力,aep14e3具有较低的结合能力。此外,5个亲和力成熟结合蛋白与无关抗原的结合并不明显,说明5个亲和力成熟结合蛋白能够特异性地与epcam结合。
图5是采用mtt法检测亲和力成熟结合蛋白对肿瘤细胞du145、pc-3和mcf-7增殖能力的影响结果图;其中,a为du145细胞,b为pc-3细胞,c为mcf-7细胞;*p<0.05相对于0μg/ml,**p<0.01相对于0μg/ml,***p<0.001相对于0μg/ml,****p<0.0001相对于0μg/ml(n=3)。结果表明:对于du145细胞,与野生型结合蛋白aep3d4相比,在使用100μg/ml浓度时,aep17d8和aep18e7能较有效地抑制肿瘤细胞的增殖。对于pc-3细胞,与aep3d4相比,在使用50和100μg/ml浓度时,aep17d8和aep18e7能较有效地抑制肿瘤细胞的增殖。对于mcf-7细胞,与aep3d4相比,在使用50μg/ml浓度时,aep17d8能较有效地抑制肿瘤细胞的增殖。
图6是采用流式细胞分析仪和annexinv/pi双染试剂盒检测亲和力成熟结合蛋白对肿瘤细胞du145,pc-3和mcf-7凋亡的影响结果;其中,a、c、e分别是du145细胞、pc-3细胞、mcf-7细胞的结果照片图;b、d、f分别是依据a、c、e得到的数据分析结果图;*p<0.05相对于对照,**p<0.01相对于对照,***p<0.001相对于对照,****p<0.0001相对于对照,###p<0.001相对于aep3d4(n=3)。结果表明:对于du145、pc-3和mcf-7细胞,与野生型结合蛋白aep3d4相比,aep17d8和aep18e7具有较高的诱导凋亡能力。aep20c10和aep24d10具有类似的诱导凋亡能力,aep14e3具有较低的诱导凋亡能力。
图7是采用细胞划痕方法检测亲和力成熟结合蛋白对肿瘤细胞du145和mcf-7迁移能力的影响结果图;其中,a、c分别是du145细胞、mcf-7细胞的结果照片图;b、d分别是依据a、c得到的数据分析结果图。结果表明:5个亲和力成熟结合蛋白能够抑制du145和mcf-7细胞的迁移,随着5个亲和力成熟结合蛋白浓度升高,癌细胞的迁移能力能够逐步地降低。
图8是采用transwell迁移方法检测亲和力成熟结合蛋白对肿瘤细胞迁移的影响结果图;a、c、e分别是du145细胞、pc-3细胞、mcf-7细胞的结果;b、d、f分别是依据a、c、e得到的数据分析结果图。结果表明:5个亲和力成熟结合蛋白能够抑制du145、pc-3和mcf-7细胞的迁移,随着5个亲和力成熟结合蛋白浓度升高,癌细胞的迁移能力能够逐步地降低。
图9是采用transwell侵袭方法检测亲和力成熟结合蛋白对肿瘤细胞侵袭的影响结果图;a、c分别是du145细胞、mcf-7细胞的结果照片图;b、d分别是依据图a、c得到的数据分析结果图。结果表明:5个亲和力成熟结合蛋白能够抑制du145和mcf-7细胞的侵袭,随着5个亲和力成熟结合蛋白浓度升高,癌细胞的侵袭能力能够逐步地降低。
图10是采用动物实验检验亲和力成熟结合蛋白aep17d8和aep18e7在du145前列腺癌细胞小鼠模型中对肿瘤增长的影响结果图;其中,a为给药后肿瘤的体积变化折线图;b为给药周期结束时各组的肿瘤大小;c为给药周期结束后各组的肿瘤重量;d为肿瘤组织的he染色及免疫组化分析结果图;e是利用imagepro-plus软件对d的免疫组化分析片图进行光密度分析得到的数据分析结果图;*p<0.05相对于pbs,**p<0.01相对于pbs,***p<0.001相对于pbs,****p<0.0001相对于pbs,#p<0.05相对于aep3d4(n=4-5)。结果表明:根据图10a肿瘤体积图,与野生型结合蛋白aep3d4相比,aep17d8具有较好地抑制体内肿瘤细胞生长的能力。根据图10b肿瘤图,与野生型结合蛋白aep3d4相比,aep17d8具有较小的肿瘤。根据图10c肿瘤重量图,与野生型结合蛋白aep3d4相比,aep17d8具有较低的肿瘤重量。根据图10e免疫组化染色的积分光密度结果,与野生型结合蛋白aep3d4相比,aep18e7和aep17d8能够在体内抑制肿瘤细胞增殖(ki67)。2个亲和力成熟结合蛋白对于肿瘤组织血管生成(cd31)和诱导肿瘤细胞凋亡(c-caspase-3)没有明显影响。
具体实施例
下面结合具体实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1构建亲和力成熟结合蛋白文库
(一)随机易错pcr扩增结合蛋白基因片段
(1)根据按照genemorphii随机突变试剂盒(购自美国agilent)的厂家说明书对epcam的野生型结合蛋白aep3d4进行易错pcr。实验例中作为野生型结合蛋白的aep3d4具有如seqidno:6所示氨基酸序列。编码aep3d4的核苷酸序列如seqidno:14所示。aep3d4是实验室前期以epcam为抗原筛选得到的。
(2)配制pcr反应体系:10×mutazymeiireactionbuffer5μl、40mmdntpmix1μl、引物f(seqidno:17)(250ng/μl,5’-actggcccaggcggccatggcccaggtgcagctg-3’)0.5μl、引物r(seqidno:18)(250ng/μl,5’-actggccggcctggcctgcggccgcgctcgagacg-3’)0.5μl、模板1ng、mutazymeiidnapolymerase(2.5u/μl)1μl、无菌去离子水补足至50μl。
(3)pcr反应:95℃2min;95℃30sec、65℃30sec、72℃1min,30个循环;72℃10min。
(4)采用琼脂糖凝胶电泳鉴定pcr产物:将pcr产物与上样缓冲液(loadingbuffer)混匀后上样至一个凝胶孔道内,并在邻近孔道点入5μldnamarker,设置电压参数为130v跑25min后,将其放入凝胶成像系统中观察结果。
(5)从琼脂糖凝胶上切下目的条带,放入1.5mlep管中,通过pcr产物纯化试剂盒对pcr产物进行切胶回收纯化。加入与凝胶等量的结合缓冲液(bindingbuffer,×p2)约350μl,随后将该ep管放在56℃水浴锅中直至凝胶完全溶解,溶解后的混合物体积约700μl。
(6)将hibinddna离心柱与收集管装好,然后将步骤(5)得到的700μl混合物加入离心柱中,10000g室温离心1min。
(7)倒掉收集管中液体后,将收集管重新装到离心柱上,向离心柱中加入结合缓冲液(bindingbuffer,×p2)约300μl,13000g室温离心1min。
(8)倒掉收集管中液体后,将收集管重新装到离心柱上,向离心柱中加入spw洗涤缓冲液(washbuffer)约700μl,13000g室温离心1min。
(9)倒掉收集管中液体后,将收集管重新装到离心柱上,14000g室温离心2min以去除离心柱中残余液体。
(10)将离心柱放在一个新的ep管中,向离心柱中加入去离子水30μl并静置2min,然后12000g室温离心1min,ep管中洗脱的液体即为扩增的pcr产物,-20℃保存。
(二)将pcr产物酶连至噬菌体质粒pcomb3xss中
(1)分别配制pcomb3xss噬菌体质粒(购自武汉淼灵生物)和pcr产物的酶切反应体系:
pcomb3xss质粒2μg、酶切缓冲液5μl、sfii1μl,无菌水补足至50μl。
pcr产物2.4μg、酶切缓冲液5μl、sfii1μl,无菌水补足至50μl。
(2)将步骤(1)的酶切反应体系在放置在50℃水浴锅中过夜酶切。
(3)采用琼脂糖凝胶电泳和切胶回收分离纯化酶切产物。
(4)配制酶连反应体系:pcomb3xss酶切产物0.2μg、目的片段酶切产物0.24μg、10×t4dna连接酶缓冲液(t4dnaligasebuffer)5μl、t4dna连接酶(t4dnaligase)2μl,无菌水补足至50μl。
(5)步骤(4)的酶连反应体系在放置在16℃中过夜酶连,得到连接产物。
(三)电转酶连产物构建亲和力成熟结合蛋白文库
(1)将连接产物以电穿孔法转化至大肠杆菌dh5α电转感受态细胞中,每转化1支感受态使用2μl酶连产物,转化后立即加入950μl37℃预热的soc培养基,于37℃震荡培养1h,共转化了20支感受态。
(2)培养结束后,取出10μl菌液梯度稀释并涂布于含有100μg/ml氨苄青霉素的tye平板,37℃过夜培养后根据长出的菌落数量来计算细菌文库的库容。
(3)将培养后的20支菌液全部加入至1l含有100μg/ml氨苄青霉素和1%(w/v)葡萄糖的2×ty培养基中,于37℃继续震荡培养2h。
(4)待培养结束后,3200g离心10min收集菌体沉淀,并重悬于20ml含有15%(v/v)甘油的2×ty培养基中,即得到亲和力成熟结合蛋白的细菌文库,可于-80℃保存。
(5)取500μl步骤(4)中得到的细菌文库,加入至50ml含有100μg/ml氨苄青霉素和1%(v/v)葡萄糖的2×ty培养基中,然后于37℃震荡培养约2h直至菌液的od600nm为0.5左右。
(6)取出培养好的菌液,向其中加入约1011km13辅助噬菌体,并于37℃水浴锅中孵育30min。
(7)孵育结束后,3200g离心10min收集菌体沉淀,并重悬于50ml含有100μg/ml氨苄青霉素、50μg/ml卡那霉素和0.1%(w/v)葡萄糖的2×ty培养基中,于25℃震荡培养20h。
(8)3200g离心10min,将培养上清收集至干净的离心管中,向其中加入约为上清1/5体积的20%peg-nacl溶液,并立即放在冰上孵育1h。
(9)在4℃下3200g离心30min,去掉上清,用2mlpbs重悬噬菌体沉淀,即为噬菌体文库,采用0.22μm过滤膜对重悬的噬菌体溶液进行过滤除菌,于-80℃保存噬菌体文库。
(10)噬菌体文库滴度测定:取步骤(9)得到的噬菌体文库10μl进行梯度稀释用于侵染大肠杆菌tg1菌液,37℃水浴锅中孵育30min后,取适量菌液涂布到含100μg/ml氨苄青霉素的tye平板,37℃过夜培养后根据长出的菌落数量来计算噬菌体文库的滴度。得到的噬菌体文库滴度为1.43×1013pfu/ml。
实施例2从噬菌体文库中筛选富集epcam亲和力成熟结合蛋白
(1)向nunc免疫管中加入浓度为100μg/ml的epcam多肽(上海波泰生物科技公司)溶液4ml进行抗原包被,同时向另一支免疫管中加入4mlpbs缓冲液作为空白对照,2支免疫管均于4℃过夜。
(2)2支免疫管均弃包被液,并加入4.5mlpbs洗涤免疫管,重复洗涤步骤3次,然后加入4.5ml的2%(w/v)bsa溶液,于室温下封闭免疫管2h。
(3)2支免疫管均弃封闭液,并加入4.5mlpbs洗涤免疫管,重复洗涤步骤3次,然后加入4ml含有5×1012噬菌体的2%(w/v)bsa溶液,于室温下孵育2h。
(4)2支免疫管均弃噬菌体溶液,并加入4.5mlpbst洗涤免疫管,重复洗涤步骤10次。
(5)向2支免疫管中分别加入浓度为1mg/ml的胰蛋白酶溶液500μl,在室温下连续翻转10min以洗脱噬菌体,洗脱后可于4℃保存2周。
(6)取步骤(5)得到的噬菌体洗脱液125μl用于侵染875μl处于对数生长期的大肠杆菌tg1菌液,37℃水浴锅中孵育30min。
(7)侵染结束后,从中取出10μl菌液梯度稀释并涂布于含有100μg/ml氨苄青霉素的tye平板,37℃过夜培养后根据长出的菌落数量来计算洗脱的噬菌体数。剩余的990μl菌液离心并重悬后涂布于含有100μg/ml氨苄青霉素和1%(w/v)葡萄糖的tye平板,于37℃过夜培养。
(8)向步骤(7)过夜培养后的平板中加入2ml含15%(v/v)甘油的2×ty培养基,刮下平板上生长的所有菌落,可于-80℃长期保存。
(9)取步骤(8)得到的甘油菌500μl扩大培养,生成的噬菌体文库用于下一轮的筛选,具体步骤同以上实施例1中第(三)部分的步骤(5)-(10)。
(10)以上即为第1轮筛选,一共需进行5轮筛选。第2-5轮筛选包被的多肽浓度依次为50、50、25、25μg/ml,加入免疫管中用于孵育的噬菌体文库均来自上一轮洗脱后扩增所得文库,此外,每轮使用pbst洗涤免疫管的次数由第1轮的10次增加为20次,其余步骤同第1轮一样。
实施例3多克隆噬菌体elisa
(1)向nunc96孔免疫板的孔中加入浓度为2μg/ml的epcam多肽溶液100μl进行抗原包被,同时在其他孔中分别加入100μlpbs缓冲液,2μg/ml的cxcr4和egfr多肽溶液作为空白对照和阴性对照,于4℃包被过夜。
(2)弃包被液,并向每孔加入250μlpbs洗涤免疫板,重复洗涤步骤3次,每次洗涤后均需反复拍打免疫板使孔内残留液体尽量去除干净,然后加入200μl浓度为2%(w/v)的bsa溶液,于室温下封闭2h。
(3)弃封闭液,并加入250μlpbs洗涤免疫管,重复洗涤步骤3次,每次洗涤后均需反复拍打免疫板使孔内残留液体尽量去除干净,然后分别加入100μl含有以上每轮筛选产出的噬菌体文库的2%bsa溶液作为一抗,于室温下孵育1h。
(4)弃噬菌体溶液,并加入250μlpbst洗涤免疫管,重复洗涤步骤3次,每次洗涤后均需反复拍打免疫板使孔内残留液体尽量去除干净,然后加入100μl已按产品说明书要求稀释的hrp-m13(hrp标记的抗m13抗体)作为二抗,于室温下孵育1h。
(5)弃二抗溶液,并加入250μlpbst洗涤免疫管,重复洗涤步骤3次,每次洗涤后均需反复拍打免疫板使孔内残留液体尽量去除干净。
(6)向每孔同时加入100μltmb显色液,避光室温孵育5min后,向每孔同时加入50μl浓度为1m的稀硫酸使得显色反应终止,然后在酶标仪上测定od450nm波长处的吸光值。图1结果表明:从第1轮至第5轮筛选抗体文库过程中,采用epcam多肽筛选文库得到的od450nm值逐轮升高,说明每轮采用epcam多肽筛选得到的文库中epcam抗体克隆的富集逐渐升高。
实施例4单克隆噬菌体elisa
(1)取实施例2中第5轮筛选产出的噬菌体文库梯度稀释后侵染处于对数生长期的大肠杆菌tg1菌液,37℃水浴锅中孵育30min后,取部分菌液涂布于含有100μg/ml氨苄青霉素和1%(w/v)葡萄糖的tye平板,37℃震荡培养过夜。
(2)在96孔板的孔中加入200μl含有100μg/ml氨苄青霉素和1%(w/v)葡萄糖的2×ty培养基,然后从步骤(1)过夜培养的平板上使用无菌枪头挑取62个单克隆菌落,分别接种到每孔中,此外,以实验室前期筛选得到的野生型结合蛋白aep3d4和aep4g2作为阳性对照,将含有这2个结合蛋白噬菌体的菌液分别接种至2个孔中,于37℃震荡培养过夜。
(3)取一个新的96孔板,在孔中加入195μl含有100μg/ml氨苄青霉素和1%(w/v)葡萄糖的2×ty培养基,取步骤(2)过夜培养的菌液5μl接种到新的板上,于37℃震荡培养2h。旧板中的菌液分别加入终含量为15%(v/v)的甘油并做好标记,于-80℃保存。
(4)将培养2h后的菌液分别转移至ep管中,并向每管加入108pfukm13辅助噬菌体,于37℃水浴锅中孵育30min。
(5)孵育结束后,3200g离心10min收集菌体沉淀,并重悬于200μl含有100μg/ml氨苄青霉素、50μg/ml卡那霉素和0.1%(w/v)葡萄糖的2×ty培养基中,于25℃震荡培养20h。
(6)在4℃下3200g离心10min后,分别收集上清100μl并加入300μl浓度为2%(w/v)的bsa溶液,混匀后作为单克隆噬菌体elisa中的一抗。
(7)单克隆噬菌体elisa的其余步骤同以上多克隆噬菌体elisa实验方法中描述的全部步骤,仅需将一抗换成步骤(6)中制备得到的含有单克隆噬菌体的2%bsa溶液即可。实验共挑取了1116个单克隆,图2a为其中32个具有代表性的单克隆噬菌体的elisa结果,候选阳性克隆已采用箭头指出,候选阳性克隆需要具有比野生型结合蛋白aep3d4更高的吸光值。
(8)将筛选得到的候选阳性克隆送华大基因公司进行了dna测序,将测得的基因序列翻译后互相进行比对,并与野生型结合蛋白aep3d4比对,排除氨基酸序列相同的重复克隆和未发生氨基酸突变的克隆,最终得到了8个候选阳性克隆。
(9)将挑选出的8个候选阳性克隆进行多个无关抗原噬菌体elisa以验证其epcam抗原特异性,包被的抗原包括:ifn、ngf、cd28、cd31、csf1r、icam-1、egfr、epcam完整胞外段(8种抗原均购自北京义翘神州生物技术公司)、epcam多肽;每种抗原设3个复孔。一抗为采用8个候选阳性克隆分别制备的噬菌体,其余步骤同单克隆噬菌体elisa一样。最终选择了5个亲和力成熟结合蛋白的阳性克隆,其氨基酸序列如seqidno.1~5所示,分别命名为aep14e3、aep17d8、aep18e7、aep20c10、aep24d10。图2b的结果表明:与野生型结合蛋白aep3d4相比,aep14e3、aep17d8和aep18e7与epcam胞外段和epcam多肽具有较高的结合能力,aep20c10和aep24d10与epcam多肽具有类似的结合能力。
实施例5获得阴性对照结合蛋白
本实验室前期实验通过噬菌体展示技术,采用人表皮生长因子受体2(her2)和血管内皮生长因子(vegf)合成多肽为抗原,采用以上方法筛选人源结合蛋白噬菌体文库,通过elisa挑选2个不与对应抗原结合的克隆,分别获得阴性对照结合蛋白aher2-13c1和ave201,将其作为阴性对照。阴性对照结合蛋白aher2-13c1和ave201分别如seqidno:7和seqidno:8所示氨基酸序列;编码aher2-13c1和ave201的核苷酸序列分别如seqidno:15和seqidno:16所示。
实施例6epcam亲和力成熟结合蛋白的表达与纯化
(1)由金唯智生物科技公司合成亲和力成熟结合蛋白的dna序列,并插入pet-22b质粒的ncoi和noti酶切位点之间,构建其原核表达质粒。
(2)取一支大肠杆菌bl21(de3)感受态细胞,置于冰上化冻后,向其中加入0.1μg步骤(1)中构建好的表达质粒,轻轻拨动ep管混匀后继续放在冰上30min,然后放入预热好的42℃水浴锅中2min,快速转移至冰上冰浴2min,最后加入900μllb培养基于37℃震荡培养1h,涂布含有100μg/ml氨苄青霉素的lb平板并37℃培养过夜。
(3)用无菌枪头挑取一个平板上长出的单克隆,接种至5ml含有100μg/ml氨苄青霉素的lb培养基中,于37℃震荡培养过夜。
(4)将菌液以1:100的比例稀释到500ml含有100μg/ml氨苄青霉素的lb培养基中,于37℃震荡培养约2h直至菌液的od600nm为0.6,取1ml菌液作为未诱导的菌液样品。
(5)向菌液中加入终浓度为0.5mmol/l的iptg溶液,于25℃继续震荡培养约6h诱导蛋白表达,然后取1ml菌液作为诱导的菌液样品,剩余菌液在4℃下5000g离心5min后,保留菌体沉淀。
(6)以20ml预冷的破菌缓冲液重悬菌体沉淀于50ml烧杯中,并将烧杯转移至冰上,采用超声破碎仪对菌液进行破碎,设置破碎仪参数如下:功率为40%,工作4s,停8s,工作时间为40min。菌体破碎完成后,在4℃下15000g离心30min,上清和沉淀分别取样后,保留上清液。
(7)取ni-nta纯化柱,向柱中加入10倍柱体积的去离子水过柱,再加入10倍柱体积破菌缓冲液平衡柱子,然后将步骤(6)中保留的上清液过柱,期间收集少量过柱液作为样品。上清液过完柱后,向柱中加入20ml洗杂缓冲液(含有20mm咪唑的破菌缓冲液)洗涤柱体,期间收集少量过柱液作为洗杂样品。最后向柱中加入10ml洗脱缓冲液(含有200mm咪唑的破菌缓冲液)洗脱目的蛋白,并立即收集5管洗脱液,共5ml,每管洗脱液均取少量用作蛋白洗脱样品并使用nanodrop2000检测其蛋白浓度。
(8)向柱中加入5倍柱体积的8m尿素洗涤柱子,再使用30倍柱体积的去离子水过柱以去除残留的尿素,封闭纯化柱的两端,4℃保存。
(9)将蛋白洗脱液转移至透析袋中,袋内液体不超过透析袋1/2体积,封住袋口后悬浮于2l预冷的pbs缓冲液中,在4℃下使用磁力搅拌器搅拌透析过夜后,收集袋中蛋白溶液,使用nanodrop2000检测其蛋白浓度并保存于-80℃。
(10)sds-page凝胶电泳鉴定蛋白大小:向步骤(9)中保留的样品中加入sds-page缓冲液(buffer),在95℃煮沸10min后分别点样于sds-page凝胶的上样孔中,并在邻近孔道加入5μl蛋白marker,设置电压为70v跑30min直至样品跑过浓缩胶后,设置电压为110v继续电泳直至样品跑到凝胶底部。取出凝胶并切除其浓缩胶,使用考马斯亮蓝染色液在室温下对凝胶染色30min后,使用脱色液在室温下对凝胶脱色直至能看见清晰的条带,拍照记录蛋白电泳的结果。结果如图3所示,5幅sds-page电泳图均可看出,在15kda左右,诱导后全蛋白比未诱导全蛋白目的条带颜色更深,说明这5个结合蛋白被成功诱导表达。每幅sds-page电泳图最后5条是经ni-ntahis·bindresin纯化柱纯化后收集的目的蛋白洗脱液电泳条带,从图中可看出,在15kda左右的目的条带单一且颜色较深,说明在过柱纯化时已将大部分杂蛋白洗掉,洗脱液中主要含有我们所需的目的蛋白。
实施例7elisa检测纯化的亲和力成熟结合蛋白与抗原的结合能力
将表达纯化的亲和力成熟结合蛋白用于多个无关抗原elisa,包被的抗原包括:ifn、ngf、cd28、cd31、csf1r、icam-1、egfr、epcam完整胞外段、epcam多肽。一抗换为浓度为20μg/ml的5个亲和力成熟结合蛋白(aep14e3、aep17d8、aep18e7、aep20c10、aep24d10)和野生型结合蛋白aep3d4,二抗为蛋白a-辣根过氧化物酶(proteina-hrp),其余步骤同实施例4单克隆噬菌体elisa。
图4结果表明:与野生型结合蛋白aep3d4相比,aep17d8和aep18e7与epcam胞外段和epcam多肽具有较高的结合能力,aep20c10和aep24d10具有类似的结合能力,aep14e3具有较低的结合能力。此外,5个亲和力成熟结合蛋白与无关抗原的结合并不明显,说明5个亲和力成熟结合蛋白能够特异性地与epcam结合。
实施例8细胞传代培养
(1)在显微镜下观察细胞的生长密度,当密度达到约90%时,需要对细胞进行传代。
(2)将细胞培养皿移入超净工作台中,吸出皿中的培养基,并向培养皿中加入2mlpbs缓冲液洗涤残留的培养基。
(3)去除pbs后,向培养皿中加入2ml浓度为0.25%的胰酶溶液用于消化贴壁细胞。
(4)在显微镜下观察细胞形态,当细胞开始回缩变圆时,向培养皿中加入2ml含有10%v/v小牛血清的dmem细胞培养基,终止消化。
(5)轻轻吹打贴壁细胞,待细胞从培养皿上脱落后,将皿中的细胞悬液吸至离心管中,1000g离心5min。
(6)离心完成后,去除上清液,向离心管中加入1ml含有10%v/v小牛血清的dmem细胞培养基,轻轻吹打细胞沉淀至完全悬浮
(7)从离心管中取约330μl的重悬细胞液吸至100mm细胞培养皿中,再向皿中加入7.7ml含有10%v/v小牛血清的dmem细胞培养基,混合均匀后,放入37℃,含5%co2的细胞培养箱中培养。
实验例9mtt法检测纯化后的亲和力成熟结合蛋白对肿瘤细胞增殖能力的影响
(1)使用胰酶消化处于对数生长期的细胞,1000g离心5min收集细胞,使用含有10%v/v小牛血清的dmem细胞培养基重悬细胞,向细胞计数板中加入10μl细胞悬液进行计数,然后调节细胞密度为2.5×104个/ml,接种到96孔细胞培养板,每孔加200μl,即5000个细胞/孔。
(2)将细胞培养板放入37℃,含5%co2的细胞培养箱中培养过夜,使细胞贴壁。
(3)吸出过夜培养基,向培养板中每孔加入200μl含有10%v/v小牛血清的dmem细胞培养基,使细胞饥饿培养6h。
(4)向每孔分别加入不同终浓度(0、25、50和100μg/ml)的8个结合蛋白(aep14e3、aep17d8、aep18e7、aep20c10、aep24d10、aep3d4、aher2-13c1和ave201),然后将培养板放入37℃,含5%co2的细胞培养箱中培养72h。
(5)向每孔分别加入30μlmtt溶液(5mg/ml),然后将培养板放入37℃,含5%co2的细胞培养箱,继续培养4h。
(6)吸出细胞培养基,向每孔加入200μldmso,并将培养板放在摇床上快速摇晃10min,使产生的晶体充分溶解。
(7)在酶标仪上测定od570nm波长处的吸光值。图5结果表明:对于人前列腺癌du145细胞,与野生型结合蛋白aep3d4相比,在使用100μg/ml浓度时,aep17d8和aep18e7能较有效地抑制肿瘤细胞的增殖。对于人前列腺癌pc-3细胞,与aep3d4相比,在使用50和100μg/ml浓度时,aep17d8和aep18e7能较有效地抑制肿瘤细胞的增殖。对于人乳腺癌mcf-7细胞,与aep3d4相比,在使用50μg/ml浓度时,aep17d8能较有效地抑制肿瘤细胞的增殖。
实验例10流式检测亲和力成熟结合蛋白对肿瘤细胞凋亡的影响
(1)使用胰酶消化处于对数生长期的细胞,1000g离心5min收集细胞,使用含有10%v/v小牛血清的dmem细胞培养基重悬细胞,向细胞计数板中加入10μl细胞悬液进行计数,然后接种到6孔细胞培养板,每孔接种2.5×105个细胞。
(2)将细胞培养板放入37℃,含5%co2的细胞培养箱中培养过夜,使细胞贴壁。
(3)吸出过夜培养基,向每孔加入2ml含1%v/v小牛血清的dmem培养基,使细胞饥饿培养4h。
(4)向每孔分别加入终浓度为100μg/ml的结合蛋白(aep14e3、aep17d8、aep18e7、aep20c10、aep24d10、aep3d4、aher2-13c1和ave201),同时每种肿瘤细胞各设置一个没加结合蛋白的对照组,然后将培养板放入37℃、含5%co2的细胞培养箱中培养48h。
(5)使用胰酶消化细胞,1000g离心5min后去掉上清,分别收集每孔的细胞。
(6)使用pbs缓冲液重悬细胞,1000g离心5min后去掉上清,以洗去残留培养基,此步骤重复2次。
(7)按照凋亡检测试剂盒说明书操作,将洗涤后的细胞重悬于195μl结合缓冲液,再向其中加入5μlannexinv-fitc,室温下避光孵育15min。
(8)孵育结束后,1000g离心5min后去掉上清,再加入200μl结合缓冲液洗涤细胞,然后1000g离心5min,去掉上清。
(9)将洗涤后的细胞重悬于190μl结合缓冲液,再向其中加入10μl碘化丙啶(propidiumiodide),轻轻吹打混匀。
(10)处理好的细胞在4h内,使用流式细胞仪检测肿瘤细胞凋亡情况。结果如图6所示,图6a、6c、6e分别是凋亡的du145、pc-3和mcf-7肿瘤细胞二维散点图,可以看出图中5个亲和力成熟结合蛋白组的凋亡细胞比对照均有增多(右半边);图6b、6d、6f分别是从图6a、6c、6e得到的凋亡比例。结果表明:对于du145、pc-3和mcf-7细胞,与野生型结合蛋白aep3d4相比,aep17d8和aep18e7具有较高的诱导凋亡能力;aep20c10和aep24d10具有类似的诱导凋亡能力,aep14e3具有较低的诱导凋亡能力。
实验例11细胞划痕法检测纯化后的亲和力成熟结合蛋白对肿瘤细胞迁移能力的影响
(1)使用胰酶消化处于对数生长期的细胞,1000g离心5min收集细胞,使用含有10%v/v小牛血清的dmem细胞培养基重悬细胞,向细胞计数板中加入10μl细胞悬液进行计数,然后接种到12孔细胞培养板,每孔接种2×105个细胞。
(2)将细胞培养板放入37℃、含5%co2的细胞培养箱中培养过夜,使细胞贴壁。
(3)吸出过夜培养基,向每孔加入500μl含1%v/v小牛血清的dmem培养基,使细胞饥饿培养6h。
(4)使用无菌的200μl枪头在贴壁的细胞上划一条笔直的线,然后吸出孔内的培养基,并用pbs缓冲液洗涤细胞2次,以洗去划痕时被刮下的细胞团。
(5)向每孔加入500μl含1%v/v小牛血清的dmem培养基,然后分别加入不同终浓度(0、25、50和100μg/ml)的8个结合蛋白(aep14e3、aep17d8、aep18e7、aep20c10、aep24d10、aep3d4、aher2-13c1和ave201)。
(6)在显微镜下拍照,记录下结合蛋白孵育0h的划痕宽度(l0)。
(7)将细胞培养板放入37℃、含5%co2的细胞培养箱中培养24h后,在显微镜下拍照,记录下结合蛋白孵育24h的划痕宽度(l24)。
(8)在photoshop中使用标尺工具分别测量0h和24h的图片中的划痕宽度,并使用公式计算迁移率:(l0﹣l24)/l0×100%。结果如图7所示,图7a、7c分别是du145、mcf-7肿瘤细胞的划痕图,图7b、7d分别是从图7a、7c计算得到的迁移率。结果表明:5个亲和力成熟结合蛋白能够抑制du145和mcf-7细胞的迁移,随着5个亲和力成熟结合蛋白浓度升高,癌细胞的迁移能力能够逐步地降低。
实验例12transwell迁移实验检测结合蛋白对肿瘤细胞迁移能力的影响
(1)使用胰酶消化处于对数生长期的细胞,1000g离心5min收集细胞,使用含有1%v/v小牛血清的dmem细胞培养基重悬细胞,向细胞计数板中加入10μl细胞悬液进行计数,然后调节细胞密度为2.5×105个/ml,
(2)将transwell小室(8μm孔径)放置于24孔细胞培养板中,取200μl细胞悬液接种到小室的上室中,即每个小室5×104个细胞,向每个小室的上室中加入不同终浓度(0、25、50和100μg/ml)的8个结合蛋白(aep14e3、aep17d8、aep18e7、aep20c10、aep24d10、aep3d4、aher2-13c1和ave201),并在下室中加入500μl含20%v/v小牛血清的dmem培养基。
(3)将细胞培养板放入37℃、含5%co2的细胞培养箱中培养24h。
(4)吸出上室和下室中的培养基,用棉签擦掉上室中的基质胶和未侵袭的细胞。
(5)在下室加入500μl4%多聚甲醇,固定细胞10min后,吸出固定液,在下室加入500μl0.1%w/v结晶紫染色液,室温染色30min。
(6)使用蒸馏水洗涤小室3次后,将小室放在显微镜下拍照。
(7)在下室加入100μl浓度为33%v/v的乙酸溶液,待附着在细胞上的结晶紫充分溶解后,吸出下室中的液体转移至96孔板中,在酶标仪上测定od570nm波长处的吸光值。结果如图8所示,图8a、8c、8e分别是du145、pc-3和mcf-7肿瘤细胞的transwell迁移图;图8b、8d、8f分别是迁移后的du145、pc-3和mcf-7肿瘤细胞的结晶紫洗脱液的吸光值。结果表明:5个亲和力成熟结合蛋白能够抑制du145、pc-3和mcf-7细胞的迁移,随着5个亲和力成熟结合蛋白浓度升高,癌细胞的迁移能力能够逐步地降低。
实验例13transwell侵袭实验检测结合蛋白对肿瘤细胞侵袭能力的影响
将小室放置于24孔细胞培养板中,在上室中加入50μl基质胶(1μg/μl),放入37℃细胞培养箱中12h,使基质胶凝固。剩余步骤同以上实施例12一样。结果如图9所示,图9a、9c分别是du145、mcf-7肿瘤细胞的transwell侵袭图;图9b、9d分别是侵袭后的du145、mcf-7肿瘤细胞的结晶紫洗脱液的吸光值。结果表明:5个亲和力成熟结合蛋白能够抑制du145和mcf-7细胞的侵袭,随着5个亲和力成熟结合蛋白浓度升高,癌细胞的侵袭能力能够逐步地降低。
实施例142个亲和力成熟结合蛋白对小鼠前列腺癌模型的作用
(一)动物饲养与肿瘤建模
(1)从北京华埠康生物科技有限公司购入4周龄的雄性balb/c-nu/nu裸鼠,分笼后饲养于暨南大学实验动物中心的spf级动物实验室,饲养条件为25~27℃恒温,45~50%恒湿,饲养期间的给食给水和消毒换笼工作由专人负责。在10天的动物隔离检疫期过后,可使用裸鼠进行实验操作。
(2)使用胰酶消化处于对数生长期的du145细胞,1000g离心5min收集细胞。
(3)使用10mlpbs缓冲液重悬细胞,1000g离心5min后去掉上清,以洗去残留培养基,此步骤重复2次后,使用适量pbs缓冲液重悬细胞,向细胞计数板中加入10μl细胞悬液进行计数,然后调节细胞密度为5×107个/ml。
(4)使用规格为1ml的一次性注射器吸出100μl细胞悬液,即5×106个细胞,皮下注射至裸鼠右侧腋下。
(5)注射后约10天,裸鼠右侧腋下可见皮下肿瘤时,每隔3天测量一次肿瘤体积,使用游标卡尺测量肿瘤的长度(a)与宽度(b),并通过公式计算肿瘤体积:a×b2×0.5。
(二)结合蛋白给药与肿瘤测量
(1)在裸鼠的肿瘤体积长到约100mm3时,将裸鼠随机分为6组,每组5只。
(2)6组小鼠对应不同的药物治疗组,分别为:pbs空白对照组、阴性结合蛋白对照组、野生型结合蛋白对照组、2个亲和力成熟结合蛋白组、顺铂ddp组,结合蛋白的给药量均为10mg/kg,ddp的给药量为2mg/kg。使用一次性注射器进行尾静脉注射给药,每只裸鼠给药注射100μl,空白对照组则使用100μl无菌pbs缓冲液进行注射。
(3)每3天给药一次,并在每次给药前测量肿瘤体积。在第10次给药后3天,测量肿瘤体积,然后颈椎脱臼处死裸鼠,将裸鼠腋下的肿瘤完整剥出并称量肿瘤重量。结果表明:根据图10a肿瘤体积图,与野生型结合蛋白aep3d4相比,aep17d8具有较好地抑制体内肿瘤细胞生长的能力。根据图10b肿瘤图,与野生型结合蛋白aep3d4相比,aep17d8具有较小的肿瘤。根据图10c肿瘤重量图,与野生型结合蛋白aep3d4相比,aep17d8具有较低的肿瘤重量。
(4)将肿瘤组织放入装有4%w/v多聚甲醛溶液的离心管中,使多聚甲醛溶液浸没肿瘤组织,固定过夜后用于进一步研究。
(三)肿瘤包埋切片与免疫组化分析
(1)配制浓度梯度增高的乙醇溶液:50%→70%→80%→90%→95%→100%,流水冲洗固定后的肿瘤组织,然后依次放入配制好的乙醇溶液中,每个浓度浸泡约1h,使肿瘤组织脱水。
(2)按1:1体积比例配制二甲苯与无水乙醇的混合溶液,然后将脱水的肿瘤组织放入该混合溶液中浸泡1h,再放入二甲苯溶液中浸泡0.5h。
(3)按1:1体积比例配制二甲苯与石蜡的混合溶液,将步骤(2)中浸泡后的肿瘤组织放入该混合溶液中,在40℃下浸蜡40min,再于58℃放入石蜡中包埋70min,重复此步骤1次后,使用切片机将包埋后的肿瘤组织切为6μm厚的石蜡切片。
(4)将石蜡切片放入二甲苯溶液中进行脱蜡处理,再放入浓度递减的乙醇溶液中,最后放入双蒸水中进行水化处理。处理后的切片将分别用于he染色和免疫组化分析。
(5)将用于he染色的切片在室温下用苏木精染色10min,蒸馏水洗去残余染液后,再放入分化液中30s,蒸馏水洗去残余分化液后,在室温下用伊红染色液染色2min。将完成染色的切片依次放入浓度梯度增高的乙醇溶液进行脱水处理,再放入二甲苯溶液中2min进行透明处理并重复此步骤1次。最后使用中性树胶封固切片,并在显微镜下拍照。
(6)将用于免疫组化分析的切片放入pbs缓冲液中洗涤5min,重复3次。在90℃下把切片放入ph=6.0的柠檬酸钠修复液中20min以修复抗原,然后在室温下放入双氧水中30min,再用pbs缓冲液洗涤3次。
(7)将修复后的切片放入封闭液中室温封闭0.5h,pbs洗涤3次后,分别加入1:200稀释后的一抗(ki67,cd31,c-caspase-3)室温孵育1h。pbs洗涤3次后,在室温下加入二抗孵育0.5h。pbs洗涤3次后,在室温下加入dab显色液孵育10min后,双蒸水洗去残余显色液以终止显色反应。
(8)显色后的切片用苏木精衬染,然后按照以上(5)中步骤进行脱水透明处理和封固,并在显微镜下拍照,结果如图10d所示,he染色结果显示,在使用实验药物的治疗组中未发现明显的组织病理学异常。采用imageproplus软件对拍摄的图片进行光密度分析。结果表明:根据图10e免疫组化染色的积分光密度结果,与野生型结合蛋白aep3d4相比,aep18e7和aep17d8能够在体内抑制肿瘤细胞增殖(ki67)。2个亲和力成熟结合蛋白对于肿瘤组织血管生成(cd31)和诱导肿瘤细胞凋亡(c-caspase-3)没有明显影响。
实施例中所用到的试剂的配置方法如下:
(1)pbs缓冲液(ph=7.4):kh2po40.24g、nacl8g、kcl0.2g、na2hpo4·12h2o9.07g。
使用去离子水溶解以上试剂,调节ph后定容至1l,121℃高压蒸汽灭菌20min后,保存于室温。
(2)sds-page电泳缓冲液:甘氨酸18.8g、tris-碱6.04g、sds1g。
使用去离子水溶解以上试剂,定容至1l后保存于4℃。
(3)tae核酸电泳缓冲液:tris-碱4.84g、na2edta·2h2o0.74g、冰醋酸1.1ml。
使用去离子水溶解以上试剂,定容至1l后保存于4℃。
(4)20%peg-nacl溶液:peg6000100g、nacl73g。
使用去离子水溶解以上试剂并定容至0.5l,使用0.22μm过滤器过滤除菌后保存于4℃。
(5)2×ty液体培养基:nacl5g、胰蛋白胨16g、酵母提取物10g。
使用去离子水溶解以上试剂并定容至1l,121℃高压蒸汽灭菌20min后,保存于室温。
(6)tye固体培养基:琼脂粉3g、nacl2g、胰蛋白胨2.5g、酵母提取物1.25g。
使用去离子水溶解以上试剂并定容至0.2l,121℃高压蒸汽灭菌20min,再加入1%葡萄糖无菌溶液,倒平板后保存于4℃。
(7)lb液体培养基:nacl10g、胰蛋白胨10g、酵母提取物5g。
使用去离子水溶解以上试剂并定容至1l,121℃高压蒸汽灭菌20min后,保存于室温。
(8)lb固体培养基:nacl2g、胰蛋白胨2g、酵母提取物1g、琼脂粉3g。
使用去离子水溶解以上试剂并定容至0.2l,121℃高压蒸汽灭菌20min后,待培养基冷却至大约60℃,加入氨苄青霉素和葡萄糖,氨苄青霉素的终浓度为100μg/ml,葡萄糖的终浓度为1%,混匀后倒平板后保存于4℃。
(9)破菌缓冲液:tris碱2.42g、nacl14.6g。
使用去离子水溶解以上试剂并定容至1l,保存于4℃,使用前加入终浓度为2mm的pmsf。
(10)考马斯亮蓝染色液:考马斯亮蓝r-2501g、异丙醇250ml、乙酸100ml。
使用去离子水溶解以上试剂并定容至1l后,保存于室温。
(11)考马斯亮蓝脱色液:乙酸100ml、乙醇50ml。
使用去离子水溶解以上试剂并定容至1l,保存于4℃。
(12)pbst溶液:向pbs缓冲液中加入0.1%的tween20,121℃高压蒸汽灭菌20min后,保存于4℃。
(13)2%bsa溶液:向100mlpbs缓冲液中加入2gbsa粉末,使用0.22μm过滤器过滤除菌后,保存于4℃。
(14)氨苄青霉素溶液(100mg/ml):向10ml去离子水中加入1g氨苄青霉素粉末,使用0.22μm过滤器过滤除菌后,保存于4℃。
(15)卡那霉素溶液(50mg/ml):向10ml去离子水中加入0.5g卡那霉素粉末,使用0.22μm过滤器过滤除菌后,保存于4℃。
(16)胰蛋白酶溶液(10mg/ml):向10mlpbs缓冲液中加入0.1g胰蛋白酶粉末,使用0.22μm过滤器过滤除菌后,保存于-20℃。
(17)iptg溶液(0.5m):向10ml去离子水中加入1.2giptg粉末,使用0.22μm过滤器过滤除菌后,保存于-20℃。
(18)4%多聚甲醛溶液:称取4g多聚甲醛粉末,加入80ml去离子水,在37℃水浴锅中溶解,待完全溶解后定容至100ml,保存于室温。
(19)5×sds-page上样缓冲液:1mtris-hcl(ph6.8)1.25ml、甘油2.5ml、溴酚蓝25mg、sds0.5g。
将试剂定容至5ml,小份(500μl/份)分装,使用前将25μlβ-巯基乙醇加入每小份中,室温保存。
(20)上样缓冲液:同破菌缓冲液。
洗杂缓冲液:量取9.9ml上样缓冲液,加入2m咪唑100μl,充分混匀,现配现用。
洗脱缓冲液:量取9ml上样缓冲液,加入2m咪唑1ml,充分混匀,现配现用。
(21)20%葡萄糖溶液:称取200g葡萄糖粉末溶解于1l去离子水中,使用0.2μm滤器过滤除菌,-4℃保存。
(22)1m硫酸溶液:量取9.8ml浓硫酸缓慢加入187ml去离子水中,充分混匀,室温保存。
(23)30%甘油水溶液:量取15ml甘油加入35ml去离子水中,充分混匀,使用0.22μm滤器过滤除菌,-4℃保存。
(24)100×pmsf储液:称取1.74gpmsf粉末溶解于100ml异丙醇,-20℃保存。
(25)2m咪唑:称取1.14g咪唑粉末溶解于10ml破菌缓冲液,-4℃保存。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他任何未背离本发明的精神实质与原理下所做的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
<110>暨南大学
<120>肿瘤干细胞标志分子epcam的亲和力成熟结合蛋白及其应用
<160>18
<170>siposequencelisting1.0
<223>aep14e3亲和力成熟结合蛋白的氨基酸序列
<400>1
metalaglnvalglnleuleugluserglyglyglyleuvalglnpro
151015
glyglyserleuargleusercysalaalaserglyvallyspheser
202530
asnhisaspmetthrtrpvalargglnalaproglylysglyleuglu
354045
trpvalseralaileasnserglyglyglyserthrtyrtyralaasp
505560
servallysglyargphethrileserargaspasnserlysasnthr
65707580
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
859095
tyrcysalaargleuglyargglnalaargvalprohishismetarg
100105110
phetrpglyglnglythrleuvalthrvalserseralaalaala
115120125
<223>aep17d8亲和力成熟结合蛋白的氨基酸序列
<400>2
metalaglnvalglnleuleugluserglyglyglyleuvalglnpro
151015
glyglyserleuargleusercysvalalaserglyvallyspheser
202530
asnhisaspmetthrtrpvalargglnalaproglylysglyleuglu
354045
trpvalseralaileasnserglyglyglyserthrtyrtyralaasp
505560
servallysglyargphethrileserargaspasnserlysasnthr
65707580
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
859095
tyrcysalaargmetglyargglnalaargvalprohishismetarg
100105110
phetrpglyglnglythrleuvalthrvalserseralaalaala
115120125
<223>aep18e7亲和力成熟结合蛋白的氨基酸序列
<400>3
metalaglnvalglnleuleugluserglyglyglyleuvalglnpro
151015
glyglyserleuargleusercysalaalaserglyvallyspheser
202530
asnhisaspmetthrtrpvalargglnalaproglylysglyleuglu
354045
trpvalseralaileasnserglyglyglyilethrtyrtyralaasp
505560
servallysglyargphethrileserargaspasnserlysasnthr
65707580
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
859095
tyrcysalaargmetglyargglnalaargvalprohishismetarg
100105110
phetrpglyglnglythrleuvalthrvalserseralaalaala
115120125
<223>aep20c10亲和力成熟结合蛋白的氨基酸序列
<400>4
metalaglnvalglnleuleugluserglyglyglyleuvalglnpro
151015
glyglyserleuargleusercysalaalaserglyvallysphearg
202530
asnhisaspmetthrtrpvalargglnalaproglylysserleuglu
354045
trpvalseralaileasnserglyglyglyserthrtyrtyralaasp
505560
servallysglyargphethrileserargaspasnserlysasnthr
65707580
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
859095
tyrcysalaargmetglyargglnalaargvalprohishismetarg
100105110
pheargglyglnglythrleuvalthrvalserseralaalaala
115120125
<223>aep24d10亲和力成熟结合蛋白的氨基酸序列
<400>5
metalaglnvalglnleuleugluserglyglyglyleuvalglnpro
151015
glyglyserleuargleusercysalaalaserglyleulyspheser
202530
asnhisaspmetthrtrpvalargglnalaproglylysglyleuglu
354045
trpileseralaileasnserglyglyglyserthrtyrtyralaasp
505560
servallysglyargphethrileserargaspasnserlysasnthr
65707580
leutyrleuglnmetlysserleuargalagluaspthralavaltyr
859095
tyrcysalaargmetglyargglnalaargvalprohishismetarg
100105110
phetrpglyglnglythrleuvalthrvalserseralaalaala
115120125
<223>aep3d4结合蛋白的氨基酸序列
<400>6
metalaglnvalglnleuleugluserglyglyglyleuvalglnpro
151015
glyglyserleuargleusercysalaalaserglyvallyspheser
202530
asnhisaspmetthrtrpvalargglnalaproglylysglyleuglu
354045
trpvalseralaileasnserglyglyglyserthrtyrtyralaasp
505560
servallysglyargphethrileserargaspasnserlysasnthr
65707580
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
859095
tyrcysalaargmetglyargglnalaargvalprohishismetarg
100105110
phetrpglyglnglythrleuvalthrvalserseralaalaala
115120125
<223>aher2-13c1阴性对照结合蛋白的氨基酸序列
<400>7
metalaglnvalglnleuleugluserglyglyglyleuvalglnpro
151015
glyglyserleuargleusercysalaalaserglytyrservalser
202530
sergluasnmetglytrpvalargglnalaproglylysglyleuglu
354045
trpvalserglyileleualaglyaspglyserthrtyrtyralaasp
505560
servallysglyargphethrileserargaspasnserlysasnthr
65707580
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
859095
tyrcysalaargphethrserglyglnglyserleuargserasppro
100105110
ileargsertrpglyglnglythrleuvalthrvalserseralaala
115120125
ala
<223>ave201阴性对照结合蛋白的氨基酸序列
<400>8
metalaglnvalglnleuleugluserglyglyglyleuvalglnpro
151015
glyglyserleuargleusercysalaalaserglyvalservalser
202530
asnglualametglytrpvalargglnalaproglylysglyleuglu
354045
trpvalserserilethraspglnserglyserthrtyrtyralaasp
505560
servallysglyargphethrileserargaspasnserlysasnthr
65707580
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
859095
tyrcysalaargglyglnargargargglnmethissertyrlysval
100105110
sersertrpglyglnglythrleuvalthrvalserseralaalaala
115120125
<223>编码aep14e3亲和力成熟结合蛋白的核苷酸序列
<400>9
atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctg60
cgtctctcctgtgcagcctccggagttaagtttagcaatcacgatatgacctgggtccgc120
caggctccagggaagggtctagagtgggtatcagccattaatagcggaggcggtagcaca180
tactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacg240
ctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgaga300
ttgggtcgtcaggcgcgtgttccgcaccacatgcggttttggggtcagggaaccctggtc360
accgtctcgagcgcggccgca381
<223>编码aep17d8亲和力成熟结合蛋白的核苷酸序列
<400>10
atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctg60
cgtctctcctgtgtagcctccggagttaagtttagcaatcacgatatgacctgggtccgt120
caggctccagggaagggtctagagtgggtatcagccattaatagcggaggcggtagcaca180
tactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacg240
ctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgaga300
atgggtcgtcaggcgcgtgttccgcaccacatgcggttttggggtcagggaaccctggtc360
accgtctcgagcgcggccgca381
<223>编码aep18e7亲和力成熟结合蛋白的核苷酸序列
<400>11
atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctg60
cgtctctcctgtgcagcctccggagttaagtttagcaatcacgatatgacctgggtccgc120
caggctccagggaagggtctagagtgggtatcagccattaatagcggaggcggtatcaca180
tactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacg240
ctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgaga300
atgggtcgtcaggcgcgtgttccgcaccacatgcggttttggggtcagggaaccctggtc360
accgtctcgagcgcggccgca381
<223>编码aep20c10亲和力成熟结合蛋白的核苷酸序列
<400>12
atggcccaggtgcagctgctggagtctgggggaggcttggtacagcctggggggtccctg60
cgtctctcctgtgcagcctccggagttaagtttagaaatcacgatatgacctgggtccgc120
caggctccagggaagagtctagagtgggtatcagccattaatagcggaggcggtagcaca180
tactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacg240
ctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgaga300
atgggtcgtcaggcgcgtgttccgcaccacatgcggtttaggggtcagggaaccctggtc360
accgtctcgagcgcggccgca381
<223>编码aep24d10亲和力成熟结合蛋白的核苷酸序列
<400>13
atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctg60
cgtctctcctgtgcagcctccggacttaagtttagcaatcacgatatgacctgggtccgc120
caggctccagggaagggtctagagtggatatcagccattaatagcggaggcggtagcaca180
tactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacg240
ctgtatctgcaaatgaagagtctgcgtgccgaggacaccgcggtatattattgcgcgaga300
atgggtcgtcaggcgcgtgttccgcaccacatgcggttttggggtcagggaaccctggtc360
accgtctcgagcgcggccgca381
<223>编码aep3d4亲和力成熟结合蛋白的核苷酸序列
<400>14
atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctg60
cgtctctcctgtgcagcctccggagttaagtttagcaatcacgatatgacctgggtccgc120
caggctccagggaagggtctagagtgggtatcagccattaatagcggaggcggtagcaca180
tactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacg240
ctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgaga300
atgggtcgtcaggcgcgtgttccgcaccacatgcggttttggggtcagggaaccctggtc360
accgtctcgagcgcggccgca381
<223>编码aher2-13c1阴性对照结合蛋白的核苷酸序列
<400>15
atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctg60
cgtctctcctgtgcagcctccggatatagcgttagctctgagaatatgggctgggtccgc120
caggctccagggaagggtctagagtgggtatcaggcattttggcgggagacggtagcaca180
tactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacg240
ctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgaga300
tttacgtcgggtcaggggtcgttgcggtccgaccccatccggtcttggggtcagggaacc360
ctggtcaccgtctcgagcgcggccgca387
<223>编码ave201阴性对照结合蛋白的核苷酸序列
<400>16
atggcccaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctg60
cgtctctcctgtgcagcctccggagttagcgttagcaatgaggctatgggctgggtccgc120
caggctccagggaagggtctagagtgggtatcaagcattactgaccaaagcggtagcaca180
tactacgcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacg240
ctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattattgcgcgaga300
gggcagcgtcgtaggcagatgcattcgtacaaggtcagctcttggggtcagggaaccctg360
gtcaccgtctcgagcgcggccgca384
<223>引物f
<400>17
actggcccaggcggccatggcccaggtgcagctg34
<223>引物r
<400>18
actggccggcctggcctgcggccgcgctcgagacg35
- 还没有人留言评论。精彩留言会获得点赞!