一种益生菌模拟物及其制备方法与流程
1.本发明属于益生菌模拟物制备技术领域,尤其涉及一种益生菌模拟物及其制备方法。
背景技术:
2.目前,毒品滥用问题非常严重。药物依赖与酒精依赖等物质依赖的神经学原理类似,益生菌或益生元调节肠道微生物群是治疗物质依赖的一种有前途和安全的方法。为了评估益生菌和/或益生元对物质依赖的影响,尤其是对成瘾的不同行为方面,如抑郁、焦虑、压力反应、认知、冲动和药物寻求行为的影响,肯定需要进行前瞻性、随机、安慰剂对照的临床试验。
3.甲基苯丙胺成瘾者肠道菌群改变,宁婷婷建立了对甲基丙苯胺(ma)产生依赖的大鼠的条件性位置偏爱模型,然后收集大鼠的粪便,进行16srdna测序发现,在对甲基丙苯胺成瘾的大鼠的肠道微生物与普通饲养的大鼠比较,许多特异的微生物类群发生了变化,其中值得引起注意的有厚壁菌门(产丙酸)的属的相对含量在对冰毒成瘾的大鼠体内下降。后续的气相色谱
‑
质谱检测进一步证实了肠道内丙酸含量也显著下降。因为丙酸与脑
‑
肠轴功能存在密切的关系,而且更为重要的是通过饮食添加丙酸可以显著改善多种精神症状。除此之外,瘤胃菌科的两个属的含量因为对冰毒成瘾而上升,瘤胃菌科被报道与位置记忆呈负相关,与压力呈正相关。因此,该菌类群的变化可以部分说明ma成瘾的一些症状的原因。fulcher等的研究也表明,甲基苯丙胺的使用是导致肠道微生物改变的重要因素。在这项纳入37名人类免疫缺陷病毒
‑
1(human immunodeficiency virus
‑
1,hiv
‑
1)阳性的男性同性性行为受试者的研究中,甲基苯丙胺的使用与肠道微生物中卟啉菌属(porphyromonas)以及颗粒链菌属(granulicatella)细菌丰度的升高,瘤胃球菌属(ruminococcus)、柯林斯氏菌属(collinsella)以及副杆状菌属(parabacteroides)细菌丰度的降低有关。
4.目前尚未发现肠道微生物在甲基苯丙胺依赖中的作用或调控机制的相关研究。基于有限的证据,prakash等提出如下假设:甲基苯丙胺的使用导致肠道屏障及血脑屏障的通透性增高,使肠道微生物及其代谢产物能够穿过被削弱的屏障结构,在循环系统的介导下从肠道进入大脑,并引起一系列的外周及中枢神经系统的免疫炎症反应。上述假设提示,在甲基苯丙胺的作用下,肠道会产生炎症导致肠道屏障功能丧失等一系列肠道疾病问题。针对由甲基苯丙胺引发的肠道疾病问题进行缓解和治疗,可能会对甲基苯丙胺产生正面积极的戒断作用。
5.益生菌对于甲基苯丙胺成瘾的作用,益生菌目前已经被证实可以改善不同人群的生理和心理状态。益生菌的摄入,有助于改善个体对疼痛和负面情绪的整体认知性反应。定期服用含有双歧杆菌和乳杆菌的制剂,较低了肠易激综合征(ibs)患者的焦虑情绪,并降低了大脑杏仁核和额叶边缘区域对于负面情绪刺激的反应。taylor等人发现成人健康女性的焦虑情绪与双歧杆菌数成反比;补充益生菌,同时接受适度的抵抗力训练对于老年人的认知及焦虑功能有显著改善;对于ibs患者以及精神分裂症患者,接受益生菌制剂的治疗后其
焦虑情况均得到了好转。目前尚没有关于物质成瘾人群服用益生菌后心理状态变化的报导,但结合之前的研究可以得出益生菌可能对于成瘾者心理状态有调节作用的结论。
6.此外,将益生菌用于物质成瘾的治疗是物质成瘾研究的趋势。leclercq等人提出,利用益生菌或益生元调节肠道微生物群是治疗酒精依赖的一种有前途和安全的方法。为了评估益生菌和/或益生元对酒精依赖的影响,尤其是对成瘾的不同行为方面,如抑郁、焦虑、压力反应、认知、冲动和药物寻求行为的影响,肯定需要进行前瞻性、随机、安慰剂对照的临床试验。而甲基苯丙胺成瘾与酒精成瘾的神经学机制类似,都是物质影响了人们的奖惩反应。
7.益生菌的施用已显示出作为改善与炎症性肠病(ibd)有关的症状的辅助疗法的功效。根据世界卫生组织的说法,益生菌被定义为“活微生物,当给予适量的微生物时,会对宿主产生健康益处。”这些细菌包括革兰氏阳性杆菌和双歧杆菌,以及一些大肠杆菌菌株,已显示出多种有益作用,例如调节宿主免疫系统,改善上皮屏障功能以及影响肝细胞的平衡。肠道中的各种细菌菌株。
8.将益生菌分离的膜泡(mvs)加载到微粒表面形成益生菌模拟物(pbms),可克服mvs在胃肠道的稀释效应和降解效应,提高mvs的递送浓度。并证明pbms具有抗炎作用,且缓解炎症引起的肠道屏障功能丧失,具有进一步发展成为抗炎制剂的潜力。
9.益生菌具有广阔的发展前景,但由于它们具有增生能力,因此仍不总是适合用作治疗剂。特别是对于长期使用免疫抑制剂治疗ibd的患者,不建议同时使用益生菌,因为它会导致菌血症和败血症。一项研究报告说,大肠杆菌nissle1917(通常用作益生菌的一种菌株)具有与其他大肠杆菌中检测到的致病性相同的基因。一旦这些沉默基因被未知触发物激活,它们可能会在患者中引起致病作用,从而大大限制了益生菌的安全性。
10.通过上述分析,现有技术存在的问题及缺陷为:益生菌对于长期使用免疫抑制剂治疗ibd的患者,会导致菌血症和败血症;同时大肠杆菌具有与其他大肠杆菌中检测到的致病性相同的基因,一旦这些沉默基因被未知触发物激活,它们可能会在患者中引起致病作用,从而大大限制了益生菌的安全性。
11.解决以上问题及缺陷的难度为:由于益生菌存在的增生能力,因此总是不适合用作治理剂,特别是长期使用免疫抑制治疗剂ibd的患者,使用益生菌会导致菌血症和败血症。使用益生菌则需考虑到其增生能力且不能和别的细菌同时使用,而且还需高效快速的将模拟物递送,不影响别的细菌且高效是本技术所解决问题的难度所在。
12.解决以上问题及缺陷的意义为:益生菌模拟物制备技术首次将mvs耦连到微粒表面上,这是一种新型的模拟细菌系统,不仅如此,益生菌模拟物在制备过程中也证明了乳杆菌在液体培养中产生大量mv的能力,这对扩大模拟物制备规模提供了便利。在悬浮液中生长的细菌可以用更大的容器培养,例如发酵罐等,这也可以很容易的增加mv的产量。益生菌模拟物的制备发掘除了仿生仿制药的巨大潜力,在未来的研究中可以进一步开发仿生药物的新型治疗剂。
技术实现要素:
13.针对现有技术存在的问题,本发明提供了一种益生菌模拟物及其制备方法。本发明通过制备益生菌模拟物,作为一种抗炎制剂,来改善炎症引起的肠道屏障功能丧失,以此
对甲基苯丙胺产生戒断作用,帮助吸毒人员戒毒。
14.本发明是这样实现的,一种益生菌模拟物制备方法,所述益生菌模拟物制备方法,包括:
15.步骤一,在补充胎牛血清的dulbecco改良的eagle培养基中培养caco
‑
2htb
‑
37细胞;
16.步骤二,在caco
‑
2 htb
‑
37细胞第30
±
10代时,进行teer的测量;
17.步骤三,根据干酪乳杆菌和植物乳杆菌的选择培养条件,进行细胞培养;细菌的显微图像在图s1(支持信息)中找到;
18.步骤四,生长48小时后,进行中压隔离;细菌培养物通过离心去除残留细菌,将含ev的上清液通过聚偏二氟乙烯膜进行过滤;将上清液转移至超速离心管中离心,弃去上清液,并将沉淀重新分散在过滤的pbs中;
19.步骤五,悬浮的沉淀物通过装有sepharose cl
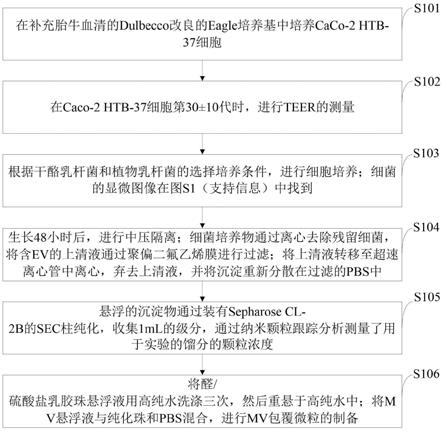
‑
2b的sec柱纯化,收集1ml的级分,通过纳米颗粒跟踪分析测量了用于实验的馏分的颗粒浓度;
20.步骤六,将醛/硫酸盐乳胶珠悬浮液用高纯水洗涤三次,然后重悬于高纯水中;将mv悬浮液与纯化珠和pbs混合,进行mv包覆微粒的制备。
21.进一步,所述步骤一中,胎牛血清为dulbecco改良的eagle培养基10%,其中培养基中1%非必需氨基酸混合物。
22.进一步,所述步骤一中,培养caco
‑
2 htb
‑
37细胞后期管理为:每2
‑
3天向细胞补充新鲜培养基,一周后,当细胞达到80
‑
90%汇合时,将其分裂;thp
‑
1细胞悬浮于rpmi
‑
1640培养基中;每3
‑
4天后,将2.5ml细胞悬液转移至10ml培养基中。
23.进一步,所述步骤一中,在teer的测量测定之前,将thp
‑
1细胞离心并重新分散在含有佛波醇12
‑
肉豆蔻酸酯
‑
13
‑
乙酸酯(7.5ng ml)的培养基中,并以每孔1
×
10细胞的密度接种到96孔板中;然后允许细胞分化24小时以进行存活力测试,并分化48小时以进行细胞因子测定。
24.进一步,所述步骤二中,teer的测量具体过程为:将第30
±
10代中的caco
‑
2htb
‑
37细胞以每孔2
×
10细胞的密度播种在corning transwell插入物上;然后使细胞在37℃和5%co下生长11d,每2
‑
3天更换一次培养基(顶室500μl,基底外侧室1500μl);11
‑
12d后,在每个孔中测量teer(t=0);
25.随后,将培养基吸到根尖腔中,并添加250μl新鲜培养基,其中补充了来自大肠杆菌的lps(10μg ml)和250μl样品(微粒或ev悬浮液)中加入;使用evom测量teer值3和6小时后;然后,收集上清液以定量细胞因子。
26.进一步,所述大肠杆菌为:0111:b4,经γ射线辐照,bioxtra,适用于细胞培养的sigma
‑
aldrich;样品为微粒或ev悬浮液。
27.进一步,所述步骤三中,干酪乳杆菌在deman
‑
rogosa
‑
sharpe琼脂上在ecotron ht恒温箱中于37℃下在微需氧条件下培养5d;
28.从该库存(储存在4℃下)中接种液体培养物,将一个菌落转移到100ml deman
‑
rogosasharpe液体培养基中,使培养物在37℃下生长48小时;
29.植物乳杆菌在ecoman ht孵化器中,于deman
‑
rogosa
‑
sharpe琼脂上于30℃下培养5d;从该储备板(储存于4℃)中;
30.使用一个菌落将液体培养物接种到100ml deman
‑
rogosasharpe液体培养基中,使培养物在30℃下生长48小时。
31.进一步,所述步骤四中,中压隔离具体过程为:生长48小时后,将细菌培养物以9500
×
g离心5分钟以去除残留细菌;接下来,将含ev的上清液通过0.45μm聚偏二氟乙烯膜过滤;然后将上清液转移至超速离心管中,并在4℃下以100000
×
g离心2h;弃去上清液,并将沉淀重新分散在过滤的pbs(400μl)中;
32.悬浮的沉淀物通过装有35ml sepharose cl
‑
2b的sec柱纯化;收集1ml的级分;通过纳米颗粒跟踪分析测量了用于实验的馏分的颗粒浓度。
33.进一步,所述步骤六中,mv包覆微粒的制备过程为:将500μl的4μm醛/硫酸盐乳胶珠悬浮液用1ml高纯水洗涤三次,重悬于500μl高纯水中;
34.将300μl mv悬浮液与10μl纯化珠和690μl pbs混合,使用氢氧化钠溶液和盐酸将混合物调节至所需的ph值ph=5和ph=7,并在室温(rt)摇动(300rpm)下温育16h,使赖氨酸基团mv的表面蛋白质与微粒表面的醛基反应;
35.通过2500
×
g离心纯化微粒在4℃下反应5分钟,用1ml pbs交换上清液;洗涤程序重复两次;在洗涤步骤之后,将pbm重悬于1ml无菌过滤的pbs中。
36.本发明的另一目的在于提供一种利用所述的益生菌模拟物制备方法制备的益生菌模拟物,本质是利用益生菌所具有的治疗肠道炎性疾病的巨大潜力来实现对甲基苯丙胺的戒断作用。所述益生菌模拟物通过利用醛基官能化将益生菌分离出的膜泡耦连到微粒表面,构成益生菌模拟微生物。
37.结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明中的制备方法可实现mvs的高浓度递送,发明制备的pbms作为一种抗炎制剂,显著降低促炎性tnf
‑
α(降低86%),而原始mvs不能;pbms能改善炎症引起的肠道屏障功能丧失,通过此方法可以实现对甲基苯丙胺的戒断作用,从而对戒毒产生积极影响。本发明制备所采用的的益生菌在液体中培养的乳杆菌产生大量的mvs,对其大小、蛋白质内容、形态进行观测之后发现,mvs对巨噬细胞系dthp
‑
1和肠细胞系caco
‑
2无毒,可作为治疗药物进一步开发。本发明所采取的醛基官能化将益生菌分离出的膜泡(mvs)耦连到微粒表面,由此构成益生菌模拟微生物(pbms)可以实现而原始mvs的高浓度递送。本发明的益生菌模拟微生物作为一种抗炎制剂,可以显著降低促炎性tnf
‑
α(降低86%),而原始mvs不能。传统的益生菌囊泡不是最佳的给药方式,因为它们的体积小,在给药后很容易被清除,并且在口服时易于在胃肠道中快速稀释。而本发明的pbms则会弥补这些缺点,它们将富集在肠粘膜的顶膜上,而不是像大小相似的微粒那样迅速被清除。这可能导致发生炎症的粘膜细胞上的mv浓度增加。此外,已经提出了所开发的不扩散系统具有实质性的安全优势,并且可以用于包括免疫功能低下的患者在内的多种患者中。“仿生药物”代表了一种独特而新颖的策略,将功能性生物材料与固有活性的mv结合在一起,以靶向自身免疫性炎症。
附图说明
38.为了更清楚地说明本申请实施例的技术方案,下面将对本申请实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的
附图。
39.图1是本发明实施例提供的益生菌模拟物制备方法流程图。
具体实施方式
40.本发明的创新理念是首次采用了对巨噬细胞样dthp
‑
1和肠细胞样caco
‑
2细胞系无毒的mv,并用全新的方法根据醛基官能团将mvs结合到微粒表面上,以获得仿生菌,因此进一步发展为抗炎剂。
41.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
42.针对现有技术存在的问题,本发明提供了一种益生菌模拟物及其制备方法,下面结合附图对本发明作详细的描述。
43.如图1所示,本发明实施例提供的益生菌模拟物制备方法,包括:
44.s101:在补充胎牛血清的dulbecco改良的eagle培养基中培养caco
‑
2htb
‑
37细胞。
45.s102:在caco
‑
2 htb
‑
37细胞第30
±
10代时,进行teer的测量。
46.s103:根据干酪乳杆菌和植物乳杆菌的选择培养条件,进行细胞培养;细菌的显微图像在图s1(支持信息)中找到。
47.s104:生长48小时后,进行中压隔离;细菌培养物通过离心去除残留细菌,将含ev的上清液通过聚偏二氟乙烯膜进行过滤;将上清液转移至超速离心管中离心,弃去上清液,并将沉淀重新分散在过滤的pbs中。
48.s105:悬浮的沉淀物通过装有sepharose cl
‑
2b的sec柱纯化,收集1ml的级分,通过纳米颗粒跟踪分析测量了用于实验的馏分的颗粒浓度。
49.s106:将醛/硫酸盐乳胶珠悬浮液用高纯水洗涤三次,然后重悬于高纯水中;将mv悬浮液与纯化珠和pbs混合,进行mv包覆微粒的制备。
50.本发明实施例提供的s101中,胎牛血清为dulbecco改良的eagle培养基10%,其中培养基中1%非必需氨基酸混合物。
51.本发明实施例提供的s101中,培养caco
‑
2 htb
‑
37细胞后期管理为:每2
‑
3天向细胞补充新鲜培养基,一周后,当细胞达到80
‑
90%汇合时,将其分裂;thp
‑
1细胞悬浮于rpmi
‑
1640培养基中;每3
‑
4天后,将2.5ml细胞悬液转移至10ml培养基中。
52.本发明实施例提供的s101中,在teer的测量测定之前,将thp
‑
1细胞离心并重新分散在含有佛波醇12
‑
肉豆蔻酸酯
‑
13
‑
乙酸酯(7.5ng ml)的培养基中,并以每孔1
×
10细胞的密度接种到96孔板中;然后允许细胞分化24小时以进行存活力测试,并分化48小时以进行细胞因子测定。
53.本发明实施例提供的s102中,teer的测量具体过程为:
54.将第30
±
10代中的caco
‑
2 htb
‑
37细胞以每孔2
×
10细胞的密度播种在corning transwell插入物上;然后使细胞在37℃和5%co下生长11d,每2
‑
3天更换一次培养基(顶室500μl,基底外侧室1500μl);11
‑
12d后,在每个孔中测量teer(t=0);
55.随后,将培养基吸到根尖腔中,并添加250μl新鲜培养基,其中补充了来自大肠杆菌的lps(10μg ml)和250μl样品(微粒或ev悬浮液)中加入。使用evom测量teer值3和6小时
后;然后,收集上清液以定量细胞因子。
56.所述大肠杆菌为:0111:b4,经γ射线辐照,bioxtra,适用于细胞培养的sigma
‑
aldrich;样品为微粒或ev悬浮液。
57.本发明实施例提供的s103中,干酪乳杆菌在deman
‑
rogosa
‑
sharpe琼脂上在ecotron ht恒温箱中于37℃下在微需氧条件下培养5d;
58.从该库存(储存在4℃下)中接种液体培养物,将一个菌落转移到100ml deman
‑
rogosasharpe液体培养基中,使培养物在37℃下生长48小时。
59.本发明实施例提供的s103中,植物乳杆菌在ecoman ht孵化器中,于deman
‑
rogosa
‑
sharpe琼脂上于30℃下培养5d。从该储备板(储存于4℃)中;
60.使用一个菌落将液体培养物接种到100ml deman
‑
rogosasharpe液体培养基中,使培养物在30℃下生长48小时。
61.本发明实施例提供的s104中,中压隔离具体过程为:生长48小时后,将细菌培养物以9500
×
g离心5分钟以去除残留细菌;接下来,将含ev的上清液通过0.45μm聚偏二氟乙烯膜(stericup
‑
hv 150ml durapore pvdf 0.45滤瓶,德国达姆施塔特默克)过滤;然后将上清液转移至超速离心管中,并在4℃下以100000
×
g离心2h;弃去上清液,并将沉淀重新分散在过滤的pbs(400μl)中。
62.本发明实施例提供的s105中,悬浮的沉淀物通过装有35ml sepharose cl
‑
2b的sec柱(德国不伦瑞克ge healthcare)纯化。收集1ml的级分。通过纳米颗粒跟踪分析测量了用于实验的馏分的颗粒浓度。
63.本发明实施例提供的s106中,mv包覆微粒的制备过程为:将500μl的4μm醛/硫酸盐乳胶珠悬浮液用1ml高纯水洗涤三次,重悬于500μl高纯水中;
64.将300μl mv悬浮液与10μl纯化珠和690μl pbs混合,使用氢氧化钠溶液和盐酸将混合物调节至所需的ph值ph=5和ph=7,并在室温(rt)摇动(300rpm)下温育16h,使赖氨酸基团mv的表面蛋白质与微粒表面的醛基反应;
65.通过2500
×
g离心纯化微粒在4℃下反应5分钟,用1ml pbs交换上清液。洗涤程序重复两次;在洗涤步骤之后,将pbm重悬于1ml无菌过滤的pbs中。
66.下面结合具体实施例对本发明的技术方案作进一步的描述。
67.本发明所用菌种干酪乳杆菌和植物乳杆菌,(干酪乳杆菌编号为h1410,植物乳杆菌编号为ji22133)购买于信阳市中检计量生物科技有限公司。
68.1、细胞培养
69.在补充了10%胎牛血清(fcs)(gibco,waltham,ma)的dulbecco改良的eagle培养基(dmem)(gibco,waltham,ma)中培养caco
‑
2 htb
‑
37(atcc,manassas,va)细胞。1%非必需氨基酸混合物(马萨诸塞州沃尔瑟姆市的gibco)。每2
‑
3天向细胞补充新鲜培养基。一周后,当细胞达到80
‑
90%汇合时,将其分裂。thp
‑
1(dsmz,不伦瑞克,德国)细胞悬浮于rpmi
‑
1640(gibco,waltham,ma)培养基中。每3
‑
4天后,将2.5ml细胞悬液转移至10ml培养基中。为了进行测定,将thp
‑
1细胞离心并重新分散在含有佛波醇12
‑
肉豆蔻酸酯
‑
13
‑
乙酸酯(7.5ng ml)的培养基中,并以每孔1
×
10细胞的密度接种到96孔板中。然后允许细胞分化24小时以进行存活力测试,并分化48小时以进行细胞因子测定。
70.2、teer的测量
71.将第30
±
10代中的caco
‑
2 htb
‑
37细胞以每孔2
×
10细胞的密度播种在corning transwell插入物上。然后使细胞在37℃和5%co下生长11d。每2
‑
3天更换一次培养基(顶室500μl,基底外侧室1500μl)。11
‑
12d后,在每个孔中测量teer(t=0)。随后,将培养基吸到根尖腔中,并添加250μl新鲜培养基,其中补充了来自大肠杆菌(0111:b4,经γ射线辐照,bioxtra,适用于细胞培养的sigma
‑
aldrich)的lps(10μg ml)(密苏里州圣路易斯)和250μl样品(微粒或ev悬浮液)中加入。使用evom测量teer值3和6小时后(世界精密仪器公司,佛罗里达州萨拉索塔)。然后,收集上清液以定量细胞因子。
72.3、细菌培养
73.干酪乳杆菌(dsmz,不伦瑞克,德国)在deman
‑
rogosa
‑
sharpe琼脂(carl roth gmbh+co.kg,德国卡尔斯鲁厄)上在ecotron ht恒温箱中于37℃下在微需氧条件下培养5d。瑞士巴塞尔)。从该库存(储存在4℃下)中接种液体培养物,将一个菌落转移到100ml deman
‑
rogosasharpe液体培养基中。使培养物在37℃下生长48小时。植物乳杆菌(ncimb,阿伯丁,英国)在ecoman ht孵化器(infors,巴塞尔,瑞士)中,于deman
‑
rogosa
‑
sharpe琼脂上于30℃下培养5d。从该储备板(储存于4℃)中,使用一个菌落将液体培养物接种到100ml deman
‑
rogosasharpe液体培养基中。使培养物在30℃下生长48小时。对于两种菌株,根据供应商给出的说明选择培养条件。细菌的显微图像可以在图s1(支持信息)中找到。
74.4、中压隔离
75.生长48小时后,将细菌培养物以9500
×
g离心5分钟以去除残留细菌。接下来,将含ev的上清液通过0.45μm聚偏二氟乙烯膜(stericup
‑
hv 150ml durapore pvdf 0.45滤瓶,德国达姆施塔特默克)过滤。然后将上清液转移至超速离心管中,并在4℃下以100000
×
g离心2h。然后,弃去上清液,并将沉淀重新分散在过滤的pbs(400μl)中。悬浮的沉淀物通过装有35ml sepharose cl
‑
2b的sec柱(德国不伦瑞克ge healthcare)纯化。收集1ml的级分。通过纳米颗粒跟踪分析测量了用于实验的馏分的颗粒浓度。
76.5、mv包覆微粒的制备
77.将500μl的4μm醛/硫酸盐乳胶珠(invitrogen,waltham,ma)悬浮液用1ml高纯水(milliq质量)洗涤三次,然后重悬于500μl高纯水中。接下来,将300μl mv悬浮液(通过方法优化找到的量)与10μl纯化珠和690μl pbs混合。然后使用氢氧化钠溶液和盐酸将混合物调节至所需的ph值ph=5和ph=7,并在室温(rt)摇动(300rpm)下温育16h,使赖氨酸基团mv的表面蛋白质与微粒表面的醛基反应。然后通过2500
×
g离心纯化微粒在4℃下反应5分钟,然后用1ml pbs交换上清液。洗涤程序重复两次。在洗涤步骤之后,将pbm重悬于1ml无菌过滤的pbs中。
78.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1