具有抗氧化性和DPP-IV抑制活性的多肽混合物及其制备方法与流程
具有抗氧化性和dpp
‑
iv抑制活性的多肽混合物及其制备方法
技术领域
1.本发明属于食品加工技术领域,具体涉及具有抗氧化性和dpp
‑
iv抑制活性的多肽混合物及其制备方法。
背景技术:
2.人体内细胞在代谢过程中产生大量自由基和活性氧,而抗氧化系统可以有效地清除自由基。当自由基产生过多或抗氧化系统失效时,这种平衡就会被打破,机体将处于氧化应激状态,这种情况会导致细胞损伤。已有研究认为持续的氧化应激反应是神经退行性疾病、癌症、肝损伤、衰老、心血管疾病、慢性胰腺炎等疾病的诱因。细胞一般通过预防、修复、产生抗氧化剂或摄入膳食中的抗氧化剂来保护自己免受氧化损伤。已知的膳食抗氧化剂包括抗坏血酸,维生素e,多酚类物质和类胡萝卜素等。
3.糖尿病是一种在世界范围内广泛传播的疾病,患病人数呈指数型增长,是世界第三大疾病。糖尿病属于代谢性疾病,主要是由胰岛素代谢障碍或分泌不足引起,并且以高血糖浓度为特征。糖尿病常导致不同器官发生长期性损伤,功能性障碍或衰竭,尤其是眼睛、肾脏、神经、心脏和血管,是一种慢性终身性疾病。随着对糖尿病发病机制的研究,dpp
‑
iv逐渐成为治疗糖尿病的新靶点。dpp
‑
iv是一种普遍存在于肾脏和胃肠道等组织中的丝氨酸肽酶,可以降解包括胰高血糖素样肽1(glucagon like peptide 1,glp
‑
1)和葡萄糖依赖性促胰岛素多肽(glucose
‑
dependent insulinotropic polypeptide,gip)在内的肠促胰岛素。这些肠促胰岛素的降解使其促胰岛素活性降低,从而导致胰岛素分泌不足、血糖升高。因此,抑制体内的dpp
‑
iv可有效保持肠促胰岛素的活性,延长促胰岛素的作用时间,可用于在餐后阶段增加胰岛素的分泌,从而可以实现更好的血糖调节。
4.天然的抗氧化剂、dpp
‑
iv抑制剂与人工合成的抗氧化剂、dpp
‑
iv抑制剂相比,具有作用温和、安全性高、副作用小等优点。乳清蛋白因其酶解物具有较强的抗氧化、降血糖等作用而备受关注。
5.乳清蛋白是乳清的主要固形物之一,具有较高的营养价值和生物利用效率,被广泛的应用于各种食品中。乳清蛋白主要由β
‑
乳球蛋白、α
‑
乳白蛋白、免疫球蛋白及其他多种活性成分组成。乳清蛋白产品可以分为蛋白质含量在35%
‑
85%的乳清浓缩蛋白(wpc)和蛋白质含量在90%以上的乳清分离蛋白(wpi)等。乳清分离蛋白包含有多种生物活性序列,用适当的蛋白酶水解并从乳清分离蛋白中释放出来之后,成为具有生理活性的肽段。酶解具有水解条件温和、对蛋白质底物破坏较小等优点,是生产食品级蛋白质水解物的理想方法。酶解前对乳清分离蛋白进行预处理改性,可以有效提高乳清分离蛋白的酶解效率。目前常见的乳清分离蛋白预处理改性方法主要是热处理法。
6.超高压是一种非热处理技术。通过将样品密封于腔体中,以水或其他流体作为传压介质,在仪器内部瞬时且均匀的将压力传送至样品。超高压技术能够使蛋白质发生结构变化,从而改变蛋白质的功能特性。超高压一般不会改变蛋白质的共价键及氢键,对一级结构基本无影响,但会明显改变蛋白质的非共价键,从而影响其高级结构。超高压技术对蛋白
质结构构象的影响是一种复杂的现象,与蛋白质的种类、浓度、压力大小、施压时间、温度和ph有关。超高压对蛋白质结构的影响会导致暴露出更多的酶切位点从而有利于水解反应的进行。与热处理等方法改性乳清分离蛋白相比,超高压处理具有安全无毒,快速高效,节约能源,绿色环保等优点,在乳清分离蛋白预处理改性与功能性产品开发方面潜力巨大。
7.目前,由于乳清蛋白包含了种类繁多的蛋白,因此各种蛋白的存在使得超高压诱导的变性机制变得十分复杂,进而导致很难准确制备出具有特定功能活性的生物活性肽。本发明所要解决的技术问题在于克服现有技术之不足,提供一种利用超高压协同酶解制备具有较高抗氧化活性及dpp
‑
iv抑制活性的多肽混合物的方法。
技术实现要素:
8.本发明所要解决的技术问题是:克服在传统常压下蛋白质酶解达不到预期效果且生产成本较高的缺陷,采用超高压技术预处理,改善乳清蛋白水解进程从而减少加酶量降低生产成本,并获得较高抗氧化及dpp
‑
iv抑制活性的乳清蛋白肽。
9.本发明以乳清蛋白为原料,经超高压预处理,探究200~600mpa不同压力下,在31℃条件下处理5~30min后协同酶解法制备乳清蛋白抗氧化及dpp
‑
iv抑制活性肽。再利用色谱技术将乳清蛋白抗氧化及dpp
‑
iv抑制肽分成分子量和疏水性不同的各个组分,经旋转蒸发及冷冻干燥成粉,得到抗氧化及dpp
‑
iv抑制活性较高的乳清蛋白多肽混合物。
10.为了实现上述目的,本发明的技术方案如下:
11.一方面,本发明提供了具有抗氧化性和dpp
‑
iv抑制活性的多肽混合物,所述多肽混合物的氨基酸序列包括:hlvdepqnlik、ddqnphssn、ddevdvdgtveedlgk。
12.进一步地,多肽混合物来源于乳清蛋白。
13.另一方面,本发明还提供了一种具有抗氧化性和dpp
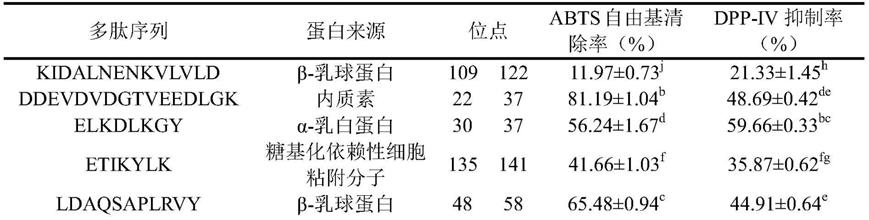
‑
iv抑制活性的多肽混合物的制备方法,其特征在于,该制备方法包括如下步骤:
14.步骤一:将浓度为1%的乳清分离蛋白溶液进行超高压处理,得到超高压分离乳清蛋白液;
15.步骤二:调节步骤一中所述超高压分离乳清蛋白液的ph至2.0
‑
3.0,然后加入胃蛋白酶和酸性蛋白酶,加热水解,灭酶,离心取上清液,旋转蒸发后冷冻干燥,得到多肽混合物粗品;
16.步骤三:将所述多肽混合物粗品浓度调整为1mg/ml,采用凝胶过滤色谱和rp
‑
hplc对其进行分离提纯。
17.进一步地,步骤一中,超高压处理的压力为200
‑
600mpa,超高压处理的时间为5
‑
30min。
18.进一步地,步骤二中,先加入胃蛋白酶,水解60min;再加入酸性蛋白酶,水解60min。
19.进一步地,步骤二中,加热的温度为40
‑
55℃,灭酶时间为10min。
20.进一步地,所述步骤三中,采用凝胶过滤色谱将多肽混合物粗品分离为4个组分,筛选抗氧化性和dpp
‑
iv抑制活性最优的组分。
21.进一步地,对所述最优的组分进行rp
‑
hplc分离,收集得到13个组分,筛选13个组分中抗氧化性和dpp
‑
iv抑制活性最优的组分,该组分即为多肽混合物。
22.进一步地,采用lc
‑
ms/ms对所述多肽混合物进行氨基酸序列测试。
23.进一步地,多肽混合物包括14条多肽序列。
24.本发明的积极进步效果在于:
25.(1)本发明利用超高压协同酶解制备具有较高抗氧化活性及dpp
‑
iv抑制活性的多肽混合物,通过采用超高压技术对乳清蛋白预处理,可使乳清蛋白的三级和四级结构破坏,并破坏其疏水键以及离子键等非共价键,使肤链伸展,立体结构松散。从而增加蛋白酶的接触位点,使酶解更充分,并提高多肽混合物的抗氧化及dpp
‑
iv抑制活性。本发明具有制备工艺简单,易操作,环保无污染,易于推广等优点。同时本发明也为超高压预处理技术对牛乳、鱼、虾等富含蛋白的动物资源的酶解提供参考。
26.(2)本发明主要利用超高压处理对乳清蛋白结构的影响。超高压处理主要是破坏蛋白质的三级、四级结构的非共价键,而对共价键作用较小。不同超高压力处理对蛋白质结构的影响不同。一般在100~200mpa下,蛋白质变化是可逆的。但当压力超过300mpa时,蛋白质会发生氢键断裂,产生不可逆变性而改变蛋白质的三级结构。适度的超高压作用可使蛋白质的三级和四级结构破坏,并破坏其疏水键以及离子键等非共价键,使蛋白质肽链伸展,立体结构松散。从而增大肽链与酶的接触面积,使酶解更充分,提高酶解效率。
附图说明
27.附图仅用于示出具体实施例的目的,而并不认为是对本发明的限制,在整个附图中,相同的参考符号表示相同的部件。
28.图1为凝胶过滤层析洗脱曲线图;
29.图2为凝胶过滤层析各组分abts自由基清除率图;
30.图3为凝胶过滤层析各组分dpp
‑
iv抑制率图;
31.图4为n3组分的rp
‑
hplc图;
32.图5为n3组分rp
‑
hplc分离后各子组分的abts自由基清除率图;
33.图6为n3组分rp
‑
hplc分离后各子组分的dpp
‑
iv抑制率图;
34.图7为多肽ddqnphssn的lc
‑
ms/ms图。
具体实施方式
35.为更清楚的对本发明技术方案予以阐述,下面将结合具体实施方式对本发明的技术方案进行进一步阐述:
36.本发明提供的技术方案之一是:
37.本发明提供了具有抗氧化性和dpp
‑
iv抑制活性的多肽混合物,如图1
‑
7所示,多肽混合物的氨基酸序列包括:hlvdepqnlik、ddqnphssn、ddevdvdgtveedlgk。
38.多肽混合物来源于乳清蛋白。
39.本发明利用超高压协同酶解制备具有较高抗氧化活性及dpp
‑
iv抑制活性的多肽混合物,通过采用超高压技术对乳清蛋白预处理,可使乳清蛋白的三级和四级结构破坏,并破坏其疏水键以及离子键等非共价键,使肤链伸展,立体结构松散。从而增加蛋白酶的接触位点,使酶解更充分,并提高乳清蛋白肽的抗氧化及dpp
‑
iv抑制活性。本发明具有制备工艺简单,易操作,环保无污染,易于推广等优点。同时本发明也为超高压预处理技术对牛乳、
鱼、虾等富含蛋白的动物资源的酶解提供参考。
40.本发明提供的技术方案之二是:
41.本发明还提供了一种具有抗氧化性和dpp
‑
iv抑制活性的多肽混合物的制备方法,该制备方法包括如下步骤:
42.步骤一:将浓度为1%的乳清分离蛋白溶液进行超高压处理,得到超高压分离乳清蛋白液;
43.步骤二:调节步骤一中所述超高压分离乳清蛋白液的ph至2.0
‑
3.0,然后加入胃蛋白酶和酸性蛋白酶,加热水解,灭酶,离心取上清液,旋转蒸发后冷冻干燥,得到多肽混合物粗品;
44.步骤三:将所述多肽混合物粗品浓度调整为1mg/ml,采用凝胶过滤色谱和rp
‑
hplc对其进行分离提纯。
45.具体的,步骤一中,超高压处理的压力为200
‑
600mpa,超高压处理的时间为5
‑
30min。
46.示例性的,用去离子水配制浓度为1%(w/w)的乳清分离蛋白溶液,将乳清分离蛋白溶液分装于聚乙烯袋中并真空包装,置于超高压容器中。在循环水系统控制温度为31℃、超高压升压速率为8.3mpa/min、处理压力200~600mpa、处理时间5~30min的条件下进行超高压处理。
47.具体的,步骤二中,先加入胃蛋白酶,水解60min;再加入酸性蛋白酶,水解60min。
48.步骤二中,加热的温度为40
‑
55℃,灭酶时间为10min。
49.示例性的,用1mol/l盐酸(也可以用1mol/l盐酸和1mol/l氢氧化钠)调节步骤一中得到的乳清分离蛋白溶液ph值2.0~3.0,然后向乳清分离蛋白溶液中加入胃蛋白酶和酸性蛋白酶,在磁力搅拌器上以40~55℃的温度水解120min,沸水浴灭酶活10min,离心取上清,旋转蒸发后冷冻干燥获得具有抗氧化和dpp
‑
iv抑制活性的乳清分离蛋白肽粗品。
50.具体的,步骤三中,凝胶过滤色谱分离为:采用蛋白纯化系统对样品进行凝胶过滤层析分离。条件为:洗脱液蒸馏水,流速1.0ml/min,检测波长为280nm。根据洗脱曲线分离收集到4个组分,用真空冷冻干燥机,测定各组分的抗氧化活性和dpp
‑
iv抑制活性,筛选生物活性最高的组分进行下一步分离。
51.具体的,rp
‑
hplc分离为:采用rp
‑
hplc对组分进行下一步分离。条件为:色谱柱对组分进行下一步离。条件为:色谱柱xbridge c18;流动相a为含0.1%三氟乙酸(tfa)的超纯水;流动相b为含0.1%tfa的乙腈溶液;进样量500μl;进样浓度为50mg/ml;流速1ml/min;检测波长280nm。洗脱条件为0
‑
5min,100%a;5
‑
20min,100%a~45%b;20
‑
30min,100%b;31min停止。通过自动收集器对各个组分进行收集,冷冻干燥后测定其生物活性。
52.具体的,步骤三中,采用凝胶过滤色谱将多肽混合物粗品分离为4个组分,筛选抗氧化性和dpp
‑
iv抑制活性最优的组分,即为n3组分。
53.对所述最优的组分进行rp
‑
hplc分离,收集得到13个组分,筛选13个组分中抗氧化性和dpp
‑
iv抑制活性最优的组分n3
‑
8,该组分即为多肽混合物。
54.示例性的,依次利用凝胶过滤色谱和rp
‑
hplc对制备获得的乳清蛋白肽粗品进行分离纯化。获得目标组分在浓度为1mg/ml时其abts自由基清除率和dpp
‑
iv抑制率分别达到82.96%和68.83%。
55.步骤三之后,还包括步骤四:乳清蛋白肽质谱分析与鉴定。即采用lc
‑
ms/ms对所得组分的氨基酸序列进行鉴定。色谱条件为:流动相a为含0.1%甲酸的超纯水;流动相b为含0.1%甲酸的乙腈溶液;进样量为5μl;进样质量浓度为1mg/ml;梯度洗脱条件为0~63min,b从2%到100%。采用电喷雾正离子扫描模式,扫描范围为0.2~2ku;二级质谱碰撞电压为28ev。利用peaks 10.0软件对swiss
‑
prot蛋白质数据库中的牛种属氨基酸序列进行搜索,得到多肽混合物的氨基酸序列,如表1所示。
56.该多肽混合物包括14条多肽序列。
57.表1多肽混合物的氨基酸序列及性能参数
[0058][0059][0060]
本发明的积极进步效果在于:
[0061]
(1)本发明利用超高压协同酶解制备具有较高抗氧化活性及dpp
‑
iv抑制活性的乳清蛋白肽,通过采用超高压技术对乳清蛋白预处理,可使乳清蛋白的三级和四级结构破坏,并破坏其疏水键以及离子键等非共价键,使肤链伸展,立体结构松散。从而增加蛋白酶的接触位点,使酶解更充分,并提高乳清蛋白肽的抗氧化及dpp
‑
iv抑制活性。本发明具有制备工艺简单,易操作,环保无污染,易于推广等优点。同时本发明也为超高压预处理技术对牛乳、鱼、虾等富含蛋白的动物资源的酶解提供参考。
[0062]
(2)本发明主要利用超高压处理对乳清蛋白结构的影响。超高压处理主要是破坏蛋白质的三级、四级结构的非共价键,而对共价键作用较小。不同超高压力处理对蛋白质结构的影响不同。一般在100~200mpa下,蛋白质变化是可逆的。但当压力超过300mpa时,蛋白质会发生氢键断裂,产生不可逆变性而改变蛋白质的三级结构。适度的超高压作用可使蛋白质的三级和四级结构破坏,并破坏其疏水键以及离子键等非共价键,使蛋白质肽链伸展,立体结构松散。从而增大肽链与酶的接触面积,使酶解更充分,提高酶解效率。
[0063]
在符合本领域常识的基础上,通过上述各优选条件,可任意组合,即得本发明各较佳实例。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。在符合本领域常识的基础上,通过上述各优选条件,可任意组合,即得本发明各较佳实例。
[0064]
下面结合实施例对本发明的实施方案进行详细描述,并不局限于所述最佳的实施
方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其它现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均在本发明的保护范围之内。
[0065]
实施例中未注明实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
[0066]
实施例1
[0067]
本发明提供了具有抗氧化性和dpp
‑
iv抑制活性的多肽混合物,该多肽混合物的具体来源、氨基酸序列、位点、abts自由基清除率和dpp
‑
iv抑制率如表1所示。
[0068]
该多肽混合物的氨基酸序列包括:hlvdepqnlik、ddqnphssn、ddevdvdgtveedlgk。
[0069]
该多肽混合物来源于乳清蛋白,共有14个多肽。
[0070]
实施例2
[0071]
本发明还提供了具有抗氧化性和dpp
‑
iv抑制活性的多肽混合物的制备方法,该制备方法包括如下步骤:
[0072]
步骤一:用去离子水配制浓度为1%(w/w)的乳清分离蛋白溶液,将乳清分离蛋白溶液分装于聚乙烯袋中并真空包装,置于超高压容器中。控制超高压容器中循环水系统,使得容器内温度为31℃、超高压升压速率为8.3mpa/min、处理压力200~600mpa、处理时间5~30min的条件下进行超高压处理,得到超高压处理后的乳清蛋白溶液;
[0073]
步骤二:用1mol/l盐酸调节步骤一中经超高压处理后的乳清分离蛋白溶液ph值为2.0~3.0,然后向乳清分离蛋白溶液中加入胃蛋白酶和酸性蛋白酶,在磁力搅拌器上以40~55℃的温度水解120min,沸水浴灭酶活10min,离心取上清,旋转蒸发后冷冻干燥获得具有抗氧化和dpp
‑
iv抑制活性的多肽混合物粗品;
[0074]
具体的,先加入胃蛋白酶,水解60min;再加入酸性蛋白酶,水解60min。
[0075]
步骤三:利用凝胶过滤色谱对制备获得的多肽混合物粗品进行分离,收集到4个组分,冻干后分别测定4个组分抗氧化活性和dpp
‑
iv抑制活性。本实施例得到的4个组分的抗氧化活性和dpp
‑
iv抑制活性见图2和图3,可见,组分n3的abts自由基清除率和dpp
‑
iv抑制率显著高于其他组分,达到了71.82%和52.43%(多肽混合物粗品的浓度1mg/ml)。
[0076]
选择抗氧化活性和dpp
‑
iv抑制活性最高的组分(n3)进行rp
‑
hplc分离,收集到13个组分,冻干后分别测定其抗氧化活性和dpp
‑
iv抑制活性。选择抗氧化活性和dpp
‑
iv抑制活性均较高的组分(n3
‑
8)进行质谱鉴定,得到了14条多肽序列,分别合成并测定其抗氧化活性和dpp
‑
iv抑制活性。
[0077]
本实施例得到的14条多肽的抗氧化活性和dpp
‑
iv抑制活性见表1,多肽(ddqnphssn)的的abts自由基清除率和dpp
‑
iv抑制率均较为显著,分别达到了91.42%和66.28(浓度1mg/ml)。
[0078]
选择抗氧化活性和dpp
‑
iv抑制活性均较高的多肽(ddqnphssn)进行质谱鉴定。本实施例得到的多肽混合物的质谱图见图3。
[0079]
具体的,抗氧化活性的测定方法:
[0080]
abts自由基清除率的测定:在20ml 7mmol/l abts溶液中加入2.45mmol/l过硫酸钾,制成40ml abts
·
+
工作液,使用前室温避光静置12
‑
16小时。之后将abts
·
+
工作液用pbs稀
释至合适的倍数(20
‑
50倍),使734nm下的吸光度为(0.70
±
0.02)。将乳清分离蛋白酶解液冻干粉制备成10mg/ml的酶解液,取5μl的酶解液加入到500μl稀释后的abts
·
+
工作液中。室温反应6min后,测定734nm处的吸光度。
[0081][0082]
其中as为加入样品后abts
·
+
工作液吸光度;ab为空白对照组吸光度;ad为未加样品时abts
·
+
工作液的吸光度。
[0083]
dpp
‑
iv抑制活性的测定方法:
[0084]
用0.1mol/l的三(羟甲基)氨基甲烷盐酸缓冲液(tris
‑
hcl buffer,ph 8.0)溶解样品,取100μl样品加入96孔微孔板中(浓度从0.0125mg/ml到1.25mg/ml),加入50μl 0.55mmol/l h
‑
gly
‑
pro
‑
pna
·
hcl溶液,混匀,37℃孵育10min,再加入50μl 2u/l dpp
‑
iv溶液,混匀,37℃反应60min,最后加入200μl 1.0mol/l醋酸/醋酸钠缓冲液(ph4.0)终止反应。通过酶标仪在405nm波长下,测定吸光度值(a),代入公式(2)计算对dpp
‑
iv的抑制率(%),并以diprotin a(浓度为1.25μg/ml,3.6μm)为阳性对照。
[0085][0086]
本实施例的制备方法还包括步骤四:乳清蛋白肽质谱分析与鉴定。即采用lc
‑
ms/ms对所得组分的氨基酸序列进行鉴定。色谱条件为:流动相a为含0.1%甲酸的超纯水;流动相b为含0.1%甲酸的乙腈溶液;进样量为5μl;进样质量浓度为1mg/ml;梯度洗脱条件为0~63min,b从2%到100%。采用电喷雾正离子扫描模式,扫描范围为0.2~2ku;二级质谱碰撞电压为28ev。利用peaks 10.0软件对swiss
‑
prot蛋白质数据库中的牛种属氨基酸序列进行搜索,得到多肽混合物的氨基酸序列。
[0087]
实施例3
[0088]
本发明还提供了具有抗氧化性和dpp
‑
iv抑制活性的多肽混合物的制备方法,该制备方法包括如下步骤:
[0089]
步骤一:用去离子水配制浓度为1%(w/w)的乳清分离蛋白溶液,将乳清分离蛋白溶液分装于聚乙烯袋中并真空包装,置于超高压容器中。控制超高压容器中循环水系统,使得容器内温度为31℃、超高压升压速率为8.3mpa/min、处理压力200~600mpa、处理时间5~30min的条件下进行超高压处理,得到超高压处理后的乳清蛋白溶液;
[0090]
步骤二:用1mol/l氢氧化钠调节步骤一中经超高压处理后的乳清分离蛋白溶液ph值为8.0~8.5,然后向乳清分离蛋白溶液中加入胰蛋白酶和碱性蛋白酶,在磁力搅拌器上以35~60℃的温度水解120min,沸水浴灭酶活10min,离心取上清,旋转蒸发后冷冻干燥获得具有抗氧化和dpp
‑
iv抑制活性的多肽混合物粗品,其abts自由基清除率和dpp
‑
iv抑制活性分别为54.31%和48.92%;
[0091]
具体的,先加入胰蛋白酶,水解60min;再加入碱性蛋白酶,水解60min。
[0092]
实施例3与实施例2的区别在于所用的两种蛋白酶的不同,实施例3得到的多肽混合物粗品的抗氧化活性及dpp
‑
iv抑制活性均低于实施例2。
[0093]
实施例4
[0094]
本发明还提供了具有抗氧化性和dpp
‑
iv抑制活性的多肽混合物的制备方法,该制
备方法包括如下步骤:
[0095]
步骤一:用去离子水配制浓度为1%(w/w)的乳清分离蛋白溶液,将乳清分离蛋白溶液分装于聚乙烯袋中并真空包装,置于超高压容器中。控制超高压容器中循环水系统,使得容器内温度为31℃、超高压升压速率为8.3mpa/min、处理压力200~600mpa、处理时间5~30min的条件下进行超高压处理,得到超高压处理后的乳清蛋白溶液;
[0096]
步骤二:用1mol/l盐酸调节步骤一中经超高压处理后的乳清分离蛋白溶液ph值为2.5,然后向乳清分离蛋白溶液中加入胃蛋白酶,在磁力搅拌器上以40℃的温度水解120min,沸水浴灭酶活10min,离心取上清,旋转蒸发后冷冻干燥获得具有抗氧化和dpp
‑
iv抑制活性的多肽混合物粗品,其abts自由基清除率和dpp
‑
iv抑制活性分别为33.49%和41.07%;
[0097]
实施例4与实施例2的区别在于仅使用一种蛋白酶进行水解,实施例4得到的多肽混合物粗品的抗氧化活性及dpp
‑
iv抑制活性远低于实施例2。
[0098]
对比例1
[0099]
步骤一:用去离子水配制浓度为1%(w/w)的乳清分离蛋白溶液,50℃水浴处理10min,得到热处理后的乳清蛋白溶液;
[0100]
步骤二:用1mol/l盐酸调节步骤一中经超高压处理后的乳清分离蛋白溶液ph值为2.5,然后向乳清分离蛋白溶液中加入胃蛋白酶,在磁力搅拌器上以40℃的温度水解120min,沸水浴灭酶活10min,离心取上清,旋转蒸发后冷冻干燥获得仅具有抗氧化活性的多肽混合物粗品,其abts自由基清除率为53.29%;
[0101]
对比例与实施例的不同在于,对比例1未采用超高压工艺,在其他实验条件相同的情况下,对比例得到的多肽混合物不具备dpp
‑
iv抑制活性。
[0102]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1