一种基于RAA技术检测单增李斯特菌的引物探针组合、试剂盒及方法与流程
一种基于raa技术检测单增李斯特菌的引物探针组合、试剂盒及方法
技术领域
1.本发明属于微生物检测技术领域,具体涉及一种基于raa技术检测单增李斯特菌的引物探针组合、试剂盒及方法。
背景技术:
2.单增李斯特菌(listeria monocytogenes)广泛存在于自然界中,易污染肉类、奶类、海产品和蔬菜等,由于其易形成生物被膜,在食品中能够存活很长的时间。世界卫生组织在有关食物中毒报告中指出4
‑
8%的海产品、5
‑
10%的奶及制品和30%以上的肉制品存在单增李斯特菌污染。而且该菌在4℃冰箱保存的食物中也可生长繁殖,导致其潜在的危害性进一步增大。食用被单增李斯特菌污染的食物除了会出现恶心、败血、腹泻等一般细菌性食物中毒症状外,还会导致心肌炎、脑膜炎、肠胃炎和肺炎等。1986年,who和fda 设立了李斯特菌研究中心,专门协调该菌的病原学、流行学及临床等研究工作,该菌已被列为90年代四大食品致病菌之一,欧美、日本由单增李斯特菌造成的临床疾病和食物污染问题在细菌性食物中毒中占第一位。因此,现在世界各国都把单增李斯特菌列为食品卫生法定检测项目。
3.目前单增李斯特菌的检测方法主要包括细菌分离鉴定、免疫学方法、分子生物学方法等。细菌分离鉴定工作量大,成本较低,但检测周期长,灵敏度低;免疫学方法易交叉污染,假阳性严重,灵敏度偏低;分子生物学方法应用最为广泛,主要包括pcr、实时荧光pcr、lamp、基因芯片等,但是这些方法也普遍存在缺点:普通pcr操作繁琐,需要电泳;荧光pcr设备较大,只能在实验室使用,没法进行现场检测;lamp等温扩增速度快但特异性不高,容易污染;基因芯片的检测灵敏度往往不够高,成本也不菲。因此,目前还缺少一种既能进行实验室检测又能进行现场快速检测的灵敏、简便、快速和低成本的单增李斯特菌检测方法。
技术实现要素:
4.为解决上述问题,本发明提供了一种基于raa技术检测单增李斯特菌的引物探针组合、试剂盒及方法。
5.重组酶介导链替换核酸扩增技术(recombinase
‑
aided amplification, raa),亦称重组酶聚合酶扩增技术(recombinase polymerase amplification, rpa),是一种可使微量核酸在体外高效快速扩增的新技术。raa技术主要依赖于三种酶:能结合单链核酸(寡核苷酸引物)的重组酶、单链dna结合蛋白(ssb)和链置换dna聚合酶。重组酶与引物结合形成的蛋白
‑
dna复合物,能在双链dna中寻找同源序列;一旦引物定位了同源序列,就会发生链交换反应形成并启动dna合成,对模板上的目标区域进行指数式扩增;被替换的dna链与ssb结合,防止进一步替换。在这个体系中,由两个相对的引物起始一个合成事件,整个过程进行得非常快,一般可在十分钟之内获得可检出水平的扩增产物。与传统pcr 及等温扩增技术相比较,其最显著的优势是无须高温扩增,半小时左右能观察到检测结果,且操作简
单,设备成本低廉。
6.作为本发明的第一方面,本发明提供一种基于raa技术检测单增李斯特菌的引物探针组合,包括一引物对和一探针,所述引物对包括上游引物和下游引物,所述上游引物的序列如seq id no.1所示,所述下游引物的序列如seq id no.2所示,所述探针的序列如seq id no.5所示;seq id no.1:ctgtaaataatagcttgaatgtaaacttcggcgc;seq id no.2:tctgcattcactccaagcgcttgcaactgctc;seq id no.5:tagttttaaacaaatttactataacgtgaa(fam
‑
dt)(thf)(bhq
‑
dt)taatgaacctacaag。
7.作为本发明的第二方面,本发明提供一种基于raa技术检测单增李斯特菌的试剂盒,包括上述引物探针组合。
8.优选的,所述基于raa技术检测单增李斯特菌的试剂盒还包括缓冲液、乙酸镁以及纯化水。其中缓冲液为raa基础通用试剂,包括重组酶、单链dna结合蛋白、dna聚合酶、dntp等成分,可以自行配制,也可以通过购买商品化的raa扩增试剂得到。
9.作为本发明的第三方面,本发明提供一种基于raa技术检测单增李斯特菌的方法,具体步骤如下:提取待测样本的基因组dna;以待测样本的基因组dna为模板,采用上述基于raa技术检测单增李斯特菌的试剂盒进行实时荧光raa扩增;根据实时荧光raa扩增曲线分析待测样本是否含有单增李斯特菌。
10.优选的,所述raa扩增的反应体系中,上游引物和下游引物的终浓度为300
‑
500nmol/l,所述探针的终浓度为350
‑
450 nmol/l。
11.进一步的,上游引物、下游引物和探针的终浓度分别为400nmol/l。
12.进一步的,所述raa扩增的反应体系为:缓冲液25μl,上游引物和下游引物各2.1μl,探针0.6μl,乙酸镁2.5μl,dna模板和纯化水共17.7μl。
13.优选的,所述raa扩增的反应条件为:温度40
‑
45℃,时间28
‑
33min。
14.进一步的,所述raa扩增的反应条件为:温度42℃,时间30min。作为本发明的第四方面,本发明还提供了上述基于raa技术检测单增李斯特菌的方法在检测食品中单增李斯特菌的应用,可以用于检测鱼类、肉类、蔬菜、奶制品等食品中的单增李斯特菌,适用范围广。本发明具有以下有益效果:1、特异性好:与铜绿假单胞菌、奇异变形杆菌、肺克克雷伯氏菌、鼠伤寒沙门氏菌、产气肠杆菌、大肠埃希氏菌、迟缓爱德华氏菌、英诺克李斯特菌、斯氏李斯特菌、伊氏李斯特菌、格氏李斯特菌、威氏李斯特菌、金黄色葡萄球菌、粪肠球菌、溶血性链球菌均无交叉反应。
15.2、灵敏度高:单增李斯特菌raa试验灵敏度可达到3
×
10
2 cfu/ml,且在实际样本检测中检出限要低于传统划线培养方法;3、准确性高:对实际样本的检测结果基本与传统划线培养方法的检测结果一致,可信度高;4、操作简单:不需要特殊试剂,不需要预先进行双链dna的变性等繁琐步骤,只需要恒温的荧光仪,条件温和,整个反应简单快速,根据实时荧光数据直接判断扩增结果,无需电泳检测,不仅适用于实验室检测,同时也适用于有大量样品的非实验室场所的现场检测;
5、成本低:仪器、时间以及人力成本与现有的分子生物学检测方法相比,均明显降低,具有良好的应用前景。
附图说明
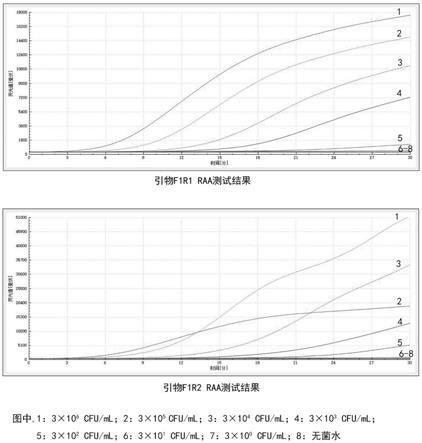
16.图1:引物f1r1、f1r2组合的raa测试结果。
17.图2:引物f2r1、f2r2组合的raa测试结果。
18.图3:单增李斯特菌 30℃、35℃、39℃的raa扩增结果。
19.图4:单增李斯特菌42℃、45℃的raa扩增结果。
20.图5:单增李斯特菌不同引物浓度raa扩增效果。
21.图6:单增李斯特菌不同探针浓度raa扩增效果。
22.图7:单增李斯特菌特异性测试结果。
23.图8:单增李斯特菌atcc7644 raa灵敏度测试结果。
24.图9:牛肉中不同浓度的单增李斯特菌不同增菌时间后raa检测结果。
25.图10:三文鱼中不同浓度的单增李斯特菌不同增菌时间后raa检测结果。
26.图11:奶酪中不同浓度的单增李斯特菌不同增菌时间后raa检测结果。
具体实施方式
27.以下结合附图和具体实施例对本发明进行进一步的说明。
28.实施例1本实施例提供一种基于raa技术检测单增李斯特菌的引物探针组合,包括一引物对和一探针,所述引物对包括上游引物和下游引物,所述上游引物的序列如表1中seq id no.1所示,所述下游引物的序列如表1中seq id no.2所示,所述探针的序列如表1中seq id no.5所示。
29.本实施例单增李斯特菌的引物探针设计和筛选过程如下:(1)引物探针设计:从ncbi genbank数据库中获得单增李斯特菌hlya序列,根据raa引物、探针设计原则设计荧光raa引物和探针序列。引物、探针由上海生工生物工程有限公司合成,具体序列下表1。
30.表1单增李斯特菌 raa 引物探针序列注:探针序列中,fam为发光基团,bhq为猝灭基团,thf为四氢呋喃。
31.(2)引物筛选:将两条上游引物(li
‑
hlya
‑
f1、li
‑ꢀ
hlya
ꢀ‑
f2)与两条下游引物(li
‑ꢀ
hlya
ꢀ‑
r1、li
ꢀ‑
hlya
ꢀ‑
r2)互相组合,与探针(li
‑ꢀ
hlya
ꢀ‑
p)形成四个组合,测试f1r1、f1r2、f2r1、f2r2引物对结合探针的扩增效果,通过荧光信号值的大小以及反应时间筛选最佳引物、探针组合。
32.具体的,采用raa
‑
1620荧光raa检测仪(江苏奇天基因生物科技有限公司)进行raa扩增,反应条件为:温度39℃、时间30min(常规raa扩增条件);反应体系为:缓冲液25μl(购自江苏江苏奇天基因生物科技有限公司的荧光raa扩增试剂盒),上下游引物(10μm)各2.1μl,探针(10μm)0.6μl,乙酸镁2.5μl,dna模板4μl、纯化水13.7μl;dna模板为3
×
10
‑3×
10
6 cfu/ml六个浓度梯度的单增李斯特菌基因组dna,以无菌水作为阴性对照。
33.四组引物探针组合的扩增结果如图1
‑
2示,可以看出f1r1组合下不同稀释度的菌液扩增曲线及灵敏度最稳定,故筛选f1r1引物对作为以后的扩增引物。
34.实施例2根据实施例1引物筛选结果,本实施例提供一种基于raa技术检测单增李斯特菌的试剂盒,所述试剂盒包括:上游引物li
‑
hlya
‑
f1、下游引物li
‑ꢀ
hlya
ꢀ‑
r1、缓冲液、乙酸镁以及纯化水,其中缓冲液购自江苏奇天基因生物科技有限公司的荧光raa扩增试剂盒。
35.实施例3本实施例提供一种基于raa技术检测单增李斯特菌的方法,具体步骤如下:提取待测样本的基因组dna;以待测样本的基因组dna为模板,采用实施例2的试剂盒进行实时荧光raa扩增,raa扩增的反应体系为:缓冲液25μl,上游引物和下游引物各2.1μl,探针0.6μl,乙酸镁2.5μl,dna模板4μl,纯化水13.7μl;根据实时荧光raa扩增曲线分析待测样本是否含有单增李斯特菌。操作时,将缓冲液、上下游引物、探针及纯化水混匀离心后,分装至荧光基础反应单元中,轻柔手弹使冻干粉充分重溶均匀,短暂离心,打开反应单元,向每个反应单元的管盖上加入乙酸镁,然后向各反应单元加入dna模板,充分混匀并离心,将反应管放入荧光检测仪中反应30 min。
36.本实施例还对raa扩增的引物探针浓度和反应条件进行了优化,具体过程如下:(1)反应温度的优化将raa反应液在不同温度(30℃、35℃、37℃、39℃、42℃、45℃)中进行反应,确定最佳扩增温度,采用的上下游引物以及探针的浓度为10μm(即反应体系中引物终浓度420nmol/l,探针终浓度120nmol/l)。结果由图3
‑
4所示(图中,well3为扩增,well4为空白对照孔),从扩增曲线和荧光强度看,最佳扩增温度为42℃。
37.(2)引物探针浓度的优化将引物终浓度分别稀释为100nmol/l、200nmol/l、400nmol/l、800nmol/l,探针终浓度分别稀释为100nmol/l、200nmol/l、300nmol/l 、400nmol/l进行扩增,筛选最佳扩增效果时引物探针浓度。结果如图5
‑
6所示,在探针浓度不变时,扩增信号随引物浓度增大而递增,当引物浓度为800 nmol/l时扩增曲线异常(图5);在引物浓度不变时,随着探针浓度增大,扩增信号也呈现明显增强(图6);故最后选择引物及探针终浓度均为400 nmol/l。
38.综上,本实施例选择上游引物、下游引物和探针的终浓度分别为400nmol/l;raa扩增的反应条件为:温度42℃,时间30min。
39.对实施例3所述的基于raa技术检测单增李斯特菌的方法进行以下效果评价:一、特异性检测选取单增李斯特菌(atcc7644)、单增李斯特菌分离株m2
‑
m7、英诺克李斯特菌(atcc33090)、斯氏李斯特菌(atcc35967)、伊氏李斯特菌(atcc19119)、格式李斯特菌(atcc700545)、威氏李斯特菌(atcc35897)、铜绿假单胞菌(atcc27853)、奇异变形杆菌
(atcc12453)、肺炎克雷伯氏菌(atcc13883)、鼠伤寒沙门氏菌(atcc14028)、产气肠杆菌(atcc13048)、大肠埃希氏菌(atcc29522)、迟缓爱德华氏菌(atcc15947)、金黄色葡萄球菌(atcc6538)、粪肠球菌(atcc49452)、溶血性链球菌(atcc21059),提取dna模板后进行荧光raa检测,无菌水作为阴性对照,验证方法特异性。
40.单增李斯特菌分离株m2
‑
m7为本实验室分离保存,所有菌株
‑
80℃保存于10%(w/v)甘油肉汤中,菌株的复苏及dna提取方法如下:菌株复苏:从甘油冻存管中取100 μl菌液接种到5 ml脑心浸液培养肉汤中,37 ℃ 150 r/min振荡过夜;dna模板制备:取1ml 细菌培养物1.5ml ep离心管,12000r/min 离心10min收集菌液,弃上清;按照细菌基因组dna提取试剂盒方法提取细菌dna;
‑
20℃保存备用。
41.荧光raa扩增结果如图7所示,可以看出,只有单增李斯特菌atcc株及分离株能扩出特异性条带,其余菌株均没有扩增信号,表明设计的引物探针特异性好。
42.二、灵敏度检测将过夜培养的单增李斯特菌菌液涡旋混匀后,用无菌pbs进行10倍比稀释;稀释后的菌液1 ml加入灭菌培养皿,倒入56 ℃恒温水浴的计数琼脂,轻轻摇匀,冷却后置生化培养箱;37 ℃恒温倒置培养24 h,每个梯度做3个平行对照,同时设pbs为空白对照。各稀释度的菌液按特异性检测中所述方法制备dna模板,用建立的荧光raa法检测,观察记录结果。过夜培养的计数平板,选取菌落数在30
‑
300之间的平板进行菌落计数,计算出单增李斯特菌培养悬液的浓度,从而推算出该方法的检测灵敏度。
43.荧光raa扩增结果如图8所示,可以看出,单增李斯特菌raa试验灵敏度可达到3
×
10
2 cfu/ml。
44.三、基质检出限测试为了验证该方法对样本中单增李斯特菌的检出限,自上海口岸进境冰鲜、肉类中选取牛肉、三文鱼、奶酪,分别按照传统方法和raa方法检测,传统方法为gb 4789.30
‑
2016《食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验》规定的划线培养法。
45.具体操作如下:称取25 g样品于225 ml lb1肉汤中,分别吸取混合液于10个试管中,每个试管9 ml;将一系列不同浓度梯度的菌悬液分别加入10个试管中,制成不同初始污染浓度(3
×
10
6 cfu/ml~3
×
10
‑
3 cfu/ml)的样品,30℃
±
1℃预增菌培养(采用lb1培养基)24h,再吸取0.1 ml样品至10 ml lb2分别增菌2h、4h和24h;将增菌2h、4h和24h的菌液提取dna模板后进行raa检测,同时采用传统分离划线方法进行检测。注:lb1和lb2为李氏增菌肉汤基础培养基,购自北京陆桥技术有限责任公司。
46.检出限测试结果如下:(1)牛肉中raa法和传统法检出限比较牛肉样品中人工污染不同浓度的单增李斯特菌,raa检测结果和传统划线培养结果如图9和表2所示,可以看出,增菌4h后,raa对牛肉中单增李斯特菌的检出限即可达到3 cfu/ml,传统划线培养法增菌24h检出限才达到3
×
10 cfu/ml,raa法灵敏度高于传统划线培养法。
47.表2 牛肉中不同浓度的单增李斯特菌增菌后raa和传统方法检测结果
(2)三文鱼中raa法和传统法检出限比较三文鱼样品中人工污染不同浓度的单增李斯特菌,raa检测结果和传统划线培养结果如图10和表3所示,可以看出,增菌2h后,raa对三文鱼中单增李斯特菌的检出限即可达到3 cfu/ml,增菌4h后,可达到3
×
10
‑
1 cfu/ml;传统划线培养法增菌24h后检出限为3 cfu/ml, raa法灵敏度明显高于传统划线培养法。
48.表3 三文鱼中不同浓度的单增李斯特菌增菌后raa和传统方法检测结果(3)奶酪中raa法和传统法检出限比较奶酪样品中人工污染不同浓度的单增李斯特菌,raa检测结果和传统划线培养结果如图11和表4所示,可以看出,增菌4h后,raa对奶酪中单增李斯特菌的检出限即可达到3
×
10 cfu/ml;传统划线培养法增菌24h检出限为3
×
10 cfu/ml, raa法灵敏度高于传统划线培养法。
49.表4 奶酪中不同浓度的单增李斯特菌增菌后raa和传统方法检测结果
四、实际样品检测按照gb 4789.30
‑
2016对上海口岸跨境及市售的肉类、冰鲜、奶酪等100份进行前处理增菌后,提取基因组dna,采用建立的raa方法进行检测,同时采用gb 4789.30
‑
2016中推荐的传统划线培养方法进行检测,结果如表5所示,可以看到,raa方法检测结果与现有国家标准gb 4789.30
‑
2016检测结果一致。
50.表5 实际样品中单增李斯特菌检测结果综上,用本发明试剂盒和方法检测单增李斯特菌特异性好,准确性高,且与传统的划线培养方法相比,不仅灵敏度更好,而且检测时间大大缩短(本发明在增菌后只要30min左右即可出结果,而传统法增菌后还需要再培养24h才能出结果),优势显著。
51.本具体实施方式仅仅是对本发明的解释,并不是对本发明的限制,本领域技术人员在阅读了本发明的说明书之后所做的任何改变,只要在本发明权利要求书的范围内,都将受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1