体外诱导产生人胰岛β细胞的培养基体系及方法与流程
本发明属于生物医学领域,更具体地,本发明涉及体外诱导产生人胰岛β细胞的培养基及其应用。
背景技术:
糖尿病已成为威胁人类健康的主要疾病之一,给全世界数百万人带来沉重的负担。糖尿病是由绝对(1型糖尿病)或相对(2型糖尿病)胰岛素缺乏引起的。这两种类型糖尿病发生高血糖和发展综合征的主要决定因素都是功能胰腺β细胞数量的不足。目前治疗1型糖尿病的方法是通过多次注射或微量注射给予外源性胰岛素,这些方法无法模拟胰岛β细胞在体内对葡萄糖稳态的精确和动态调节,导致许多糖尿病患者出现高血压和心血管疾病。
胰腺或胰岛的移植可以帮助患者恢复生理血糖控制,消除严重低血糖,提高生活质量,是一种很有前景的治疗方法。近年来,再生医学领域集中精力从胚胎来源的干细胞、脐带血、脐带胶样组织或多种成人组织中分化,制备葡萄糖敏感的、能够产生胰岛素的细胞(ipcs)。然而,由于患者对移植物的免疫排斥作用或自身的胰岛缺乏,胰岛移植在临床上的应用受到限制。
最近的研究表明,骨髓(bm)来源的间充质干细胞(mesenchymalstemcells,mscs)有分化为胰腺β细胞的潜能。其通常从成年人身上采集,可以很容易地用于自体移植,不存在胚胎组织固有的伦理问题,在治疗糖尿病的临床应用中前景广阔,开发一种有效的从bm-mscs,体外制备ipcs的方案,具有成本低、无伦理问题、副作用少等优点,将在临床上为糖尿病患者提供更为安全有效的治疗途径。
技术实现要素:
发明目的:为解决现有技术中存在的技术问题,本发明提出一种体外诱导产生人胰岛β细胞的培养基体系及其应用。
为实现上述目的,本发明提出了一种体外诱导产生人胰岛β细胞的培养基体系,包含如下五阶段培养基:
第一阶段培养基为含有0.1-0.3%(v/v)hsa、40-60ng/ml激活素a(activina)、20-30ng/mlwnt3a(蛋白,r&dsystems)和40-60μmly294002(50μm,pi3kα,δ和β抑制剂,abcam)的低糖dmem培养液(gibco);
第二阶段培养基为含有0.5-2%(v/v)b27、30-60ng/ml角质形成细胞生长因子(kgf)、5-15mm烟酰胺的rpmi培养基;
第三阶段培养基为含有0.5-2%(v/v)b27、5-15mm烟酰胺、10-30ng/ml表皮生长因子(egf)、1-3μm全反式维甲酸(ra),40-60ng/mlnoggin蛋白、0.2-0.3μm3-酮-n-(氨基乙基-氨基己基-二氢肉桂基)(kaad)-环巴胺(cyc)(stemgent04-0028)的低糖dmem培养基;
第四阶段培养基为含有0.5-2%(v/v)b27、5-15mm烟酰胺、40-60ng/ml胰岛素样生长因子-1(igf-1)的高糖dmem培养基;
第五阶段培养基为含有0.5-2%(v/v)b27、8-15mm烟酰胺、40-60ng/mligf和40-60ng/mlexendin-4(肠促胰岛素类似物)的cmrl培养基。
所述培养体系包含如下五阶段培养基:
第一阶段培养基为含有0.1%(v/v)hsa、50ng/ml激活素a、25ng/mlwnt3a和50μmly294002的低糖dmem培养液;
第二阶段培养基为含有1%(v/v)b27、50ng/ml角质形成细胞生长因子、10mm烟酰胺的rpmi培养基;
第三阶段培养基为含有1%(v/v)b27、10mm烟酰胺、20ng/ml表皮生长因子、2μm全反式维甲酸(ra),50ng/mlnoggin蛋白、0.25μm3-酮-n-(氨基乙基-氨基己基-二氢肉桂基)-环巴胺的低糖dmem培养基;
第四阶段培养基为含有1%(v/v)b27、10mm烟酰胺和50ng/ml胰岛素样生长因子-1(igf-1)的高糖dmem培养基;
第五阶段培养基为含有1%(v/v)b27、10mm烟酰胺、50ng/mligf和50ng/mlexendin-4的cmrl培养基。
本发明进一步提出了利用上述培养基体系在体外诱导制备具有胰岛素分泌功能的人胰岛β细胞上的方法。
具体地,使用细胞汇合度在80%~-90%,第3~4代的人bm-msc诱导产生ipcs,采用优化的逐级培养方案诱导bm-mscs体外分化为ipcs,然后采用优化的逐级培养方案诱导人bm-mscs体外分化为ipcs,依次使用第一阶段培养基、第二阶段培养基、第三阶段培养基、第四培养基和第五阶段培养基进行培养,每一阶段每隔一天更换新鲜培养基。
优选地,分五个阶段采用逐级培养方案诱导人bm-mscs体外分化为ipcs:
第一阶段,细胞培养在第一阶段培养基中培养4天;
第二阶段,培养基改为第二阶段培养基,培养4天;
第三阶段,培养基更换为第三培养基继续培养4天;
第四阶段,细胞转移至低吸附六孔板,在第四培养基中培养4天;
第五阶段,细胞在第五阶段培养基中再培养6天;
其中,上述每一阶段每隔一天更换新鲜培养基。
优选地,在上述方法中,第一阶段培养基为含有0.1%(v/v)hsa、50ng/ml激活素a、25ng/mlwnt3a和50μmly294002的低糖dmem培养液;
第二阶段培养基为含有1%(v/v)b27、50ng/ml角质形成细胞生长因子、10mm烟酰胺的rpmi培养基;
第三阶段培养基为含有1%(v/v)b27、10mm烟酰胺、20ng/ml表皮生长因子、2μm全反式维甲酸(ra),50ng/mlnoggin蛋白、0.25μm3-酮-n-(氨基乙基-氨基己基-二氢肉桂基)-环巴胺的低糖dmem培养基;
第四阶段培养基为含有1%(v/v)b27、10mm烟酰胺和50ng/ml胰岛素样生长因子-1(igf-1)的高糖dmem培养基;
第五阶段培养基为含有1%(v/v)b27、10mm烟酰胺、50ng/mligf和50ng/mlexendin-4的cmrl培养基。
利用方法制备得到的具有胰岛素分泌功能的人胰岛β细胞同样在本发明的保护范围之内。
本发明进一步提出了上述具有胰岛素分泌功能的人胰岛β细胞在制备用于治疗糖尿病的药物上的应用。
有益效果:本发明使用人类bm-mscs作为ipcs的来源,采用优化的逐级培养方案诱导bm-mscs体外分化为ipcs。我们在动物实验中证明了接受分化的ipcs移植后葡萄糖依赖性的胰岛素的产生。同理,从患者骨髓中获得的间充质干细胞可以增殖、诱导并分化为ipcs,随后可移植到同一患者体内。这种方法可以克服异体胰岛细胞移植治疗糖尿病的供体不足和免疫排斥等副反应,具有广阔的应用前景。
附图说明
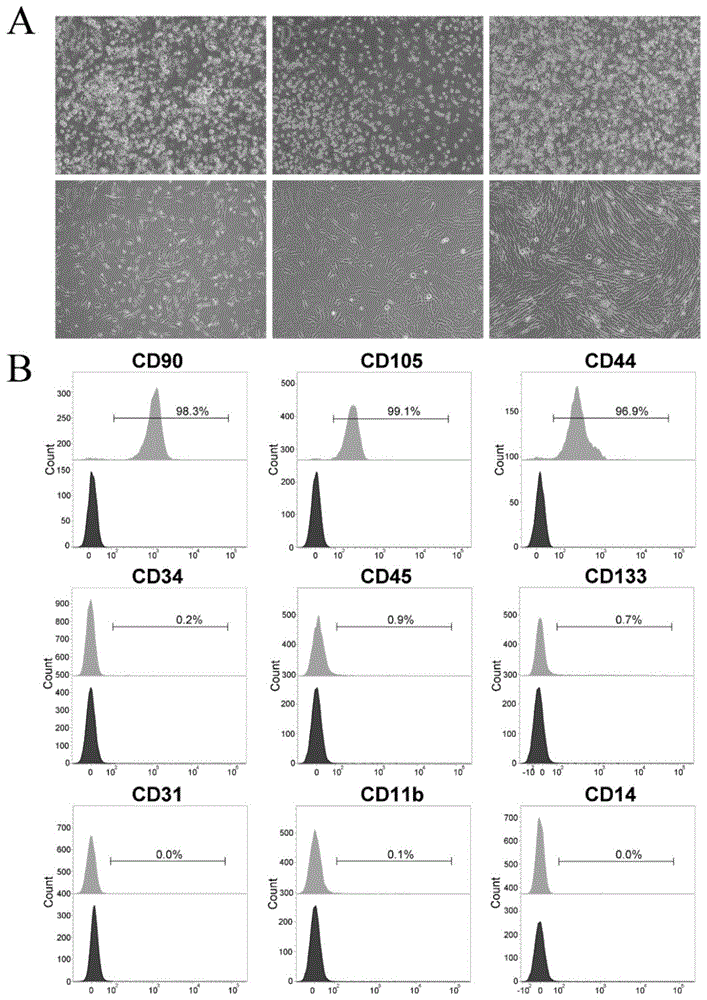
图1为bm-mscs的分离和鉴定结果图,(a)为新鲜培养液接种骨髓单个核细胞后第6天出现典型梭形细胞,梭形成纤维细胞样细胞从第9天到第15天迅速增加;(b)为通过免疫染色cd90、cd105、cd44、cd34、cd45、cd133、cd31、cd11b和cd14(红色填充直方图)或同型对照(黑色填充直方图)对骨髓源性mscs进行代表性流式细胞术分析;
图2为培养过程中细胞形态的改变及dtz染色结果,(a)为22天内分5期诱导梭形细胞和成纤维细胞样细胞(0期)形成胰岛样簇;(b)表明分化后的胰岛样簇dtz染色阳性;
图3为qrt-pcr和westerin-blot检测相关基因sox17、pdx-1及insulin在不同阶段的表达量;
图4中,(a)免疫荧光分析检测到sox17、pdx-1和胰岛素分别在第1、3和5阶段末出现;(b)最终分化的胰岛样团完整地粘附在载玻片上,经pdx-1和胰岛素染色,用dapi对细胞核(蓝色)进行反染色,用荧光显微镜拍摄图像;(c)pdx-1和胰岛素细胞内染色后分化ipcs的代表性流动分析;(d)分泌到细胞外液中的人胰岛素对0-25mm不同浓度葡萄糖的反应。结果以平均值±sem表示,**,与0ng/ml葡萄糖相比,p<0.01;与5.5ng/ml葡萄糖相比,p<0.001,先单因素方差分析,后和dunnett的多重比较检验;
图5中,(a)移植ipcs至小鼠肝门静脉后葡萄糖水平变化(红色)、未移植链脲佐菌素诱导糖尿病小鼠(绿色)葡萄糖水平变化和正常健康小鼠(黑色)血糖水平的变化;(b)上述三组处理的体重变化;(c)人pdx-1和胰岛素在ipc移植的链脲佐菌素诱导的糖尿病小鼠肝脏切片中的免疫检测;(d)从移植了分化的ipcs或生理盐水(对照组)的小鼠血清中用elisa法测定人胰岛素,在移植后第2周给小鼠注射葡萄糖之前(灰色条)和之后60分钟(黑色条)进行测量,结果以平均值±sem表示,**,p<0.01;***,p<0.001,单因素方差分析和dunnett的多重比较检验。
具体实施方式
下面结合具体实施例对本发明做进一步详细说明。给出了详细的实施方式和具体的操作过程,实施例将有助于理解本发明,但是本发明的保护范围不限于下述的实施例。
实施例1:人骨髓间充质干细胞的分离与培养。
首先,从采集的人骨髓样本中分离出间充质干细胞。将3-5ml骨髓用磷酸盐缓冲液(pbs,ph=7.2)稀释,然后加入ficoll-paquetm(1.077g/ml,gehealthcare17-1140-02),以500×g离心30分钟,分离单核细胞。分离得到的单核细胞用pbs洗两次,以5mlmsc培养基培养(stemcell,05411),按1×106细胞/ml,置于37℃,以5%co2细胞培养箱中培养。6天后,将非贴壁细胞丢弃,剩下的贴壁细胞再培养约2周。当细胞达到约90%融合度时,用0.25%胰蛋白酶和1mm乙二胺四乙酸(edta,gibco)处理1-2分钟,离心收集细胞,以每cm21000个细胞的密度传代。
在显微镜下观察,细胞呈成纤维细胞样形态。如图1a所示。
用胰酶处理收集细胞,离心后用pbs洗涤2次,用小鼠抗人藻红素(pe)偶联cd14、cd44、cd45抗体(bdpharmingen,sandiego,ca);异硫氰酸荧光素(fitc)偶联cd31、cd105和cd144抗体;异源藻蓝蛋白(apc)偶联cd34、cd11b抗体(bdpharmingen,圣地亚哥,ca)、cd133/1抗体(ac133;miltenyibiotec)和pe-cy5tmcd90抗体(bdpharmingen,圣地亚哥,加利福尼亚州),在室温下孵育20分钟。随后用1mlpbs洗涤细胞,用200μlpbs重悬。使用流式细胞仪facsverse(bd,sandiego,ca)检测细胞的表面标志物表达情况。
通过流式检测,这些细胞高表达cd90、cd44和cd105,但不表达cd34,cd31,cd45,cd133,cd14和cd11b,证实这些细胞为人骨髓间充质干细胞。如图1所示。其中,(a)为新鲜培养液接种骨髓单个核细胞后第6天出现典型梭形细胞。梭形成纤维细胞样细胞从第9天到第15天迅速增加。(b)为通过免疫染色cd90、cd105、cd44、cd34、cd45、cd133、cd31、cd11b和cd14(红色填充直方图)或同型对照(黑色填充直方图)对骨髓源性mscs进行代表性流式细胞术分析。
实施例2:从骨髓间充质干细胞诱导分化为胰岛分泌细胞。
我们采用优化的细胞因子组合、浓度和分阶段培养方案将骨髓来源的msc在体外诱导分化为胰岛素分泌细胞(ipcs)。我们使用细胞汇合度在80%~-90%,第3~4代的msc诱导产生ipcs,培养过程分5个阶段,第一阶段,细胞培养在低糖dmem培养液中,添加hsa(0.1%v/v)、activina(50ng/ml)、wnt3a(25ng/ml)和ly294002(50μm)一起培养4天。第二阶段,培养基改为含有b27(1%)、50ng/ml角质形成细胞生长因子(kgf)、烟酰胺(10mm)的rpmi培养基,培养4天。第三阶段,培养基更换为添加b27(1%)、烟酰胺(10mm)、20ng/ml表皮生长因子(egf),全反式维甲酸(ra,2μm),noggin(50ng/ml),3-酮-n-(氨基乙基-氨基己基-二氢肉桂基)(kaad)-环巴胺(cyc;0.25μm)的低糖dmem继续培养4天。第四阶段,细胞转移至低吸附六孔板,在b27(1%)、烟酰胺(10mm)和胰岛素样生长因子-1(igf-1;50ng/ml)的高糖dmem中培养4天。第五阶段,细胞在含有b27(1%)、烟酰胺(10mm)、igf(50ng/ml)和exendin-4(50ng/ml)的cmrl中再培养6天(图1)。为每一阶段准备含有适当生长因子和补充物的培养基,并每隔一天更换新鲜培养基。
从显微镜下观察,细胞逐渐从成纤维细胞样的mscs分化为类胰岛团样细胞。用dtz染色,细胞呈阳性。如图2所示。其中,图2(a)为22天内分5期诱导梭形细胞和成纤维细胞样细胞(0期)形成胰岛样簇。图2(b)表明分化后的胰岛样簇dtz染色阳性。
实施例3:实时荧光定量pcr检测标志物的表达
对培养至第1、3、5阶段末的细胞,使用trizol(invitrogencorp.,grandisland,ny)提取总rna,使用dnasei处理去除体系中的dna。将1μg的总rna通过rtpremixkit进行反转录,随后利用sybrmastermix检测,以管家基因β-actin作为内参,检测相关基因的表达情况。
表1用于定量pcr分析的引物
a根据genbank中的序列设计引物。
结果表明,未分化的bm-mscs不表达sox17,pdx-1和胰岛素(insulin)。随着诱导分化的进行,这些基因逐渐开始表达。在第一阶段培养末期,限定性内胚层细胞(definitiveendodermgene)sox17增加了53.53±5.31倍。随着细胞逐渐分化为胰腺β-细胞,sox17表达量慢慢下调。在培养第3阶段和第5阶段末期,后前肠典型基因(posteriorforeguttypicalgene)pdx-1的表达量显著增加,分别增加199.65±16.78和205.76±27.67倍.与此同时,胰岛素的表达量显著增加,在第3阶段和第5阶段末期分别增加352.66±42.15和1546.49±296.09倍。证实了bm-mscs细胞逐渐分化为胰岛β细胞。如图3a,b,c所示,在分化为ipcs的第0、1、3和5阶段,分析sox17(a)、pdx-1(b)和胰岛素(c)的基因表达水平。
实施例4:westernblot鉴定标志蛋白的表达。
westernblotting分析第0阶段、1阶段、3阶段和5阶段分化的细胞中sox17、pdx-1和胰岛素的表达。使用ripa溶液从细胞中提取总蛋白,利用bradford法(bio-rad,美国)测定提取的蛋白浓度。将100μg的细胞裂解液上样到12%或18%的sds-page凝胶孔进行电泳。电泳完的凝胶在恒压条件下湿转至pvdf膜,转印后的膜浸泡在含有5%脱脂奶粉的pbst封闭液(0.1%tween20inpbsbuffer)孵育2h。之后取出膜,用洗涤液pbst洗10min,重复3次。加入sox17、pdx-1或insulin对应的一抗(美国abcam,浓度参照说明书),于4℃过夜孵育。用pbst洗涤3次后,将膜与辣根过氧化物酶(hrp)结合的二抗(invitrogen,usa)在室温下孵育1小时。清洗后,使用增强化学发光(ecl)试剂盒(美国amersham),并根据说明进行胶片曝光,观察条带。
如图3d,e,f所示,将细胞基因转录产物与未分化bm-mscs(阴性对照)进行比较。基因表达的相对水平被标准化为人β-肌动蛋白,转录值以平均值±sem的形式显示在每张图中。****与0期细胞相比p<0.0001。单因素方差分析和邓内特多重比较检验。经诱导分化的细胞能够逐渐表达sox17,pdx-1和胰岛素。
实施例5:免疫荧光染色和流式检测ipcs。
将培养至第1、3、5阶段末的细胞用4%的多聚甲醛固定15分钟,之后用pbs洗涤。将固定的细胞在含0.1%tritonx-100和5%bsa的pbs中37℃孵育30min,以减少非特异性结合。pbs洗涤3次后,将细胞与一抗(sox17、pdx-1和胰岛素(abcam,usa))在4℃孵育过夜。pbs洗涤后,用荧光标记的二抗在37℃孵育1小时。然后,洗涤细胞,用含有dapi(sigma-aldrich,usa)的封片液进行封片。免疫染色的细胞在激光扫描共聚焦显微镜或荧光显微镜下观察。
如图4a,b所示,在第一阶段诱导后,sox17蛋白明显富集表达,说明我们明显富集到了定性内胚层细胞。在第3和第5阶段末,可以明显检测到pdx-1和insulin的表达。说明分化已逐渐分化为表达pdx-1和insulin的ipcs胞内蛋白pdx-1和胰岛素水平也通过流式细胞仪间接染色和检测。检测方法如下:首先将细胞用4%多聚甲醛(pfa)固定,随后用0.1%tritonx-100处理15分钟,用5%的牛血清白蛋白(bsa)阻断后,用一抗和带荧光基团的二抗对细胞分别染色。使用流式细胞术检测细胞内pdx-1和胰岛素的表达。
通过流式检测,这些最终分化得到的细胞80%表达pdx-1,超过60%以上表达胰岛素,即通过这种培养方案,可以高效的将bm-mscs诱导分化为ipcs。如图4c所示。
实施例6:体外检测ipcs对葡萄糖刺激的胰岛素释放。
通过将ipcs与含有不同浓度葡萄糖的krebs-ringer碳酸氢盐(krb;美国sigma-aldrich公司)孵育,评估葡萄糖刺激下细胞的胰岛素释放水平。将分化的ipcs先在无葡萄糖的krb中孵育1小时,然后分别在含5.5mm和25mm葡萄糖的krb中孵育1小时。使用insulinhumanelisa试剂盒(thermofisher,usa)测定培养上清中的胰岛素水平,以未分化的bm-mscs为阴性对照,每组设3个复孔,检测450nm下的吸光度(od),并根据标准曲线计算胰岛素含量。由于各组细胞数量不同,各组释放胰岛素的绝对含量以葡萄糖刺激后各组细胞提取的总dna的量进行归一化。
如图4d所示,未分化的bm-mscs在葡糖糖刺激下,胰岛素分泌水平无明显变化。在ipcs中,胰岛素水平在低糖(5.5mm)刺激下增加至0.51±0.025μiu/ml,在高糖(25mm)刺激下为1.75±0.13μiu/μg,约为低糖时的3.4倍。我们从bm-msc诱导分化得到的胰岛β细胞在葡萄糖刺激下能分泌胰岛素。
实施例7:在小鼠体内检测ipcs移植后的活性与功能。
按90mg/kg链脲佐菌素(sigma-aldrich,美国),连续2天腹腔注射,构建i型糖尿病小鼠模型,其中血糖水平超过16.7mm并稳定维持至少一周认为成功构建高血糖模型。将构建成功的小鼠随机分为移植组和非移植组。其中移植组小鼠(n=6)经肝门静脉移植5×106ipcs。对照组为经肝门静脉注射等量生理盐水的高血糖小鼠(n=6)和正常健康小鼠(n=6)。从移植后第一天开始,每2-3天检测小鼠的空腹血糖水平和体重。
为了在活体水平验证移植的ipcs对葡萄糖刺激的反应,在移植后的两周,给禁食一夜的小鼠腹腔注射2mg/g体重的葡萄糖。30min后采集小鼠血清,测定小鼠血中人胰岛素水平。移植后一周分离肝脏,制备冷冻切片并进行免疫荧光染色(胰岛素和pdx-1)。
ipcs移植后第3天,i型糖尿病模型组小鼠(n=6)的血糖水平明显降低,移植后第1-7周维持在10mm左右的相对正常水平。未接受移植的i型糖尿病模型组的小鼠血糖浓度在20mm左右(图5a),仍处于高血糖状态。此外,移植组小鼠体重的增长速度较慢(图5b)。细胞注射一周后,免疫组化结果显示,表达pdx-1和胰岛素的ipcs主要分布在小鼠的肝组织(图5c)。在移植后第2周,我们在移植组小鼠的血浆中检测到葡萄糖刺激的胰岛素分泌,如图5d所示。在对照组中,注射生理盐水的小鼠体内检测不到任何人胰岛素。
本发明使用人类bm-mscs作为ipcs的来源,采用优化的逐级培养方案诱导bm-mscs体外分化为ipcs。我们在动物实验中证明了接受分化的ipcs移植后葡萄糖依赖性的胰岛素的产生。同理,从患者骨髓中获得的间充质干细胞可以增殖、诱导并分化为ipcs,随后可移植到同一患者体内。这种方法可以克服异体胰岛细胞移植治疗糖尿病的供体不足和免疫排斥等副反应,具有广阔的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!