基于美洲大蠊嗅觉受体基因OR3X设计的dsRNA、编码基因及其制备方法与应用与流程
本发明涉及卫生害虫防治领域,具体涉及基于美洲大蠊嗅觉受体基因or3x设计的dsrna、编码基因及其制备方法与应用。
背景技术:
蟑螂是一类重要的世界性卫生害虫,对人类健康和公共卫生造成严重危害。蟑螂携带多种病原微生物,可引发霍乱、炭疽、结核等传染性疾病,也会引起皮疹、哮喘等过敏反应。美洲大蠊(periplanetaamericanal.)是蜚蠊目蟑螂中最常见种之一,也是华南地区优势种群,具有超强的环境适应能力和生命力,惊人的繁殖力和解毒能力。美洲大蠊在我国已发展为城镇蟑螂群落的优势物种,加之全球温室效应逐渐增强,危害和爆发频率逐年加重并且有不断北迁的趋势。
群聚行为对于种群的维持及单个个体的生存都有非常重要的意义,比如动物大规模的集体迁徙,寻找新资源,躲避天敌,集体同步繁殖等。群聚行为可以提高美洲大蠊繁殖后代的成功率和后代的生存能力。例如,美洲大蠊通过调整生殖周期的同步性来降低配偶与其他雌性聚集的机会,同时也增加了后代的生存能力,美洲大蠊可聚集产卵,从而增加后代躲避天敌的能力,并且保证同步孵化;美洲大蠊可群聚而行,为后代躲避天敌以及获得充足的食物提供了保证,提高后代的的存活率,保持种群的繁衍。
昆虫嗅觉系统是识别气味化合物的主要感知系统,包括中枢神经系统和外周神经系统,其中触角是外周神经系统的延伸。昆虫对外界的气味分子的识别主要依赖于触角。触角表面分布着不同类型的嗅觉感受器(俗称感觉毛),感受器的表皮上有许多孔隙,外界气味分子可以通过孔隙进入到感受器中。嗅觉受体(odorantreceptors,or)是识别外界气味分子的关键蛋白,可将化学信号转变为电信号,最终传入中枢神经系统。嗅觉受体可分为两大类:一类是在不同昆虫间具有高度变异性,同源性极低,称为传统气味受体(conventionalodorantreceptor),其中包括了普通气味受体(generalodorantreceptor)和性信息素受体(pheromonereceptor,pr);另一类是在不同昆虫间高度保守的非典型气味受体,亦称气味受体辅助受体或复合受体(odorantreceptorco-receptor,orco),它们的结构和功能非常保守,可与各种传统嗅觉受体形成异源二聚体,辅助后者在嗅觉神经元上正确定位,发挥共受体的功能。普通嗅觉受体只有与高度保守的orco共同形成特异性的阳离子通道,才可识别特定的外界气味分子。
目前对美洲大蠊防治仍主要依赖于传统的化学农药,但抗药性、药剂残留和再猖獗等问题日益攀升,严重威胁着人畜健康和生态环境。因此,发掘新的生物防治方法、探索新的美洲大蠊防治策略势在必行。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种美洲大蠊嗅觉受体基因or3x,能够用于防控美洲大蠊。
本发明还提出一种制备上述基因dsrna的方法。
本发明还提出一种上述基因的dsrna。
本发明还提出一种上述基因的dsrna的编码基因及含有该编码基因的表达载体、转基因细胞系或宿主菌。
本发明还提出上述基因的应用。
根据本发明的第一方面实施方式的美洲大蠊嗅觉受体基因or3x,所述基因的核苷酸序列如seqidno.1所示。
根据本发明第二方面实施方式的制备上述基因dsrna的方法,包括以下步骤:以美洲大蠊嗅觉受体基因or3x的cdna为模板,以干扰引物组为引物进行pcr扩增。
根据本发明的一些实施方式,所述干扰引物组包括上游引物or3xfp和下游引物or3xrp,其中,所述上游引物or3xfp的核苷酸序列如seqidno.5所示;所述下游引物or3xrp的核苷酸序列如seqidno.6所示。
根据本发明的一些实施方式,所述制备方法具体为:将上述引物组用于扩增靶向沉默or3x基因的dsrna靶向序列dna片段,将扩增得到的dna片段克隆到pmd18-t载体,命名为pmd18-t-or3x,然后以pmd18-t-or3x为模板,设计两端含有t7启动子的引物,进行pcr扩增,得到dsrna靶向序列。
根据本发明的一些实施方式,所述两端含有t7启动子的引物的上游引物or3xt7-fp的核苷酸序列如seqidno.7所示;下游引物or3xt7-rp核苷酸序列如seqidno.8所示。
根据本发明的一些实施方式,所述dsrna靶向序列采用t7ribomaxexpressrnaisystem转录合成即得。
根据本发明的一些实施方式,所述dsrna在制备用于美洲大蠊防治药物中的应用。
根据本发明的一些实施方式,所述dsrna在制备用于干扰美洲大蠊聚集成群的产品中的应用。
根据本发明的一些实施方式,所述dsrna在制备用于控制美洲大蠊聚集繁殖产品中的应用。
根据本发明第三方面实施方式的上述基因的dsrna,所述dsrna为由如seqidno.2所示的核苷酸序列作为正义链及与seqidno.2所示的核苷酸序列反向互补的核苷酸序列seqidno.3作为反义链组成的双链rna。
根据本发明的一些实施方式,所述dsrna的核苷酸序列如seqidno.9所示。
根据本发明第四方面实施方式的上述基因的dsrna的编码基因及含有该编码基因的表达载体、转基因细胞系或宿主菌。
根据本发明的一些实施方式,所述基因的制备方法包括以下步骤:基于上述基因核苷酸序列设计启动子引物对,进行pcr扩增即得。
根据本发明的一些实施方式,所述基因还包括含有上述基因的表达载体、表达盒、转基因细胞系或宿主菌。
根据本发明的一些实施方式,所述表达载体为pmd18-t。
根据本发明的一些实施方式,所述宿主菌为dh5α。
根据本发明第五方面实施方式的上述基因的应用,所述应用为在制备美洲大蠊防治药物中的应用。
一种防治美洲大蠊的方法,包括以下步骤:将上述dsrna导入到美洲大蠊体内。
根据本发明的一些实施方式,所述导入操作通过注射的方式;优选地,所述注射操作为显微注射。
根据本发明的一些实施方式,所述导入操作为导入至美洲大蠊成虫的腹腔中。
根据本发明的一些实施方式,所述导入操作还可以通过饲喂的方式。
根据本发明的一些实施方式,所述导入操作在操作前对美洲大蠊进行co2麻醉。
根据本发明的一些实施方式,所述注射操作是从沿腹部从下往上方向的第3至第4腹节处注入。
根据本发明的一些实施方式,所述导入操作是在刚羽化后的第三天注射一次。
本发明的有益效果在于:本发明提供了一种美洲大蠊嗅觉受体基因or3x,通过设计合成了靶向沉默美洲大蠊嗅觉受体基因or3x的dsrna序列,将该dsrna导入美洲大蠊体内,能够显著抑制or3x基因的表达,以干扰雌、雄成虫或美洲大蠊幼虫所释放的聚集信息素,从而达到阻断美洲大蠊显著的聚集,最终达到防治美洲大蠊的目的,本发明提供了一种对环境友好、高效、低毒的蟑螂防治方法,为美洲大蠊的防控提供了新的技术和策略。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
图1为本发明实施例二中or3x基因在不同组织中表达水平结果图;
图2为本发明实施例二中or3x基因在羽化后时间表达水平结果图;
图3为本发明实施例三中or3x基因干扰效率结果图;
图4为本发明实施例三中or3x基因干扰后美洲大蠊雄虫对虫体粪便气味选择结果图。
具体实施方式
为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附图予以说明。实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,均可从商业途径得到的试剂和材料。
一种基于美洲大蠊嗅觉受体基因or3x设计的dsrna,该dsrna的核苷酸序列的正义链序列如seqidno.2所示,反义链序列为由如seqidno.2所示的核苷酸序列反向互补的核苷酸序列(如seqidno.3所示),其制备过程如下:通过对嗅觉受体or3x基因的序列(如seqidno.1所示)进行了分子克隆,并对dna测序检验了序列的真实性和同源性,以此利用体外合成的方法获得质量合格、效果可靠的美洲大蠊嗅觉受体基因or3x的dsrna产物。
美洲大蠊品系采购于腾飞育种基地(安徽,中国),实验室长期将其饲喂于透气性良好的塑料箱中,饲养环境为温度28±1℃、相对湿度70%-80%、光周期合理(亮:暗=12h:12h)的封闭温室。并定期按时按量给予美洲大蠊充足的狗粮(购自艾嘉生物科技,天津)和饮用水。分拣羽化后的雌雄虫,按需进行聚集以维持种群的数量和规模。
实施例1:dsrna的设计与合成
dsrna的设计与合成包括以下步骤:
(1)引物设计
从已报道的其他物种的or3x基因的序列,在美洲大蠊基因组中进行同源比对,得到美洲大蠊嗅觉受体基因or3x的完整序列(如seqidno.1所示)。利用dsrna设计网站e-rnai(https://www.dkfz.de/signaling/e-rnai3/),将整个美洲大蠊嗅觉受体基因or3x开放阅读框序列复制粘贴到网站中,通过设计参数筛选得到dsrna靶向序列i(如seqidno.2所示)。根据序列seqidno.2所示的核苷酸序列设计引物,正向引物or3x-fp:attgcacggaatttgtt(seqidno.5)和反向引物or3x-rp:agtctgagtagtggactg(seqidno.6)。
美洲大蠊嗅觉受体基因or3x序列(seqidno.1)具体如下:
atgaaacatcgcctttgtcagaacgacgtcggactccacgccactaccctctgtctagcagcaatcataaaaatacccccgtcagctcagggccagggctgcatagggggttgctgccaccccacgccagttctgaatctagctctgctgaagacgaagcaagtttttcaagttatcggctgcagccgccatccgggttctctgatagccgtgaactgagtgaggcggaatgtgacagggacaacacactacatcttgacaagctacttgcaaggttccaacaggagaaggagcaagaacgcctccagttcaccatacatgtgtgataagtgagatgaaaagtgtgaatgattgcatgccttatccatgtggatccgaacatttggggcttcttccccatacagtcggggaatctcttcatgaaaaattgagtccatggcattctcttagaagtaggctgaatttatctttacaatttggcaactctgtgaatcttgagttgcccctgagcgcaataacctgcaactaccatgaaccccttggaaaacttttctttttttttccccagatgaagttggagtttcctttcgacccattggattgtagtaaattgcacggaatttgtttatatcatctagataaatccatgcatcatccagagaaaccacccattgccacttttcacctgccaggtggtgtttgtacagttgtttagcgttctctgaggtgctgctctttcaacaagtgtctgcttgctttatgccactgctctagacccaaattttcatgaattatgcgataaactgtgcctttagatgtgcggttggcgatgcttccttgtgtttgtggattttcttgtgtcgctgctgccctcaccttggccactattgctgttctttgtgtgagttgcgtcctttgtctcgttaattttttcccgcattgcacaccgaatgaatcccggtgcagtgacagtccactactcagactacaataatttgcacataatagttcattgtgtgacaccattttcacagcctgaatgacagttgcatggtatgtgtgacgttaatacacattcagaattcatactgtaactctctgcaatcgtttaatttatttctatgtgaaattcgaaccgagtattctaaaaacttatctatgttagttcaagataagcaccgaacataaaaattaaattaattgtaaatgaaattcttttcagaagggtccacagaaataaaatatattaattaa。
靶向沉默美洲大蠊嗅觉受体基因or3x的dsrna靶向序列i(如seqidno.2所示),具体如下:
attgcacggaatttgtttatatcatctagataaatccatgcatcatccagagaaaccacccattgccacttttcacctgccaggtggtgtttgtacagttgtttagcgttctctgaggtgctgctctttcaacaagtgtctgcttgctttatgccactgctctagacccaaattttcatgaattatgcgataaactgtgcctttagatgtgcggttggcgatgcttccttgtgtttgtggattttcttgtgtcgctgctgccctcaccttggccactattgctgttctttgtgtgagttgcgtcctttgtctcgttaattttttcccgcattgcacaccgaatgaatcccggtgcagtgacagtccactactcagact。
靶向沉默美洲大蠊嗅觉受体基因or3x的dsrna靶向序列(如seqidno.3所示),具体如下:
agtctgagtagtggactgtcactgcaccgggattcattcggtgtgcaatgcgggaaaaaattaacgagacaaaggacgcaactcacacaaagaacagcaatagtggccaaggtgagggcagcagcgacacaagaaaatccacaaacacaaggaagcatcgccaaccgcacatctaaaggcacagtttatcgcataattcatgaaaatttgggtctagagcagtggcataaagcaagcagacacttgttgaaagagcagcacctcagagaacgctaaacaactgtacaaacaccacctggcaggtgaaaagtggcaatgggtggtttctctggatgatgcatggatttatctagatgatataaacaaattccgtgcaat。
(2)目的片段的克隆与载体的构建
取美洲大蠊成虫的触角(雌雄)、口器、前足、脑、翅、精巢和卵巢的样品均经液氮研磨后放入trizol试剂(lifetechnologies,carlsbad,ca,usa)中,按照标准流程提取上述样品的总rna。使用nanodrop2000微量分光光度计(thermofisherscientific,waltham,massachusetts,usa)测定样本rna的浓度,并进行电泳检测。采用turbodna酶(lifetechnologies,carlsbad,ca,usa)处理样本中残留的基因组dna后,统一起始浓度为2μg的rna作为合成cdna的模板。cdna合成体系选用primescriptii反转录酶(takarabio,shiga,japan)和oligo(dt)引物(promega,madison,wi,usa),按照说明书合成cdna模板。以cdna为模板扩增得到核苷酸序列如seqidno.4所示的dna片段,并将其克隆到pmd18-t载体(aidlab,china)中,测序验证序列是否存在碱基突变,挑选没有任何突变的克隆用于后续实验,载体命名为pmd18-t-or3x。
(3)重组载体的转化
将构建好的载体连接转化感受态细菌(dh5α),制作成重组菌株。筛选出阳性克隆,扩大培养后提取重组质粒。
(4)合成or3xdsrna
设计两端含有t7启动子的引物,or3xt7-fp:taatacgactcactataggattgcacggaatttgtt(如seqidno.7所示)和or3xt7-rp:taatacgactcactataggagtctgagtagtggactg(如seqidno.8所示)。以pmd18-t-or3x载体为模板进行扩增,得到两端含有t7启动子的pcr产物,然后利用t7ribomaxexpressrnaisystem(promega,madison,wisconsin,usa)来合成正向和反向rna,在t7rna聚合酶和dnasei依次处理后将两条正反向的rna混合并70℃处理10min,然后逐渐降温到室温使其退火变成dsrnai,序列为由seqidno.2所示的核苷酸序列及与seqidno.2所示的核苷酸序列反向互补的如seqidno.3所示核苷酸序列组成的双链rna。dsor3x靶向的mrna片段序列如seqidno.9所示。
同样地,根据gfp基因序列设计dsgfp引物:gfpfp:cacaagttcagcgtgtccg(如seqidno.10所示)和gfprp:gttcaccttgatgccgttc(如seqidno.11所示)。以质粒pegfp-n1(takara,kusatsu,shigaprefecture,japan)为模板扩增得到含有靶向序列的dna片段ii,并将其克隆、测序、验证序列后获得载体,命名为pmd18-t-gfp。设计两端含有t7启动子的引物,gfpt7fp:taatacgactcactataggcacaagttcagcgtgtccg(seqidno.12)和gfpt7rp:taatacgactcactatagggttcaccttgatgccgttc(seqidno.13)。以pmd18-t-gfp载体为模板进行扩增,得到两端含有t7启动子的pcr产物,然后利用t7ribomaxexpressrnaisystem(promega,madison,wi,usa)合成dsrnaii,序列为由seqidno.14所示的核苷酸序列组成的双链rna。
靶向沉默美洲大蠊嗅觉受体基因or3x的dna序列(如seqidno.4所示),具体如下:
attgcacggaatttgtttatatcatctagataaatccatgcatcatccagagaaaccacccattgccacttttcacctgccaggtggtgtttgtacagttgtttagcgttctctgaggtgctgctctttcaacaagtgtctgcttgctttatgccactgctctagacccaaattttcatgaattatgcgataaactgtgcctttagatgtgcggttggcgatgcttccttgtgtttgtggattttcttgtgtcgctgctgccctcaccttggccactattgctgttctttgtgtgagttgcgtcctttgtctcgttaattttttcccgcattgcacaccgaatgaatcccggtgcagtgacagtccactactcagact。
靶向沉默美洲大蠊嗅觉受体基因or3x的dsrna序列(如seqidno.9所示),具体如下:
auugcacggaauuuguuuauaucaucuagauaaauccaugcaucauccagagaaaccacccauugccacuuuucaccugccaggugguguuuguacaguuguuuagcguucucugaggugcugcucuuucaacaagugucugcuugcuuuaugccacugcucuagacccaaauuuucaugaauuaugcgauaaacugugccuuuagaugugcgguuggcgaugcuuccuuguguuuguggauuuucuugugucgcugcugcccucaccuuggccacuauugcuguucuuugugugaguugcguccuuugucucguuaauuuuuucccgcauugcacaccgaaugaaucccggugcagugacaguccacuacucagacu。
靶向沉默美洲大蠊gfp基因的dsrna序列(如seqidno.14所示),具体如下:
cacaaguucagcguguccggcgagggcgagggcgaugccaccuacggcaagcugacccugaaguucaucugcaccaccggcaagcugcccgugcccuggcccacccucgugaccacccugaccuacggcgugcagugcuucagccgcuaccccgaccacaugaagcagcacgacuucuucaaguccgccaugcccgaaggcuacguccaggagcgcaccaucuucuucaaggacgacggcaacuacaagacccgcgccgaggugaaguucgagggcgacacccuggugaaccgcaucgagcugaagggcaucgacuucaaggaggacggcaacauccuggggcacaagcuggaguacaacuacaacagccacaacgucuauaucauggccgacaagcagaagaacggcaucaaggugaac。
实施例2美洲大蠊不同组织和不同发育时间or3x的表达水平
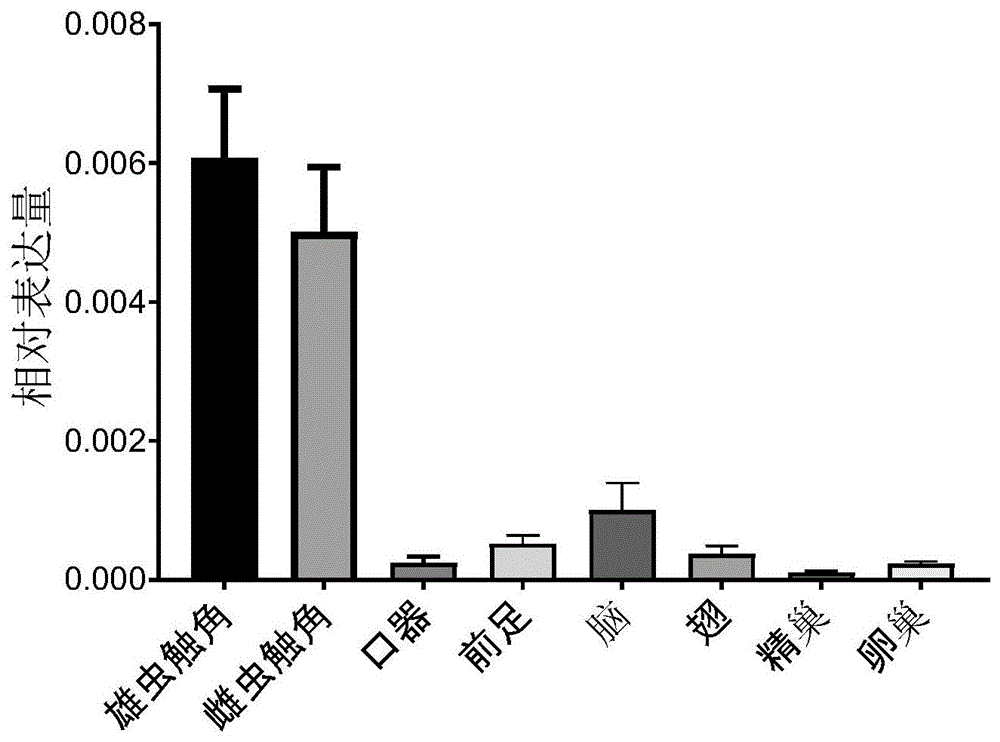
利用primerpremier5引物设计软件设计qpcr引物。荧光定量pcr检测所用到引物如表1所示,使用sybrgreenqpcrmix(yisheng,china)进行基因表达定量检测,通过定量pcr的方法测定了触角(雌雄)、口器、前足、脑、翅、精巢和卵巢中or3x基因的表达水平(如图1所示),并且进一步测定羽化前后雄虫触角的or3x基因表达水平(如图2所示)。
从图1中可以看出,or3x基因在触角的表达量较高,并且雄虫触角的表达量与雌虫触角表达水平无明显差异,表明了or3x无性别表达差异,这与聚集信息素仅与种群的聚集信号相关,与性别差异无关的特点相符。从图2中可以看出,or3x基因的表达量在羽化前后差异较大,尤其是羽化后第4天到第7天表达水平较高,这可能与此时美洲大蠊易发生较大规模的聚集行为相关。
表1用于or3x基因定量pcr的引物序列
实施例3dsrna对or3x基因干扰影响
(1)对美洲大蠊活体注射特异抑制美洲大蠊嗅觉受体基因or3x的dsrna
挑选刚完成羽化的健康的美洲大蠊雌雄虫,单只单独饲养,分为实验组和对照组(注射无法靶向美洲大蠊任何基因的dsgfp),在羽化后第三天,采用二氧化碳无损害麻醉的方式处理雄虫,随后将其放置于解剖台上,利用显微注射方法将总量为2μg的靶向or3x基因的dsrna沿腹部第3至第4腹节处(从下往上方向)缓慢注入其腹腔中。同时注射相同剂量的gfp基因干扰片段作为阴性对照。已完成注射dsrna的美洲大蠊雄虫仍单只放置于y-选择玻璃管中;并放入提纯的粪便提取物。持续观察并拍摄雌雄虫的聚集的起始时间和聚集过程的时长。为保证有效统计的重复数,注射or3x基因和gfp基因的dsrna的美洲大蠊雄虫各为20只。
(2)dsrna对or3x基因干扰效果验证
注射dsrna(包括or3x基因和gfp基因)48小时后,采用二氧化碳麻醉处理美洲大蠊雄虫,切除并取下触角,经液氮研磨后放入trizol试剂中,按照标准流程提取触角的总rna,利用超微量分光光度计nanodrop2000(thermofisherscientific,waltham,massachusetts,usa)测定总rna浓度,然后取2μgrna进行反转录得到cdna。使用定量pcr方法来检测检测靶基因干扰效果(具体定量引物序列如表1所示)。
or3x基因干扰率的计算公式为(dsgfp表达量-dsor3x表达量)/dsgfp表达量×100%。
or3x基因干扰效率结果如图3所示,从图中可以看出,触角中的or3x基因表达水平降低了51.8%。由于高丰度表达的基因更容易被rnai诱导沉默,上述结果不仅表明了触角or3x基因主要的表达场所,也表明了rnai诱导沉默系统在美洲大蠊中具有高效性。
(3)or3x基因干扰后“y”型管实验
or3x基因干扰后美洲大蠊雄虫对粪便气味选择结果如图4所示,从图中可以看出,与对照组相比,注射or3x基因dsrna的美洲大蠊雄虫对气味选择偏好显著降低,表现为无法正确识别含有聚集气味粪便。or3x基因干扰组的美洲大蠊聚集时间较注射对照组的美洲大蠊产生延迟及少数无聚集现象,并且“y”型管选择实验证明美洲大蠊雄虫对聚集气味的趋向性消失,进而可说明干扰or3x基因对美洲大蠊的聚集行为有显著的延迟作用和减弱效应。
本发明就嗅觉受体or3x对美洲大蠊的聚集行为进行深入研究,测定了触角(雌雄)、口器、前足、脑、翅、精巢和卵巢的表达水平,并且进一步测定羽化前后雄虫触角的or3x基因表达水平。在确定干扰or3x的效率,尤其是与嗅觉密切相关的触角or3x的干扰效率,并在此基础上检测了雄虫触角对聚集信息素的响应程度。结果显示or3x的转录水平的降低显著降低了对美洲大蠊雄虫对聚集气味的识别,并进一步检测了选择偏好性的差异。
综上所述,本发明提供的嗅觉受体or3x基因对美洲大蠊的聚集行为进行了深入研究,由于嗅觉在识别美洲大蠊聚集信息素过程中不可或缺,因此,前期鉴定了美洲大蠊嗅觉受体,发现受体基因or3x在美洲大蠊聚集和繁殖过程中具有关键作用。本发明的结果显示了干扰嗅觉受体基因or3x的表达会显著减弱美洲大蠊的聚集,为美洲大蠊的防控提供了新的策略。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等同变换,或直接或间接运用在相关的技术领域,均同理包括在本发明的专利保护范围内。
序列表
<110>华南师范大学
梅州市华师昆虫发育生物学与应用技术重点实验室广梅园研发中心
<120>基于美洲大蠊嗅觉受体基因or3x设计的dsrna、编码基因及其制备方法与应用
<160>16
<170>siposequencelisting1.0
<210>1
<211>1254
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgaaacatcgcctttgtcagaacgacgtcggactccacgccactaccctctgtctagca60
gcaatcataaaaatacccccgtcagctcagggccagggctgcatagggggttgctgccac120
cccacgccagttctgaatctagctctgctgaagacgaagcaagtttttcaagttatcggc180
tgcagccgccatccgggttctctgatagccgtgaactgagtgaggcggaatgtgacaggg240
acaacacactacatcttgacaagctacttgcaaggttccaacaggagaaggagcaagaac300
gcctccagttcaccatacatgtgtgataagtgagatgaaaagtgtgaatgattgcatgcc360
ttatccatgtggatccgaacatttggggcttcttccccatacagtcggggaatctcttca420
tgaaaaattgagtccatggcattctcttagaagtaggctgaatttatctttacaatttgg480
caactctgtgaatcttgagttgcccctgagcgcaataacctgcaactaccatgaacccct540
tggaaaacttttctttttttttccccagatgaagttggagtttcctttcgacccattgga600
ttgtagtaaattgcacggaatttgtttatatcatctagataaatccatgcatcatccaga660
gaaaccacccattgccacttttcacctgccaggtggtgtttgtacagttgtttagcgttc720
tctgaggtgctgctctttcaacaagtgtctgcttgctttatgccactgctctagacccaa780
attttcatgaattatgcgataaactgtgcctttagatgtgcggttggcgatgcttccttg840
tgtttgtggattttcttgtgtcgctgctgccctcaccttggccactattgctgttctttg900
tgtgagttgcgtcctttgtctcgttaattttttcccgcattgcacaccgaatgaatcccg960
gtgcagtgacagtccactactcagactacaataatttgcacataatagttcattgtgtga1020
caccattttcacagcctgaatgacagttgcatggtatgtgtgacgttaatacacattcag1080
aattcatactgtaactctctgcaatcgtttaatttatttctatgtgaaattcgaaccgag1140
tattctaaaaacttatctatgttagttcaagataagcaccgaacataaaaattaaattaa1200
ttgtaaatgaaattcttttcagaagggtccacagaaataaaatatattaattaa1254
<210>2
<211>378
<212>dna
<213>人工序列(artificialsequence)
<400>2
attgcacggaatttgtttatatcatctagataaatccatgcatcatccagagaaaccacc60
cattgccacttttcacctgccaggtggtgtttgtacagttgtttagcgttctctgaggtg120
ctgctctttcaacaagtgtctgcttgctttatgccactgctctagacccaaattttcatg180
aattatgcgataaactgtgcctttagatgtgcggttggcgatgcttccttgtgtttgtgg240
attttcttgtgtcgctgctgccctcaccttggccactattgctgttctttgtgtgagttg300
cgtcctttgtctcgttaattttttcccgcattgcacaccgaatgaatcccggtgcagtga360
cagtccactactcagact378
<210>3
<211>378
<212>dna
<213>人工序列(artificialsequence)
<400>3
agtctgagtagtggactgtcactgcaccgggattcattcggtgtgcaatgcgggaaaaaa60
ttaacgagacaaaggacgcaactcacacaaagaacagcaatagtggccaaggtgagggca120
gcagcgacacaagaaaatccacaaacacaaggaagcatcgccaaccgcacatctaaaggc180
acagtttatcgcataattcatgaaaatttgggtctagagcagtggcataaagcaagcaga240
cacttgttgaaagagcagcacctcagagaacgctaaacaactgtacaaacaccacctggc300
aggtgaaaagtggcaatgggtggtttctctggatgatgcatggatttatctagatgatat360
aaacaaattccgtgcaat378
<210>4
<211>378
<212>dna
<213>人工序列(artificialsequence)
<400>4
attgcacggaatttgtttatatcatctagataaatccatgcatcatccagagaaaccacc60
cattgccacttttcacctgccaggtggtgtttgtacagttgtttagcgttctctgaggtg120
ctgctctttcaacaagtgtctgcttgctttatgccactgctctagacccaaattttcatg180
aattatgcgataaactgtgcctttagatgtgcggttggcgatgcttccttgtgtttgtgg240
attttcttgtgtcgctgctgccctcaccttggccactattgctgttctttgtgtgagttg300
cgtcctttgtctcgttaattttttcccgcattgcacaccgaatgaatcccggtgcagtga360
cagtccactactcagact378
<210>5
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>5
attgcacggaatttgtt17
<210>6
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>6
agtctgagtagtggactg18
<210>7
<211>36
<212>dna
<213>人工序列(artificialsequence)
<400>7
taatacgactcactataggattgcacggaatttgtt36
<210>8
<211>37
<212>dna
<213>人工序列(artificialsequence)
<400>8
taatacgactcactataggagtctgagtagtggactg37
<210>9
<211>378
<212>rna
<213>人工序列(artificialsequence)
<400>9
auugcacggaauuuguuuauaucaucuagauaaauccaugcaucauccagagaaaccacc60
cauugccacuuuucaccugccaggugguguuuguacaguuguuuagcguucucugaggug120
cugcucuuucaacaagugucugcuugcuuuaugccacugcucuagacccaaauuuucaug180
aauuaugcgauaaacugugccuuuagaugugcgguuggcgaugcuuccuuguguuugugg240
auuuucuugugucgcugcugcccucaccuuggccacuauugcuguucuuugugugaguug300
cguccuuugucucguuaauuuuuucccgcauugcacaccgaaugaaucccggugcaguga360
caguccacuacucagacu378
<210>10
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>10
cacaagttcagcgtgtccg19
<210>11
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>11
gttcaccttgatgccgttc19
<210>12
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>12
taatacgactcactataggcacaagttcagcgtgtccg38
<210>13
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>13
taatacgactcactatagggttcaccttgatgccgttc38
<210>14
<211>420
<212>rna
<213>人工序列(artificialsequence)
<400>14
cacaaguucagcguguccggcgagggcgagggcgaugccaccuacggcaagcugacccug60
aaguucaucugcaccaccggcaagcugcccgugcccuggcccacccucgugaccacccug120
accuacggcgugcagugcuucagccgcuaccccgaccacaugaagcagcacgacuucuuc180
aaguccgccaugcccgaaggcuacguccaggagcgcaccaucuucuucaaggacgacggc240
aacuacaagacccgcgccgaggugaaguucgagggcgacacccuggugaaccgcaucgag300
cugaagggcaucgacuucaaggaggacggcaacauccuggggcacaagcuggaguacaac360
uacaacagccacaacgucuauaucauggccgacaagcagaagaacggcaucaaggugaac420
<210>15
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>15
ctacatcttgacaagctactt21
<210>16
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>16
tccacatggataaggcatgc20
- 还没有人留言评论。精彩留言会获得点赞!